Введение
Успехи в технологии эндоскопического оборудования привели к революции в лечении патологии верхних отделов мочевого тракта. Развитие семиригидных, оптоволоконных, а также гибких уретроскопов с управляемым концом сделало доступным все отделы мочевого тракта, включая собирательную систему [3, 7].
В то же время развитие эндоскопических технологий в лечении уретролитиаза было бы невозможным без интралюминарного дренирования мочеточника, для чего с середины 1970-х годов широко применяются специальные стенты [2, 6]. Но до сих пор не предложено универсальных рекомендаций, регламентирующих их использование, уход за ними и эффективность. Несмотря на постоянное совершенствование биоматериалов, из которых изготавливают стенты, и их дизайна, современные –JJ-стенты не избавляют от осложнений и проблем, а поиск идеального JJ-стента остается утопией [1, 5].
Многими исследователями описана гематурия, связанная с установкой стента (с частотой 2–21 %), а также массивная гематурия после стентирования с необходимостью гемотрансфузии [4].
Со стентированием связывают возникновение пузырно-лоханочного рефлюкса с болевым синдромом и повышением температуры тела у 3,4–11 % пациентов. К ухудшению качества жизни также приводит учащение мочеиспусканий в дневное и ночное время, связанное с раздражением стенки мочевого пузыря, — у 12,3–18,9 % пациентов. Известно также, что использование стентов значительно удорожает эндоскопическую процедуру [4, 7].
Таким образом, изучение показаний и усовершенствование тактики в плане подходов к после–операционному стентированию мочеточника представляет значительный теоретический интерес и имеет большую как научную, так и практическую ценность.
Цель работы: определение показаний к использованию мочеточниковых стентов при выполнении ретроперитонеоскопической уретролитотомии (РПСУ).
Материалы и методы
Нами проведен анализ результатов лечения 53 пациентов, которым по поводу камня мочеточника была выполнена ретроперитонеоскопическая уретролитотомия. При этом у 18 (34 %) пациентов стент после операции не устанавливали (группа 1), а у 35 (66 %) больных был установлен стент (группа 2).
Предоперационное обследование пациентов включало детальное изучение жалоб, анамнеза заболевания, выявления сопутствующей патологии. Лабораторное обследование заключалось в изучении анализов мочи, клинических анализов крови, биохимических анализах. Больным выполняли ультразвуковое исследование органов мочевыводящей системы, рентгенологическое исследование включало обзорную и экскреторную урографию органов мочевой системы, позволявшую уточнить размеры и локализацию конкремента, а также анатомические и функциональные особенности почек и собирательной системы. При необходимости выполняли компьютерную томографию (КТ) забрюшинного пространства.
При изучении размера камня измеряли его наибольший продольный и поперечный длинник на основании данных обзорного рентгенологического исследования или КТ.
Показаниями к операции являлись ситуации, когда уретроскопическая литоэкстракция была невозможной или нежелательной, то есть при невозможности достичь камня при уретроскопии (УРС), размерах камня, превышающих 1,5 см, а также при длительном нахождении камня в просвете мочеточника.
Возраст больных составил от 24 до 76 лет (в среднем — 46,03 ± 2,09 года).
По локализации справа камни выявлены у 27 (50,1 %) больных 1-й группы, а слева — у 26 (49,9 %) больных. В группе 2 правосторонняя локализация конкрементов отмечена у 12 (66,7 %) пациентов, а левосторонняя локализация имела место у 6 (33,3 %) больных. В группе 2 камни правого мочеточника выявлены в 15 (42,9 %) случаях, а камни левого мочеточника — в 20 (57,1 %) случаях. В верхней трети мочеточника камни локализовались у 37 (69,8 %) больных, в средней трети мочеточника — у 16 (30,2 %) больных.
Поперечные размеры камня мочеточника у больных колебались в пределах от 5 до 14 мм, а в среднем составили 8,12 ± 0,76 мм.
Из сопутствующих заболеваний у 5 (9,4 %) больных выявлен сахарный диабет, у 7 (13,2 %) больных отмечена гипертоническая болезнь, 4 (7,2 %) пациентов страдали ишемической болезнью сердца, а по 2 (3,8 %) человека — соответственно хронической почечной недостаточностью и бронхиальной астмой.
Показания к операции РПСУ у пациентов: невозможность достижения камня при УРС вследствие анатомических особенностей нижележащих отделов мочеточника и при высоком расположении камня — у 20 (37,7 %) пациентов, при больших размерах камня (как правило, больше 15 мм) — у 17 (32,1 %), а также при давности заболевания более 3 недель — у 16 (30,2 %) больных.
Объем предоперационной подготовки во всех случаях определялся индивидуально и зависел как от общего состояния, так и от данных дополнительного исследования. При наличии сопутствующей патологии стремились к стабилизации артериального давления, нормализации сердечной деятельности, уровня глюкозы крови и т.д.
Во время предоперационной подготовки 12 (22,6 %) пациентам выполнена пункционная нефростомия. Показаниями к выполнению данного вмешательства явились наличие единственной функционирующей почки у 2 (3,8 %) пациентов и обострение обструктивного пиелонефрита у 10 (18,9 %) больных.
Критерии для выполнения ретроперитонеоскопического удаления камней у пациентов: нормализация общего состояния, стабилизация артериального давления, температуры тела, положительная динамика биохимических показателей, анализов крови и мочи.
Предоперационное лабораторное обследование выполнено у всех пациентов. Результаты обследования представлены в таблице 1.
Операцию выполняли под общей интубационной анестезией. После интубации трахеи больному вводили назогастральный зонд и уретральный катетер. Пациента укладывали в положение латерального декубитуса, подкладывая валик под поясничную область для максимального разведения краев реберной дуги и гребня подвздошной кости.
Операцию начинали с доступа в забрюшинное пространство. Для этого осуществляли разрез кожи длиной до 1,5 см в точке посередине между краем 12-го ребра и гребнем подвздошной кости по задней подмышечной линии. Тупым путем с помощью кровоостанавливающего зажима разводили подлежащие мягкие ткани — фасции и мышцы поясничной области до ощущения провала.
В образовавшийся канал вводили указательный палец. Последним создавали полость в забрюшинном пространстве, разводя методично забрюшинный жир, снимая его с передне-боковых отделов брюшной стенки, большой поясничной мышцы, нижнего полюса почки. Дополнительно для создания полости в забрюшинном пространстве туда вводили баллон, который изготавливали, фиксируя лигатурой к концу троакара 10 мм указательный палец от резиновой перчатки. Последний заполняли стерильным физиологическим раствором в объеме 500 мл с последующей экспозицией 10 минут.
В созданную полость вводили 10-мм троакар для оптики, на мягкие ткани и кожу вокруг него для создания дополнительной герметичности накладывали 2 провизорных шва. После этого осуществляли инсуффляцию углекислого газа, повышая давление в полости до 14–15 мм рт.ст. Для визуализации операционного поля использовали лапароскоп с углом обзора 30°.
После осмотра забрюшинного пространства и визуализации брюшной стенки под оптическим контролем вводили рабочие троакары: 5-мм троакар по среднеподмышечной линии на 1,5 см ниже реберного края, 10-мм троакар по среднеподмышечной линии на 1,5–2 см выше гребня подвздошной кости. Дополнительно 5-мм троакар для канюли отсоса вводили на 4 см краниальнее и на 2 см ниже оптического троакара.
Для диссекции использовали окончатый зажим и ножницы Метценбаума. На первом этапе операции убирали остатки жировой ткани в забрюшинном пространстве, тупым и острым путем, с использованием монополярной коагуляции убирали забрюшинный, сдвигая его в каудальном направлении, жир со складки париетальной брюшины, большой поясничной мышцы, таким образом максимально улучшая обзор и увеличивая пространство для выполнения дальнейших манипуляций.
Базовым ориентиром для обнаружения мочеточника являлась поясничная мышца. Мочеточник, как правило, располагался по ее внутреннему краю. Рядом с ним и медиальнее находилась гонадальная вена.
Результаты и обсуждение
У 32 (60,4 %) пациентов мочеточник был обнаружен практически сразу после введения лапароскопа. Идентификации его способствовало наличие перифокального воспаления, утолщение мочеточника в области камня, характерная анатомическая картина, а также перистальтическая активность органа. У остальных больных (21 (39,6 %)) обнаружению мочеточника предшествовал более длительный поиск. Причинами затрудненной идентификации мочеточника являлись избыточное количество жира в забрюшинном пространстве, рубцовый процесс из-за ранее выполненных оперативных вмешательств, воспалительная инфильтрация тканей, аномальное расположение мочеточника (рядом с аортой или нижней полой веной). В таких случаях для обнаружения мочеточника вскрывали фасцию Герота в области нижнего полюса почки, мобилизовали полюс, идентифицировали почечную лоханку и пиелоуретеральный сегмент, выделяли мочеточник в нисходящем направлении до места стояния камня.
Если камень был расположен в средней 1/3 мочеточника, ближе к границе с нижней 1/3, то поиск его был эффективен от зоны пульсации подвздошной артерии, где достаточно легко определяли мочеточник, пересекающий последнюю. Далее поиск камня осуществляли в восходящем направлении.
Как правило, в зоне стояния камня обнаруживалось выраженное в той или иной степени перифокальное воспаление с вовлечением серозной оболочки мочеточника, иногда окружающей его жировой ткани с формированием воспалительного коржа. В зоне локализации камня отмечалось расширение мочеточника в виде оливы. Выше просвет мочеточника был расширен, ниже просвет его был значительно сужен.
В зоне стояния камня осторожно мобилизовали мочеточник, при необходимости использовали диссектор с возможностью биполярной коагуляции. При необходимости стенку мочеточника освобождали от окружающего воспалительного коржа.
При возможном смещении камня в вышележащие отделы мочевого тракта на мочеточник выше конкремента накладывали сосудистый зажим Дебейки. Для рассечения стенки мочеточника использовали игольчатый лапароскопический монополярный электрод. Просвет мочеточника вскрывали у верхнего полюса конкремента таким образом, что 1/3 разреза приходилась на свободный просвет мочеточника, а 2/3 — на просвет, обтурированный камнем. Длина разреза зависела от размеров камня, как правило, была сопоставима с наибольшим поперечным размером последнего.
Конкремент, если он не был прочно фиксирован к слизистой оболочке, старались извлечь методом «выдаивания», выталкивая в краниальном направлении дистальный полюс конкремента мягким граспером. При этом камень выпадал из просвета мочеточника.
Если конкремент был плотно фиксирован в просвете мочеточника за счет интимного срастания со слизистой, его захватывали за верхний полюс граспером, одновременно выталкивая со стороны каудального полюса наружу.
Одновременно с этим совершали расшатывающие движения, осторожно высвобождая конкремент из сращений со слизистой мочеточника.
После удаления камня из мочеточника его извлекали наружу, если позволяли размеры 10-мм порта; если размеры порта были меньше диаметра камня, последний помещали в контейнер, изготовленный из пальца хирургической перчатки.
После извлечения камня из просвета мочеточника принимали решение о необходимости стентирования мочеточника. При отсутствии выраженного периуретрального воспаления, особенно с формированием воспалительного коржа из окружающих тканей, если не был выражен отек стенки мочеточника, отсутствовали значительные изменения слизистой оболочки, связанные с фиксацией камня, если не было значительного сужения просвета мочеточника ниже зоны стояния конкремента, стент в просвет мочеточника не устанавливали.
При наличии у пациента вышеописанных изменений принимали решение об установке мочеточникового стента. Для этого использовали стент с глухим концом размерами 5–6 Fr. Стент подводили на проводнике к дефекту стенки мочеточника через порт. Для более точных манипуляций со стентом и герметичности порта использовали трубку с наружным диаметром, соответствующим внутреннему диаметру 5-мм порта. Конец стента с помощью струны-проводника вводили в каудальном направлении до упора, затем струну подтягивали на 2–3 см и стент проводили глубже на несколько сантиметров.
После этого струну убирали. Свободный конец стента с помощью грасперов проводили в краниальном направлении до образования «завитка» над разрезом стенки мочеточника. «Завиток» стента разворачивали и погружали в просвет мочеточника.
Просвет мочеточника ушивали 3–4 узловыми швами в зависимости от длины разреза. Два шва накладывали по углам раны, остальные — между данными швами до создания герметичности разреза. При наложении швов использовали монофиламентную нить 3-0 на атравматической игле 26 мм. В ряде случаев накладывали непрерывные швы.
После ушивания разреза мочеточника осуществляли контроль на гемостаз, дополнительную аспирацию крови и мочи. К зоне операции через троакар подводили полихлорвиниловую дренажную трубку. Мешок-контейнер с камнем вводили под оптическим контролем в просвет троакара и удаляли вместе с последним. Кожные раны зашивали лавсановыми швами.
В послеоперационном периоде назначали антибактериальную терапию, используя, как правило, фторхинолоны и/или цефалоспорины. Системно антибактериальные препараты вводили в течение 3–6 суток, затем использовали таблетированные формы. Проводили, как правило, 1–2 курса антибактериальной терапии под контролем клинических и лабораторных данных, прежде всего клинических анализов крови и мочи. Для обезболивания использовали ненаркотические анальгетики в течение 2–4 суток. Потребности в применении наркотических препаратов для обезболивания в послеоперационном периоде не возникло ни у одного из больных. Катетер Фолея удаляли у пациентов группы 1 на следующие сутки после операции, а у пациентов группы 2 — на 2–4-е сутки послеоперационного периода.
Всех больных активизировали на следующий день после операции. Дренаж из забрюшинного пространства удаляли после исчезновения отделяемого, как правило, на 2–4-е сутки. После чего, после ультразвукового контроля состояния верхних мочевых путей и положения стента в почечной лоханке и мочеточнике, больных выписывали домой. Стент удаляли на 14–28-е стуки, к данной процедуре подходили строго индивидуально, в зависимости от исходных изменений стенки мочеточника, окружающих тканей, особенностей оперативного вмешательства, связанных с рассечением мочеточника, удалением камня, наложением интракорпорального шва.
Нами был проведен анализ показаний к установке стента после операции РПСУ у пациентов с камнями мочеточника. Данные представлены в таблице 2.
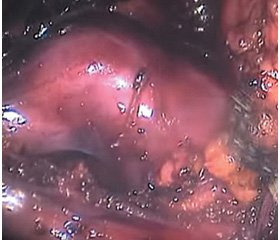
Основными показаниями к установке стента у пациентов группы 2 были выраженные воспалительные изменения периуретральных тканей с формированием коржа (рис. 1). Данный симптом имел место у 18 (51,4 %) из 35 пациентов группы 2.
Камень мочеточника, плотно фиксированный в его просвете, вызывающий пролежень слизистой, с поперечными размерами не менее 1 см был выявлен у 21 (60 %) пациента (рис. 2).
Выраженный стекловидный отек всех слоев стенки мочеточника отмечен у 26 (74,3 %) пациентов данной группы (рис. 3).
Изъязвление слизистой оболочки вследствие пролежня, выявленное после удаления камня, отмечено у 24 (68,6 %) пациентов (рис. 4).]
У 17 пациентов дополнительным показанием к установке стента явилось истечение мочи с примесью гноя, отмеченное после вскрытия просвета мочеточника.
Резкое сужение просвета мочеточника ниже зоны стояния камня как показание к стентированию имело место у 12 (34,3 %) больных (рис. 5).
Длительное, 1 месяц и более, нахождение камня в просвете мочеточника явилось показанием к установке стента у 19 (54,3 %) пациентов.
Необходимо отметить, что у всех больных группы 2 наблюдалось два симптома и более, требовавших дренирования просвета мочеточника стентом.
Нами проведен сравнительный анализ течения послеоперационного периода у пациентов 1-й и 2-й группы. При этом мы анализировали как клинические, так и лабораторные данные. Динамика данных лабораторного обследования представлена в таблице 3.
Анализ лабораторных данных свидетельствовал о том, что в раннем послеоперационном периоде у пациентов группы 1 и 2 имели место определенные различия лабораторных показателей.
Так, на 2-е сутки после операции концентрация эритроцитов в периферической крови составляла 3,81 ± 0,15 Т/л в группе 1 (р < 0,5 по сравнению с контрольной группой) и 3,08 ± 0,09 Т/л в группе 2 (р < 0,01 по сравнению с контрольной группой). Концентрация гемоглобина у пациентов группы 1 была снижена до 134,3 ± 1,0 г/л (р < 0,5 по сравнению с контролем), а у пациентов группы 2 — до 109,9 ± 0,6 г/л (р < 0,1 по сравнению с контрольной группой).
В то же время у пациентов группы 1 анемия через 14 суток после операции отсутствовала: концентрация эритроцитов составила 3,94 ± 0,12 Т/л (различия недостоверны, p > 0,5 по сравнению с контрольной группой) и гемоглобина — 143,0 ± 1,9 г/л (p > 0,5). У пациентов группы 2 в эти сроки наблюдения отмечено умеренное снижение данных показателей: концентрация эритроцитов составляла 3,94 ± 0,12 Т/л, а гемоглобина — 128,30 ± 2,08 г/л (p < 0,5 по сравнению с соответствующими показателями контрольной группы).
На 2-е сутки после операции у пациентов обеих групп отмечен гиперлейкоцитоз, что свидетельствовало об активизации у них воспалительного процесса. В группе 1 этот показатель был повышен до 11,34 ± 1,64 Г/л (р < 0,5 по сравнению с контрольной группой), а в группе 2 — до 12,05 ± 0,36 Г/л (р < 0,01 по сравнению с контрольной группой). Через 2 недели отмечена нормализация данного показателя в обеих группах, составив 8,21 ± 1,67 Г/л (р > 0,5) и 7,23 ± 1,45 Г/л (p > 0,5) соответственно.
При биохимическом обследовании пациентов в раннем послеоперационном периоде выявлены определенные нарушения гомеостаза. Уровень общего белка на 2-е сутки после операции не отличался от данных контрольной группы только у пациентов группы 1, достигнув 66,35 ± 1,97 г/л (p > 0,5), а в группе 2 этот показатель был достоверно ниже, составив 54,03 ± 0,76 г/л (p < 0,5). В то же время при контрольном обследовании через 14 дней выявлено, что в обеих группах эти показатели нормализовались, составив 67,88 ± 4,93 и 65,68 ± 0,75 г/л (p > 0,05, различия с контрольной группой недостоверны) соответственно.
У больных с уретролитиазом в раннем после–операционном периоде были отмечены нарушения гемокоагуляции, одними из проявлений которых явились умеренная гипофибриногенемия и снижение протромбинового индекса (ПТИ). Уровень фибриногена на 2-е сутки после операции в группе 1 составил 2,26 ± 0,21 г/л (p < 0,1 по сравнению с контрольной группой), а в группе 2 — 2,23 ± 0,32 г/л (p < 0,1 по сравнению с контрольной группой). При контрольном обследовании через 14 суток данный показатель нормализовался, составив в среднем у пациентов группы 1 2,94 ± 0,41 г/л, а у пациентов группы 2 — 2,91 ± 0,32 г/л.
Такие же тенденции отмечены и при изучении ПТИ: через 2 суток после операции данный показатель был снижен в группе 1 до 80,73 ± 1,15 % (различия достоверны, p < 0,5), а в группе 2 — до 78,21 ± 2,56 % (различия достоверны, p < 0,1).
У всех пациентов при поступлении отмечено определенное нарушение функции почек, что, в частности, проявлялось повышением уровня креатинина в группе 1 до 138,00 ± 14,01 мкмоль/л и в группе 2 — до 136,05 ± 9,11 мкмоль/л (уровень показателя контрольной группы — 57,01 ± 38,02 мкмоль/л, различия достоверны, p < 0,01). Уровень мочевины также оказался в данные сроки наблюдения повышенным, достигнув у пациентов группы 1 7,51 ± 0,91 ммоль/л (уровень показателя в контрольной группе — 4,42 ± 0,89 ммоль/л, различия достоверны, р < 0,01), а в группе 2 — 7,95 ± 1,35 ммоль/л (различия достоверны, р < 0,01 по сравнению с контрольной группой).
Через 2 недели отмечена нормализация уровня азотистых шлаков. Так, концентрация креатинина в группе 1 составила в среднем 61,09 ± 5,12 мкмоль/л (p > 0,05 по сравнению с контрольной группой, различия недостоверны), а в группе 2 — 56,41 ± 6,01 ммоль/л (p > 0,05 по сравнению с контрольной группой, различия недостоверны). Уровень мочевины в группе 1 в данные сроки составил 4,73 ± 0,52 ммоль/л, а в группе 2 был повышен до 4,34 ± 0,73 ммоль/л (p > 0,05 в обеих группах, различия недостоверны по сравнению с контролем).
Таким образом, сравнительный анализ динамики лабораторных показателей в группах больных с уретролитиазом после выполнения РПСУ продемонстрировал, что, несмотря на существенные различия в состоянии стенки мочеточника и окружающих тканей во время операции, не выявлено существенных различий в основных клинических и лабораторных показателях уже через 2 недели после операции. Имевшиеся некоторые различия в этих показателях в ранние сроки после операции уже на 14-е сутки после операции были купированы. Полученные данные подтверждают правильность выбранной тактики в плане внутреннего дренирования мочеточника в обеих группах пациентов после выполнения РПСУ.
Осложнения в послеоперационном периоде отмечены как в группе 1, так и в группе 2 (табл. 4).
Боли в поясничной области ноющего характера имели место у 1 (5,6 %) пациента группы 1 и 3 (8,6 %) больных группы 2. Данное осложнение возникало на следующий день после удаления катетера Фоллея из мочевого пузыря и было связано, по-видимому, с явлениями пузырно-мочеточникового рефлюкса. Болевой синдром не сопровождался уретеропиелоэктазией, не отмечалось значительного повышения температуры тела. Данное осложнение было купировано после назначения нестероидных противовоспалительных препаратов-анальгетиков, коррекции режима мочеиспусканий.
Повышение температуры тела выше 38 °С отмечено как в 1-й, так и во 2-й группе — соответственно у 3 (16,7 %) и 5 (14,3 %) пациентов. Гипертермия не требовала усиления антибактериальной терапии, возникала на 1–4-е сутки послеоперационного периода, была купирована на 2-е — 3-и сутки после возникновения осложнения после назначения нестероидных противовоспалительных препаратов.
Подтекание мочи по дренажу имело место у 4 (11,4 %) пациентов 2-й группы. Возникало оно на 3-и — 5-е сутки послеоперационного периода. Мы связывали данное осложнение с потерей герметичности шва стенки мочеточника вследствие уменьшения отека тканей либо с прорезыванием одной из лигатур.
Учащение мочеиспусканий до 12–14 в сутки отмечено у 9 (25,7 %) пациентов группы 2, оно было связано с наличием стента и раздражающим его воздействием на слизистую мочевого пузыря. Данное осложнение отмечено на 2-е — 3-и сутки после удаления катетера Фоллея и исчезало сразу после дестентирования. Миграция дистального конца стента в мочеточник, потребовавшая выполнения уретроскопии при его удалении, отмечена у 1 (2,9 %) пациента соответствующей группы.
Таким образом, при выполнении РПСУ при лечении камней мочеточника послеоперационные –осложнения не носили тяжелого характера, проходили самостоятельно или требовали незначительного усиления терапии в послеоперационном периоде. Данные осложнения существенно не влияли на длительность лечения или его исходы.
Ниже представлен анализ непосредственных результатов лечения пациентов как при использовании уретральных стентов, так и при отказе от послеоперационного дренирования мочеточника (табл. 5).
Длительность операции у пациентов группы 1 была существенно меньше, чем у пациентов группы 2, составив соответственно 76,15 ± 4,76 и 97,32 ± 6,07 мин (различия достоверны, р < 0,01). Данные различия связаны как с большими трудностями при выделении мочеточника в зоне фиксации камня у пациентов группы 2, так и с затратами времени на установку стента.
В то же время длительность нахождения на койке после операции в обеих группах была примерно одинаковой, составив соответственно 6,82 ± 1,34 суток и 7,04 ± 1,76 суток (различия недостоверны, р > 0,5). Также достоверно не отличалась и длительность временной нетрудоспособности, составив у пациентов группы 1 16,20 ± 1,92 суток, а у пациентов группы 2 — 16,09 ± 2,04 суток (различия недостоверны, р > 0,5).
Количество инъекций ненаркотических анальгетиков у пациентов группы 1 составило 5,42 ± 0,78, а в группе 2 — 6,04 ± 1,21 (различия также недостоверны, р > 0,5). Примерно одинаковой была и длительность инфузионной терапии: соответственно в группе 1 3,21 ± 0,46 суток, а в группе 2 — 3,78 ± 0,67 суток (достоверность различий отсутствует, р > 0,5).
Длительность антибактериальной терапии в группе 1 была существенно меньшей, составив 9,04 ± 1,07 суток, а в группе 2 — 14,05 ± 2,11 суток (различия достоверны, р < 0,1).
Выводы
Нами не отмечено кардинальных различий в плане непосредственных результатов лечения пациентов с уретролитиазом после выполнения РПСУ независимо от того, был использован стент для дренирования просвета мочеточника у пациента или нет. У пациентов группы 1 абсолютно оправданным явился отказ от использования стентирования, в то время как у пациентов группы 2 данная процедура являлась необходимой. То есть, с одной стороны, дренирование мочеточника путем установки стента является совершенно оправданной процедурой при наличии выраженных изменений в стенке мочеточника, которые проявляются отеком всех слоев, наличием изъязвлений слизистой оболочки, а также явлениями перифокального воспалительного процесса в окружающих мочеточник тканях с формированием воспалительного коржа. С другой стороны, стентирование мочеточника после выполнения РПСУ не является рутинной процедурой, и при отсутствии вышеописанных изменений от него можно отказаться без возникновения каких-либо осложнений.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.

/75-1.jpg)
/77-1.jpg)
/77-3.jpg)
/77-2.jpg)
/78-3.jpg)
/78-1.jpg)
/79-1.jpg)
/78-2.jpg)
/80-1.jpg)