Согласно определению Европейского общества кардиологов и Европейского респираторного общества (ЕОК, 2008, ESC, ERS, 2015), легочная гипертензия (ЛГ) — это гемодинамическое и патофизиологическое состояние, которое характеризуется повышением среднего давления в легочной артерии (ЛА) более 25 мм рт.ст. и оценивается по данным катетеризации правых отделов сердца [16, 30].
Классификация ЛГ претерпела целый ряд изменений начиная с 1973 г., когда прошла Первая международная конференция по первичной легочной гипертензии под эгидой Всемирной организации здравоохранения [27]. Тогда классификация включала только две категории (первичная ЛГ и вторичная ЛГ, в зависимости, как считали авторы, от наличия или отсутствия идентифицируемой причины ее развития). Клинический термин «первичная легочная гипертония» (ПЛГ) использовался для описания больных ЛГ, причину которой не удалось установить. Вторичной считалась ЛГ, которая наблюдалась при множестве заболеваний (например, пороки сердца, заболевания легких, тромбоэмболии ЛА и др.).
Почти двадцать пять лет спустя, когда накопился значительный опыт по изучению патоморфологии, клинической картины ЛГ, на Второй международной конференции по ЛГ в Эвиане (Франция, 1998) было уже предложено сгруппировать ЛГ по пяти категориям, исходя из представлений о патоморфологии, клиническом течении и терапевтических подходах [24], оставив термин «ПЛГ» для заболевания с невыясненной причиной.
Третья международная конференция по ЛГ проходила в Венеции (Италия) в 2003 г. [34]. Наиболее значимыми изменениями в классификации ЛГ, которые были внесены на этой конференции, были замена термина «первичная легочная гипертензия», который к этому времени широко вошел в литературу со времен D.T. Dresdale et al. [23], на «идиопатическая легочная артериальная гипертензия», а также выделение семейной и ассоци-ированных форм ЛГ.
Введение термина «ассоциированная ЛГ» вместо «вторичная ЛГ» явилось более правильным с точки зрения его сути. При ряде заболеваний, которые к настоящему времени относятся к группе ассоциированных, найдены общие механизмы развития этих заболеваний, которые все еще нуждаются в изучении, так же как и особенности их лечения.
На сегодняшний день выделяют такие ассоциированные формы легочной артериальной гипертензии (ЛАГ, прекапиллярной):
1. Диффузные заболевания соединительной ткани.
2. Инфекция вирусом иммунодефицита человека.
3. Портальная гипертензия (ПГ).
4. Врожденные пороки сердца.
5. Шистосомоз.
В этом плане клинический интерес представляет история болезни больной Д.
Больная Д., 1994 г.р., жительница г. Днепра, наблюдалась нами с декабря 2012 по апрель 2015 г. Жалобы на одышку при физической нагрузке. Поводом к обращению к врачу стало синкопальное состояние (11.12.2012). Считает себя больной с 2012 г., когда стала ощущать одышку и синкопальные состояния.
Из анамнеза жизни известно, что родители больной здоровы. Родилась от первой беременности с массой 3400 г. Внутриутробных инфекций не было, катетеризация пупочной вены не производилась, цианоза, желтухи не было. Развивалась нормально, соответственно возрасту. В 7-летнем возрасте был эпизод кровавой рвоты. Тогда же было диагностировано варикозное расширение вен пищевода, по поводу чего было проведено их склерозирование. В дальнейшем не обследовалась, чувствовала себя нормально.
Курение, алкоголизм, наркотические препараты в анамнезе отсутствуют. Не замужем.
Больная правильного телосложения, кожные покровы чистые, обычной окраски, отмечен легкий цианоз губ, «барабанные палочки» на пальцах верхних и нижних конечностей не обнаружены. Частота дыхания — 16 в 1 мин, артериальное давление — 110/64 мм рт.ст., пульс — 58 уд/мин. Сосуды шеи обычные, признаки застойной сердечной недостаточности не выявляются. Границы сердца не изменены. Выслушивается акцент 2-го тона над ЛА, систолический шум в точке Боткина. В легких на всем протяжении везикулярное дыхание. Хрипы и шум трения плевры не определяются. Живот обычной формы, на передней брюшной стенке патологических изменений не обнаружено, при пальпации безболезненный. При глубокой пальпации край печени выступает из-под реберной дуги на 1–1,5 см, безболезненный, селезенка пальпируется на 3–4 см ниже левого подреберья. Почки не пальпируются. Симптом Пастернацкого отрицательный.
Результат теста с 6-минутной ходьбой — 480 м. SaO2 — 96 %. Общий анализ крови от 16.12.2012: Hb — 140 г/л, Э. — 4,6 × 1012/л, Л. — 5,7 × 109/л; формула: э. — 0 %, п. — 2 %, с. — 61 %, л. — 31 %, м. — 6 %; тромбоциты — 160 тыс. ед/мкл; скорость оседания эритроцитов — 4 мм/ч.
Биохимический анализ крови: билирубин общий — 14,2 мкмоль/л, билирубин прямой — 3,0 мкмоль/л, билирубин непрямой — 10,2 мкмоль/л, щелочная фосфатаза — 79 ед/л, тимоловая проба — 3,5 ед, глюкоза — 5,2 ммоль/л, креатинин — 76 мкмоль/л, аланинаминотрансфераза — 4,9 ед/л, общий холестерин — 3,94 г/л, триглицериды — 1,6 г/л, калий — 4,81 ммоль/л, натрий — 140,7 ммоль/л, фибриноген — 2,2 г/л, протромбиновый индекс — 80 %, общий белок — 65,9 г/л, международное нормализованное отношение — 2,51 ед.
Вирусные антигены и вирус-специфические антитела (HBs Ag, антиHBs Ag, антиHBc) — отрицательные.
В общем анализе мочи: удельная плотность — 1022, белок — не обнаружен, лейкоциты — 2–4, эритроциты — 0–1 в поле зрения.
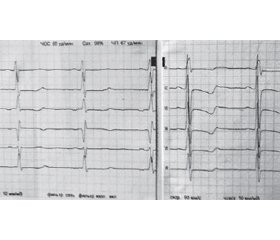
На электрокардиографии (ЭКГ) от 19.12.2012 (рис. 1): частота сердечных сокращений (ЧСС) — 68 уд/мин, QT — 400 мс. Ритм синусовый. Признаки перегрузки и гипертрофии правого желудочка (ПЖ).
В связи с полученными вышеуказанными данными было проведено дальнейшее обследование пациентки [14].
Эхокардиография (ЭхоКГ) от 22.12.2012: гипертрофия стенок правого желудочка (толщина передней стенки — 0,7 см), дилатация правых камер сердца (правое предсердие (ПП) — 4,6 × 5,9 см), недостаточность трехстворчатого клапана — 1,5+. Расчетное систолическое давление в ПЖ — 110 мм рт.ст., конечный диастолический объем левого желудочка — 78 мл, фракция выброса — 66 %, левое предсердие — 3,0 см. Клапанные структуры не изменены. Дефекты перегородок, открытый артериальный проток не выявлены.
На основании данных ЭКГ и ЭхоКГ, свидетельствующих о признаках гипертрофии ПЖ, повышении давления в ЛА, отсутствии указаний на врожденный порок сердца, с учетом жалоб больной (одышка, синкопальные состояния) и данных аускультации сердца (акцент 2-го тона над ЛА), поставлен диагноз «идиопатическая легочная артериальная гипертензия». Для окончательного уточнения и дифференциальной диагностики проведена катетеризация правых отделов сердца [1, 8, 16].
Данные катетеризации правых отделов сердца от 26.12.2012: под местной анестезией 1% лидокаина проведена пункция и катетеризация правой внутренней яремной вены. Поставлен интродьюсер BALTON.
Результаты измерения основных гемодинамических показателей: ЧСС — 82 в 1 мин. Систолическое/диастолическое давление в ЛА — 109/46 мм рт.ст. Cреднее давление в ЛА — 74 мм рт.ст. Давление в ПП — 6 мм рт.ст. Давление в правом желудочке — 110/45 мм рт.ст. Давление заклинивания в легочных капиллярах — 7 мм рт.ст. Неинвазивное систолическое и диастолическое системное артериальное давление — 115/70 мм рт.ст. Сердечный выброс — 5,9 л/мин. Площадь поверхности тела — 1,84 м2.
На основании полученных результатов были вычислены следующие показатели: сердечный индекс — 3,21 л/мин/м2; легочное сосудистое сопротивление — 853 дин × с/см5 (норма — 50–150 дин × с/см5 или < 2 ед. Вуда).
Величина давления заклинивания (7 мм рт.ст.) исключала наличие посткапиллярной (венозной) ЛГ. Полученные при катетеризации данные дали возможность установить диагноз легочной артериальной гипертензии.
С учетом других симптомов заболевания (указание на варикозно расширенные вены пищевода, увеличение селезенки) диагностический поиск был продолжен для выявления сопутствующих заболеваний и возможной их связи с ЛАГ [1, 2, 4, 5, 12).
02.01.2013 было проведено ультразвуковое исследование (УЗИ) органов брюшной полости.
УЗИ печени. Толщина левой доли — 6,2 см, толщина правой доли — 12,0 см, размеры не увеличены. Контуры ровные, четкие. Край обычный. Паренхима диффузно неоднородная, мелкозернистая. Эхогенность умеренно повышена. Желчные ходы не уплотнены, не расширены. Холедох — 0,5 см, не расширен. Портальная вена — 0,9 см в диаметре, не расширена. Нижняя полая вена на вдохе — 2,3 см, на выдохе — 2,1 см, не расширена. Сосудистый рисунок печени: вены системы портальной вены извиты, расширены. Лимфоузлы в воротах печени не увеличены. Очаговые изменения: в правой доле S-6 визуализируется эхогенное образование с ровными, четкими контурами, неоднородное по структуре, с размерами 3 × 6,1 см. При цветовой допплерэхографии данного образования визуализируется преимущественно перинодулярный и скудный интранодулярный кровоток (варикозная гемангиома? гепатома?). Рядом визуализируется гиперэхогенное образование с неровными, нечеткими контурами, неоднородное по структуре, с кальцификатами внутри, размерами 1,7 × 1,9 см. Аналогичное образование определяется в правой доле в S-4, размерами 2,1 см в диаметре. Свободной жидкости в плевральных полостях и в брюшной полости не выявлено.
УЗИ желчного пузыря. Размеры 5,3 × 2,2 см, не увеличен. Деформирован за счет парапроцесса извне. Стенка уплотнена, не утолщена. В просвете желчь.
УЗИ поджелудочной железы. Поджелудочная железа визуализируется с трудом фрагментами из-за выраженного метеоризма. Видимые участки с неровными, нечеткими контурами, неоднородными по структуре.
УЗИ селезенки. Расположение обычное. Размеры 16,3 × 6,1 см, увеличены. Контуры ровные, четкие. Форма не изменена. Дыхательная подвижность сохранена. Структура паренхимы неоднородная за счет мелких кальцинатов. Эхогенность обычная. Селезеночная вена 1,2 см в диаметре, расширена. Определяется кавернозная трансформация селезеночной вены. Подкапсульно визуализируется гиперэхогенный участок размером 2,4 × 1,8 см с множественными мелкими кальцификатами.
УЗИ почек. Размеры левой почки — 10,1 × 4,8 см, правой — 9,9 × 4,3 см. Дыхательная подвижность повышена. Контуры обеих почек ровные, четкие. Паренхима однородная, структурная. Эхогенность паренхимы обычная. Толщина паренхимы обычная. Площадь почечного синуса не расширена. Структура почечного синуса неоднородная за счет солевых включений в обеих почках. Чашечно-лоханочная система расширена за счет единичных капикоэктазий до 0,9 см в обеих почках. Паранефральные лимфоузлы не визуализируются.
Область надпочечников — без патологических образований.
Мочевой пузырь слабо наполнен. Лимфоузлы забрюшинного пространства не визуализируются. Брюшной отдел аорты не расширен, без патологических изменений.
Заключение: ультразвуковые признаки очаговых изменений в печени, селезенке, спленомегалии, дилатации и кавернозной трансформации селезеночной вены [2, 4, 33], диффузных изменений в печени, солевого диатеза, единичной капикоэктазии обеих почек.
Поскольку генез очаговых изменений в печени и селезенке оставался неизвестным [2, 4, 12], было рекомендовано проведение компьютерной томографии органов брюшной полости с контрастированием [7, 9]. Результаты мультиспиральной компьютерной томографии (МСКТ) органов брюшной полости (ОБП) и забрюшинного пространства от 03.01.2013: аллергической реакции на внутривенное введение контраста не наблюдалось. На серии полученных МСК-томограмм ОБП: печень — контуры ровные, четкие; размеры увеличены. Паренхима неоднородная за счет наличия множества разнокалиберных гемангиом, в 7-м сегменте — с элементами обызвествления. Плотность паренхимы печени — 50–55 HU (в норме — 65 ± 10 HU). При контрастном усилении накопление контраста неравномерное. Внутри- и внепеченочные протоки не расширены. Ворота печени структурны, признаков лимфоаденопатии не выявлено. Желчный пузырь: размеры не увеличены, контуры ровные, четкие. Стенка равномерная, не утолщена, равномерно накапливает контраст. Содержимое однородное. Поджелудочная железа: нормально расположена, размеры не увеличены, контуры неровные, четкие; структура однородная. При контрастном усилении равномерно накапливает контраст. Проток поджелудочной железы не расширен. Очаговой патологии не выявлено. Окружающие ткани структурны. Селезенка: контуры ровные, четкие; размеры увеличены. Структура неоднородная за счет наличия множественных обызвествлений. При контрастном усилении равномерно накапливает контраст. Селезеночная вена — 13 см, извита. Ворота селезенки структурны. Дополнительных образований не выявлено. Надпочечники обычной Y-образной формы. Контуры четкие. Структура однородная. При контрастном усилении равномерно накапливают контраст. Дополнительных образований не выявлено. Почки: определяется U-образная почка. Правая — нормально расположена. Размеры не увеличены, контуры ровные, четкие. Паренхима однородная. При контрастном усилении накапливает контраст. Чашечно-лоханочная система удвоена, не деформирована. Лоханка расположена экстраренально. Мочеточник не расширен, прослеживается на всем протяжении исследования. Паранефральная клетчатка без особенностей. Левая почка смещена книзу, ротирована вокруг оси кпереди. Размеры увеличены, контуры неровные, четкие. Паренхима однородная; при контрастном усилении равномерно накапливает контраст. Чашечно-лоханочная система не деформирована, удвоена. Лоханка расположена экстраренально. Мочеточник не расширен, прослеживается на всем протяжении исследования. Паранефральная клетчатка без особенностей.
Крупные сосуды имеют четкие очертания. Признаков лимфоаденопатии не выявлено. Определяются кифосколиотическая деформация оси позвоночного столба, спондилоартроз поясничного отдела позвоночника, множественные грыжи Шморля.
Анамнестические данные у пациентки: варикозное расширение вен пищевода (с 2001 г.) [17], наличие клинического увеличения селезенки; данные УЗИ и СКТ брюшной полости: гепатолиенальный синдром, расширение селезеночной вены, ее извитость, кавернозная трансформация перестройки вены, что наблюдается при длительно текущих случаях повышения давления в венах [2], дифференциальная диагностика при абдоминальном ультразвуковом исследовании — свидетельствуют о портальной гипертензии.
Очаговыми изменениями в печени и селезенке являются множественные гемангиомы, некоторые из них достигают довольно крупных размеров. Гемангиома печени (ГП) — это доброкачественная опухоль, представляющая собой клубок сосудов, нарушение в развитии которого произошло в эмбриональном периоде. Заболевание считается врожденным. В данном случае врожденный характер заболевания подтверждают и другие выявленные изменения у больной: удвоение чашечно-лоханочной системы почек, кифосколиотическая деформация оси позвоночного столба, спондилоартроз поясничного отдела позвоночника, множественные грыжи Шморля.
Связаны ли указанные очаговые изменения с портальной гипертензией?
Портальная гипертензия — синдром повышенного давления в системе воротной вены из-за нарушения кровотока в портальных сосудах, печеночных венах и нижней полой вене. Портальная гипертензия делится на 2 группы: пресинусоидальная (внепеченочная и внутрипеченочная), печеночная (внутрипеченочная и постсинусоидальная).
В качестве этиологических факторов ПГ встречаются:
— в 70–80 % — цирроз печени (вирусный, алкогольный, билиарный), гепатит, жировой гепатоз;
— врожденные и приобретенные патологии печеночных вен и нижней полой вены;
— болезнь Киари (облитерирующий эндофлебит печеночных вен);
— синдром Бадда — Киари;
— аномалии печеночных вен;
— портальный фиброз печени (воспалительный или посттравматический);
— болезнь Кароли;
— миелофиброз;
— опухолевые заболевания органов панкреатобилиарной зоны;
— паразитарные заболевания (шистосомоз, эхинококкоз);
— кардиальный цирроз печени;
— флебосклероз, облитерация или тромбоз воротной вены, врожденный стеноз и атрезия воротной вены и ее ветвей;
— гемангиомы печени и селезенки.
Причинами внепеченочной ПГ являются [11, 13, 18] аномалии и пороки развития воротной вены, тромбоз воротной вены.
Гемангиомы печени впервые описали Dupuytren и Gruveilhier в 1816 г. [19]. По данным статистики [9], ГП обнаруживаются у 7 % людей, чаще у женщин. При клинических исследованиях гемангиомы диагностируют у 2–4 % взрослых, а во время операций по поводу очаговых образований печени их выявляют у 10–28 % пациентов [19].
По морфологическим признакам гемангиомы печени разделяются:
— на кавернозные гемангиомы, которые представляют доброкачественные опухоли в виде клубка переплетенных сосудов, расположенных в ткани органа;
— капиллярные гемангиомы. Гемангиома этого вида представляет собой скопление заполненных кровью синусоидов, которые разделяют перегородки. Развитию капиллярной гемангиомы способствует беременность или длительный прием эстрогенных препаратов.
Как причина ПГ гемангиомы печени встречаются довольно редко [3, 9, 32].
Нарушение портальной гемодинамики любого происхождения запускает каскад вегетативных, нейрогуморальных (гиперпродукции серотонина, интерлейкина 1, тромбоксана и других вазоактивных веществ) и метаболических реакций, что приводит к полиорганным внепеченочным проявлениям, среди которых — легочная артериальная гипертензия [1, 6, 28]. Не исключено, что в развитие ЛГ вносит вклад рецидивирующая тромбоэмболия легочной артерии, в частности из расширенных вен пищевода. По мнению Сухова, в развитии легочной гипертензии у больных с внепеченочной портальной гипертензией также может играть роль микроэмболия ЛА из бассейна системы воротной вены [19]. По мнению ряда авторов, у всех больных с внепеченочной портальной гипертензией в разной степени имеется гипертензия в легочной артерии [15, 19].
Легочная гипертензия, ассоциированная с портальной гипертензией, или, как ее называют ряд авторов, портопульмональная гипертензия [19, 31], встречается примерно у 5 % ожидающих трансплантацию печени [5]. Основные критерии этого состояния — повышение среднего давления в легочной артерии > 25 мм рт.ст.; высокое легочное сосудистое сопротивление (больше 3 ед. Вуда), а также одышка у больного с циррозом печени (ЦП).
Портопульмональную гипертензию (ППГ) определяют как ЛГ, ассоциированную с портальной гипертензией, вследствие ЦП или без него [28]. Встречается при ЦП с частотой от 2 до 16 % [3, 28)], по другим данным, наблюдается у 21,4 % [6]. Присоединение ЛГ значительно утяжеляет прогноз и возможности хирургического лечения [31]. При этом следует дифференцировать два понятия — «гепатопульмональный синдром» и «портопульмональная гипертензия», что соответствует современному понятию «легочная артериальная гипертензия, ассоциированная с портальной гипертензией». Ключевым симптомом обоих состояний является наличие портальной гипертензии, о чем в нашем случае свидетельствуют увеличение селезенки, дилатация воротной вены, варикозно расширенные вены пищевода.
От портопульмональной гипертезии следует отличать гепатопульмональный синдром, который характеризуется триадой признаков: заболевание печени, артериальная гипоксемия и внутрилегочная дилатация [21, 29]. Гепатопульмональный синдром и портопульмональная гипертензия имеют различную распространенность, патогенез, клинику, исходы и терапию [6, 26]. Гепатопульмональный синдром встречается примерно у 20 % лиц, ожидающих трансплантацию печени. В основе его лежит дилатация прекапиллярного и капиллярного ложа.
Ключевые симптомы у этих пациентов:
— печеночная недостаточность;
— гипоксемия (рО2 = 70 мм рт.ст.);
— дилатация сосудов легких;
— альвеолярно-артериальный блок (затруднена диффузия О2 из альвеол в артериальную кровь);
— внутрилегочные шунты;
— артериальная гипокапния как результат одышки за счет гипервентиляции. При обследовании обнаруживаются внутрилегочное шунтирование справа налево, расширение сосудов легких.
Таким образом, в результате обследований и дифференциальной диагностики у больной Д. был установлен диагноз «легочная артериальная гипертензия, ассоциированная с портальной гипертензией, вследствие распространенного гемангиоматоза печени и селезенки; ІІІ ст., ІІ ФК по NYHA».
Лечение. Таким больным назначается такое же лечение, как и при других формах ЛАГ. Однако из-за того, что имеет место риск кровотечения, антикоагулянтная терапия не применяется. Наличие ЛАГ имеет важное значение при планировании трансплантации печени. При этом наличие ЛАГ оценивается как основной фактор риска. Некоторые специализированные центры могут предлагать комбинированную трансплантацию печени, сердца и легких для тщательно отобранных больных [31]. В заключение приводим рекомендации по ведению больных ЛАГ, ассоциированной с портальной гипертензией (табл. 1).
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Ахметзянова Э.Х., Гайнитдинова В.В. и соавт. Легочная артериальная гипертензия и заболевания печени // Российский кардиологический журнал. — 2010. — № 6. — С. 61-63.
2. Биссет Р.А., Хан А.Г. Дифференциальный диагноз при абдоминальном ультразвуковом исследовании. Справочное пособие. — 1997.
3. Гарбузенко Д.В. Патогенез портальной гипертензии при циррозе печени // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. — 2002. — № 5. — С. 23-29.
4. Делягин В.М. Клиническая трактовка результатов ультразвуковых исследований печени // SonoAce Ultrasound (Эхография в педиатрии).
5. Ивашкин В.Т. Национальное Интернет-общество специалистов по внутренней медицине. — Интернет-сессия, 17 марта 2014.
6. Калачева Т.П., Чернявская Г.М., Белобородова Э.И. Формирование легочной гипертензии у больных циррозом печени // Бюллетень сибирской медицины. — 2009. — № 4. — С. 45-48.
7. Кармазановский Г.Г., Тинькова И.О., Щеголев А.И., Яковлева О.В. Гемангиомы печени: компьютерно-томографические и морфологические сопоставления // Медицинская визуализация. — 2003. — № 4. — С. 37-45.
8. Коноплева Л.Ф. Синдром легочной гипертензии // Здоровье Украины. — 2010. — Тематический номер. — С. 46-48.
9. Курзанцева О.М. Сложности в диагностике гигантской кавернозной гемангиомы печени. Клинический пример // SonoAce Ultrasound. — https//www.medison.ru art322.
10. Курсов С.В., Михневич К.Е., Лизогуб Н.В., Скороплет С.Н. Гепатопульмональный синдром // Медицина неотложных состояний. — 2009. — № 5.
11. Леонтьев А. Внепеченочная портальная гипертензия у детей // Медицина неотложных состояний. — 2006. — № 2(3).
12. Митьков В.В. Допплерография в диагностике заболеваний печени, желчного пузыря, поджелудочной железы и их сосудов. — 2000.
13. Могилевец Э.В. Портальная гипертензия при отсутствии цирроза печени (обзор литературы) // Журнал Гродненского государственного медицинского университета. Текст научной статьи по специальности «медицина и здравоохранение». — 2015.
14. Неклюдова Г.В., Калманова Е.Н. Роль эхокардиографии в диагностике легочной гипертензии // Болезни сердца и сосудов. — 2006. — Т. 2, № 2. — С. 1-18.
15. Раевнева Т.Г. Легочно-сосудистые осложнения цирроза печени / Т.Г. Раевнева // Здравоохранение Белоруссии. — 2010. — № 2. — С. 37-41.
16. Рекомендации Европейского общества кардиологов (European Society of Cardiology, ESC) и Европейского респираторного общества (European Respiratory Society, ERS), 2015.
17. Силивончик Н.Н. Осложнения цирроза печени, возможности медикаментозной терапии варикозных кровотечений // Минские новости. — 2000. — № 11. — С. 29-31.
18. Сопронова Н.Г., Ерошенко О.Л., Косовцев Е.В. и соавт. Особенности диагностики и лечения внепеченочной портальной гипертензии // Фундаментальные исследования. — 2013. — № 9(6). — С. 1139-1145.
19. Сухов М.Н., Белокриницкая И.Е., Собакинских Т.В. Внепеченочная портальная гипертензия у больных с кардиоваскулярной патологией // Детская больница. — 2010. — № 2. — С. 12-18.
20. Шерлок Ш., Дули Дж. Заболевания печени и желчных путей. Практическое руководство / Под ред. З.Г. Апросиной, Н.А. Мухина. — М.: ГЭОТАР-Медицина, 1999. — 864 с.
21. Шульпекова Ю.О., Соколина И.А. Гепатопульмональный синдром: патологическая физиология, клиническое течение, диагностика и лечение // Клинич. перспективы гастроэнтерологии и гепатологии. — 2006. — № 4. — С. 16-21.
22. ACCF /AHA 2009 Expert Consensus Document on Pulmonary Hypertension. A Report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association. Developed in Collaboration With the American College of Chest Physicans American Thoracic Society, Ins., and Pulmonary Hypertension Association.
23. Dresdale D.T., Schultz M., Michtom R.J. Primary pulmonary hypertension clinical and hemodynamic study // Am. J. Med. — 1951. — Vol. 11. — P. 686-705.
24. Fishman А.Р. Clinical classification of pulmonary hypertension // Clin. Chest Med. — 2001. — Vol. 22. — P. 385.
25. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS) / Galiè N., Humbert M., Vachiery J.L. et al. // Eur. Heart J. — 2016. — 1(37). — P. 67-119.
26. Ghent C.N., Levstik M.A., Marotta P.J. et al. The Hepatopulmonary Syndrome // N. Engl. J. Med. — 2008. — 21. — P. 866-867.
27. Hatano S., Strasser Т. Primary Pulmonary Hypertension. Report on a WHO Meeting. October 15–17, 1973. — Geneva: World Health Organization, 1975.
28. Krowka M.J., Wiseman G.A., Burnett O.L. et al. Hepatopulmonary syndrome: a prospective study of relationships between severity of liver disease, PaO2 response to 100% oxygen, and brain uptake after (99m) TcMAA lung scanning // Chest. — 2000. — № 118. — P. 615-624.
29. Lima B.L, Franza A.V., Pazin-Filho A. еt al. Frequency, clinical characteristics, and respiratory parameters of hepatopulmonary syndrome // Mayo Clin. Proc. — 2004. — Vol. 79(1). — P. 42-48.
30. McLaughlin V.V., Archer S.L., Badesch D.B. et al. ACCF/ANA // Circulation. — 2009. — 119(16). — Р. 2250-94; Am. Coll. Cardiol. — 2009. — 53(17). — P. 1573-1619.
31. Pavec I.J., Souzal I. Jr, Harvel P. et al. Portopulmonaly Hypertension. Survival and Prognostic Factors // American J. Respiratory and Critical Care Medicine. — 2008. — Vol. 178. — P. 637-643.
32. Pitlik S., Cohen L., Hadar H., Srulijes C., Rosenfeld J.B. Portal Hypertension and Esophageal Varices in Hemangiomatosis of the Spleen // Gastroenterology. — 1977. — 72, Pt. 1. — Р. 937-940.
33. Raby N., Meire H.B. Duplex ultrasound in the diagnosis of cavernosis transformation of the portal vein // Radiol. — 1988. — V. 61. — P. 586-588.
34. Simoneau G., Gaile N., Rubin L.J. et al. Clinical classification of pulmonary hypertension // J. Am. Coll. Cardiol. — 2004. — 43. — Р. 5-12.
/51.jpg)

/54.jpg)