Украинский журнал хирургии 2 (37) 2018
Вернуться к номеру
Порівняльне модельне дослідження механічної резистентності стінок кишки та шлунка до тиску в прототипі пристрою для створення циркулярного анастомозу
Авторы: Подпрятов С.С.(1, 2), Подпрятов С.Є.(1, 2), Маринський Г.С.(3), Чернець О.В.(3), Ткаченко В.А.(3), Грабовський Д.А.(3), Лопаткіна К.Г.(3), Ткаченко С.В.(3), Буряк Ю.З.(3), Сердюк В.К.(3)
(1) — Київський міський лікувальний навчально-впроваджувальний центр електрозварювальної хірургії та нових хірургічних технологій, м. Київ, Україна
(2) — Київська міська клінічна лікарня № 1, м. Київ, Україна
(3) — Інститут електрозварювання ім. Є.О. Патона НАН України, м. Київ, Україна
Рубрики: Хирургия
Разделы: Клинические исследования
Версия для печати
Актуальність. Створення структурного з’єднання в анастомозі вимагає попереднього стиснення стінки кишечника на межі його структурної деформації. Необхідна величина тиску знаходиться в діапазоні від фізіологічних значень 0,005–0,4 Н/м2 до застосованих дослідниками 1–6 Н/мм2. Мета: отримати дані про зміни механічної резистентності та зробити проекцію на її структурні компоненти на основі порівняльного дослідження стінок кишечника й шлунка під тиском в модельному експерименті. Матеріали та методи. Свинячі кишечник і шлунок доставляли з ферми в лабораторію протягом 6 годин при 4 °С, після чого нагрівали в 0,9% NaCl до 26–32 °С. Дві стінки органа укладали та фіксували всередині прототипу пристрою для створення кругового анастомозу людини, між електродами, після чого піддавали дії певної величини тиску протягом 60 секунд, безпосередньо перед радіочастотним електрозварюванням. Здійснили 117 проб в декількох комбінаціях, за яких досліджували дію тиску величиною 2,1, 3,0, 3,9 та 6,0 Н/мм2 (або 2,1–6,0 × 104 Н/м2). Зміни товщини стінки органа визначали приєднаним до електродів мікрометром. Результати. Графік швидкості потоншення стінок органів, яка є обернено пропорційною до її механічної резистентності, візуально розділений на дві фази: швидкого (1–5 с) і значного потоншення невдовзі після прикладення тиску та подальшого повільного та низькоамплітудного витончення. Резистентність стінки тонкої кишки була вищою, ніж у шлунка, а також у комбінації стінок шлунка та кишечника при всіх значеннях досліджуваного тиску. Діапазон значень потоншення починався від 43–54 і до 92–99 %. Протягом другої фази витончення його темп більше вказував на величину прикладеного тиску, ніж на тип стінок органів. При цьому темп був повільнішим в діапазоні прикладеного тиску 3,0–3,9 Н/мм2, що дає підстави визначити межу резистентності м’язового шару та загальної цілісності стінки кишки та шлунка в цьому діапазоні. Висновки. Амплітуду стиснення стінки порожнистого органа в інструменті в першій фазі прикладення тиску слід планувати відповідно до особливостей складу тканин його стінки. Межа механічної резистентності м’язового шару та загальної цілісності стінки кишки і шлунка перебуває в діапазоні тиску 3,0–3,9 Н/мм2, прикладеного протягом 60 секунд.
Актуальность. Создание структурного соединения в анастомозе требует предварительного сжатия стенки кишечника на границе его структурной деформации. Необходимая величина давления находится в диапазоне от физиологических значений 0,005–0,4 Н/м2 до примененных исследователями 1–6 Н/мм2. Цель: получить данные об изменениях механической резистентности и сделать проекцию на ее структурные компоненты на основе сравнительного исследования стенок кишечника и желудка под давлением в модельном эксперименте. Материалы и методы. Свиные кишечник и желудок доставляли с фермы в лабораторию в течение шести часов при 4 °С, после чего нагревали в 0,9% NaCl до 26–32 °С. Две стенки органа заключали и фиксировали внутри прототипа устройства для создания кругового анастомоза человека, между электродами, после чего подвергали воздействию определенной величины давления в течение 60 секунд, непосредственно перед радиочастотной электросваркой. Осуществили 117 проб в нескольких комбинациях, в которых исследовали действие давления величиной 2,1, 3,0, 3,9 и 6,0 Н/мм2 (или 2,1–6,0 × 104 Н/м2). Изменения толщины стенки органа определяли присоединенным к электродам микрометром. Результаты. График скорости утончения стенок органов, которая является обратно пропорциональной ее механической резистентности, визуально разделен на две фазы: быстрого (1–5 с) и значительного утончения вскоре после приложения давления и последующего медленного и низкоамплитудного истончения. Резистентность стенки тонкой кишки была выше, чем в желудке, а также в комбинации стенок желудка и кишечника при всех значениях исследуемого давления. Диапазон значений утончения начинался от 43–54 и до 92–99 %. В течение второй фазы истончения его темп больше указывал на величину приложенного давления, чем на тип стенок органов. При этом темп был медленным в диапазоне приложенного давления 3,0–3,9 Н/мм2, что позволяет определить границу резистентности мышечного слоя и общей целостности стенки кишки и желудка в этом диапазоне. Выводы. Амплитуду сжатия стенки полого органа в инструменте в первой фазе приложения давления следует планировать в соответствии с особенностями состава тканей его стенки. Предел механической резистентности мышечного слоя и общей целостности стенки кишки и желудка находится в диапазоне давления 3,0–3,9 Н/мм2, приложенного в течение 60 секунд.
Background. The vital margins of the gut wall squeezing, which is observed in cases of functional distension, negative pressure wound therapy or magnetic anastomosis device placing, ranged from 0.005 to 0.4 N/m2. The desirable short-time formation of structural connection in anastomotic line due to radio frequency electric influence, obviously, requires not vital, but a tight compression of the intestine wall on the verge of its structural deformation. C. Holmer et al. established the optimal value of electrode pressure onto the porcine intestine close to 1,125 mN/mm2.
In our experiments, compression range of 2–6 · 104 N/m2 was found as more favorable for the radio frequency electric welding connection in anastomosis of the hollow organs. The purpose was to study the mechanical resistance of gut and stomach walls for comparative projection on its structural changes under strong pressure at the anastomosis model conditions. Materials and methods. The porcine intestine and stomach were delivered from the farm to laboratory during 6 hours in 4 оС and then heated in 0.9% NaCl up to 26–32 оС [6]. Two organ walls were placed inside the prototype device for human circular anastomosis, and then pressed for 60 seconds before radio frequency welding. The 117 probes were made in several combinations investigating pressure values 2.1, 3.0, 3.9 and 6.0 N/mm2 (or · 104 N/m2) effect for organ wall by connected micrometer device. Results. The wall thinning time, which is inversely proportional to resistance, visually divided into two phases: the fast (1–5 s) and significant thinning of the tissue after initial pressure application, then slow and low-amplitude thinning. The small intestine wall resistance was higher than the stomach one as well as the combination of the stomach and intestinal under all values of initial pressure. Conclusions. The first compression phase is unique according to the thinned organ. Some thinning rate decrease occurred at the second phase under the pressure 3.0–3.9 N/mm2 comparing to 2.1 N/mm2 up to 60 seconds, determines the limit of mechanical resistance of the wall muscle layer as well as overall gut and stomach integrity up to such pressure level. Obtained data helps to project the structural changes inside intestinal and/or stomach walls compressed into circular anastomotic device, which is important for the planning of further effects.
резистентність; тиск; стінка кишки; шлунок; анастомоз; інструмент; свиня
резистентность; давление; стенка кишки; желудок; анастомоз; инструмент; свинья
resistance; pressure; intestine wall; stomach; anastomosis; instrument; pig
Вступ
Наявні дослідження зміни товщини стінки кишки моделюють межі фізіологічних і клінічних станів, не досягаючи структурних меж міцності.
Негативний зовнішній тиск присмоктування, сильніший за 0,006 Н/м2, спричинює стійкий розлад кровообігу в стінці кишки, навіть опосередковано через мембрану [1]. Максимальне фізіологічне розтягнення стінки дванадцятипалої кишки відбувається внаслідок повільного зростання розпираючого тиску до 0,005 Н/м2 і стресового — до 0,065 Н/м2. При цьому витончення стінки на 50 % відбувалося лінійно, на відміну від триетапного збільшення окружності кишки [2]. Для створення міжкишкового анастомозу за механізмом повільного ішемічного некрозування внаслідок стискання магнітними з’єднувальними кільцями тиск всередині них становить 0,1– 0,4 Н/м2 [3].
Бажана одномоментність створення структурного міжкишкового з’єднання в анастомозі під радіочастотним електричним впливом вочевидь вимагає не життєздатного, а щільного стискання стінки кишки, на межі її структурної деформації.
С. Holmer зі співавторами отримали найкращу міцність такого з’єднання при стисканні стінки кишки свині між електродами 1,125 Н/мм2 [4]. В наших експериментах більш оптимальним тиском для створення радіочастотного електричного «електрозварювального» з’єднання порожнистих органів визначили стискання в діапазоні 2–
6 Н/мм2 [5], даних про вплив якого на механічні властивості стінки кишки чи шлунка ми не знайшли в літературі.
Мета: отримати дані про зміни механічної резистентності та зробити проекцію на її структурні компоненти на основі порівняльного дослідження стінок кишечника й шлунка під тиском в модельному експерименті.
Матеріали та методи
Дослідження здійснили в умовах лабораторії відділу електрозварювання живих тканин Інституту електрозварювання ім. Є.О. Патона НАН України.
Матеріалом для дослідження був біоімітатор кишки та шлунка людини з відповідним діаметром та товщиною стінки органа. Біоімітатором слугував органокомплекс сільськогосподарської тварини — свині. Органокомплекс у свині забирали безпосередньо на фермі після умертвіння, яке було заплановане з не пов’язаними з експериментом причинами та відбувалося з дотриманням вимог Закону України № 3447-IV «Про захист тварин від жорстокого поводження» та законодавства ЄС.
Біоімітатор охолоджували до 4 °С та протягом 6 годин доставляли до лабораторії. В лабораторії його готували до експерименту, занурюючи у теплий (26–32 °С) розчин 0,9% NaCl на 10–20 хв, до досягнення тканиною температури розчину [6]. Температуру тканини та розчину вимірювали інфрачервоним безконтактним пірометром GM300 (Benetech).
Використовували розроблений в інституті електрозварювання експериментальний електрозварювальний стенд з електродною частиною — прототипом клінічного інструмента.
Біоімітатор складали вдвічі, серозними оболонками до середини, моделюючи розташування кишки в циркулярному анастомозі, та фіксували між електродами експериментального стенду. Випробували три варіанти складання біоімітатора: кишка до кишки, шлунок до шлунка та кишка до шлунка.
У 117 пробах прикладали до електродів навантаження, створюючи між ними тиск 2,1, 3,0, 3,9 або 6,0 Н/мм2 (2,1–6,0 ´ 104 Н/м2) протягом 60 секунд. Показники тиску та тривалість виміру були встановлені нами в попередніх дослідженнях як етапні для тонкої кишки.
Мікрометр «Індикатор багатообертовий годинникового типу 1МИГП», клас точності 1,0 (ТОВ «Западприбор»), приєднували до електроду дослідного стенду та здійснювали виміри в статичному положенні й динаміці стискання, його покази фіксували на відео. Використовуючи ці показання, визначали первинну товщу тканини стінки кишки між електродами, динаміку та амплітуду стиснення, остаточну товщу тканини між електродами.
Статистичні дані оцінювали з застосуванням дисперсійного аналізу (ANOVA) та t-тесту Стьюдента. Рівень був встановлений на рівні P < 0,05. Дані аналізували, використовуючи відкрите програмне забезпечення.
Результати та обговорення
Механічна резистентність стінки кишки порожнистого органа змінювалась залежно від величини тиску та тривалості його впливу. Темп стиснення, який обернено пропорційний зростанню резистентності, можна умовно розподілити на дві фази: перша — швидка фаза первинного стиснення, друга — фаза повільного подальшого стиснення.
Під час первинного прикладення тиску відбувалося значне витончення тканини між тиснучими поверхнями електродів.
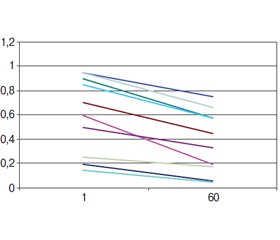
При цьому резистентність тонкої кишки була вищою за резистентність шлунка та комбінації шлунок — кишка в усіх варіантах стискання: 2,1; 3,0–3,9; 6,0 Н/мм2 (рис. 1–6).
Резистентність комбінації шлунка з тонкою кишкою була подібною до резистентності шлунка (рис. 7, 8).
Відносне потоншення шлунка під тиском 2,1 Н/мм2 в І фазі стиснення перевищувало цей показник у тонкої кишки в кілька разів (табл. 1).
Структурною складовою стінки шлунка, яка первинно стискається на 83,6 % та може за своїми якостями відрізнятися в кілька разів від такої складової в стінці тонкої кишки, є слизова оболонка з підслизовим шаром. Це припущення підтверджується подібністю результатів відносного потоншення комбінації стінок тонкої кишки й шлунка з потоншенням двох стінок шлунка під тиском 3,0–3,9 Н/мм2.
Можна припустити, що висока повторюваність відносного потоншання слизової оболонки під тиском 2,1 Н/мм2 зумовлена відповідністю її природній резистентності, надто у шлунку.
Під тиском 3,0–3,9 Н/мм2 відбувається кількаразове збільшення покажчика відносного потоншення тонкої кишки і наближення до такого в шлунку. Оскільки відносна товщина слизової оболонки тонкої кишки менша, найвищий покажчик діапазону стиснення може свідчити про стиснення або руйнування м’язового шару стінки кишки.
Під тиском 6,0 Н/мм2 зростання ширини діапазону результатів та наближення окремих до 100 % свідчить про високу ймовірність руйнування м’язового шару стінки органу.
У другій фазі стиснення відбувалось повільніше, і його темп більше вказував на величину прикладеного тиску, ніж на тип складених стінок (рис. 9–13).
Але органна відмінність найяскравіше відбилася в зміні товщини під тиском 3,0–3,9 Н/мм2. Порівняно з таким під тиском 2,1 Н/мм2 стискання стінок тонкої кишки відбувалося подібно, а стискання стінок шлунка відбувалося глибше, з нижчої точки старту і з нижчим темпом (табл. 2), що, на нашу думку, зумовлено додатковою резистентністю внаслідок товщого підслизового шару.
Під тиском 6 Н/мм2 притиснення не лише поглиблювалося відносно попередніх проб (табл. 2), але й зростав його темп (рис. 14–16), незважаючи на нижчу точку старту. При цьому стиснення в шлунку та комбінації шлунка з кишкою відбувалося у двох варіантах темпу, що відбилося на коливанні середніх покажчиків кінцевої товщини, — 0,37 ± 0,21 мм і 0,35 ± 0,26 мм відповідно, що дає підстави припустити структурне руйнування м’язового шару стінок шлунка та кишки принаймні в одному з варіантів темпу.
Загалом, деяке сповільнення темпу стискання в другій фазі відбувалося в діапазоні тиску 3,0–3,9 Н/мм2 порівняно з 2,1 Н/мм2 (табл. 2), що дає підстави визначити межу резистентності м’язового шару та загальної цілісності стінки кишки та шлунку в цьому діапазоні.
Висновки
1. Характеристики первинного стиснення внаслідок прикладення зовнішнього тиску є характерними для кожного порожнистого органа, натомість подальше стиснення залежить переважно від величини прикладеного тиску.
2. Межа механічної резистентності м’язового шару та загальної цілісності стінки кишки та шлунка перебуває в діапазоні тиску 3,0–3,9 Н/мм2, прикладеному протягом 60 секунд.
3. Отримані показники окреслюють перебіг структурних змін у складених стінках тонкої кишки та/або шлунка у моделі циркулярного анастомозу, що є важливим для планування подальшого впливу з метою створення з’єднання між стінками.
Перспектива подальших досліджень. Отримані дані допомагають оцінити структурні зміни усередині стінки кишки та/або шлунка, стиснутих в циркулярному прототипі інструмента, що є важливим для планування подальшого електрозварного впливу для створення анастомозу.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Lindstedt S., Malmsjö M., Hlebowicz J., Ingemansson R. Comparative study of the microvascular blood flow in the intestinal wall, wound contraction and fluid evacuation during negative pressure wound therapy in laparostomy using the V.A.C. abdominal dressing and the ABThera open abdomen negative pressure therapy system // Int. Wound. J. — 2015 Feb. — 12(1). — Р. 83-8.
2. Jørgensen C.S., Dall F.H., Jensen S.L., Gregersen H. A new combined high-frequency ultrasound-impedance planimetry measuring system for the quantification of organ wall biomechanics in vivo // Int. Wound. J. — 2013 Aug. — 10(4). — Р. 411-7.
3. Fei Xue, Hong-Chang Guo, Jian-Peng Li, Jian-Wen Lu, Hao-Hua Wang, Feng Ma, Ya-Xiong Liu, Yi Lv. Choledochojejunostomy with an innovative magnetic compressive anastomosis: How to determine optimal pressure? // World J. Gastroenterol. — 2016 Feb 21. — 22(7). — Р. 2326-2335.
4. Holmer C., Winter H., Kröger M., Nagel A., Jaenicke A., Lauster R., Kraft M., Buhr H.J., Ritz J.P. Bipolar radiofrequency-induced thermofusion of intestinal anastomoses-feasibility of a new anastomosis technique in porcine and rat colon // Langenbecks Arch. Surg. — 2011 Apr. — 396(4). — Р. 529-33.
5. Подпрятов С.Є., Гичка С.Г., Подпрятов С.С., Маринський Г.С., Чернець О.В., Ткаченко В.А., Грабовський Д.А., Лопаткіна К.Г., Ткаченко С.В., Буряк Ю.З., Сердюк В.К. Складові утворення електрозварного з’єднання шлунка та тонкої кишки // Клінічна хірургія. — 2017. — 2. — С. 57-58.
6. Егоров В.И., Турусов Р.А., Счастливцев И.А., Баранов А.О. Кишечный шов. Физико-механические аспекты. — М.: Видар, 2004. — 200 с.

/55-1.jpg)
/56-1.jpg)
/58-1.jpg)
/57-1.jpg)