Украинский журнал хирургии 2 (37) 2018
Вернуться к номеру
Сучасні методики лікування гемороїдальної хвороби з використанням різних видів енергії (огляд літератури)
Авторы: Кондратенко А.П.
Донецький національний медичний університет, м. Лиман, Україна
Рубрики: Хирургия
Разделы: Справочник специалиста
Версия для печати
Частота виникнення геморою серед працездатного населення призводить до тимчасової непрацездатності в періоди загострення, а також до зниження рівня якості життя, що робить лікування геморою важливою загальномедичною і соціально-економічною проблемою. Найкраща тактика лікування хронічного геморою, як і раніше, залишається не простою та до кінця не вирішеною проблемою. У статті проведений порівняльний аналіз технік виконання гемороїдектомії за допомогою використання різних інструмантальних методів шляхом вивчення спеціалізованої літератури.
Частота возникновения геморроя среди трудоспособного населения приводит к временной нетрудоспособности в периоды обострения, а также к снижению качества жизни, что делает лечение геморроя важной общемедицинской и социально-экономической проблемой. Лучшая тактика лечения хронического геморроя по-прежнему остается непростой и до конца не решенной проблемой. В статье проведен сравнительный анализ техник выполнения геморроидэктомии посредством использования различных инструментальных методов путем изучения специализированной литературы.
The incidence of hemorrhoids among working age population leads to temporary disability during periods of exacerbation, as well as to a decrease in the quality of life, which makes hemorrhoid treatment an important medical and socio-economic problem. The best approach to the treatment of chronic hemorrhoids remains a complex and unresolved problem. The article presents a comparative analysis of techniques for performing hemorrhoidectomy using various instrumental methods through the study of specialized literature.
геморой; гемороїдальна хвороба; гемороїдектомія; ультразвукова коагуляція; лазерна гемороїдектомія; огляд
геморрой; геморроидальная болезнь; геморроидэктомия; ультразвуковая коагуляция; лазерная геморроидэктомия; обзор
hemorrhoids; hemorrhoidal illness; hemorrhoidectomy; ultrasonic coagulation; laser hemorrhoidectomy; review
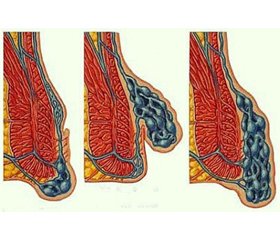
Геморой — одна з найпоширеніших аноректальних патологій у розвинених країнах. Частота виникнення досягає 120–140 випадків на 1000 дорослого населення [5, 14, 42, 50]. Серед захворювань прямої кишки і анального каналу гемороїдальна хвороба становить 34–41 % [14, 19, 32]. Середній вік людей, які страждають від гемороїдальної хвороби, становить 30–50 років [5, 14, 33, 39]. Частота виникнення геморою серед працездатного населення, що призводить до тимчасової непрацездатності в періоди загострення, а також до зниження рівня якості життя, робить лікування геморою важливою загальномедичною і соціально-економічною проблемою.
В Україні оперативне лікування геморою застосовується в 75 % хворих, які звернулися за медичною допомогою. Незважаючи на наявність міні-інвазивних методів лікування, і до сьогодні найбільш популярним методом лікування залишаються операція Міллігана — Моргана та її модифікації, спрямовані на висічення основних груп гемороїдальних вузлів [5, 14, 21, 40]. Найкраща тактика лікування хронічного геморою, як і раніше, залишається не простою та до кінця не вирішеною проблемою. Невщухаючий інтерес до неї викликаний не цілком задовільними результатами оперативного лікування. Різні ранні та пізні ускладнення після геморроїдектомії продовжують залишатися досить частими та досягають 20–34 % [3, 5, 14, 30, 52].
Протягом останнього десятиліття в Україні в практику широко впроваджуються методи оперативного лікування, що засновані на досягненнях сучасних медичних технологій. Усе частіше для хірургічного втручання використовуються різні сучасні апарати: електроножі, лазери, радіохвильові й ультразвукові скальпелі, зшиваючі апарати. Широко застосовуються міні-інвазивні методи лікування. Не менше ніж у 30 % хворих на геморой виникають показання до радикальної гемороїдектомії [5, 13, 30]. Як правило, це пацієнти з III–IV стадіями хронічного комбінованого геморою.
Згідно з даними Г.І. Воробйова та співавт. [5] і C. Simillis та співавт. [27], існує приблизно 300 методів оперативного лікування геморою. Однак значного поширення набули лише кілька з них. Принципово всі методи оперативного лікування діляться на такі групи.
Перша група оперативних втручань спрямована на видалення основних колекторів кавернозної тканини. В 1937 р. у госпіталі Святого Марка в Лондоні англійські проктологи E. Milligan і C. Morgan запропонували спосіб геморроїдектомії, що до сьогодні залишається найбільш популярним методом лікування гемороїдальних хвороб. Класична гемороїдектомія за Мілліганом — Морганом полягає у висіченні зовні всередину трьох груп внутрішніх і зовнішніх гемороїдальних вузлів із прошивкою і перев’язкою їх судинних ніжок біля основи. При цьому в анальному каналі утворюється три рани, що не зашиваються, а залишаються відкритими, тому операцію Міллігана — Моргана часто називають відкритою гемороїдектомією.
Згодом, а також із накопиченням досвіду методики гемороїдектомії зазнали низку істотних змін. Існуючі нині модифікації відрізняються від оригінальної використанням різних прийомів (повне або часткове ушивання слизової і т.д.), а також застосуванням сучасних технічних засобів (використання діатермокоагуляції, біполярної коагуляції, лазерної коагуляції, ультразвукової дисекції, плазмового скальпеля і т.д.) [5, 26, 27, 41, 44].
Удосконалення технічних засобів оснащення дозволило використовувати електрокоагуляцію для впливу на тканини під час оперативних втручань. Найбільшого поширення набула високочастотна монополярна електрокоагуляція, при якій можливо коагулювати судини діаметром не більше 1 мм. При виконанні гемороїдектомії як основа використовується принцип операції Міллігана — Моргана з лігуванням судинної ніжки гемороїдального вузла, кавернозні тільця висікаються в режимі електрокоагуляції. Гемороїдектомія із застосуванням високочастотної електрокоагуляції може виконуватися з подальшим ушиванням дефекту слизової оболонки або з відкритим залишенням ран.
До недоліків електрокоагуляції відносять: велику глибину термічного впливу на оточуючі тканини, більш тривалі терміни загоєння ран, ненадійність гемостазу при коагуляції судин більше 1 мм, необхідність у зв’язку з цим додатково лігувати судинну ніжку [6, 17, 24].
Відносно недавно в клінічній практиці стали використовувати електротермічну систему, так звану апаратно-контрольовану біполярну коагуляцію Liga Sure [16, 27]. Сучасною альтернативою класичній гемороїдектомії є метод біполярної коагуляції гемороїдальних вузлів апаратом Liga Sure, успішно використовується в III–IV стадії захворювання. В основу методу покладено принцип біполярної коагуляції модернізованим генератором, забезпеченим блоком оберненого зв’язку, що дозволяє диференціювати тканини. Система забезпечує точне дозування енергії, що подається, і тиску електрода на тканину протягом необхідного часу з метою повного і надійного заварювання судин, а також дозволяє звести до мінімуму прилипання тканини до браншей зажиму, обвуглювання і термічне пошкодження прилеглих тканин. Операція виконується за принципом операції Міллігана — Моргана, гемороїдальні вузли біля основи коагулюються апаратом Liga Sure, після формування щільного струпа гемороїдальний вузол відсікається. Міцність «завареної» зони порівнянна з міцністю прошитої тканини. У зв’язку з цим гемороїдектомію з використанням біполярної апаратно-контрольованої коагуляції називають закритою безшовною гемороїдектомією. При цьому не виникає звичного опіку тканини, а відбувається її зварювання за рахунок полімеризації власного колагену, і замість звичайного струпа рана покривається колагеновою плівкою [10, 28, 30, 34].
Тривалість закритої безшовної гемороїдектомії становить близько 15–25 хв. Використання біполярної коагуляції апаратом Liga Sure скорочує крововтрату під час операції, дозволяє відмовитися від використання шовного матеріалу, зменшує кількість ранніх післяопераційних ускладнень [28, 40]. Незважаючи на те, що больовий синдром у післяопераційному періоді при даній методиці менш виражений, ніж після традиційної операції, тривалість післяопераційного лікування не набагато менша, ніж при використанні електроножа, лазера або радіохвильового скальпеля, і визначається величиною раньових дефектів анального каналу [44, 51, 45].
Із середини 80-х років минулого сторіччя в арсеналі хірургів з’явився лазерний скальпель. На зорі становлення лазерної хірургії під час гемороїдектомії переважно застосовувалися СО2-лазери і Nd-YAG-лазери для видалення гемороїдальних вузлів [6, 36]. У сучасних умовах застосовуються діодні високоенергетичні імпульсні лазери, у яких розширився діапазон довжин хвиль лазерного випромінювання, підвищилася їх надійність. Акумулювання енергії лазерного випромінювання на кінці світловода в сучасних поколіннях хірургічних лазерних апаратів і концентрація променя лазера у вигляді плями малого розміру дозволяють уникнути опікових реакцій, зменшити глибину коагуляційного некрозу оточуючих тканин [6, 38]. Разом із виконанням гемороїдектомії за Мілліганом — Морганом, де резекційний етап використовується із застосуванням високочастотного лазера, багатьма авторами так само широко використовується метод лазерної коагуляції гемороїдального вузла шляхом введення світловода в його товщу після попереднього лігування судинної ніжки. Метод заснований на тому, що внутрішні гемороїдальні сплетіння знаходяться в підслизовому шарі, накінечником лазерного світловоду механічно придавлюються до м’язового шару. Лазер коагулює поверхню слизової оболонки і венозних структур, завдяки чому відбуваються коагуляція останніх з їх фіксацією до м’язів, зменшення кровонаповнення, зпустошення кавернозних тіл і, як наслідок, зменшення гемороїдальних вузлів у розмірах.
Коагуляція проводиться в 3–4 точках біля основи гемороїдального вузла. На місці коагуляції виникає поверхнева опікова рана зі струпом до 2–3 мм у діаметрі і глибиною ураження трохи більше 1 мм із повною епітелізацією протягом 2–3 тижнів [31, 46, 52].
Застосовувана сьогодні лазерна гемороїдектомія (laser gemoroidectomy) має низку переваг перед гемороїдектомією стандартним скальпелем і з використанням електрокоагуляції: зменшення тривалості операції, робота в умовах мінімальної кровоточивості розсічених тканин, зниження рівня післяопераційних ускладнень, зменшення інтенсивності післяопераційного больового синдрому.
Останнім часом у спеціальній літературі з’явилися публікації [42, 43, 47] про успішне застосування в хірургії та колопроктології ультразвукового скальпеля Harmonic. Принцип дії ультразвукового гармонійного скальпеля заснований на коливанні робочої насадки, що призводить до руйнування водневих з’єднань у білкових структурах колагену та їх склеювання. Утворений коагулят надійно обтурує просвіт кровоносних судин до 5 мм у діаметрі, при цьому глибина термічного впливу обмежена — 1,5 мм [44, 48]. При виконанні такої операції зберігається принцип гемороїдектомії за Мілліганом — Морганом: після розтину анодерми і слизової анального каналу навколо зовнішнього і внутрішнього гемороїдальних вузлів ультразвуковим скальпелем із застосуванням (по черзі) режиму коагуляції і різання виконується висічення кавернозної тканини. Судинна ніжка гемороїдального вузла не прошивається, а перетинається в режимі коагуляції. Утворені ранові поверхні зашиваються або ведуться відкрито залежно від прийнятої тактики.
Більшість авторів [25, 43, 44, 52] повідомляють про зниження інтенсивності післяопераційного больового синдрому після гемороїдектомії ультразвуковим скальпелем порівняно з традиційною операцією. За цими даними, зниження інтенсивності післяопераційного больового синдрому після гемороїдектомії ультразвуковим скальпелем порівняно із застосуванням монополярної коагуляції пов’язано з меншою глибиною термічного ураження тканин. Однак суттєво не відрізняється від гемороїдектомїі, що виконана лазером. Разом із тим і після застосування ультразвукового скальпеля в аноректальній зоні залишаються рани (при хронічному геморої III–IV стадії — великі), і проблема їх інфікування і вторинного загоєння багато в чому нівелює унікальні властивості ультразвукового впливу.
Із середини 70-х років минулого століття значне поширення в практичній хірургії отримав плазмовий скальпель. Принцип роботи плазмового генератора заснований на пропущенні інертного газу через електричний розряд, що виникає між двома електродами. При цьому відбуваються іонізація газу (аргону) й утворення факела плазми, що виходить із сопла маніпулятора. Температура потоків варіює від 3000 до 12 000 °С залежно від обраного режиму роботи і модифікації установки [2, 49, 50]. Після попередньої перев’язки судинної ніжки гемороїдального виконується висічення кавернозної тканини за допомогою плазмового скальпеля. За даними проведених досліджень, глибина коагуляційного некрозу у видалених гемороїдальних вузлах становить не більше 0,5 мм.
Враховуючи, що плазмовий пучок може надійно забезпечити гемостаз судин розміром 3–5 мм, автори [2, 22] рекомендують судинну ніжку гемороїдального вузла перетинати за допомогою плазмового скальпеля без попереднього її прошивання. З особливостей техніки оперативної допомоги слід зазначити, що з метою мінімізації термічного ураження анодерми навколо зовнішнього вузла і слизової навколо внутрішнього гемороїдального вузла попередньо розсікають їх за допомогою високочастотного електрокоагулятора, потім, захистивши оточуючі тканини вологими серветками, виконується висічення гемороїдальних вузлів плазмовим скальпелем [2, 12, 53]. Утворені раньові поверхні, як правило, не зашиваються. Порівняно з традиційною гемороїдектомією за Мілліганом — Морганом при застосуванні плазмового скальпеля зменшується тривалість оперативного втручання, знижується інтенсивність післяопераційного больового синдрому. Незважаючи на ряд переваг, терміни епітелізації ран, період реабілітації залишаються досить тривалими — близько 3–3,5 тижня [12, 37].
Відомі на сьогодні способи розтину тканин мають ряд суттєвих недоліків. Механічний розтин не забезпечує необхідного гемостазу, електрохірургічний вплив на тканини викликає коагуляційний некроз у зоні контакту з пластиною електроскальпеля, використання ультразвукової дисекції часто призводить до нагноєння ран, а при лазерному розтині тканин неминуче виникає опік у зоні впливу променя [23, 51]. Знахідкою стало виявлення незвичайного ефекту впливу енергії високочастотних радіохвиль на біологічну тканину. При впливі високочастотної радіохвилі на живі тканини у зоні зіткнення відбувається миттєве вивільнення внутрішньомолекулярної енергії і починається «випаровування» тканин. При цьому не виникає зони коагуляційного некрозу, а за рахунок випаровування рідини в просвіті пересічених судин реалізується коагуляційний ефект. Такий вплив енергії радіохвилі на біологічну тканину послужив приводом до розробки та впровадження в медичну практику радіохірургічного скальпеля [6, 23, 29].
Оперативне втручання виконується зі збереженням принципу операції Міллігана — Моргана. З особливостей слід зазначити, що спочатку прошивається судинна ніжка внутрішнього гемороїдального вузла. Далі за допомогою радіочастотного скальпеля Fcare systems у різних режимах різання і коагуляції виконується висічення гемороїдальних вузлів. Утворені рани, як правило, не зашиваються. За даними авторів [41], радіочастотна гемороїдектомія супроводжується значно менш вираженим післяопераційним больовим синдромом і досить швидким періодом загоєння післяопераційних ран [6, 10, 18].
До наступної групи операцій із приводу хронічного геморою можна віднести оперативні втручання, спрямовані на припинення артеріального припливу крові до гемороїдальних вузлів за кінцевими гілками верхньої ректальної артерії.
У 1995 р. японськими хірургами K. Morigana, K. Hasuda, T. Ikeda була розроблена методика трансанальної дезартеризації внутрішніх гемороїдальних вузлів під контролем ультразвукової допплерометрії. При геморої III–IV стадії на тлі дезартеризації відбувалося зменшення в розмірах кавернозної тканини гемороїдального сплетіння, проте внаслідок руйнування зв’язково-м’язового апарату гемороїдального сплетіння зберігався пролапс слизової. З огляду на сучасні дані про патогенез і морфофункціональні порушення при геморої в кінці 2005 р. методика дезартеризації була змінена і стала поєднувати комбінацію перев’язки гемороїдальних артерій і трансанальної мукопексії пролабуючої тканини. У літературі цей спосіб лікування зустрічається під назвою «трансанальна допплер-контрольована дезартеризація в поєднанні з мукопексією» (HAL-RAR, ліфтингова дезартеризація гемороїдальних вузлів) [5, 6, 9, 11, 33].
Для виконання операції HAL-RAR необхідні певні оснащення: допплер-аналізатор для трансанальної дезартеризації, спеціальний аноскоп з ультразвуковим датчиком і вікном для прошивання і перев’язки виявленої артерії. Після виконання допплерометрії проводиться прошивання артерії восьмиподібним швом. Ефективність лігування контролюється допплерометрією. Таким чином, прошиваються всі гемороїдальні артерії по всьому колу кишки, зазвичай від 4 до 7 постійних артерій, розташованих в 90 % на 1, 3, 5, 7, 9 і 11-й годинах за умовним циферблатом [9]. Далі виконуються ліфтинг і мукопексія слизової. Безперервний шов формується від проксимальної ділянки до дистальної частини, не доходячи до рівня зубчастої лінії на 5–6 мм. Як правило, потрібно накладання 3–5 стібків з інтервалом 0,8–1,0 см. Нитки пов’язують, підтягуючи слизову. Ліфтинг проводиться по всьому периметру кишки, як правило, на 11, 6, 3-й годинах умовного циферблату.
Післяопераційний больовий синдром у 1-шу та 3-тю добу після операції незначний і становить, за даними Е.А. Загрядського [9], 2–3 бали за цифровою шкалою болю.
Тривалість стаціонарного лікування в пацієнтів із хронічним гемороєм III стадії в середньому становить 2–3 доби, а до 5-ї доби переважна більшість пацієнтів повертається до звичної трудової діяльності. Ускладнення раннього післяопераційного періоду зустрічаються в 3–5 % пацієнтів [9, 11]. Віддалені результати лікування свідчать про високу ефективність методики трансанальної дезартеризації в пацієнтів із хронічним гемороєм II–III стадії [4, 9]. Дослідженнями К.Н. Комяк [11] встановлено, що у віддаленому періоді відзначається повне відновлення кровообігу в зоні хірургічного втручання.
Висновки
Таким чином, відмічається велике різноманіття застосованих методик у лікуванні хронічного геморою, у тому числі з використанням традиційного висічення гемороїдальних вузлів або з використанням різноманітних енергій, таких як електронож, ультразвуковий або плазмовий скальпелі. Разом із тим колопроктологи з найбільшими труднощами стикаються при лікуванні хронічного комбінованого геморою III–IV стадії. Це обумовлено розвитком у пацієнтів даної групи порушення зв’язкового апарату внутрішніх гемороїдальних вузлів, випаданням слизової оболонки й анодерми, порушенням анатомії анального каналу. Необхідність видалення значної за обсягом кількості кавернозної тканини призводить до утворення великої за площею поверхні рани при відкритій гемороїдектомії або до звуження анального каналу при накладенні швів на слизову оболонку. Цим пояснюється досить великий відсоток розвитку післяопераційних ускладнень у хворих, які були прооперовані з приводу хронічного комбінованого геморою III–IV стадії. У 23–34 % хворих у ранньому післяопераційному періоді виникає виражений больовий синдром, у 15–20 % розвиваються дизуричні розлади, у 2–4 % — кровотечі [5, 14, 27]. У віддаленому періоді в 5–9 % прооперованих хворих розвиваються стриктури анального каналу, а у 2–4 % — виявляється слабкість анального сфінктера [3, 5, 27, 44]. Період загоєння післяопераційних ран становить 4–6 тижнів [3, 5].
Для електричних енергій, таких як біполяр і монополяр (Liga Shou), період загоєння в середньому становив 25,7 дня. При лазерній коагуляції гемороїдальних вузлів загоєння проходило протягом 21 ± 7 днів [50]. Рани після ультразвукової гемороїдектомії гояться протягом 23 ± 16 днів [33]. А рани після операції Лонго заживають у середньому за 8 днів.
Численність застосованих методик пояснюється прагненням хірургів досягти радикального лікування пацієнтів у поєднанні з оптимальними функціональними результатами. Ось чому розробка і впровадження в клінічну практику нових методик гемороїдектомії і вдосконалення вже наявних є актуальним завданням сучасної колопроктології.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
1. Богомазов Ю.К. Сравнительная оценка хирургического лечения хронического геморроя с применением механического шва и закрытой стандартной геморроидэктомии: Автореф. дис... канд. мед. наук / Ю.К. Богомазов. — М., 2007. — 23 с.
2. Борисов И.Ф. Геморроидэктомия плазменным скальпелем: Автореф. дис… канд. мед. наук / И.Ф. Борисов. — М., 2011. — 16 с.
3. Благодарный, Л.А. Как улучшить результаты хирургического лечения геморроя / Л.А. Благодарный, Ю.А. Шелыгин // Consilium medicum. Хирургия. — 2006. — № 1. — Т. 8. — С. 49-52.
4. Васильев С.В. Сравнительная оценка операции Лонго и шовного лигирования терминальных ветвей верхней прямокишечной артерии в лечении хронического геморроя / С.В. Васильев, К.Н. Комяк, А.И. Недозимованный // Вестн. хирургии им. И.И. Грекова. — 2007. — № 3. — С. 70-72.
5. Воробьев Г.И. Геморрой / Г.И. Воробьев, Ю.А. Шелыгин, Л.А. Благодарный. — М.: Литтерра, 2010. — 200 с.
6. Гаин М.Ю. Малоинвазивные технологии в комплексном лечении геморроя / М.Ю. Гаин, С.В. Шахрай // Новости хирургии. — 2011. — № 4. — Т. 19. — С. 113-122.
7. Гейниц А.В. Лазеры в хирургическом лечении геморроя / А.В. Гейниц,Т.Г. Елисова // Лазерная медицина. — 2009. — № 2. — Т. 13. — С. 31-35.
8. Жерлов Г.К. Хирургическое лечение геморроя / Г.К. Жерлов и др. // Хирургия. Журн. им. Н.И. Пирогова. — 2008. — № 9. — С. 19-24.
9. Загрядский Е.А. Трансанальная допплер-контролируемая дезартеризация в сочетании с мукопексией в лечении геморроя III–IV стадии / Е.А. Загрядский, С.И. Горелов // Колопроктология. — 2010. — № 2 (32). — С. 8-14.
10. Иткин И.М. Аппаратноконтролируемая биполярная электрокоагуляция в хирургическом лечении геморроя: Автореф. дис... канд. мед. наук / И.М. Иткин. — СПб., 2006. — 19 с.
11. Комяк К.Н. Сравнительная оценка шовного лигирования терминальных ветвей верхней прямокишечной артерии и циркулярной слизисто-подслизистой резекции прямой кишки при лечении хронического геморроя: Автореф. дис... канд. мед. наук / К.Н. Комяк. — СПб., 2008. — 19 с.
12. Кузьминов А.М. Геморроидэктомия плазменным скальпелем / А.М. Кузьминов, И.Ф. Борисов // Колопроктология. — 2009. — № 2(28). — С. 3-7.
13. Кузьминов А.М. Циркулярная слизисто-подслизистая резекция нижнеампулярного отдела прямой кишки (степлерная геморроидпексия) при лечении больных хроническим геморроем / А.М. Кузьминов и др. // Росс. журн. гастроэнтерологии, гепатологии, колопроктологии. — 2010. — № 3. — С. 82-87.
14. Ливзан М.А. Болевой синдром в гастроэнтерологии — алгоритм терапии // Медицинский совет. — 2010. — № 3–4. — С. 68.
15. Acheson A.G., Scholefield J. H. Management of haemorrhoids // BMJ. — 2008. — 336. — Р. 380-383.
16. Aigner F., Bodner G., Gruber H., Conrad F., Fritsch H., Margreiter R., Bonatti H. / The vascular nature of hemorrhoids // J. Gastrointest. Surg. — 2006. — 10. — Р. 1044-1050.
17. Aigner F., Gruber H., Conrad F., Eder J., Wedel T., Zelger B., Engelhardt V., Lametschwandtner A., Wienert V., Böhler U. et al. Revised morphology and hemodynamics of the anorectal vascular plexus: impact on the course of hemorrhoidal disease // Int. J. Colorectal. Dis. — 2009. — 24. — Р. 105-113.
18. Infantino A., Bellomo R., Dal Monte P.P., Salafia C., Tagariello C., Tonizzo C.A., Spazzafumo L., Romano G., Altomare D.F. Transanal haemorrhoidal artery echodoppler ligation and anopexy (THD) is effective for II and III degree haemorrhoids: a prospective multicentric study // Colorectal. Disease. — 2009. — 12. — 8. — 804 // Wiley Online Library.
19. Alonso-Coello P., Zhou Q., Martinez-Zapata M. J., Mills E., Heels-Ansdell D., Johanson J. F., Guyatt G. Meta-analysis of flavonoids for the treatment of haemorrhoids // Br. J. Surg. — 2006. — 93. — Р. 909-920.
20. American Gastroenterological Association medical position statement: Diagnosis and treatment of hemorrhoids // Gastroenterology. — 2004. — 126. — Р. 1461-1462.
21. Damle А., Maykel J. Difficult Decisions in Colorectal Surgery, 2017. — 403 // CrossRef.
22. Angus J.M. Watson, Jemma Hudson, Jessica Wood, Mary Kilonzo, Steven R Brown, Alison McDonald, John Norrie, Hanne Bruhn, Jonathan A Cook. Comparison of stapled haemorrhoidopexy with traditional excisional surgery for haemorrhoidal disease (eTHoS): a pragmatic, multicentre, randomised controlled trial // The Lancet. — 2016. — 388. — 10058. — 2375 // CrossRef.
23. Ommer A., Grundmann R.T. Evidenzbasierte Viszeralchirurgie benigner Erkrankungen. — 2017. — 133 // CrossRef.
24. Loganathan A., Das A., Luck A., Hewett P. Transanal haemorrhoidal dearterialization for the treatment of grade III and IV haemorrhoids: a 3-year experience // ANZ Journal of Surgery. — 2016. — 86. — 1–2. — 59 // Wiley Online Library.
25. Brechtje A. Grotenhuis, Joost Nonner, Eelco J.R. de Graaf, Pascal G. Doornebosch, Implementation of a New High-Volume Circular Stapler in Stapled Anopexy for Hemorrhoidal Disease: Is Patient’s Short-Term Outcome Affected by a Higher Volume of Resected Tissue? // Digestive Surgery. — 2017 // CrossRef.
26. Chung Y.C., Hou Y.C., Pan A.C. Endoglin (CD105) expression in the development of haemorrhoids // Eur. J. Clin. Invest. — 2004. — 34. — Р. 107-112.
27. Simillis C., Thoukididou S.N., Slesser A.A.P., Rasheed S., Tan E., Tekkis P.P. Systematic review and network meta-analysis comparing clinical outcomes and effectiveness of surgical treatments for haemorrhoids // British Journal of Surgery. — 2015. — 102. — 13. — 1603 // Wiley Online Library.
28. Danson Yeo. Hemorrhoidectomy — making sense of the surgical options // World Journal of Gastroenterology. — 2014. — 20. — 45. — 16976 // CrossRef.
29. Gravante G., Giordano P. Stapled haemorrhoidopexy for IV degree haemorrhoids // Colorectal Disease. — 2009. — 11. — 8. — 884 // Wiley Online Library.
30. Han W., Wang Z.J., Zhao B., Yang X.Q., Wang D., Wang J.P., Tang X.Y., Zhao F., Hung Y.T. Pathologic change of elastic fibers with difference of microvessel density and expression of angiogenesis-related proteins in internal hemorrhoid tissues // Zhonghua Weichang Waike Zazhi. — 2005. — 8. — Р. 56-59.
31. Jason F. Hall. Modern Management of Hemorrhoidal Disease // Gastroenterology Clinics of North America. — 2013. — 42. — 4. — 759 // CrossRef.
32. Jennifer K. Lee, Sharon L. Stein. Hemorrhoids // Seminars in Colon and Rectal Surgery. — 2011. — 22. — 1. — 15 // CrossRef.
33. Cintron J., Abcarian A.M., Abcarian H., Makiewicz K., Brand M.I. Complications of Anorectal Surgery. — 2017. — 61 // CrossRef.
34. Johanson J.F., Sonnenberg A. The prevalence of hemorrhoids and chronic constipation. An epidemiologic study // Gastroenterology. — 1990. — 98. — Р. 380-386.
35. Johanson J.F., Sonnenberg A. Constipation is not a risk factor for hemorrhoids: a case-control study of potential etiological agents // Am. J. Gastroenterol. — 1994. — 89. — Р. 1981-1986.
36. Kaidar-Person O., Person B., Wexner S.D. Hemorrhoidal disease: A comprehensive review // J. Am. Coll. Surg. — 2007. — 204. — Р. 102-117.
37. Kemal P., Abdullah İ., Huriye G., Düriye G., Murat Ş., Ayca D.O., Kemal K. Comparison of Vessel Sealing Systems with Conventional // Iranian Red Crescent Medical Journal. — 2013. — 15. — 6. — 488 // CrossRef.
38. Moser K.H. Ambulante Therapie des Hämorrhoidalleidens in einer chirurgischen Praxis // Coloproctology. — 2018 // CrossRef.
39. Loder P.B., Kamm M.A., Nicholls R.J., Phillips R.K. Haemorrhoids: pathology, pathophysiology and aetiology // Br. J. Surg. — 1994. — 81. — Р. 946-954.
40. Kopljar M., Balduzzi S., Patrlj L., Mihanovic J., Markulin H., Bakota B., Shayne J.F. Zhang, Sobar M., Sambunjak D. Topical treatment for hemorrhoids // Cochrane Database of Systematic Reviews. — 2011 // Wiley Online Library.
41. Luchtefeld M., Hoedema R.E. The ASCRS Textbook of Colon and Rectal Surgery, 2016. — 183 // CrossRef.
42. Zampieri N., Castellani R., Andreoli R., Geccherle A. Long-term results and quality of life in patients treated with hemorrhoidectomy using two different techniques: Ligasure versus transanal hemorrhoidal dearterialization // The American Journal of Surgery. — 2012. — 204. — 5. — 684 // CrossRef.
43. Nitin Mishra, Jason F. Hall. Operative management of hemorrhoids // Seminars in Colon and Rectal Surgery. — 2013. — 24. — 2. — 86 // CrossRef.
44. Petra F. Janssen, Hans A.M. Brölmann, Judith A.F. Huirne. Effectiveness of electrothermal bipolar vessel-sealing devices versus other electrothermal and ultrasonic devices for abdominal surgical hemostasis: a systematic review // Surgical Endoscopy. — 2012. — 26. — 10. — 2892 // CrossRef.
45. Pigot F., Siproudhis L., Allaert F.A. Risk factors associated with hemorrhoidal symptoms in specialized consultation // Gastroenterol. Clin. Biol. — 2005. — 29. — Р. 1270-1274.
46. Mathew R., Chen L., Wong M. Hemorrhoids. — 2018 // CrossRef.
47. Mathew R., Chen L., Wong M. Hemorrhoids. — 2018. — 2. — 471 // CrossRef.
48. Ruppert R. Anopexie nach Longo bei Hämorrhoiden // Coloproctology. — 2017. — 39. — 5. — 324 // CrossRef.
49. Ruppert R. Anopexie nach Longo bei Hämorrhoiden // Der. Chirurg. — 2016. — 87. — 11. — 918 // CrossRef.
50. Simon W. Nienhuijs, Ignace H.J.T. de Hingh. Conventional versus LigaSure hemorrhoidectomy for patients with symptomatic Hemorrhoids // Cochrane Colorectal Cancer Group. — 2009 // Cochrane Database of Systematic Reviews.
51. Sharath Chandra Vikram Paravastu, Richard Slater. Metronidazole for pain after haemorrhoid surgery// Cochrane Database of Systematic Reviews. — 2013 // Wiley Online Library.
52. Sammour T., Barazanchi А.W.H., Hill A.G. Evidence-Based Management of Pain After Excisional Haemorrhoidectomy Surgery: A PROSPECT Review Update // World Journal of Surgery. — 2017. — 41. — 2. — 603 // CrossRef.
53. Higuero T., Abramowitz L., Castinel A., Fathallah N., Hemery P., Laclotte Duhoux C., Pigot F., Pillant-Le Moult H., Senéjoux A., Siproudhis L., Staumont G., Suduca J.-M., Vinson-Bonnet B. Recommandations pour la pratique clinique du traitement de la maladie hémorroïdaire — texte court // Journal de Chirurgie Viscérale. — 2016. — 153. — 3. — 220 // CrossRef.