Газета «Новости медицины и фармации» №4 (686), 2019
Вернуться к номеру
Генетические факторы и биохимические маркеры алкоголизма
Авторы: Мельник А.А., к.б.н.
Разделы: Справочник специалиста
Версия для печати
Всемирная организация здравоохранения (ВОЗ) определяет алкоголизм, или алкогольную зависимость, как «хроническое заболевание, характеризующееся постоянным или периодическим употреблением алкоголя, патологическим влечением к алкоголю и абстинентным синдромом при прекращении приема, потерей контроля при употреблении, частыми интоксикациями нарастающей тяжести» [1].
Алкогольная зависимость — это глобальная эпидемия. Так, по статистическим данным, в мире около 240 миллионов человек являются алкоголезависимыми (3–4 % в популяции). Из них 3,3 миллиона ежегодно умирают по этой причине. В Украине 2,2 % населения страдают алкогольной зависимостью, на учете в медицинских учреждениях с диагнозом «алкоголизм» сегодня находится почти 1 млн человек. Ежегодно украинцы потребляют в среднем 13,9 литра алкоголя (в пересчете на чистый спирт). Было подсчитано, что 40 % смертей мужчин трудоспособного возраста и 22 % женщин в возрасте от 20 до 64 лет являются следствием употребления алкоголя. В новом исследовании ВОЗ представлены данные о том, что украинская молодежь занимает 1-е место в мире в рейтинге потребления алкоголя среди детей и молодежи, где 40 % подростков употребляют алкогольные напитки по крайней мере один раз в месяц. Больше половины украинских школьников пьют пиво или слабоалкогольные коктейли, и уже с 13 лет они начинают свой путь к хроническому алкоголизму.
Хроническая и алкогольная интоксикация связана с множеством заболеваний, таких как рак, сердечно-сосудистая патология, цирроз печени, нейропсихические расстройства, травмы, фетальный алкогольный синдром, а также характеризуется социальными проблемами, включая самоубийства, убийства, дорожно-транспортные происшествия, аварии на производстве и уголовные преступления [2, 3].
При алкогольной зависимости обнаружен широкий полиморфизм генов, обусловленных многообразным сочетанием наследственных и средовых факторов [4, 5]. Эксперименты на животных позволили определить области, в которых необходимо искать генетические различия у людей. Прежде всего это метаболизм алкоголя, то есть реакции его пре-вращения в организме и нейрофизиологические реакции на этанол.
Выявлены две группы генов, связанных с алкоголизмом:
I. Гены, контролирующие метаболизм алкоголя (окисление этанола).
II. Гены, контролирующие функции мозга (характеризуют поведение человека).
Гены, контролирующие метаболизм алкоголя
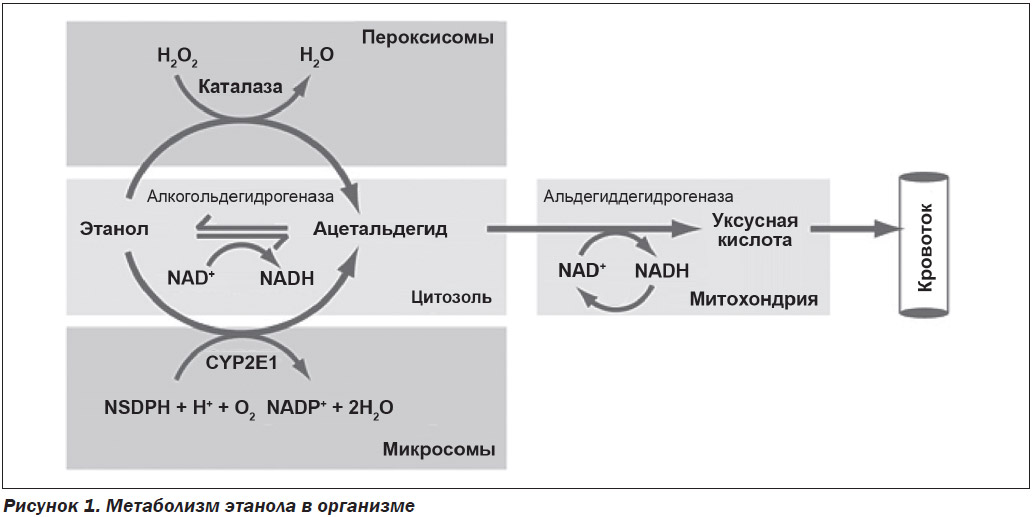
Элиминация этанола в организме осуществляется путем его экскреции в неизменном виде и биотрансформации. В неизменном виде он удаляется легкими, почками, потовыми железами, с калом. Биотрансформация этанола протекает в основном в печени и включает следующие этапы (рис. 1):
1. В цитопламе клеток этанол под действием фермента алкогольдегидрогеназы (ADH) превращается в ацетальдегид, который в дальнейшем при участии фермента альдегиддегидрогеназы (ALDH) образует уксусную кислоту (метаболизируется до 90 % принятого алкоголя).
2. Окисление в пероксисомах с помощью каталазы, оксидаз и пероксидаз тканей (метаболизируется до 2–3 %).
3. Микросомальное окисление в гладком эндоплазматической ретикулуме (фермент CYP2E1).
4. Этерификация этанола с жирными кислотами, в результате чего образуются сложные эфиры.
Основной путь расщепления этанола в организме представляет собой двухступенчатый процесс. Вначале этанол окисляется до ацетальдегида, а затем до ацетата. Накопление токсического промежуточного продукта, каким является ацетальдегид, вызывает такие физиологические симптомы, как тахикардия, тошнота, потливость, гиперемия кожных покровов лица. На скорость образования ацетальдегида и дальнейшего его превращения в уксусную кислоту влияют полиморфизм генов, кодирующих ферменты ADH и ALDH.
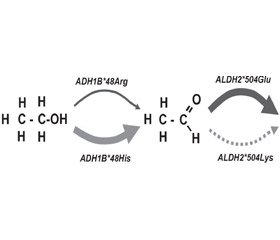
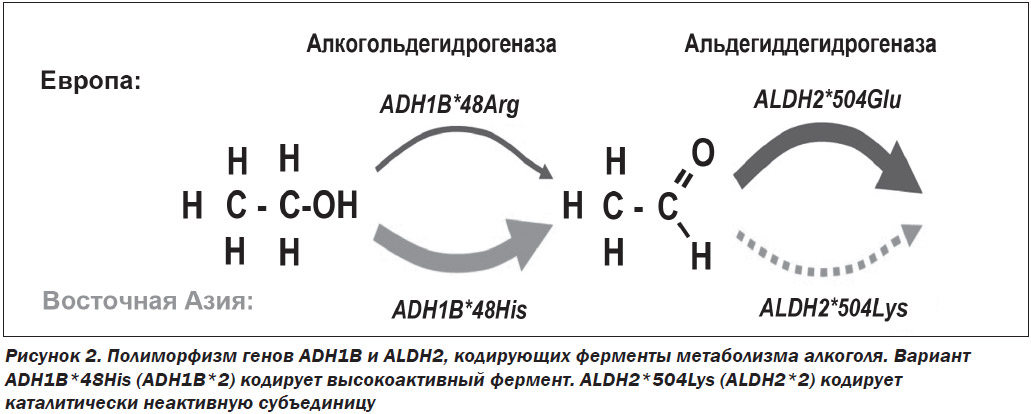
Существуют несколько изоформ ADH, которые метаболизируют алкоголь в печени, — ADH1A, ADH1B, ADH1C и ADH4-7. Основное количество алкоголя окисляется с помощью изофермента ADH1B. При этом индивидуумы с единичным нуклеотидным полиморфизмом (SNP, single-nucleotide polymorphism) ADH1B*2, у которых аминокислота аргинин в положении 48 заменена на аминокислоту гистидин (Arg48His), метаболизируют алкоголь значительно быстрее, чем лица с вариантом ADH1B*1. У жителей Восточной Азии по сравнению с другими популяциями чаще встречается вариант ADH1B*2, поэтому они имеют защитный эффект для риска развития алкоголизма [6, 7]. Вариации изоформ ALDH также связаны с риском алкоголизма. Большая часть окисления ацетальдегида до ацетата осуществляется изоферментом ALDH2. Индивидуумы с полиморфизмом ALDH2*2 (Glu504Lys) метаболизируют ацетальдегид с гораздо меньшей скоростью. Этот медленный метаболизм ацетальдегида проявляется неприятными физиологическими симптомами. Поэтому вариант ALDH2*2 связан с уменьшением риска развития алкоголизма [8, 9] (рис. 2).
Полиморфизм гена ALDH2*2 обнаружен у 44 % японцев, 53 % вьетнамцев, 27 % корейцев, 30 % китайцев. У людей, несущих ген ALDH2*2, склонность к употреблению алкоголя в 6 раз меньше.
1. Ген алкогольдегидрогеназы ADH1В
Интерпретация:
— ADH1B*1/*1 аллель — высокий риск развития алкоголизма;
— ADH1B*1/*2 аллель — риск развития алкоголизма снижен;
— ADH1B*2/*2 аллель — риск развития алкоголизма снижен на 30 %.
2. Ген альдегиддегидрогеназы ALDH2
Интерпретация:
— ALDH2*1/*1 аллель — нет предрасположенности к развитию алкоголизма;
— ALDH2*1/*2 аллель — повышен риск возникновения алкогольной зависимости;
— ALDH2*2/*2 аллель — снижен риск развития алкогольной зависимости.
Таким образом, при лабораторном исследовании с использованием генотипирования обнаружение активной формы алкогольдегидрогеназы ADH1B*2 и неактивной формы альдегиддегидрогеназы ALDH2*2 свидетельствует о том, что данный индивид предрасположен к более редкому употреблению алкоголя и в небольших количествах. Эти результаты рассматриваются как протективный фактор, однако не могут являться препятствием для развития алкогольной зависи-
мости.
В недавних исследованиях было показано влияние генетических факторов в зависимости от возраста [10]. Индивидуумы с генотипом ADH1C*1/*1 и CYP2E1*c1/*c2 склонны к алкогольной зависимости в молодом возрасте по сравнению с теми, у кого имеется генотип ADH1C*1/*2 и CYP2E1*c1/*c1. Это имеет очень важное значение, так как позволяет использовать скрининг для возможной профилактики алкогольной зависимости
Гены, контролирующие функции мозга
Алкоголь специфически влияет на определенные системы и структуры мозга, вызывая развитие синдрома зависимости. Имеются генетические варианты нескольких нейротрансмиттерных систем, связанных с алкоголизмом [11–16]. К ним относятся:
1. D2-дофаминовый рецептор.
2. Рецептор гамма-аминомасляной кислоты (ГАМК).
3. Глутаматный рецептор.
4. Серотониновый рецептор.
5. Холинергический мускариновый рецептор.
1. D2-дофаминовый рецептор
Дофамин — это нейротрансмиттер, обладающий широким спектром действия в мозге, включая мезолимбическую систему, где он функционирует как медиатор вознаграждения или удовольствия [17]. Дофамин влияет на риск развития алкоголизма через разнообразные механизмы, к которым относятся: усиление действия лекарственных препаратов, личностные характеристики, а также некоторые психические расстройства. Нарушения, связанные с функционированием дофаминовой системы, побуждают человека употреблять дополнительные стимуляторы, одним из которых является алкоголь, вызывающий высвобождение дофамина в мезолимбической системе. Результаты исследования специфических маркеров дофамина показали, что в мозге алкоголиков уменьшается плотность D2-рецепторов [18].
Существуют два типа дофаминовых рецепторов: D1 (D1-D5-рецепторы, воздействующие на аденилатциклазу) и D2-подобные (D2-, D3- и D4-рецепторы). Ген DRD2 кодирует рецептор D2, расположенный на дофаминергических нейронах. Имеется несколько альтернативных вариантов (аллелей) данного гена, появившихся в результате однонуклеотидного полиморфизма. В гене DRD2 изучены некоторые полиморфные сайты, часть которых расположена в последовательности, кодирующей белок. Нуклеотидные замены в них могут изменять структуру белка, тем самым нарушая его функцию. Для этих аллелей показана ассоциация с алкогольной зависимостью.
На регуляцию экспрессии гена DRD2 оказывает влияние ген ANKK1, находящийся рядом с ним. Один из полиморфных локусов гена ANKK1 располагается в позиции 2137 в 8-м экзоне, в котором может происходить замена цитозина (С) на тимин (T). Данный участок называется генетическим маркером C2137T (или TaqIA). В результате аминокислота глутамин замещается на лизин (Glu713Lys) в позиции 713 аминокислотной последовательности белка ANKK1.
Исследование данного генетического маркера может быть использовано для определения риска развития склонности к алкоголизму.
Интерпретация:
— С/С — генотип, не ведущий к снижению плотности рецепторов дофамина в головном мозге;
— С/Т — генотип, ведущий к снижению плотности рецепторов дофамина в головном мозге;
— Т/Т — генотип, ведущий к снижению плотности рецепторов дофамина в головном мозге.
2. Рецептор гамма-аминомасляной кислоты
Гамма-аминомасляная кислота является основным ингибирующим нейротрансмиттером в головном мозге. Действие алкоголя увеличивает активность ГАМК в мозге путем ее высвобождения, что осуществляется через два типа рецепторов — ГАМК-А и ГАМК-В. При изучении подтипов рецепторов α1 (ГАМК-А1) и α6 (ГАМК-А6) оказалось, что они могут влиять на предрасположенность к алкогольной зависимости. В некоторых исследованиях [19, 20] показана положительная корреляция генетических полиморфизмов между рецепторами ГАМК-А1 и ГАМК-А6, которые связаны с развитием алкоголизма. Генотип GG гена рецептора ГАМК-A1 играет важную роль в развитии раннего начала и тяжелого типа алкоголизма. Эти полиморфизмы приводят к образованию дефектных субъединиц, что, в свою очередь, уменьшает количество нормально функционирующих рецепторов.
3. Глутаматный рецептор
Глутамат является основным возбуждающим нейротрансмиттером в головном мозге и оказывает действие через несколько подтипов рецепторов. Существует два главных глутаматных рецептора:
1. Ионотропный глутаматный рецептор (iGluR). Обнаружен на мельчайших выпячиваниях дендритов постсинаптических клеток (опосредуют быстрые реакции нейронов).
2. Метаботропные глутаматные рецепторы (mGluRs), расположенные в мембране вокруг синапса. Они осуществляют более медленные и продолжительные реакции на синапсе и имеют модулирующие эффекты.
Ионотропные глутаматные рецепторы представлены тремя классами, которые опосредуют передачу быстрых сигналов:
— рецепторы N-метил-D-аспартата (NMDA-R);
— рецепторы α-амино-3-гидрокси-5-метилизокса-зол-4-пропионовой кислоты (AMPA-R);
— рецепторы каиновой кислоты.
Алкоголь ингибирует активность глутамата в головном мозге в отличие от ГАМК. Острое воздействие алкоголя вызывает снижение уровней внеклеточного глутамата в области полосатого тела головного мозга. Обнаружено, что алкоголь осуществляет свои эффекты в основном через рецепторы NMDA [21]. Показано, что малые и средние дозы алкоголя нарушают процессы обучения и памяти с вовлечением механизма длительной потенциации, опосредованного NМDА-рецепторами. Активация NMDA-peцепторов играет важную роль в развитии гипоксии мозга и появлении эпилептиформной активности. Действие этанола на NМDА-рецепторы объясняет возникновение судорожной активности в период отмены этанола при алкогольном абстинентном синдроме. NMDA-peцепторы, участвующие в процессе развития алкогольной зависимости, играют роль в нейронной реорганизации (нейропластичности), что способствует гипервозбудимости и тяге во время отмены алкоголя [22]. Препараты, влияющие на глутаматные рецепторы, используют для лечения алкогольной зависимости. Например, лекарственный препарат акампросат модулирует передачу глутамата, действуя на NMDA глутаматные рецепторы. Акампросат, снижая повышенную активность глутамата, тем самым блокирует чрезмерное потребление алкоголя [23].
4. Серотониновый рецептор
Серотонин представляет собой моноаминовый нейротрансмиттер, известный как 5-НТ (5-гидрокситриптамин), на который воздействуют алкоголь, кокаин, амфетамины, ЛСД. Он является производным триптофана, обнаружен в центральной нервной системе (ЦНС), желудочно-кишечном тракте, тромбоцитах. Функции серотонина в ЦНС заключаются в регулировании настроения, аппетита, сна, температуры тела, боли, сокращении мышц, модулирует поведенческую реакцию на несправедливость [24]. Большинство лекарственных препаратов, используемых для лечения депрессии, направлены на увеличение уровня серотонина в мозге [25]. Серотонин продуцируется нейронами в ядрах шва (скопление нейронов, расположенных по средней линии продолговатого мозга). Серотонин высвобождается в пространство между нейронами и диффундирует в относительно широком промежутке (> 20 мкм) для активации 5-НТ-рецепторов, расположенных на дендритах, клеточных телах и пресинаптических окончаниях соседних нейронов. Серотонинергическое действие прекращается в основном за счет поглощения 5-НТ из синапса. Это достигается через специфический транспортер моноаминов (SERT). При алкоголизме имеются мутации в гене SERT, известном также как SLC6A4. Этот ген имеет в основном две мутации, так называемую длинную и короткую аллель. Разница между двумя аллелями заключается в том, что короткая версия аллеля имеет делецию 44 bp в 5'-регуляторной области гена. Эта делеция 44 bp находится на 1 kb выше от сайта инициации транскрипции гена [26].
5. Холинергический мускариновый рецептор
Холинергические рецепторы — это трансмембранные рецепторы, эндогенным агонистом которых является ацетилхолин. Нервные волокна, выделяющие ацетилхолин из своих окончаний, называются холинергическими. На постганглионарных нейронах и клетках мозгового вещества надпочечников располагаются N-холинорецепторы (CHRN, чувствительные к никотину), а на внутренних органах — М-холинорецепторы (CHRM, чувствительные к алкалоиду мускарину). Ацетилхолиновый мускариновый рецептор относится к классу серпентиновых рецепторов, осуществляющих передачу через гетеротримерные G-белки. М-холинорецепторы подразделяются на 5 подтипов. Одним из них является CHRM2 (Cholinergic muscarinic 2 receptor), который присутствует в нейронах центральной и периферической нервной системы, сердечной и гладкой мышц и различных эндокринных железах. CHRM2 контролирует регуляцию ц-АМФ и является ответственным за опосредованное ацетилхолином ингибирование аденилатциклазной активности, обеспечивая отрицательную обратную связь для высвобождения ацетилхолина из холинергических терминалей [27–29].
В 2004 г. Wang и др. [30] в исследовании COGA (Collaborative Study of the Genetics of Alcoholism — Совместное исследование генетики алкоголизма) показали, что ген CHRM2, кодирующий холинергический мускариновый рецептор CHRM2, расположенный на 7q31-35 хромосоме, имеет три одиночных нуклеотидных полиморфизма в интронах 4 и 5. Эти изменения в гене характеризуются клиническими проявлениями алкогольной зависимости, депрессией и сопровождаются уменьшением количества рецепторов.
Биомаркеры алкоголизма
Биомаркеры являются неотъемлемой частью для оценки состояния пациентов с алкогольной зависимостью [31–33]. При алкоголизме биомаркеры используются не только для подтверждения этиологии, но и помогают решению проблемы злоупотребления алкоголем через совместное взаимодействие между доктором и пациентом. Основываясь на данных лабораторных исследований, возможно получить новые данные о первичных механизмах заболевания, вызванного этанолом. Информацию о фактическом количестве потребленного алкоголя возможно собрать с помощью специально разработанных опросников, таких как Alcohol Use Disorders Identification Test (AUDIT), CAGE alcohol questionnaire (Cut down, Annoyed, Guilty, Eye-opener), Michigan Alcoholism Screening Test (MAST) или time-line follow-back (TLFB) [34, 35]. Однако эти результаты определяются только самоотчетами врачей, которые по ряду причин часто являются ненадежными каналами информации.
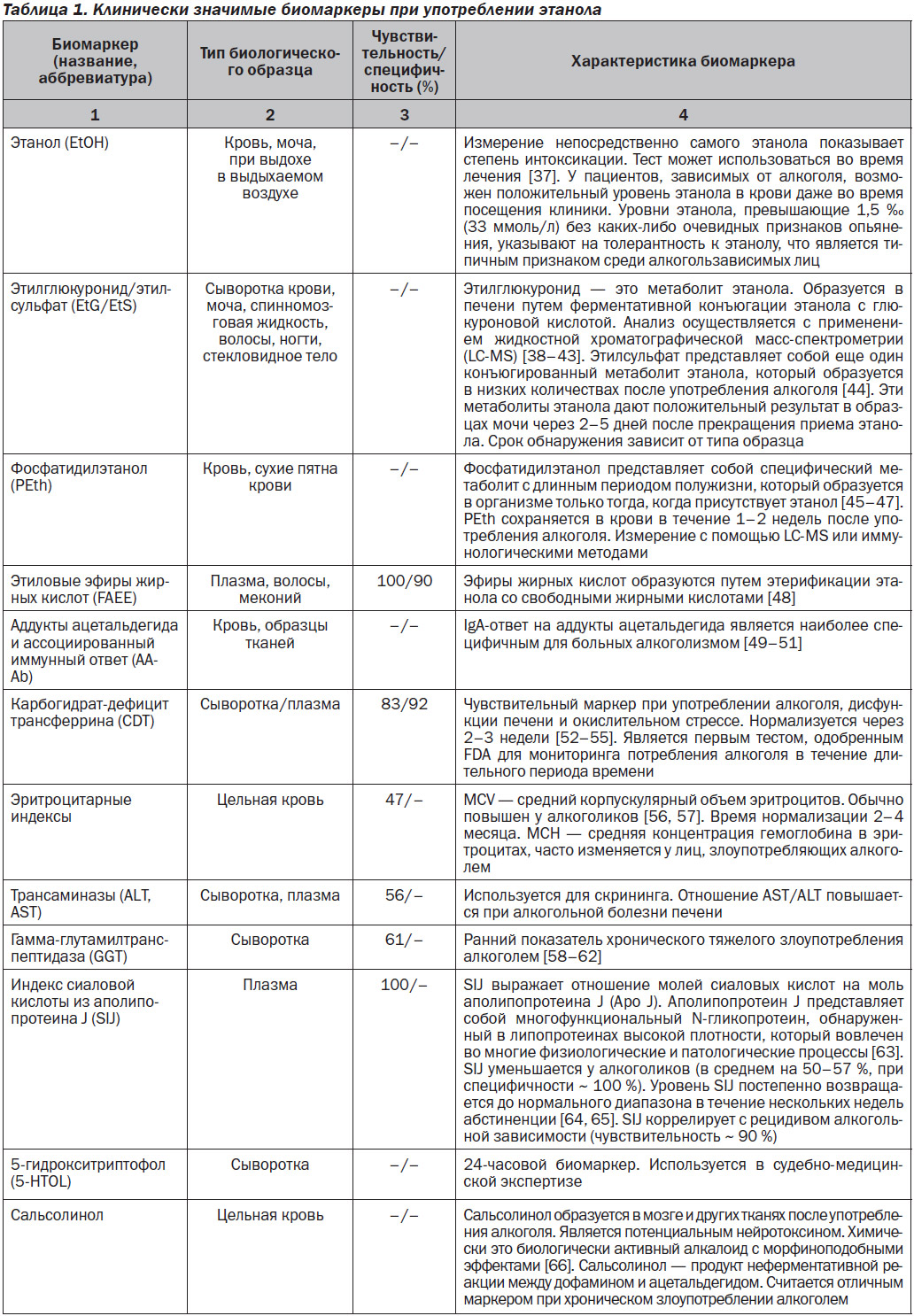
Биомаркеры имеют несколько возможных приложений для использования, а именно для ранней диагностики, скрининга или диагностических целей. В настоящее время нет биомаркеров, которые могут напрямую выявить алкоголизм. Тем не менее разработаны клинически значимые биомаркеры потребления этанола, способные определять время и интенсивность индивидуального употребления алкоголя. В последние годы выявлены несколько биохимических маркеров, обладающих значительным потенциалом для точного отражения чрезмерного потребления алкоголя по сравнению с традиционными. Эти маркеры связаны с веществами при метаболизме алкоголя (так называемые прямые маркеры) или отражают изменения в других молекулах (так называемые косвенные маркеры). Большинство из них находится в стадии клинических исследований и, возможно, в скором времени будут производиться в формате коммерческих тестов [36].
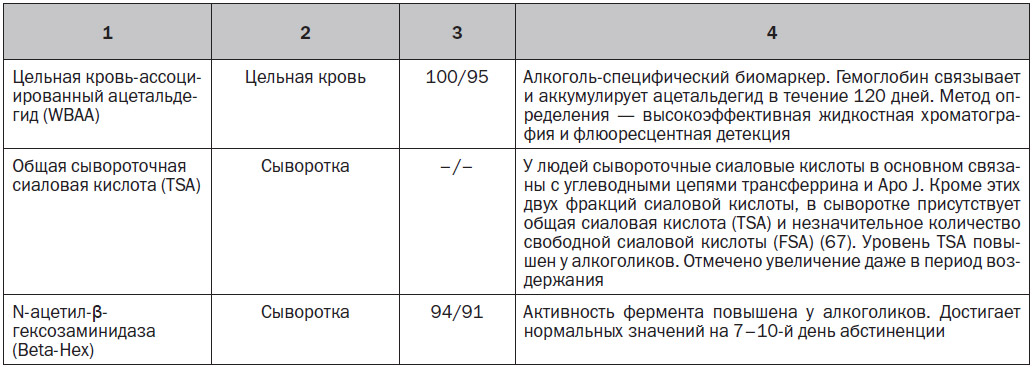
Клинически значимые биомаркеры при употреблении этанола, которые показывают содержание алкоголя в биологических образцах от нескольких часов и дней до нескольких недель, представлены в табл. 1.
Заключение
Генетические исследования вносят большой вклад в понимание биологических механизмов, лежащих в основе злоупотребления алкоголем и развития алкогольной зависимости. Выявление определенных генетических вариантов не является подтверждением диагноза, однако может служить вспомогательным тестом для врача, что позволяет выбрать наиболее оптимальный способ терапии. Продолжается поиск более специфичных и чувствительных биомаркеров алкоголизма. Маловероятно, что для достижения этих целей будет найден единый маркер, однако возможно разработать комбинацию тестов, применимых к конкретным клиническим целям, например для неселективного скрининга («пить» или «не пить»), а также подозрение на злоупотребление или зависимость. Более глубокое понимание биологических механизмов и связанных с ними генетических факторов должно прежде всего способствовать усилению и расширению профилактических мероприятий, а при необходимости — последующего лечения при злоупотреблении алкоголем.
1. WHOint. Whoint. Retrieved 25 May, 2016, from http://www.who.int/substance_abuse /terminology/ who_lexicon /en/.
2. Parry C.D., Patra J., Rehm J. Alcohol consumption and non-communicable diseases: epidemiology and policy implications // Addiction. — 2011. — 106. — Р. 1718-24.
3. Greenfield T.K., Ye Y., Kerr W. et al. Externalities from alcohol consumption in the 2005 US National Alcohol Survey: implications for policy // Int. J. Environ. Res. Public Health. — 2009. — 6. — Р. 3205-24.
4. Schuckit M.A. Biologocal, psychological and enviormental predictors of alcoholism risk: a longitudinal study // J. Stud. Alcohol. — 1998. — Vol. 59, № 5. — P. 485-494.
5. Schuckit M.A. New findings the genetics of alcoholism // JAMA. — 1999. — Vol. 281, № 20. — P. 1875-1876.
6. Edenberg H.J., Foroud T. Genetics of alcoholism // Handb Clin. Neurol. — 2014. — 125. — Р. 561-71.
7. Bierut L.J., Goate A.M., Breslau N. et al. ADH1B is associated with alcohol dependence and alcohol consumption in populations of European and African ancestry // Mol. Psychiatry. — 2012. — 17. — Р. 445-50.
8. Hurley T.D., Edenberg H.J. Genes encoding enzymes involved in ethanol metabolism // Alcohol. Res. — 2012. — 34. — Р. 339-44.
9. Li D., Zhao H., Gelernter J. Strong protective effect of the aldehyde dehydrogenase gene (ALDH2) 504lys (*2) allele against alcoholism and alcohol-induced medical disea-ses in Asians // Hum. Genet. — 2012. — 131. — Р. 725-37.
10. Cichoż-Lach Н., Celiński К., Wojcierowski J., Słomka M., Lis Е. Genetic polymorphism of alcohol-metabolizing enzyme and alcohol dependence in Polish men // Braz. J. Med. Biol. Res. — March 2010. — Vol. 43(3). — Р. 257-261.
11. Edenberg H.J., Dick D.M., Xuei X. et al. Variations in GABRA2, encoding the alpha 2 subunit of the GABA(A) receptor, are associated with alcohol dependence and with brain oscillations // Am. J. Hum. Genet. — 2004. — 74. — Р. 705-14.
12. Ray L.A., Hutchison K.E. A polymorphism of the mu-opioid receptor gene (OPRM1) and sensitivity to the effects of alcohol in humans // Alcohol. Clin. Exp. Res. — 2004. — 28. — Р. 1789-95.
13. Wang J.C., Hinrichs A.L., Stock H. et al. Evidence of common and specific genetic effects: association of the muscarinic acetylcholine receptor M2 (CHRM2) gene with alcohol dependence and major depressive syndrome // Hum. Mol. Genet. — 2004. — 13. — Р. 1903-11.
14. Munafo M.R., Matheson I.J., Flint J. Association of the DRD2 gene Taq1A polymorphism and alcoholism: a meta-analysis of case-control studies and evidence of publication bias // Mol. Psychiatry. — 2007. — 12. — Р. 454-61.
15. Mchugh R.K., Hofmann S.G., Asnaani A. et al. The serotonin transporter gene and risk for alcohol dependence: a meta-analytic review // Drug. Alcohol. Depend. — 2010. — 108. — Р. 1-6.
16. Du Y., Nie Y., Li Y. et al. The association between the SLC6A3 VNTR 9-repeat allele and alcoholism-a meta-analysis // Alcohol. Clin. Exp. Res. — 2011. — 35. — Р. 1625-34.
17. Hill S.Y. Biologic phenotypes associated with individuals at high risk for developing alcohol-related disorders, Part 1 // Addiction Biol. — 2000. — 5. — Р. 5-22.
18. Hietala J., West C., Syvalahti E. et al. Striatal D2 dopamine receptor binding characteristics in vivo in patients with alcohol dependence // Psychopharmacology. — 1994. — 116. — Р. 285-290.
19. Dick D.M., Plunkett J., Wetherill L.F., Xuei X., Goate A., Hesselbrock V. et al. Association between
GABRA1 and drinking behaviors in the collaborative study on the genetics of alcoholism sample // Alcohol. Clin. Exp. Res. — 2006. — 30. — Р. 1101-10.
20. Park C.S., Park S.Y., Lee C.S., Sohn J.W., Hahn G.H., Kim B.J. Association between alcoholism and the genetic polymorphisms of the GABAA receptor genes on chromosome 5q33-34 in Korean population // J. Korean Med. Sci. — 2006. — 21. — Р. 533-8.
21. Lovinger D.M., White G., Weight F.F. Ethanol inhibits NMDA-activated ion current in hippocampal neurons // Science. — 1989. — 243. — Р. 1721-4.
22. Pulvirenti L., Diana M. Drug dependence as a disorder of neural plasticity: Focus on dopamine and glutamate // Rev. Neurosci. — 2001. — 12. — Р. 141-58.
23. Littleton J.M. Acamprosate in alcohol dependence: Implications of a unique mechanism of action // J. Addict. Med. — 2007. — 1. — Р. 115-25.
24. Crockett M.J., Clark L., Tabibnia G., Lieberman M.D., Robbins T.W. Serotonin modulates behavioral reactions to unfairness // Science. — 2008. — 320. — 1739.
25. Benmansour S., Cecchi M., Morilak D.A., Gerhardt G.A., Javors M.A., Gould G.G. et al. Effects of chronic antidepressant treatments on serotonin transporter function, density, and mRNA level // J. Neurosci. — 1999. — 19. — Р. 10494-501.
26. Heils A., Teufel A., Petri S., Stöber G., Riederer P., Bengel D. et al. Allelic variation of human serotonin transporter gene expression // J. Neurochem. — 1996. — 66. — Р. 2621-4.
27. Fenech A.G., Billington C.K., Swan C., Richards S., Hunter T., Ebejer M.J., Felice A.E., Ellul-Micallef R., Hall I.P. Novel polymorphisms influencing transcription of the human CHRM2 gene in airway smooth muscle // Am. J. Respir. Cell Mol. Biol. — 2004. — 30. — Р. 678-686.
28. Mash D.C., Flynn D.D., Potter L.T. Loss of M2 muscarine receptors in the cerebral cortex in Alzheimer’s disease and experimental cholinergic denervation // Science. — 1985. — 228. — Р. 1115-1117.
29. Zhou C., Fryer A.D., Jacoby D.B. Structure of the human M(2) muscarinic acetylcholine receptor gene and its promoter // Gene. — 2001. — 271. — Р. 87-92.
30. Wang J.C., Hinrichs A.L., Stock H. et al. Evidence of common and specific genetic effects: association of the muscarinic acetylcholine receptor M2 (CHRM2) gene with alcohol dependence and major depressive syndrome // Hum. Mol. Genet. — 2004. — 13. — Р. 1903-1911.
31. Niemelä O. Biomarkers in alcoholism // Clin. Chim. Acta. — 2007. — 377. — Р. 39-4918.
32. O’Shea R.S., Dasarathy S., McCullough A.J. Practice guideline committee of the American Association for the Study of Liver Diseases; Practice Parameters Committee of the American College of Gastroenterology. Alcoholic liver disease // Hepatology. — 2010. — 51. — Р. 307-328.
33. Rosman A.S., Lieber C.S. Diagnostic utility of la-boratory tests in alcoholic liver disease // Clin. Chem. — 1994. — 40.
34. Aaltо M., Alho H., Halme J.T., Seppä K. AUDIT and its abbreviated versions in detecting heavy and binge drinking in a general population survey // Drug. Alcohol. Depend. — 2009. — 103. — Р. 25-29.
35. Leeman R.F., Heilig M., Cunningham C.L., Stephens D.N., Duka T., O’Malley S.S. Ethanol consumption: How should we measure it? Achieving consilience between human and animal phenotypes // Addict. Biol. — 2010. — 15. — Р. 109-124.
36. Waszkiewicz N., Popławska R., Konarzewska B. et al. Biomarkers of alcohol abuse. Part II. New biomarkers and their interpretation // Psychiatr. Pol. — 2010. — 44. — Р. 137-46.
37. Niemelä O., Alatalo P. Biomarkers of alcohol consumption and related liver disease // Scand. J. Clin. Lab. Invest. — 2010. — 70. — Р. 305-312.
38. Gutierrez H.L., Hund L., Shrestha S., Rayburn W.F., Leeman L., Savage D.D., Bakhireva L.N. Ethylglucuronide in maternal hair as a biomarker of prenatal alcohol exposure // Alcohol. — 2015. — 49. — Р. 617-623.
39. Helander A., Böttcher M., Fehr C., Dahmen N., Beck O. Detection times for urinary ethyl glucuronide and ethyl sulfate in heavy drinkers during alcohol detoxification // Alcohol. Alcohol. — 2009. — 44. — Р. 55-61.
40. Joya X., Marchei E., Salat-Batlle J., Garcia-Algar O., Calvaresi V., Pacifici R., Pichini S. Fetal exposure to ethanol: Relationship between ethyl glucuronide in maternal hair during pregnancy and ethyl glucuronide in neonatal meconium // Clin. Chem. Lab. Med. — 2015.
41. Rainio J., Ahola S., Kangastupa P., Kultti J., Tuomi H., Karhunen P.J., Helander A., Niemelä O. Comparison of ethyl glucuronide and carbohydrate-deficient transferrin in different body fluids for post-mortem identification of alcohol use // Alcohol. Alcohol. — 2014. — 49. — Р. 55-59.
42. Berger L., Fendrich M., Jones J., Fuhrmann D., Plate C., Lewis D. Ethyl glucuronide in hair and fingernails as a long-term alcohol biomarker // Addiction. — 2014. — 109. — Р. 425-431.
43. Lees R., Kingston R., Williams T.M., Henderson G., Lingford-Hughes A., Hickman M. Comparison of ethyl glucuronide in hair with self-reported alcohol consumption // Alcohol. Alcohol. — 2012. — 47. — Р. 267-272.
44. Dahl H., Hammarberg A., Franck J., Helander A. Urinary ethyl glucuronide and ethyl sulfate testing for recent drinking in alcohol-dependent outpatients treated with acamprosate or placebo // Alcohol. Alcohol. — 2011. — 46. — Р. 553-557.
45. Nissinen A.E., Mäkelä S.M., Vuoristo J.T., Liisanantti M.K., Hannuksela M.L., Hörkkö S., Savolainen M.J. Immunological detection of in vitro formed phosphatidylethanol — An alcohol biomarker — With monoclonal antibodies // Alcohol. Clin. Exp. Res. — 2008. — 32. — Р. 921-928.
46. Piano M.R., Tiwari S., Nevoral L., Phillips S.A. Phosphatidylethanol levels are elevated and correlate strongly with AUDIT scores in young adult binge drinkers // Alcohol. Alcohol. — 2015. — 50. — Р. 519-525.
47. Zheng Y., Beck O., Helander A. Method development for routine liquid chromatography-mass spectrometry measurement of the alcohol biomarker phosphatidylethanol (PEth) in blood // Clin. Chim. Acta. — 2011. — 412. — Р. 1428-1435.
48. De Giovanni N., Donadio G., Chiarotti M. The reliability of fatty acid ethyl esters (FAEE) as biological mar-kers for the diagnosis of alcohol abuse // J. Anal. Toxicol. — 2007. — 31. — Р. 93-97.
49. Freeman T.L., Tuma D.J., Thiele G.M., Klassen L.W., Worrall S., Niemela O., Parkkila S., Emery P.W., Preedy V.R. Recent advances in alcohol-induced adduct formation // Alcohol. Clin. Exp. Res. — 2005. — 29. — Р. 1310-1316.
50. Hietala J., Koivisto H., Latvala J., Anttila P., Niemelä O. IgAs against acetaldehyde-modified red cell protein as a marker of ethanol consumption in male alcoholic subjects, moderate drinkers, and abstainers // Alcohol. Clin. Exp. Res. — 2006. — 30. — Р. 1693-1698.
51. Niemelä O. Distribution of ethanol-induced protein adducts in vivo: Relationship to tissue injury // Free Radic. Biol. Med. — 2001. — 31. — Р. 1533-1538.
52. Jeppsson J.O., Arndt T., Schellenberg F., Wielders J.P., Anton R.F., Whitfield J.B., Helander A. Toward standardization of carbohydrate-deficient transferrin (CDT) measurements: I. Analyte definition and proposal of a candidate reference method // Clin. Chem. Lab. Med. — 2007. — 45. — Р. 558-562.
53. Anton R.F., Lieber C., Tabakoff B. Carbohydrate-deficient transferrin and gamma-glutamyltransferase for the detection and monitoring of alcohol use: Results from a multisite study // Alcohol. Clin. Exp. Res. — 2002. — 26. — Р. 1215-1222.
54. Romppanen J., Punnonen K., Anttila P., Jakobsson T., Blake J., Niemelä O. Serum sialic acid as a marker of alcohol consumption: Effect of liver disease and heavy drinking // Alcohol. Clin. Exp. Res. — 2002. — 26. — Р. 1234-1238.
55. Chrostek L., Cylwik B., Krawiec A., Korcz W., Szmitkowski M. Relationship between serum sialic acid and sialylated glycoproteins in alcoholics // Alcohol. Alcohol. — 2007. — 42. — Р. 588-592.
56. Koivisto H., Hietala J., Anttila P., Parkkila S., Niemelä O. Long-term ethanol consumption and macrocytosis: Diagnostic and pathogenic implications // J. Lab. Clin. Med. — 2006. — 147. — Р. 191-196.
57. Lindenbaum J. Hematologic complications of alcohol abuse // Semin. Liver Dis. — 1987. — 7. — Р. 169-181.
58. Lee D.H., Ha M.H., Kam S., Chun B., Lee J., Song K., Boo Y., Steffen L., Jacobs D.R. Jr. A strong secular trend in serum gamma-glutamyltransferase from 1996 to 2003 among South Korean men // Am. J. Epidemiol. — 2006. — 163. — Р. 57-65.
59. Lee D.H., Blomhoff R., Jacobs D.R. Jr. Is serum gamma glutamyltransferase a marker of oxidative stress? // Free Radic. Res. — 2004. — 38. — Р. 535-539.
60. Fentiman I.S., Allen D.S. Gamma-glutamyl transferase and breast cancer risk // Brit. J. Cancer. — 2010. — 103. — Р. 90-93.
61. Franzini M., Paolicchi A., Fornaciari I., Ottaviano V., Fierabracci V., Maltinti M., Ripoli A., Zyw L., Scatena F., Passino C. et al. Cardiovascular risk factors and gamma-glutamyltransferase fractions in healthy individuals // Clin. Chem. Lab. Med. — 2010. — 48. — Р. 713-717.
62. Franzini M., Fornaciari I., Rong J., Larson M.G., Passino C., Emdin M., Paolicchi A., Vasan R.S. Correlates and reference limits of plasma gamma-glutamyltransferase fractions from the Framingham heart study // Clin. Chim. Acta. — 2013. — 417. — Р. 19-25.
63. Waszkiewicz N., Szajda S.D., Kępka A. et al. Glycoconjugates in the detection of alcohol abuse // Biochem. Soc. Trans. — 2011. — 39. — Р. 365-9.
64. Wurst F.M., Thon N., Weinmann W. et al. Characterization of sialic acid index of plasma apolipoprotein J and phosphatidylethanol during alcohol detoxification — a pilot study // Alcohol. Clin. Exp. Res. — 2012. — 36. — Р. 251-7.
65. Ghosh P., Hale E.A., Lakshman M.R. Plasma sialic-acid index of apolipoprotein J (SIJ): a new alcohol intake marker // Alcohol. — 2001. — 25. — Р. 173-9.
66. Hipólito L., Sánchez-Catalán M.J., Martí-Prats L. et al. Revisiting the controversial role of salsolinol in the neurobiological effects of ethanol: old and new vistas // Neurosci Biobehav. Rev. — 2012. — 36. — Р. 362-78.
67. Chrostek L., Cylwik B., Krawiec A. et al. Relationship between serum sialic acid and sialylated glycoproteins in alcoholics // Alcohol. Alcohol. — 2007. — 42. — Р. 588-92.