Журнал «» №3-4 (65-66), 2019
Вернуться к номеру
Прогнозування несприятливих подій та ефективність лікування у хворих на гіпертонічну хворобу з серцевою недостатністю та цукровим діабетом 2-го типу
Авторы: Меденцева О.О., Рудик Ю.С., Кравченко І.Г.
ДУ «Національний інститут терапії ім. Л.Т. Малої НАМН України», м. Харків, Україна
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Гіпертонічна хвороба (ГХ) є основним фактором захворюваності та смертності, пов’язаної з серцево-судинними захворюваннями. Артеріальний тиск не контролюється добре в більшості пацієнтів із цукровим діабетом (ЦД) і гіпертензією, а ЦД збільшує частоту розвитку несприятливих подій в цієї категорії хворих. Тому метою дослідження є розробка моделі прогнозування несприятливих подій та оцінка ефективності лікування хворих на ГХ із серцевою недостатністю зі збереженою фракцією викиду лівого шлуночка та ЦД 2-го типу.
Гипертоническая болезнь (ГБ) является основным фактором заболеваемости и смертности, связанной с сердечно-сосудистыми заболеваниями. Артериальное давление не контролируется хорошо у большинства пациентов с сахарным диабетом (СД) и гипертензией, а СД увеличивает частоту развития неблагоприятных событий у этой категории больных. Поэтому целью исследования являются разработка модели прогнозирования неблагоприятных событий и оценка эффективности лечения больных ГБ с сердечной недостаточностью с сохраненной фракцией выброса левого желудочка и СД 2-го типа.
Hypertensive disease is a major contributor to cardiovascular morbidity and mortality. Blood pressure is not well controlled in most patients with diabetes mellitus (DM) and hypertension, and the DM increases the incidence of adverse events in this category of patients. Therefore, the purpose of the study is to develop prediction model of negative events and assess the effectiveness of treatment in hypertensive patients with chronic heart failure with preserved ejection fraction type 2 DM.
гіпертонічна хвороба; цукровий діабет; серцева недостатність; лікування
гипертоническая болезнь; сахарный диабет; сердечная недостаточность; лечение
hypertensive disease; diabetes mellitus; heart failure; treatment
Вступ
Дані досліджень останніх років показали значний прогрес у розумінні епідеміології, патофізіології та ризику розвитку гіпертонічної хвороби (ГХ), і існує безліч доказів, що зниження артеріального тиску (АТ) може суттєво зменшити передчасну захворюваність і смертність [1, 2]. Уже існує низка перевірених і високоефективних методів лікування шляхом модифікації способу життя та використання лікарських засобів, що можуть знизити АТ. Незважаючи на це, рівень контролю за АТ залишається недостатнім у всьому світі, а гіпертензія залишається основною причиною, яка може привести до розвитку серцево–судинних захворювань (ССЗ) і смерті від усіх причин у всьому світі [3].
Відомо, що цукровий діабет (ЦД) 2–го типу підвищує ризик розвитку несприятливих подій у хворих із серцево–судинними захворюваннями, включаючи артеріальну гіпертензію [4, 5].
Виявлення комплексу клініко–генетичних факторів, що дозволяють прогнозувати особливості перебігу коморбідної патології ГХ зі збереженою фракцією викиду лівого шлуночка (СНзберФВ ЛШ) на тлі ЦД 2–го типу, необхідне для проведення своєчасних і ефективних заходів, спрямованих на оптимізацію спостереження й лікування даної категорії хворих, а також на профілактику розвитку ускладнень.
Мета: розробити модель прогнозування несприятливих подій та оцінити ефективність лікування блокаторами ренін–ангіотензин–альдостеронової системи (РААС) у хворих на ГХ з СНзберФВ ЛШ та ЦД 2–го типу.
Матеріали та методи
Обстежені 83 пацієнти з ГХ та СНзберФВ ЛШ (45 жінок і 38 чоловіків; середній вік 61,8 ± 4,7 року) із супутнім ЦД 2–го типу. Для визначення алелей і генотипів поліморфного гена ATG М235Т проводили молекулярно–генетичне тестування ДНК з використанням набору реагентів для виявлення поліморфізмів у геномі людини методом ПЛР з подальшим аналізом поліморфізму довжин рестрикційних фрагментів. Правильність розподілу частот генотипів визначалася відповідністю рівноваги Харді — Вайнберга. Для оцінки якості життя використовували Міннесотський опитувальник для хворих із СН. Рівень NTproBNP визначали методом імуноферментного аналізу (ІФА) з використанням «NTproBNP–BEST–ELISA» (Росія), рівень супресора туморогенезу 2 (ST2) визначали методом ІФА з використанням набору реагентів «PresageST2» (США). Параметри ліпідного обміну визначали з використанням наборів реагентів «NUMAN» (Німеччина). Визначення індексу маси міокарда лівого шлуночка (ІММЛШ) проводили на основі ультразвукового методу. Носіями 235T–алелей (MT– + TT–генотипи) були 63 пацієнти, 20 пацієнтів мали ММ–генотип поліморфізму М235Т ATG. Залежно від генотипу пацієнти отримували 2 варіанти терапії блокаторами РААС: раміприлом та валсартаном впродовж 12 місяців на фоні базисної терапії, після чого були обстежені повторно (рис. 1). Оцінювали ефективність призначення комплексної терапії, а також порівнювали зміни показників при застосуванні ІАПФ або БРА ІІ. Заздалегідь визначена складова кінцева точка несприятливих подій, що включала смерть, госпіталізацію через СН, нефатальний інсульт, звернення до лікаря з приводу декомпенсації СН. Усі статистичні тести були двосторонніми і вважалися статистично значущими (p < 0,05). Оцінку перебігу захворювання проводили шляхом побудови кумулятивних кривих за Капланом — Меєром, прогностичну цінність визначали шляхом побудови ROC–кривих. Для виявлення зв’язку між показниками, що вивчались, здійснювали багатофакторний регресійний аналіз, який проводили в Statistica 10.0.
Результати та обговорення
Для оцінки прогностичного впливу різних факторів на кінцеві точки було проведено покроковий багаторівневий регресійний аналіз. У прогностичну модель увійшли: ІММЛШ, NTproBNP, ST2, генотип MT і TT, вік, тривалість СН, дані Міннесотського опитувальника, рівень холестерину ліпопротеїдів високої щільності й глюкоза в крові натще. Найбільш важливими факторами були NTproBNP (RR = 8,13 [1,62; 40,75]), ST2 (RR = 8,0 [1,52; 42,03]), генотип MT і TT (RR = 10,03 [2,72; 39,08]) (p < 0,05) (табл. 1).
Для оцінки ефективності лікування були побудовані криві за Капланом — Меєром. Виявлено, що хворі на ГХ із СНзберФВ ЛШ та ЦД 2–го типу, які отримували лікування валсартаном, мали меншу кількість несприятливих подій порівняно з пацієнтами, що приймали раміприл. (Значення логрангового критерію –11,83; p = 0,00016; F–тест Кокса = 5,19; p = 0,0002).
Прогностичну цінність біомаркера ST2 визначали за допомогою ROC–аналізу, який показав, що оптимальною точкою поділу (cut–off point) на кривій AUC для ST2 є 24,88 нг/мл (AUC ROC = 0,740 ± 0,055; р < 0,05).
Побудова кривих за Капланом — Меєром у групах пацієнтів, розподілених залежно від рівня ST2, виявило, що в пацієнтів із ГХ із СНзберФВ ЛШ і ЦД 2–го типу з рівнем ST2 > 24,88 нг/мл було достовірно більше серцево–судинних подій (рис. 2).
Також було встановлено, що протягом 24 місяців спостереження відносна кількість пацієнтів із несприятливими подіями була достовірно меншою у групі з ММ–поліморфізмом М235Т (rs699) гена АТГ порівняно з хворими із генотипами ТТ + МТ (рис. 3).
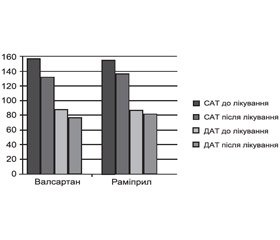
Виявлено, що призначення блокатора РААС валсартану порівняно з раміприлом хворим на ГХ із СНзберФВ ЛШ та ЦД 2–го типу, які є носіями Т–алелі поліморфізму М235Т гена ATG, асоціюється з більш вираженим зниженням артеріального тиску (рис. 4), ефективніше зменшує клінічні прояви СН, підвищує якість життя згідно з даними Міннесотського опитувальника, збільшує толерантність до фізичного навантаження (рис. 5), тоді як у хворих із генотипом ММ раміприл та валсартан однаково ефективні (p < 0,05).
Висновки
Найбільш значущими прогностичними факторами ризику розвитку несприятливих подій у хворих на ГХ із СНзберФВ ЛШ та ЦД 2–го типу є рівень біомаркера ST2 і алель T поліморфізму М235Т ATG. Використання валсартану ефективніше від раміприлу в пацієнтів із ГХ та СНзберФВ ЛШ на тлі ЦД 2–го типу, що є носіями Т–алелі поліморфізму М235Т гена ATG.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. NCD Risk Factor Collaboration. Worldwide trends in blood pressure from 1975 to 2015: a pooled analysis of 1479 population–based measurement studies with 19.1 million participants. Lancet. 2017. 389. 37–55.
2. Ettehad D., Emdin C.A., Kiran A., Anderson S.G., Callen–der T., Emberson J., Chalmers J., Rodgers A., Rahimi K. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta–analysis. Lancet. 2016. 387. 957–967.
3. 2018 ESC/ESH Guidelines for the management of arterial hypertension. B. Williams, G. Mancia, W. Spiering, E.A. Rosei, M. Azizi, M. Burnier, D.L. Clement, A. Coca, G. de Simone, A. Dominiczak, T. Kahan, F. Mahfoud, J. Redon, L. Ruilope, A. Zanchetti, M. Kerins, S.E. Kjeldsen, R. Kreutz, S. Laurent, G.Y.H. Lip,
R. McManus, K. Narkiewicz, F. Ruschitzka, R.E. Schmieder,
E. Shlyakhto, C. Tsioufis, V. Aboyans, I. Desormais. European Heart Journal 2018 September. Vol. 39, Issue 33, 01. P. 3021–3104.
4. Emdin C.A., Rahimi K., Neal B., Callender T., Perko–
vic V., Patel A. Blood pressure lowering in type 2 diabetes: a systematic review and meta–analysis. JAMA. 2015. 313. 603–615.
5. Bailey J.E., Wan J.Y., Tang J., Ghani M.A., Cushman W.C. Antihypertensive medication adherence, ambulatory visits, and risk of stroke and death. J. Gen. Intern. Med. 2010. 25. 495–503.

/179-1.jpg)
/180-1.jpg)
/181-1.jpg)
/182-1.jpg)