Газета «Новости медицины и фармации» Неврология. Нейрохирургия. Психиатрия (642) 2018 (тематический номер)
Вернуться к номеру
Обзор согласованного экспертного заключения АКК 2017 года: комплекс мероприятий по купированию у пациентов кровотечений, вызванных приемом пероральных антикоагулянтов
Рубрики: Хирургия
Разделы: Справочник специалиста
Версия для печати
Доклад рабочей группы Американской коллегии кардиологов о комплексе мероприятий, принятых в качестве согласованного экспертного заключения
Список аббревиатур
4Ф-КПК — 4-факторный концентрат протромбинового комплекса
АВK — антагонист витамина K
АКК — Американская коллегия кардиологов
АКПК — активированный концентрат протромбинового комплекса
АЧТВ — активированное частичное тромбопластиновое время
ДИ — доверительный интервал
ЖК — желудочно-кишечный
КПК — концентрат протромбинового комплекса
МНО — международное нормализованное отношение
ОР — отношение рисков
ОЦК — объем циркулирующей крови
ПАК — пероральный антикоагулянт
ПАПД — пероральный антикоагулянт прямого действия
ПВ — протромбиновое время
ПИТ — прямой ингибитор тромбина
ТВ — тромбиновое время
ТО — тромбоэмболические осложнения
ФП — фибрилляция предсердий
ЭМ — эритроцитная масса
1. Введение
Антикоагулянтная терапия является патогенетическим принципом лечения тромбоза и тромбоэмболических осложнений (ТО) различных заболеваний. Частота общих показаний к применению антикоагулянтной терапии, таких как фибрилляция предсердий (ФП) [1], продолжает расти по причине их успешной ранней диагностики и лечения [2, 3]. Согласно оценкам, более 6 миллионов пациентов в США применяют антикоагулянты [4] и, следовательно, имеют повышенный риск развития кровотечений, что влечет за собой высокую частоту кровотечений и смертности. Долгосрочная тенденция применения антикоагулянтов продемонстрировала относительно быстрое назначение пероральных антикоагулянтов прямого действия (ПАПД) для наиболее распространенного показания к антикоагулянтной терапии: ФП при отсутствии искусственного клапана и венозной тромбоэмболии. Систематические обзоры продемонстрировали благоприятные профили безопасности для ПАПД по сравнению с антагонистами витамина K (АВK) при лечении ФП, а также для низкомолекулярного гепарина при лечении и профилактике венозной тромбоэмболии [5, 6]. Благоприятные результаты терапии ПАПД и появление препаратов обратного действия [7] также способствуют дополнительному увеличению пропорционального использования ПАПД и оказывают влияние на купирование кровотечений, что усложняет использование антикоагулянтов [8].
Настоящий доклад был подтвержден представленными научными данными и экспертными заключениями, рассмотренными во время круглого стола Консорциума по антикоагулянтной терапии, с последующим обзором и обсуждением имеющихся данных авторского коллектива экспертного консенсуса. Несмотря на то что круглый стол предоставил ценную информацию о практических проблемах и пробелах в оказании медицинской помощи, настоящий доклад представляет собой отдельную и независимую работу, направленную конкретно на решение вопросов, поднятых в ходе совещания.
Работа авторского коллектива поддерживалась исключительно АКК и не имела коммерческой поддержки. Работа всех членов комитета по составлению отчетов была добровольной. Конференц-связь авторского коллектива носила конфиденциальный характер, и в ней принимали участие только члены комитета и сотрудники АКК. Все члены авторского коллектива, а также те, кто был выбран в качестве рецензентов настоящего доклада, должны были предоставить всю информацию о своем сотрудничестве в данной сфере и с другими организациями. Информация об авторском коллективе и отношениях рецензента с данной сферой, относящаяся к настоящему докладу, включена в Приложения 1 и 2 соответственно. В соответствии с политикой АКК был проведен формальный процесс экспертной оценки, куда вошли специалисты, назначенные АКК (см. Приложение 2). Для получения дополнительной информации также было проведено открытое общественное обсуждение. После согласования всех комментариев настоящий документ был одобрен к публикации руководящими органами АКК.
Представленные в настоящем докладе рекомендации предназначены для решения клинической проблемы тактики ведения пациентов с кровотечениями, вызванными приемом антикоагулянтов, включая как ПАПД, так и АВK, используемых по любым показаниям. Протокол экспертного заключения учитывал степень тяжести кровотечения (массивное или немассивное), острое терапевтическое и хирургическое лечение, необходимость отмены ПАК, целесообразность и время возобновления антикоагулянтной терапии, а также влияние соответствующих сопутствующих заболеваний и сопутствующей медикаментозной терапии. На каждом этапе алгоритмов протокола экспертного заключения следует учитывать конкретные факторы, имеющиеся у пациента.
2. Методы
Настоящий протокол экспертного заключения рассматривает вопросы купирования кровотечений у пациентов, получающих ПАПД и АВK по любым показаниям. В терапевтических алгоритмах рассматривается терапия антиагрегантными препаратами и их значение. В данном протоколе используется упрощенная классификация кровотечений, в рамках которой они подразделяются на массивные и немассивные [9]. Первые включают кровотечения, которые связаны с гемодинамическими нарушениями, происходят в анатомически важных участках тела/органах, вызывают снижение уровня гемоглобина более чем на 2 г/дл (в случае, если известен базовый уровень) и влекут необходимость трансфузии (≥ 2 единиц эритроцитной массы (ЭМ)). Все другие кровотечения относятся к немассивным. Рекомендации, содержащиеся в настоящем протоколе согласованного экспертного заключения, включают рекомендации по временному или постоянному прекращению терапии, общие подходы к купированию кровотечений, поддержку принятия решений для лечения препаратом обратного действия, а также показания и сроки для повторной антикоагулянтной терапии.
Основная цель настоящего протокола согласованного экспертного заключения — предоставить рекомендации по тактике ведения пациентов с острым кровотечением, получающих пероральные антикоагулянты (ПАК), и внести дополнение к протоколу согласованного экспертного заключения АКК 2017 года по антикоагулянтной терапии у пациентов с неклапанной ФП в перипроцедурном периоде [10], которая относится к тактике ведения пациентов, подвергающихся плановым хирургическим или интервенционным процедурам.
3. Предположения и определения
Во время разработки настоящего протокола согласованного экспертного заключения авторским коллективом были рассмотрены некоторые конкретные предположения и определения.
3.1. Общие клинические предположения
1. В настоящем протоколе рассматривается тактика ведения пациентов с острыми кровотечениями, получающих терапию ПАПД или АВK.
2. При кровотечениях с гемодинамическими нарушениями всегда должны оперативно выполняться стандартные мероприятия по восполнению ОЦК.
3. Были рассмотрены все показания к антикоагулянтной терапии, включая ФП, лечение и профилактику венозной тромбоэмболии, протезирование сердечных клапанов, наличие в анамнезе данных о ранее перенесенной тромбоэмболии, внутрисердечном тромбе, а также наличие механического поддерживающего устройства сердца (например, устройства для механической поддержки левого желудочка (ЛЖ)).
4. Рекомендации по возобновлению и прекращению антикоагулянтной терапии относятся как к ПАПД, так и к АВK.
5. Алгоритм настоящего протокола предполагает, что при наличии показаний медицинский специалист будет запрашивать информацию у соответствующих специалистов и по возможности принимать решение совместно с пациентом и/или членами его семьи.
3.2. Определения
Ниже приведены определения терминов, используемых в настоящем протоколе экспертного заключения.
ПАПД подразумевает любой пероральный антикоагулянт прямого действия.
Массивные кровотечения подразумевают все кровотечения, которые связаны с гемодинамическими нарушениями, происходят в анатомически важных участках тела/органах (например, внутричерепные), вызывают снижение уровня гемоглобина более чем на 2 г/дл (в случае, если известен базовый уровень) и влекут за собой необходимость трансфузии (≥ 2 единиц эритроцитной массы).
Немассивные кровотечения подразумевают все кровотечения, которые не относятся к массивным. В некоторых случаях немассивные кровотечения могут потребовать хирургического вмешательства или госпитализации.
ПАК подразумевает любой пероральный антикоагулянт, включая ПАПД и АВK.
Препараты обратного действия подразумевают стратегию восполнения ОЦК концентратом протромбинового комплекса (КПК), плазмой, применение витамина K и специфических препаратов обратного действия для ПАПД (например, идаруцизумаба для дабигатрана).
Примечание: классификация кровотечений была изменена на основе определения Международного общества тромбоза и гемостаза [9].
4. Резюме протокола
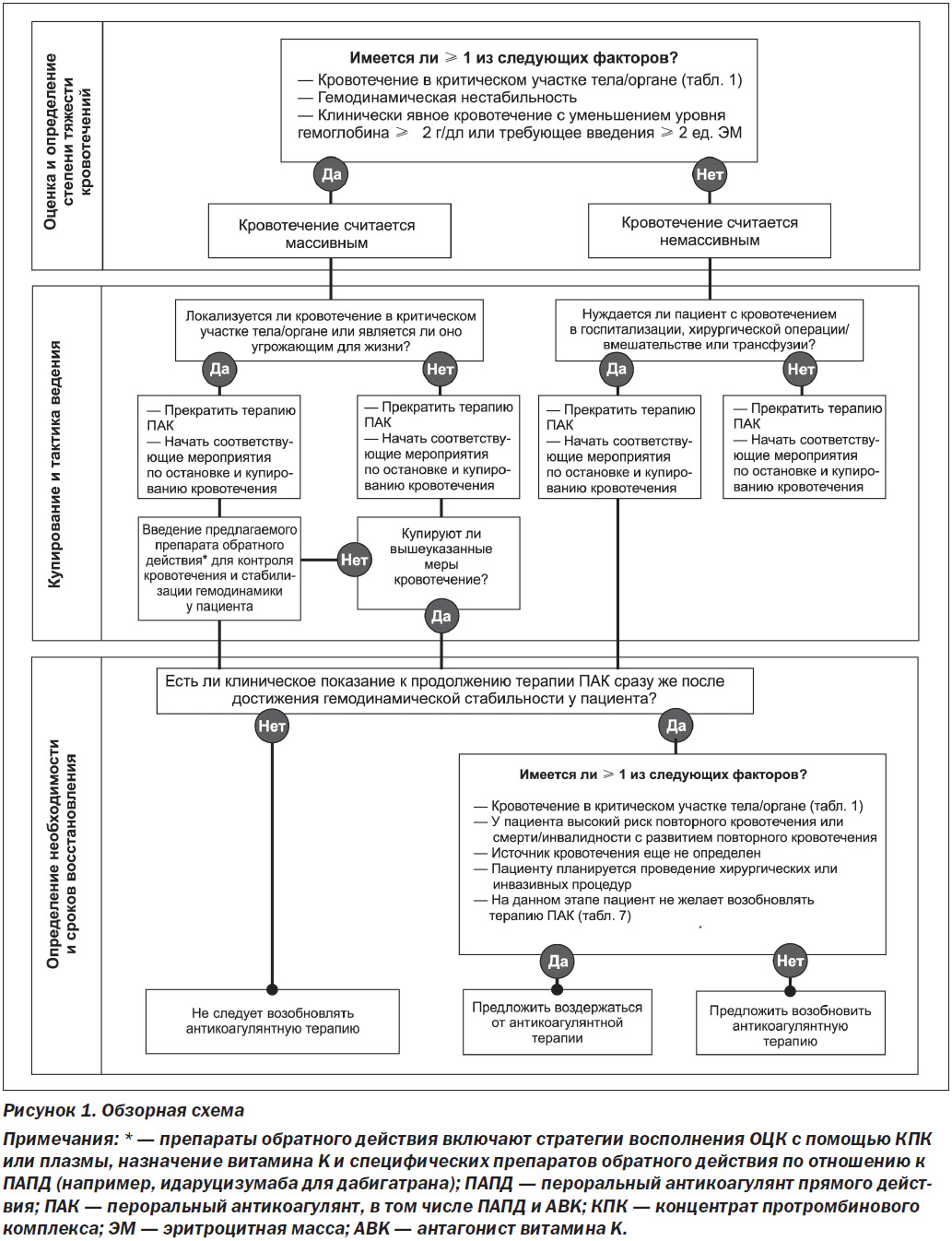
На рис. 1 представлена обзорная схема того, что рассматривается в рамках настоящего протокола эксперт-ного заключения. Для получения более подробной информации и рекомендаций см. каждый раздел.
5. Описание и обоснование
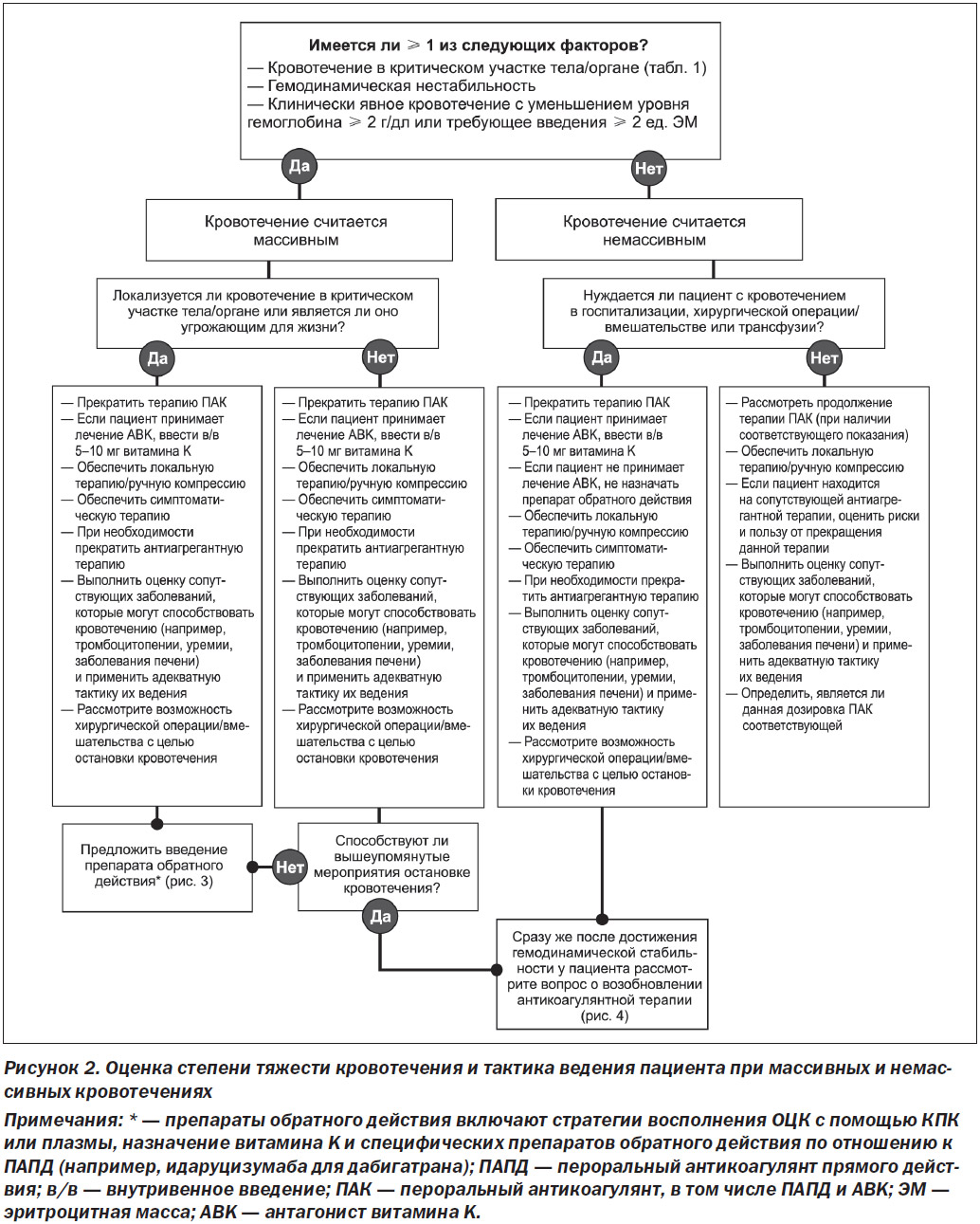
Алгоритмы настоящего протокола экспертного заключения, разработанные авторским коллективом, включают рекомендации по тактике ведения пациентов с кровотечениями, вызванными приемом ПАПД и АВK, которые описаны ниже. Для удобства клинического применения они также представлены на рис. 2.
5.1. Оценка степени тяжести кровотечения
Оценка степени тяжести кровотечения у пациентов, получавших ПАК и/или антиагрегантную терапию, имеет первостепенное значение для принятия решений о достижении гемостаза и сохранении функции органов. Во время первоначальной оценки следует целенаправленно собрать анамнез, провести физикальный осмотр, определить показатели жизненно важных функций и выполнить лабораторную оценку — это поможет определить время начала, локализацию, степень тяжести кровотечения и выяснить, продолжается ли оно в настоящее время. Оценка гемодинамической нестабильности должна проводиться быстро и часто пересматриваться. Пациенты с массивными кровотечениями, с наличием или отсутствием гемодинамической нестабильности нуждаются в тщательном мониторинге, в идеале в условиях отделения интенсивной терапии и реанимации. Дополнительными факторами являются время приема последней дозы антикоагулянта и то, была ли передозировка умышленной или непреднамеренной. Клиницисты должны помнить о наличии сопутствующих заболеваний и сопутствующих методах лечения, которые также могут способствовать кровотечению или оказывать влияние на тактику его купирования (например, прием антиагрегантной терапии, тромбоцитопения, уремия или заболевания печени) и при необходимости вносить соответствующие корректировки.
5.2. Определение степени тяжести кровотечения
Кровотечение считается массивным при наличии ≥ 1 из следующих факторов.
Кровотечение в критически важных участках тела/органах
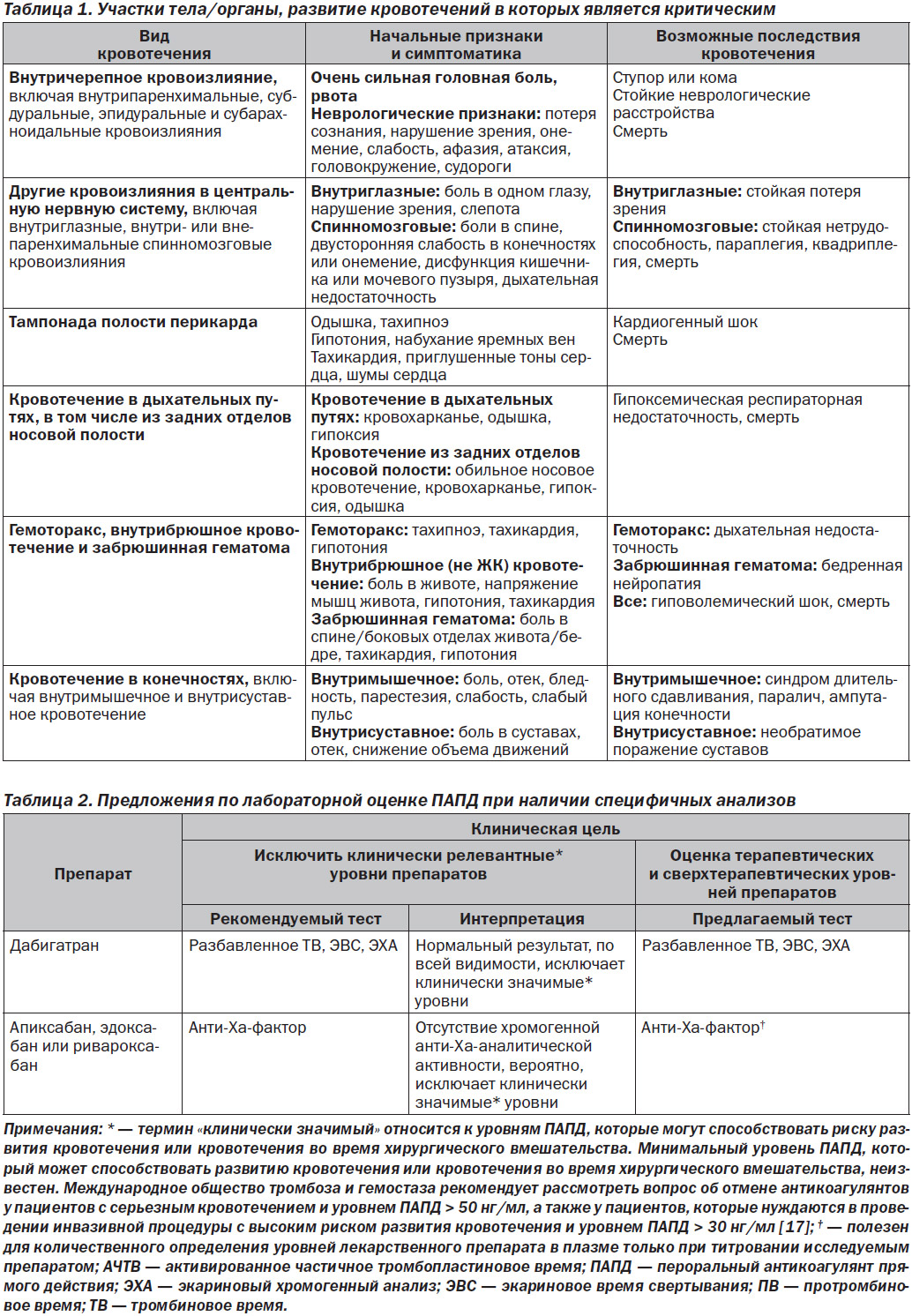
Критически важными считаются такие анатомические участки тела/органы, кровотечения в которые нарушают их функцию. Внутричерепное кровоизлияние и другие кровотечения в центральной нервной системе (например, внутриглазное, спинальное), а также грудное, внутрибрюшное, забрюшинное, внутрисуставное и внутримышечное кровотечения считаются критическими, поскольку они могут вызывать тяжелую инвалидность и для восстановления гемостаза требуют применения хирургических процедур. Внутрипросветное желудочно-кишечное (ЖК) кровотечение не считается критическим, однако оно может привести к гемодинамическим нарушениям. Список кровотечений в критически важные участки тела/органы представлен в табл. 1.
Гемодинамическая нестабильность
Увеличение ЧСС может быть первым признаком гемодинамической нестабильности вследствие кровопотери. Кроме того, САД < 90 мм рт.ст., падение САД более чем на 40 мм рт.ст. [11] или изменение ортостатического АД (снижение САД более чем на 20 мм рт.ст. или падение ДАД более чем на 10 мм рт.ст. при подъеме из положении лежа) могут указывать на гемодинамическую нестабильность. Однако неинвазивно измеренное АД не всегда может отражать внутриартериальное давление. Для оценки превосходным считается непрерывное инвазивное измерение среднего АД, и значение < 65 мм рт.ст. служит значением отсечения в плане определения гемодинамической нестабильности [11]. Для оценки гемодинамической нестабильности в дополнение к клиническим признакам могут использоваться суррогатные маркеры, определяющие перфузию органа (включая диурез < 0,5 мл/кг/ч) [11].
Явное кровотечение со снижением уровня гемоглобина более чем на 2 г/дл или необходимость трансфузии ≥ 2 ед. (стандартных пакетов объемом 450 мл) ЭМ
Кровотечения, вызывающие снижение уровня гемоглобина более чем на 2 г/дл или требующие переливания ≥ 2 ед. ЭМ, ассоциируются со значительно высоким риском смертности [12, 13]. Пациенты с ССЗ, определяемыми как наличие в анамнезе данных о стенокардии, ИМ, СН или заболевании периферических артерий, имеют повышенный риск смертности, связанной со снижением уровня гемоглобина во время госпитализации [13, 14]. Пациенты с острым кровотечением и без предшествующих данных обычно не имеют никаких исходных значений уровня гемоглобина, и следует иметь в виду, что перед проведением мероприятий по восполнению ОЦК гемоглобин может быть искусственно высоким вследствие гемоконцентрации.
Если у пациента кровотечение не является критическим (т.е. кровотечение не в критически важном участке тела/органе (табл. 1), сохраняется гемодинамическая стабильность и отсутствует клинически явное кровотечение, которое бы привело к снижению гемоглобина более чем на 2 г/дл или требовало бы трансфузии ≥ 2 ед. ЭМ), то, согласно настоящему протоколу экспертного заключения, мы относим такое кровотечение к классу немассивных.
5.3. Лабораторная оценка
У пациента с клинически значимым кровотечением, получавшего антикоагулянтную терапию, который нуждается в проведении ургентной незапланированной процедуры, определение антикоагулянтной активности является ключевой лабораторной оценкой. У всех таких пациентов следует определять протромбиновое время (ПВ) и/или активированное частичное тромбопластиновое время (АЧТВ). Интерпретация ПВ и АЧТВ, а также потенциальная необходимость в специализированных пробах на коагуляцию будут зависеть от клинической ситуации, наличия антикоагулянта и наличия соответствующего теста.
При отсутствии сопутствующего нарушения коагуляции (например, ДВС-синдрома) у пациентов, принимающих АВK, лабораторная оценка может основываться на определении ПВ/международного нормализованного отношения (МНО). МНО может использоваться для купирования кровотечений в периоперационном периоде.
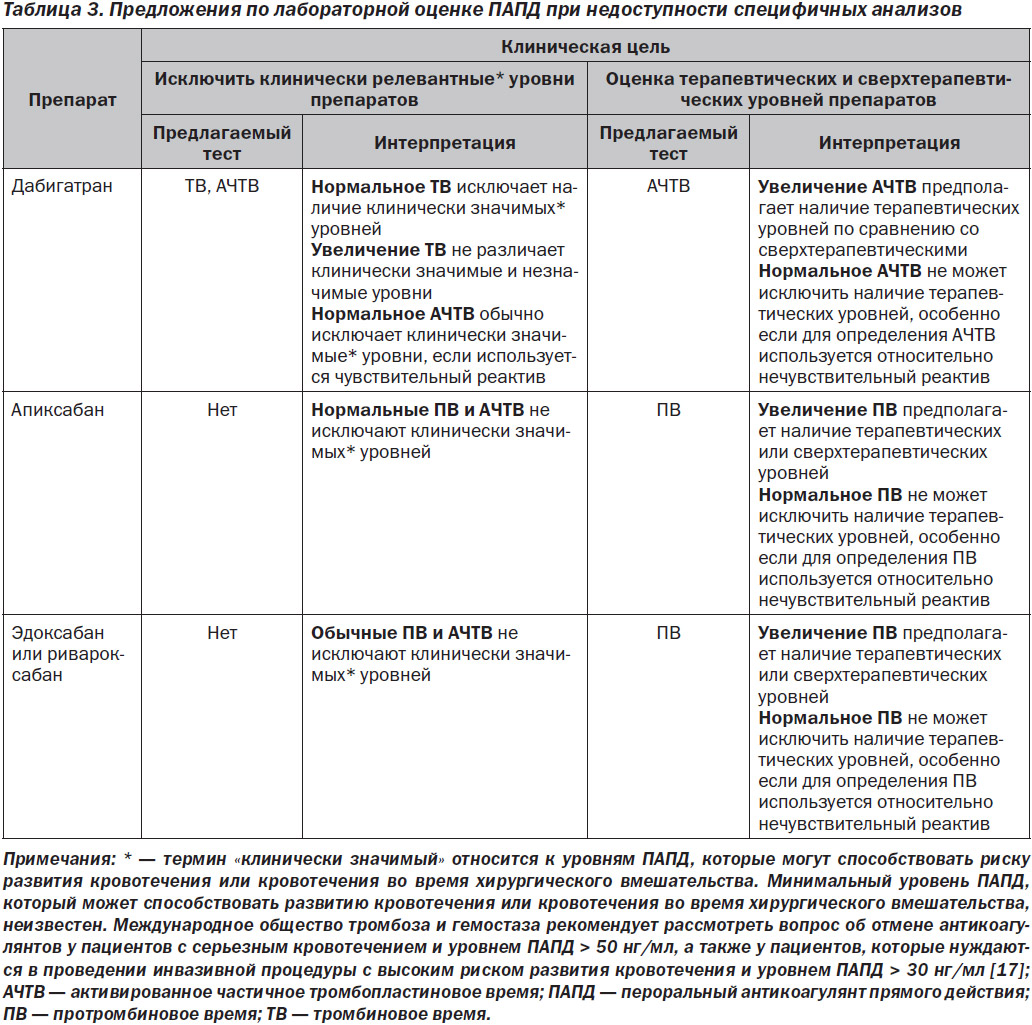
Лабораторная оценка антикоагулянтной активности ПАПД является более сложной. Лучшие тесты являются высокоспецифичными и не имеют широкого распространения в клинической практике. Более доступные тесты, такие как определение ПВ и АЧТВ, имеют значительные ограничения. Предложения по лабораторной оценке ПАПД, основанные на доступности специфичного анализа, приведены в табл. 2, 3 [15, 16].
Лучшие тесты для оценки антикоагулянтной активности дабигатрана включают в себя разбавленное тромбиновое время, экариновое время свертывания и экариновый хронометрический анализ (табл. 2) [18, 19].
Эти тесты тесно коррелируют с уровнями дабигатрана, измеренными эталонным стандартным методом, жидкостной хроматографией и тандемной масс-спектрометрией. К сожалению, эти анализы не являются широкодоступными в клинической практике, особенно в ургентной медицине [18, 19]. В их отсутствие для качественной оценки можно использовать тромбиновое время (ТВ) и АЧТВ (табл. 3). ТВ крайне чувствительно к дабигатрану, даже к очень низким концентрациям данного препарата. Таким образом, нормальное ТВ исключает клинически значимые уровни дабигатрана, а более длительное ТВ не различает его клинически значимых и незначимых концентраций. С целью быстрого исключения клинически значимых уровней дабигатрана все лаборатории, которые не проводят круглосуточный анализ количественной оценки дабигатрана, должны предлагать определение ТВ. Повышенное АЧТВ предполагает наличие высоких уровней дабигатрана на фоне проводимой терапии. Тем не менее нормальное АЧТВ не исключает наличия терапевтических уровней дабигатрана на фоне проводимой терапии, в частности, когда для определения АЧТВ применяется относительно нечувствительный реактив [16, 18, 19].
Предпочтительным лабораторным тестом для оценки антикоагулянтной активности апиксабана, эноксабана и ривароксабана является хромогенный анализ уровня анти-Ха в плазме (табл. 2) [18, 19]. Когда данный анализ проводится методом титрования интересующим препаратом, результаты тесно коррелируют с плазменными уровнями препарата, измеренными с помощью жидкостной хроматографии и тандемной масс-спектрометрии. Когда анализ откалиброван с использованием стандарта низкомолекулярного гепарина, он может быть полезен для исключения клинически значимых уровней лекарственного препарата, но не для его количественного определения. Если анализ уровня анти-Ха недоступен, для качественной оценки эноксабана и ривароксабана может быть полезно определение ПВ. Увеличенное ПВ предполагает наличие терапевтических или сверхтерапевтических уровней данных препаратов. Однако в зависимости от чувствительности реактива для определения ПВ нормальное ПВ не может исключать его терапевтических уровней [18, 19].
ПВ и АЧТВ нечувствительны к апиксабану. Увеличенное ПВ предполагает наличие клинически значимых уровней апиксабана, нормальные же ПВ и АЧТВ не исключают наличие терапевтических или сверхтерапевтических уровней данного препарата [18–20].
5.4. Купирование массивных кровотечений
Следует воздержаться от приема антикоагулянтных и антиагрегантных препаратов, а также обеспечить проходимость дыхательных путей и доступ к сосудам крупного диаметра для в/в ведения препаратов. Рекомендуется отмена ПАК и назначение препаратов обратного действия, если такие доступны для большинства пациентов с массивными кровотечениями (см. раздел «Стратегии отмены и нейтрализации действия ПАК»), но получение и введение препаратов обратного действия не должно откладывать проведения мероприятий по восполнению ОЦК и локальных гемостатических мероприятий. Для пациентов с продолжающимся кровотечением и/или гемодинамической нестабильностью локальные мероприятия по остановке кровотечения (например, сдавливание сосуда, тампонаду) следует сочетать с восполнением ОЦК. Мы рекомендуем агрессивное восполнение ОЦК с помощью в/в введения изотонических солевых растворов, таких как 0,9% раствор NaCl или лактат Рингера [21, 22]. Цель должна состоять в восстановлении стабильности гемодинамики. По всей видимости, коллоидные растворы не обладают преимуществами перед солевыми растворами [23]. Следует выполнять коррекцию гипотермии и ацидоза, поскольку они могут усугублять коагулопатию и способствовать кровотечению. Отсутствуют какие-либо доказательства, подтверждающие превосходство одного солевого раствора над другим [24]; однако при применении больших объемов физиологического раствора следует проявлять осторожность в отношении развития гиперхлоремии и гиперхлоремического ацидоза. Для окончательного купирования кровотечения мы рекомендуем на ранних стадиях задействовать соответствующие службы (например, хирургию, инвазивную радиологию, гастроэнтерологию). Это особенно актуально для кровотечений в критических участках тела/органах (табл. 1).
Поддерживающие мероприятия должны при необходимости включать гемотрансфузию. Данные рандомизированных исследований свидетельствуют о том, что стратегия гемотрансфузии должна быть скорее ограничительной, нежели обширной — это повышает выживаемость и снижает риск рецидива кровотечения у пациентов с острым кровотечением в верхних отделах ЖКТ тяжелой степени [25]. Пациентам с симптоматической анемией или активным кровотечением должна выполняться трансфузия ЭМ для поддержания уровня гемоглобина ≥ 7 г/дл [26]. Пациентам с ИБС, в частности с острыми коронарными синдромами, рекомендуется выполнять более либеральную стратегию трансфузии. Настоящие рекомендации советуют придерживаться целевого уровня гемоглобина ≥ 8 мг/дл [27]. Для поддержания количества тромбоцитов ≥ 50 • 109/л следует переливать тромбоцитарную массу [28, 29], а для поддержания уровня фибриногена > 100 мг/дл — переливать криопреципитат. Для пациентов, нуждающихся в ≥ 3 ед. (пакетов) ЭМ в течение 1 часа, следует рассмотреть возможность протоколов массивной трансфузии [30]. Протоколы различны [31], и в настоящее время многие центры используют целенаправленную трансфузию с тромбоэластографией или вращательной тромбоэластометрией. Следует контролировать уровень ионизованного кальция, и при его снижении показано введение препаратов кальция. Пациентам с травматическими поражениями следует на ранних стадиях, в течение первых 3 часов, назначать транексамовую кислоту — это приводит к уменьшению кровотечения и снижению общей смертности [32]. Авторский коллектив рекомендует продолжить восполнение ОЦК, используя стратегию обратного логического вывода, основанную на результатах лабораторных исследований.
Особое внимание следует уделять сопутствующим заболеваниям, которые могут усугублять кровотечение и его результаты. Вследствие их зависимости от функции почек (клиренса) все ПАПД имеют более высокие показатели крови и более длительный период полувыведения у пациентов с почечной дисфункцией. Это наиболее актуально для пациентов, принимающих дабигатран, от 80 до 85 % которого выводится почками [33]. Пациентам с тяжелой почечной дисфункцией мы рекомендуем выполнять лабораторную оценку для выявления остаточной антикоагулянтной активности (см. раздел «Лабораторная оценка») после введения препарата обратного действия и рассмотрения его повторного введения в случае продолжительного или рецидивирующего кровотечения. Пациенты с почечной дисфункцией также подвержены риску тромбоцитарной дисфункции, возникающей на фоне уремии, — им полезно назначать десмопрессина ацетат или криопреципитат и выполнять оптимизацию функционального состояния почек с помощью гемодиализа (дабигатран является единственным ПАК, который можно вывести посредством гемодиализа) [34–36]. Печеночная дисфункция может вызывать коагулопатию и также может оказывать влияние на кровотечение за счет снижения метаболизма антикоагулянтов. Прямые ингибиторы фактора Ха частично метаболизируются печенью и не изучались у пациентов с тяжелой печеночной дисфункцией. ПВ, МНО и АЧТВ могут не являться надежными оценками гемостатической функции у пациентов с заболеваниями печени; в этой ситуации для оценки функции гемостаза наряду с консультацией по гематологии могут быть полезны вязкоэластические тесты, такие как тромбоэластография или вращательная тромбоэластометрия [37–40]. Можно рассмотреть возможность использования антифибринолитического средства, такого как транексамовая кислота и эпсилон-аминокапроновая кислота. У пациентов с портальной гипертензией и варикозным расширением вен пищевода трансфузия плазмы должна использоваться осторожно, поскольку большие объемы могут увеличить портальное давление и усугубить кровотечение [41]. Пациенты с наследственными коагулопатиями и другими приобретенными нарушениями гемостаза (например, использование антиагрегантной терапии двумя препаратами) могут иметь предрасположенность к развитию более тяжелого и длительного кровотечения. Авторский коллектив рекомендует выполнять терапевтическую коррекцию любой патологии гемостаза, лежащей в основе возникших кровотечений. В настоящее время имеются ограниченные данные, подтверждающие обычное введение тромбоцитарной массы на фоне применения антиагрегантов (например, аспирина и ингибиторов P2Y12). В двух систематических обзорах небольших исследований был сделан вывод, что у пациентов с внутричерепным кровоизлиянием такая терапия не оказывала положительного эффекта [42, 43]. Более того, в недавнем исследовании, в котором пациенты с внутричерепным кровоизлиянием были рандомизированы в две терапевтические группы, одна из которых получала антитромбоцитарную терапию, а другая — трансфузию тромбоцитарной массы, было обнаружено, что вторая группа имела более высокие шансы смерти или зависимости [44]. Таким образом, авторский коллектив не рекомендует стандартное введение тромбоцитарной массы пациентам с кровотечениями, принимающим антиагрегантную терапию, хотя в отдельных случаях такой вариант можно рассматривать, в частности при неэффективности других мероприятий, таких как нейтрализация действия ПАК.
5.5. Купирование немассивных кровотечений
Независимо от степени тяжести кровотечения для остановки любого кровотечения при возможности должны применяться локальные мероприятия. Для пациентов с немассивными кровотечениями мы обычно не рекомендуем отменять ПАК, хотя нередко рекомендуется временно прекратить терапию ПАК до тех пор, пока пациент не достигнет клинической стабильности и не будет восстановлен гемостаз.
Вопрос относительно необходимости временной отмены ПАК у пациента с немассивным кровотечением зависит от индивидуальных характеристик пациента, мнения пациента и/или членов его семьи при совместном принятии решений, характера кровотечения и интенсивности антикоагулянтной терапии. В связи с этим на первый план выступают следующие вопросы:
— Являются ли дозы антикоагулянтной терапии сверхтерапевтическими?
— Являются ли дозы антикоагулянтной терапии терапевтическими (известны и проверяются ли поставленные терапевтические цели)?
— Нуждается ли пациент в проведении неотложной инвазивной процедуры?
— Изменилась ли у пациента предрасположенность к кровотечению (например, вследствие приема новых препаратов, острого ухудшения функции почек или печени)?
— Обоснована ли продолжительная диагностическая оценка места кровотечения или его клинических последствий?
— Имеется ли у пациента изначально тяжелая степень анемии, требующая трансфузии ≥ 1 ед. ЭМ?
— Имеются ли у пациента соответствующие медицинские сопутствующие заболевания или другие заболевания в активной фазе (например, ИМ или острая ишемия), требующие наблюдения и лечения?
— Имеется ли подозрение о наличии у пациента медленного кровотечения в критически важном участке тела/органе, требующее повторной визуализации (например, травма головы с возможным развитием субдуральной гематомы и раннее отрицательными результатами сканирования)? [45, 46].
В любой из этих ситуаций рекомендуется прекратить прием ПАК (по крайней мере временно) и рассмотреть вопрос о том, можно ли безопасно прекратить сопутствующую антиагрегантную терапию. Если после прекращения терапии ПАК все же имеется показание для продолжения антикоагулянтной терапии, предполагается, что пациенты должны будут возобновить прием ПАК после того, как будет решена проблема дополнительных осложнений кровотечения. Если пациент подвергся оперативному вмешательству, обратитесь, пожалуйста, к «Протоколу экспертного заключения АКК 2017 года для проведения антикоагулянтной терапии у пациентов с неклапанной ФП в периоперационном периоде» [10].
Если будет установлено, что пациент не нуждается в госпитализации, хирургическом вмешательстве или трансфузии и был достигнут гемостаз, авторский коллектив рекомендует продолжить прием ПАК. Если эти пациенты принимают сопутствующую антиагрегантную терапию, следует тщательно взвесить соотношение риска и пользы от прекращения приема данных препаратов, хотя, по всей видимости, целесообразно продолжить терапию теми и другими препаратами. Продолжительность действия необратимых антиагрегантов (например, аспирина, клопидогреля и прасу-греля) такова, что временное прекращение может не оказать клинического эффекта в течение нескольких дней, и в это время кровотечение вряд ли будет создавать угрозу. Единственным исключением является тикагрелор, обратимый ингибитор тромбоцитов, период полувыведения которого составляет от 7 до 9 часов. Следует опросить пациента, принимает ли он гомеопатические или натуропатические препараты, такие как рыбий жир или зверобой обыкновенный, что может повысить риск возникновения кровотечений у пациентов, принимающих ПАК.
5.6. Стратегии отмены и нейтрализации действия ПАК
При кровотечении, которое угрожает жизни или локализуется в критическом участке тела/органе, или в ситуациях, когда кровотечение невозможно остановить, требуется отмена ПАК. В этом разделе представлена информация о вариантах, доступных для отмены ингибиторов АВK, дабигатрана и фактора Xa. На рис. 3 приведены показания для назначения препаратов обратного действия, основанные на назначенных пациенту ПАК.
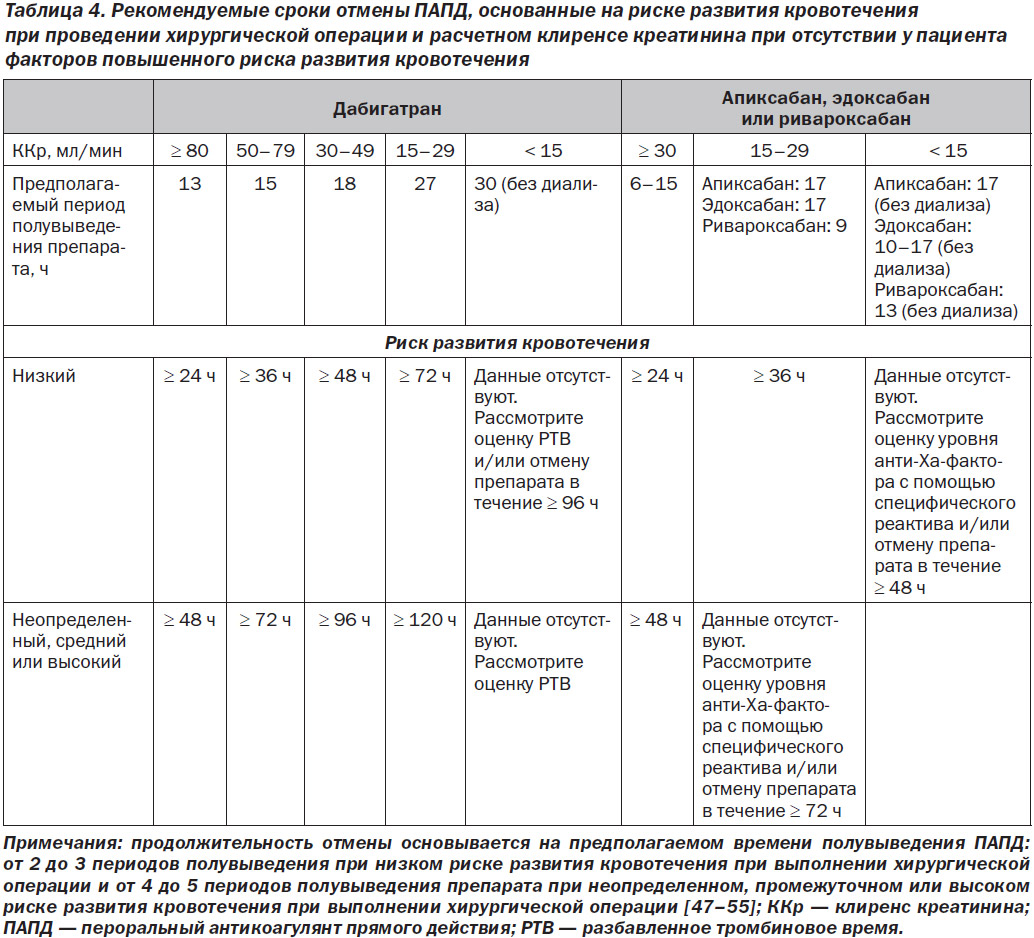
В табл. 4 указана продолжительность отмены ПАПД, основанная на предрасположенности пациента к кровотечению. Данная таблица изначально была составлена авторским коллективом, ответственным за составление «Протокола экспертного заключения 2017 года для проведения антикоагулянтной терапии у пациентов с неклапанной ФП в периоперационном периоде» [10].
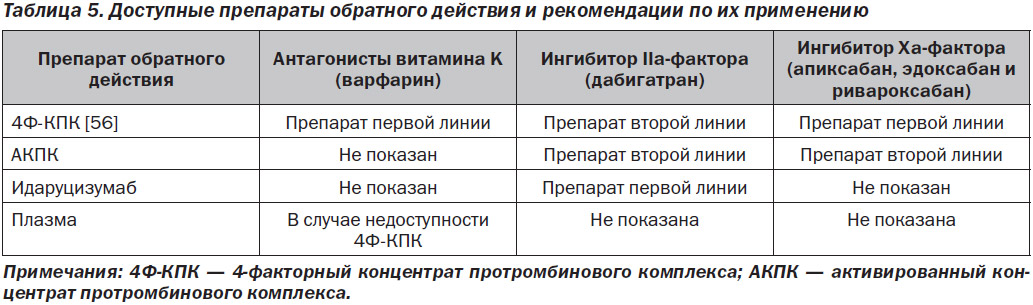
В табл. 5 приведены показания для применения препарата обратного действия для каждого из этих ПАК.
Антагонисты витамина K (варфарин)
Существует несколько вариантов нейтрализации эффекта АВK: введение витамина K, КПК и плазмы.
Витамин K является специфическим препаратом обратного действия по отношению к АВK, поскольку он восстанавливает эндогенное карбоксилирование витамин-K-зависимых печеночных факторов свертывания, нейтрализуя действие АВK дозозависимым образом (от 1 до 10 мг). Витамин K можно назначать перорально, подкожно или в/в. Медленное в/в введение (в 25–50 мл нормального физиологического раствора в течение 15–30 мин) приводит к более предсказуемому и быстрому снижению МНО (в течение 4–6 часов) по сравнению с пероральным (от 18 до 24 ч) или подкожным (непредсказуемым и нерекомендуемым) введением. Анафилактических реакций, о которых ранее сообщалось при в/в введении, при применении текущих препаратов не возникало [57]. Введение витамина K не приводит к немедленной коррекции коагулопатии, и у пациента с массивным кровотечением, согласно приведенному здесь определению, введение должно сопровождаться стратегией восполнения ОЦК (при отсутствии 4-факторного концентрата протромбинового комплекса (4Ф-КПК) восполнение производится только КПК или плазмой).
КПК содержат очищенные витамин-K-зависимые факторы свертывания, полученные из пулированной плазмы крови человека, и не содержат вирусных примесей. Неактивированный 3-факторный КПК содержат II, IX и X факторы свертывания + незначительное количество VII фактора, протеина C и S, тогда как неактивированный 4Ф-КПК содержат II, VII, IX, X факторы свертывания и протеин C и S. Количество каждого витамин K-зависимого фактора варьирует и указано на каждом флаконе. Только 4Ф-КПК лицензирован для быстрой нейтрализации действия АВK. Он не требует совместимости с системой ABO и может храниться при комнатной температуре в виде лиофилизированного порошка, поэтому его можно быстро развести и ввести инфузионно. 4Ф-КПК дозируется на основе МНО и из расчета на массу тела (при МНО 2–4 — 25 Ед/кг, при МНО 4–6 — 35 Ед/кг и при МНО > 6 — 50 Ед/кг, при массе тела 100 кг применяется максимальная доза в 5 000 Ед) для нейтрализации эффекта АВK. 4Ф-КПК содержат приблизительно в 25 раз большую (25 Ед/мл) концентрацию витамин-K-зависимых факторов в единице объема по сравнению с плазмой (1 Ед/мл). Следовательно, КПК можно вводить в гораздо меньшем объеме и с гораздо более высокой (в 8 раз выше) скоростью инфузии по сравнению с плазмой — в этом КПК предпочтителен перед плазмой [58].
Существуют опасения по поводу развития тромбоэмболических осложнений (ТО) при применении как неактивированных, так и активированных КПК. Это связано с единичными сообщениями о ТО, связанных с расширенным использованием 3Ф/4Ф-КПК у пациентов с гемофилией. Недавние рандомизированные клинические исследования, сравнивающие применение 4Ф-КПК с плазмой с целью нейтрализации эффекта АВK, продемонстрировали идентичную частоту ТО в обеих группах [56, 59].
Единицу плазмы (225–300 мл свежезамороженной, замороженной или размороженной плазмы) обычно получают от донорства цельной крови. На витамин-K-зависимые факторы свертывания не влияет температура хранения плазмы. Единица плазмы содержит не только витамин-K-зависимые факторы свертывания, но и другие факторы свертывания и белки, поэтому плазма считается неспецифическим препаратом обратного действия. Трансфузия плазмы требует соответствия системы ABO крови и размораживания замороженной плазмы. Таким образом, как правило, с момента заказа плазмы до фактического введения ее первой единицы может потребоваться до 90 минут. Поскольку 1 единица любого данного фактора присутствует в 1 мл нормальной пулированной плазмы, адекватная доза плазмы для нейтрализации действия АВK будет составлять от 15 до 30 мл/кг. Однако такая доза плазмы не применяется в клинической практике (70 кг × 30 мл = 2,100 мл = 8 Ед плазмы) для быстрой нейтрализации действия АВK, в повседневной же клинической практике используется другая доза (10–15 мл/кг (рис. 3)) [58]. Неблагоприятные эффекты переливания плазмы включают перегрузку ОЦК [58], аллергические реакции и риск развития синдрома острого посттрансфузионного повреждения легких — эти эффекты не наблюдаются при применении КПК, что, таким образом, указывает на предпочтение последнего, особенно у пациентов, чувствительных к объемной перегрузке.
Ингибиторы IIa-фактора (дабигатран)
Большинство осложнений кровотечений, связанных с терапией дабигатраном, можно купировать с помощью консервативных мероприятий и прекращения приема антикоагулянта; большинство несрочных инвазивных процедур можно временно отложить для нормального окончания антикоагулянтного эффекта принятого препарата [47]. В редких случаях кровотечение может быть настолько тяжелым или потребность в хирургических операциях у пациента, получающего лечение дабигатраном, может быть настолько острой, что показана немедленная коррекция антикоагуляционной терапии. Такие отчаянные клинические ситуации были изучены в открытом исследовании Fab-фрагмента идаруцизумаба, которое направлено конкретно на дабигатран [60]. Сродство идаруцизумаба с дабигатраном примерно в 350 раз больше, чем у дабигатрана с тромбином [61].
В исследовании RE-VERSE AD («Нейтрализация антикоагулянтного эффекта дабигатрана с помощью идаруцизумаба») пациенты, получавшие антикоагулянтную терапию дабигатраном, по экстренным показаниям (либо вследствие продолжающихся тяжелых или опасных для жизни кровотечений, либо по причине неотложных терапевтических процедур) получали терапию идаруцизумабом в фиксированной дозе 5 г в виде в/в инфузии двух аликвот по 2,5 грамма [62]. Первичная конечная точка исследования в виде максимальной нейтрализации антикоагулянтного эффекта дабигатрана в течение 4 часов составила 100 % (данный эффект оценивался с помощью разбавленного тромбинового или экаринового времени свертывания) и достигалась у всех пациентов. Остановка кровотечения у пациентов достигалась в среднем в течение 3,5–4,5 часа в зависимости от локализации кровотечения [63]. У пациентов, подвергавшихся хирургическим процедурам или операциям, лечащий хирург отмечал, что во время операции в 92 % случаев имел место нормальный гемостаз. Терапия идаруцизумабом была безопасной и не имела значимых побочных эффектов, а ТО развивались в 6 % случаев, причем примерно две трети этих осложнений имели место у пациентов, не получавших антикоагулянтной терапии после отмены дабигатрана [62]. Применение идаруцизумаба не изучалось в других клинических ситуациях помимо данных сценариев отмены дабигатрана по экстренным показаниям [64].
Идаруцизумаб широко, но не повсеместно доступен в США. В случае недоступности идаруцизумаба можно использовать либо КПК, либо активированный концентрат протромбинового комплекса (АКПК) в дозе 50 Ед/кг (максимальная доза 4 000 Ед); эти измерения основаны на некоторых ограниченных исследованиях на животных ex vivo, а также в исследованиях на человеке, продемонстрировавших вариабельную эффективность любого из препаратов в улучшении параметров гемостаза in vitro [65–71]. Поскольку дабигатран в основном (> 85 %) не связывается с белками в сыворотке, то при очень высоком уровне препарата был предложен гемодиализ, в частности у пациентов с нарушенной функцией почек [72, 73]. При приеме препарата в течение последних 2–4 часов также может использоваться активированный уголь (в дозе 50 г) [61].
Ингибиторы Ха-фактора (апиксабан, эдоксабан и ривароксабан)
В настоящее время нет конкретных клинически доступных антидотов для нейтрализации эффекта антикоагулянта Xa-фактора прямого действия. Предполагается, что дополнительное назначение фактора коагуляции с помощью КПК или АКПК является потенциальной неспецифической стратегией обратного действия для прямых ингибиторов Xa-фактора, основанной на результатах исследований in vitro, моделях на животных, образцах человека ex vivo с добавлением известного количества ингибиторов Xa-фактора и на здоровых добровольцах, получавших ингибиторы Xa-фактора, — все эти исследования имеют значительные ограничения. Ни один из данных препаратов не продемонстрировал эффективность или безопасность у пациентов, получавших ингибитор Xa-фактора, при наличии у них кровотечения или необходимости проведения ургентной операции [74, 75]. 4Ф-КПК является наиболее широко изученной неспецифической стратегией нейтрализации действия ингибиторов Xa-фактора и единственным препаратом, изученным in vivo на людях. В 3 рандомизированных исследованиях оценивали влияние 4Ф-КПК и препарата сравнения (плацебо или 3Ф-КПК) у людей-добровольцев, которым вводили пероральный ингибитор Xa-фактора прямого действия [65, 76, 77]. Во всех 3 исследованиях оценивали действие 4Ф-КПК на лабораторные показатели коагуляции (тесты на коагуляцию и тромбинообразование), и в 1 исследовании оценивали кровотечение после прицельной биопсии. Результаты продемонстрировали коррекцию вызванных антикоагулянтом отклонений лабораторных показателей от нормы, однако эти результаты не были согласованы по всем параметрам и всем исследованиям. Длительность кровотечения после прицельной биопсии была полностью нормализована путем введения максимальной дозы 4Ф-КПК (50 Ед/кг) и частично скорректирована путем введения более низкой дозы 4Ф-КПК (25 Ед/кг). Исходя из этих ограниченных данных, 4Ф-КПК (максимальная доза 50 Ед/кг в соответствии с фармакопейной статьей препарата) является разумным вариантом для экстренной нейтрализации действия ПАК, в частности при наличии у пациентов тяжелого или опасного для жизни кровотечения, возникшего на фоне приема ПАПД (ингибиторов Xa-фактора).
АКПК оказывает непостоянные эффекты на индуцированные ингибитором Xa-фактора отклонения от нормы тестов на коагуляцию и тромбинообразование in vitro и кровотечения в моделях на животных. При добавлении ex vivo к образцам здоровых добровольцев, получивших 1 дозу ривароксабана, АКПК нормализовывал отклоненные показатели тромбинообразования [66]. Для остановки кровотечений у пациентов с гемофилией на фоне приема ингибитора Xa-фактора АКПК обычно вводят в/в в дозах 50–100 мкг/кг, максимальная суточная доза составляет 200 Ед/кг [78]. Рандомизированные исследования, в которых бы изучался режим дозирования у пациентов с массивным кровотечением, связанным с приемом ингибиторов Xa-фактора, отсутствуют. На основании доклинических данных, описаний клинических случаев и данных серии случаев для пациентов с массивными кровотечениями, развившимися на фоне приема ингибитора Xa-фактора, которые могут иметь клинически значимые уровни антикоагулянта, начальная в/в доза АКПК предполагается на уровне 50 Ед/кг [79].
Препараты обратного действия по отношению к ПАК, находящиеся на стадии разработки
Андексанет альфа является специфическим препаратом обратного действия для ингибиторов Xa-фактора, который в настоящее время находится на стадии клинической разработки. Данный препарат представляет собой рекомбинантный белок со структурой, аналогичной эндогенному Xa-фактору, который связывает ингибиторы Xa-фактора, но не является ферментативно активным [80]. Болюсное введение и двухчасовая инфузия андексанета альфа быстро нейтрализовывали антикоагулянтное действие апиксабана и ривароксабана у здоровых добровольцев пожилого возраста [81]. В исследовании ANNEXA-4 («Изучение эффективности андексанета альфа у пациентов, получавших ингибитор Xa-фактора, у которых развилось острое массивное кровотечение»), которое проводится в настоящее время, оценивается эффективность андексанета у пациентов, получавших в течение 18 часов ингибитор Xa-фактора, у которых развились массивные кровотечения. Согласно предварительному анализу исследования (n = 67), андексанет уменьшал активность анти-Xa-фактора и уровней активного препарата более чем на 90 %, а клинический гемостаз был признан хорошим/отличным у 79 % пациентов [82]. Вследствие короткого периода полувыведения андексанета альфа некоторые антикоагулянтные эффекты прямого ингибитора Xa-фактора возобновляются в течение 1–3 часов после прекращения инфузии, что вызывает беспокойство относительно оптимальной продолжительности инфузии и/или необходимости повторного назначения данного препарата [81, 82]. У здоровых добровольцев андексанет увеличивает биомаркеры тромбинообразования без развития клинических ТО. Несмотря на то что данные о риске ТО при применении андексанета у пациентов с массивными кровотечениями находятся на стадии сбора, промежуточные результаты показывают, что у 18 % пациентов в течение 30 дней после инфузии андексанетом развивались ТО, и большинство из них (92 %) не возобновили антикоагулянтную терапию. Остается неясным, выше ли эта частота развития ТО, чем можно было бы ожидать, у пациентов с кровотечениями и высоким риском развития ТО, которые прекращали прием антикоагулянтов. Андексанет связывается с естественным антикоагулянтом и ингибитором пути тканевого фактора, что может вызвать прокоагулянтный эффект [80].
Цирапарантаг (PER977) представляет собой небольшую синтетическую водорастворимую молекулу, которая связывается с прямыми и непрямыми ингибиторами Xa-фактора и тромбина посредством нековалентного межзарядного взаимодействия. Связываясь с этими молекулами, цирапарантаг предотвращает связывание антикоагулянта с его эндогенной мишенью. В настоящее время цирапарантаг находится на ранних стадиях разработки, однако одно исследование демонстрирует быстрое и продолжительное (в течение 24 ч) изменение времени свертывания цельной крови у добровольцев, получающих эдоксабан [83, 84].
5.7. Рекомендации относительно повторного назначения антикоагулянтной терапии
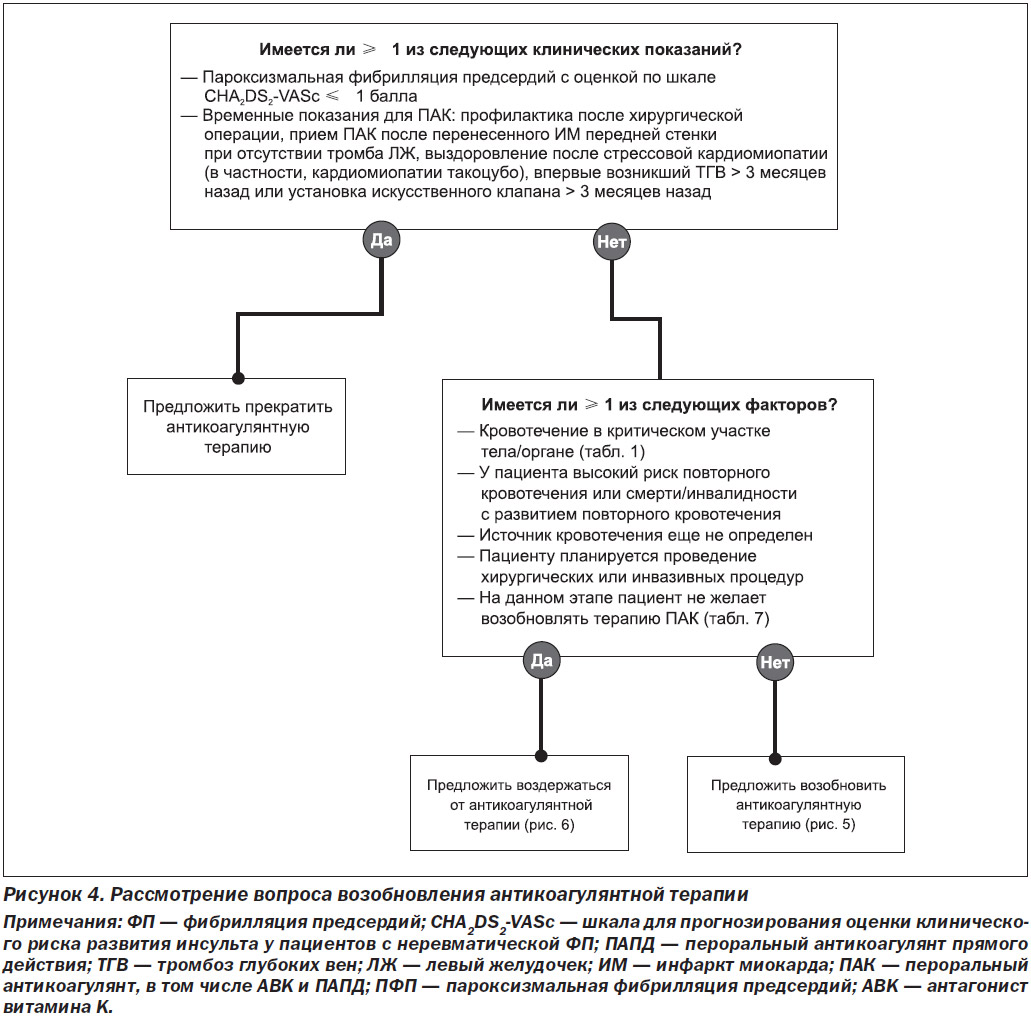
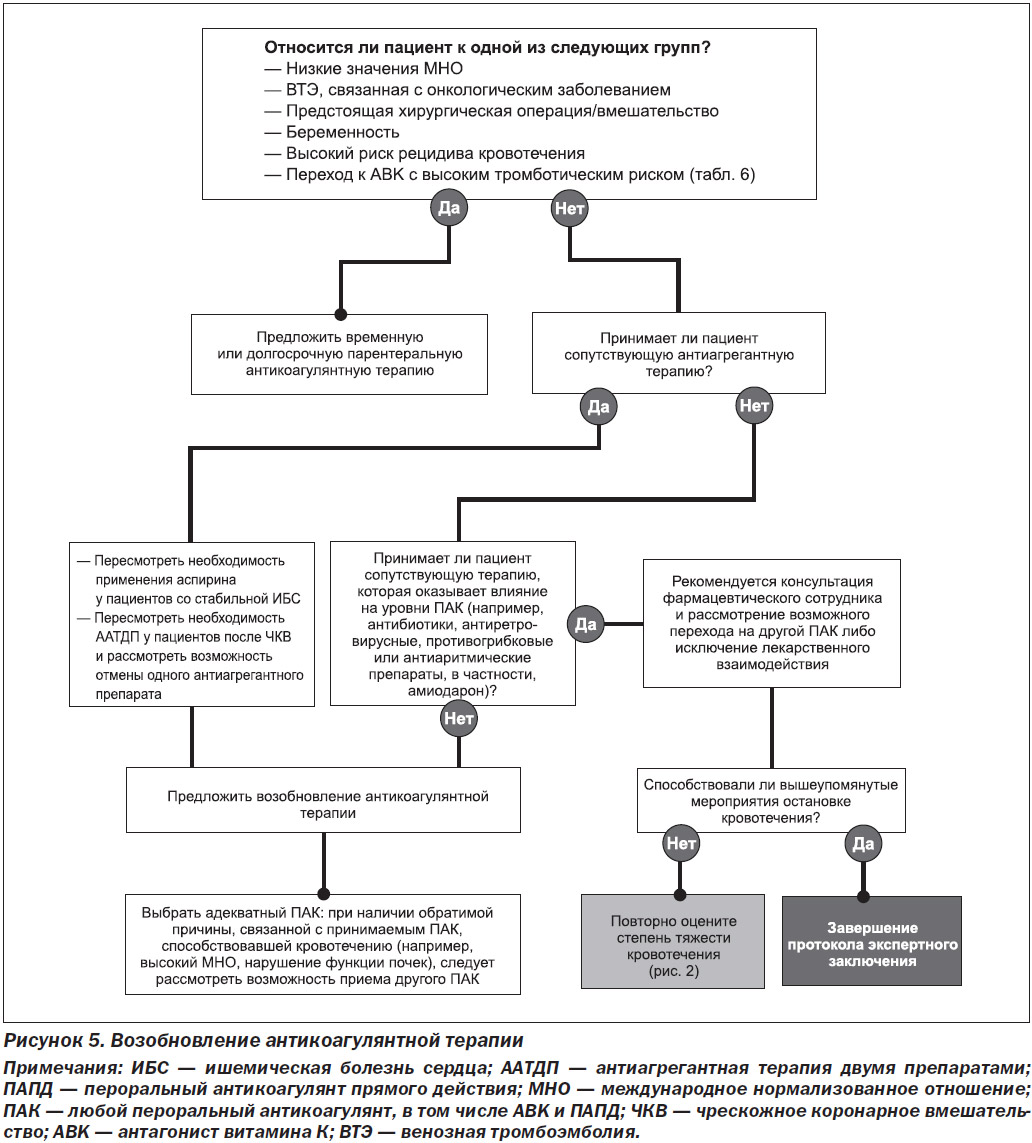
На рис. 4 приведены рекомендации относительно того, следует ли пациенту возобновлять антикоагулянтную терапию и в какие сроки.
Следует ли возобновлять антикоагулянтную терапию?
В большинстве случаев существует чистая клиническая польза для возобновления ПАК после купирования кровотечения [85]. После развития кровотечения у пациента на фоне приема ПАК необходимо провести переоценку показаний к ПАК, чтобы решить вопрос о необходимости продолжения терапии на основе разработанных клинических практических рекомендаций. ПАК больше не показаны при следующих состояниях:
— пароксизмальная фибрилляция предсердий с оценкой по шкале CHA2DS2-VASc ≤ 1 балла;
— временные показания для ПАК (например, профилактика после хирургической операции, прием ПАК после перенесенного ИМ при отсутствии тромба ЛЖ, выздоровление после стрессовой кардиомиопатии (в частности, кардиомиопатии такоцубо), венозная тромбоэмболия, впервые возникшая > 3 месяцев назад, или установка искусственного клапана > 3 месяцев назад) [86].
При наличии показаний для постоянного приема ПАК клиницист должен оценить чистую клиническую пользу ПАК в контексте недавнего кровотечения, чтобы решить, имеется ли временное или постоянное преимущество пользы лечения или профилактики тромбозов с помощью ПАК над риском развития кровотечения. Такая оценка соотношения риска и пользы должна проводиться при консультации с другими клиническими специалистами (хирургами, специалистами по инвазивным процедурам и неврологами), а также при обсуждении таких вопросов с пациентами или их опекунами.
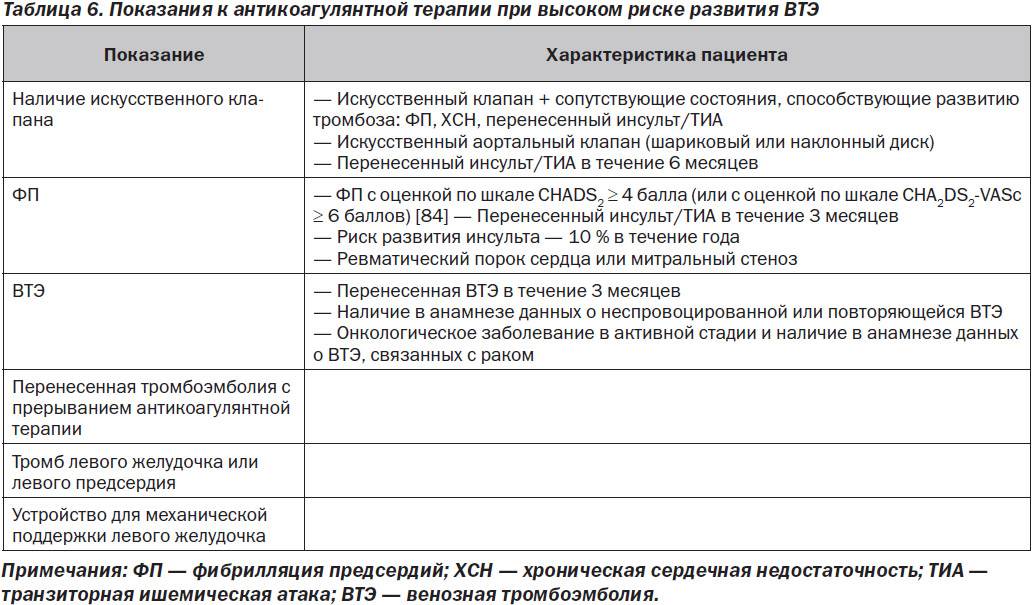
Существует множество факторов, которые способствуют оценке соотношения риска и пользы для возобновления антикоагулянтной терапии. Факторы обратного действия, которые, вероятно, могут оказывать влияние на развитие кровотечений, такие как высокий уровень МНО у пациента на фоне приема АВK, сопутствующая антиагрегантная терапия, острая или прогрессирующая почечная недостаточность, приводящая к повышенным уровням ПАК, или выраженные взаимодействия между лекарственными препаратами, которые могут повышать уровни ПАПД, могут быть устранены перед повторной терапией. Для минимизации возможных побочных эффектов важным является определение целесообразности применения данного препарата и дозы для отдельных пациентов на основании показаний, возраста, веса и функции почек. Если пациент находится на антиагрегантной терапии, следует выполнить повторную оценку необходимости антиагрегантной терапии двумя препаратами или определить, ли будет разумным прекращение приема аспирина [47]. Характеристики кровотечения, которые существенно влияют на риск возобновления антикоагулянтной терапии, включают (но не ограничиваются этим): 1) локализацию кровотечения (критически важный участок тела/орган или нет); 2) источник кровотечения (был ли он окончательно диагностирован и было ли кровотечение остановлено); 3) механизм развития кровотечения (травматическое или спонтанное) и 4) планируются ли дальнейшие хирургические или оперативные вмешательства. Наконец, следует учитывать показания к антикоагулянтной терапии, поскольку пациенты с высоким риском развития ТО, вероятнее всего, получат пользу от возобновления антикоагулянтной терапии даже при наличии высокого риска повторного кровотечения. В табл. 6 приведены показания к антикоагулянтной терапии с высоким риском развития ТО.
Сроки возобновления антикоагулянтной терапии
На рис. 5 приведено клиническое руководство для клинических ситуаций, в которых пациентам рекомендуется возобновление антикоагулянтной терапии.
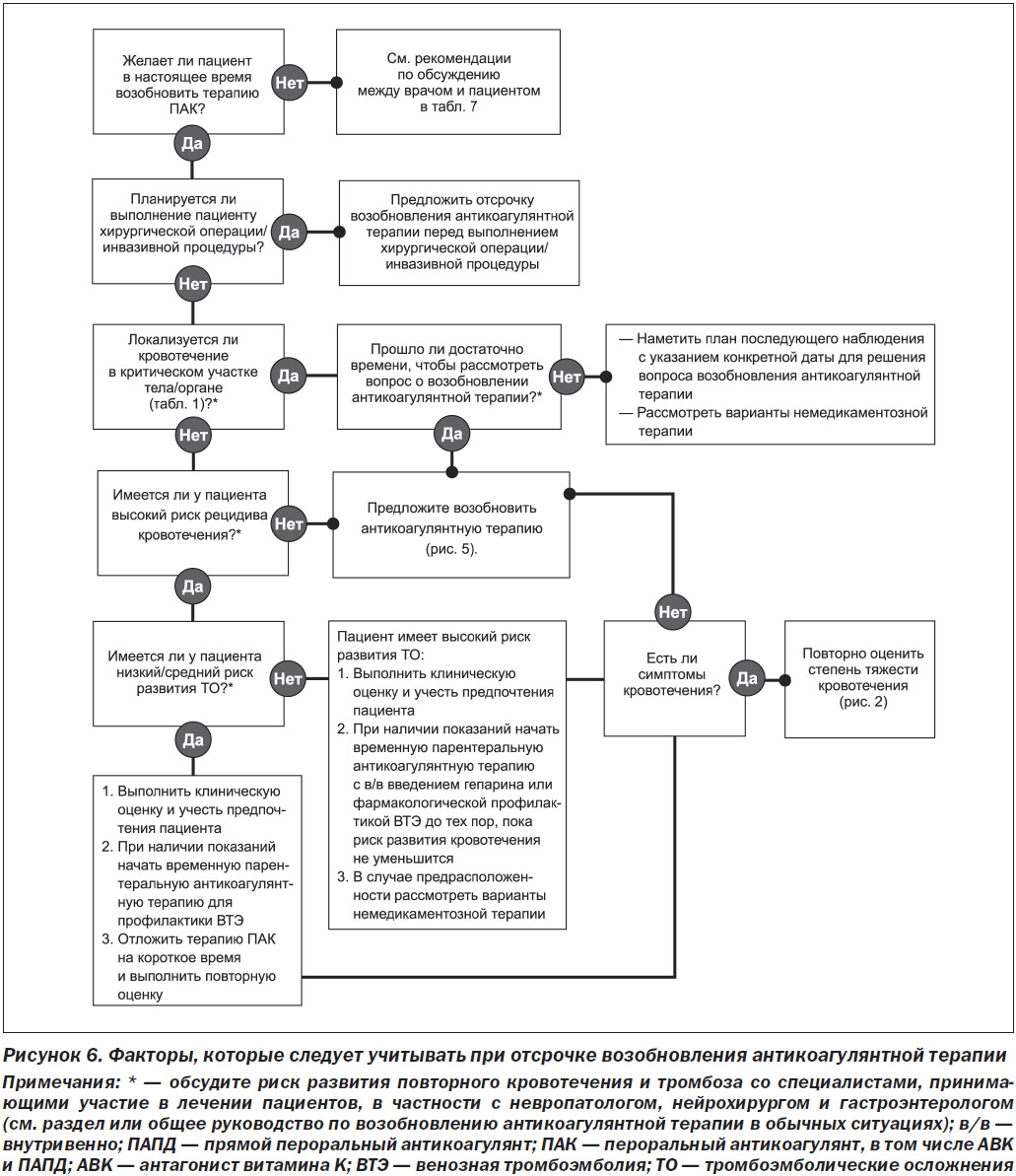
На рис. 6 представлено клиническое руководство для клинических ситуаций, в которых пациентам рекомендуется отложить возобновление антикоагулянтной терапии.
Определение оптимального времени возобновления приема ПАК преследует двойную терапевтическую цель: профилактику тромбоэмболических осложнений и сведение к минимуму возможности развития повторного кровотечения. В целом условия с высоким риском развития ТО (табл. 6) способствуют раннему возобновлению антикоагулянтной терапии после достижения гемостаза и клинической стабильности пациента. Прием ПАК можно возобновить при условии тщательного мониторинга состояния пациентов с высоким риском развития ТО, для пациентов же с умеренным или высоким риском рецидива кровотечений подходящими являются индивидуальные стратегии. Например, введение парентеральных антикоагулянтных препаратов у большинства пациентов обычно можно начинать после тщательного мониторинга их состояния в течение 1–3 дней. Для пациентов с высоким риском рецидива кровотечений, неприемлемо высоким риском развития ТО и необходимостью антикоагулянтной терапии предполагается в/в инфузионное введение нефракционированного гепарина вследствие его короткого периода полувыведения и доступного препарата обратного действия (протамина сульфата), который может быстро остановить антикоагуляцию и/или вызвать обратный эффект в случае развития повторного кровотечения.
Профилактические дозы парентеральных антикоагулянтов (например, нефракционированного или низкомолекулярного гепарина, вводимого подкожно) могут снизить риск дальнейшего кровотечения по сравнению с терапевтическими дозами. Однако в данных клинических условиях для создания баланса между риском развития кровотечения и риском развития ТО разумной стратегией является временное использование профилактических доз в комплексе с тщательным клиническим мониторингом и титрованием до терапевтических доз.
У пациентов с высоким риском развития ТО и высоким риском развития кровотечения, что является относительным или абсолютным противопоказанием к возобновлению антикоагулянтной терапии, можно рассмотреть возможность применения нефармакологической терапии. Совместно с соответствующими специалистами можно рассмотреть вопрос о применении таких устройств, как устройство для окклюзии ушка левого предсердия с целью снижения риска развития ТО при ФП или временно устанавливаемый кава-фильтр с целью профилактики острого ТГВ. Окклюзия ушка левого предсердия выполняется несколькими минимально инвазивными способами, которые несут различные риски, связанные с выполнением данной процедуры, и риск развития кровотечения. Например, эндокардиальное устройство требует антикоагулянтной терапии в течение не менее 45 дней после его установки. В отличие от него эпикардиальное устройство не требует антикоагулянтной терапии. Рекомендуется консультация специалиста, знакомого с различными способами окклюзии ушка левого предсердия. Решающее значение имеет целесообразное использование кава-фильтров, поскольку рандомизированные исследования продемонстрировали, что их применение может осложняться неблагоприятными процедурными эффектами и повышенным риском развития ТГВ, ТЭЛА или смертности без какой-либо пользы для пациента [87, 88]. Одно исследование показало количественное (но не статистически значимое) увеличение частоты ТЭЛА. Кава-фильтры считаются временными вспомогательными средствами, которые показаны только для пациентов с недавним тромбозом проксимальных глубоких вен и абсолютным противопоказанием к антикоагулянтной терапии. В случае с использованием кава-фильтров их необходимо удалять, как только будет достигнута терапевтическая антикоагуляция, предпочтительно перед выпиской из стационара [89].
В целом временное краткосрочное прекращение приема ПАК, вероятно, подходит для большинства пациентов без высокого риска развития ТО, поскольку повторное кровотечение может привести к дальнейшему более длительному прекращению приема ПАК и увеличению риска развития ТО. При возобновлении антикоагулянтной терапии после купирования кровотечения также можно рассмотреть возможность перехода на другой ПАК. В случаях, когда определяемые факторы риска (например, нарушения функции почек) ассоциировались с развитием кровотечения, целесообразно рассмотреть возможность терапии альтернативными антикоагулянтами. Например, пациент, имеющий в анамнезе лабильные значения МНО, у которого возникло осложнение в виде кровотечений с повышенным МНО на фоне приема варфарина, может извлечь пользу из терапии ПАПД; с другой стороны, пациент с нарушением функции почек, у которого возникло осложнение в виде кровотечений на фоне приема ПАПД, может извлечь пользу из терапии варфарином. Тем не менее вопросы рекомендаций индивидуальной терапии для отдельно взятых пациентов не рассматриваются в рамках настоящего документа. Конкретные клинические ситуации, связанные с ЖК кровотечением, внутричерепным кровоизлиянием, а также вопросы антикоагулянтной терапии в послеоперационном периоде изложены в следующем разделе.
Привлечение пациента к обсуждению возобновления антикоагулянтной терапии
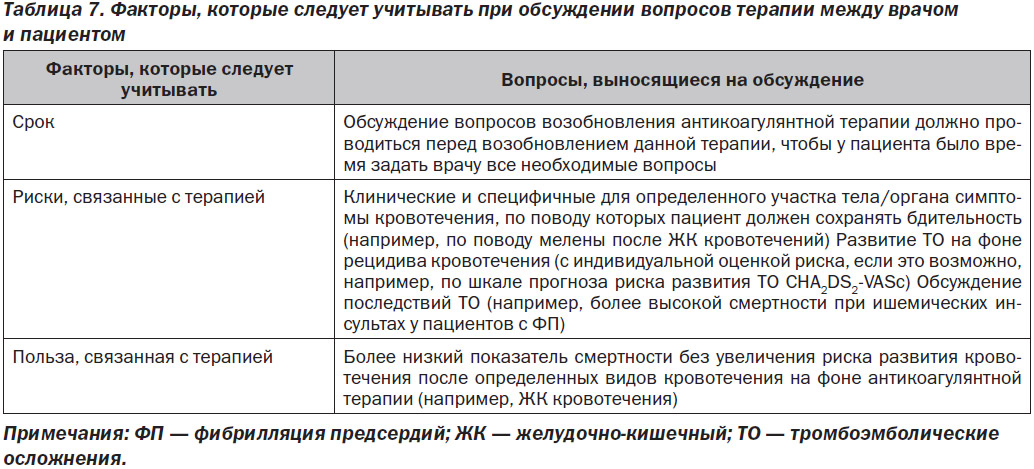
Оптимальное участие пациентов в решении возоб-новления антикоагулянтной терапии предполагает совместное принятие решений пациентами и медицинскими специалистами. Обсуждение должно включать в себя вопросы касательно рисков возможного развития кровотечений при возобновлении антикоагулянтной терапии, включая клинические признаки кровотечения (например, контроль наличия мелены после ЖК кровотечения), риск возможного развития ТО и смерти при отсутствии антикоагулянтной терапии. Например, при отсутствии приема ПАК 30-дневная смертность после ишемического инсульта, возникшего как осложнение ФП [90, 91], может достигать ~ 25 %, и важно, чтобы пациенты понимали такой риск. Обсуждение следует начинать в раннем периоде, чтобы позволить пациентам задать все вопросы или выразить беспокойство, и при возможности необходимо привлечь поставщиков первичных медицинских услуг. Важные темы для обсуждения с пациентами перед возобновлением антикоагулянтной терапии приведены в табл. 7.
Сопутствующая фармакотерапия
Комплексный обзор лекарственных препаратов должен определять такие из них, которые могут повышать уровень антикоагулянтов и возможный риск возникновения кровотечения. Препараты, которые ингибируют активность P-гликопротеина и/или цитохрома P450 3A4, такие как антиаритмические средства (амио-дарон, дилтиазем, верапамил), антиретровирусные препараты, противогрибковые средства и иммунодепрессанты, могут повышать сывороточные уровни ПАК [47]. Другие лекарственные препараты, которые влияют на гемостаз, такие как антиагрегантные препараты (аспирин, клопидогрель, прасугрель, тикагрелор, кангрелор) или НПВП, принимаемые в комбинации с ПАК, повышают риск повторного кровотечения. В частности, использование антикоагулянта на фоне антиагрегантной терапии одним или двумя препаратами является значительным фактором риска развития кровотечения с точки зрения клинических испытаний для разработки рекомендаций таким пациентам. Таким образом, для выбора подходящей терапии таким пациентам следует учитывать необходимость и продолжительность антиагрегантной терапии одним или двумя препаратами [92–94]. Для пациентов, получающих терапию АВK, следует пересмотреть рекомендации по питанию — это может помочь предотвратить лабильность значений МНО и внести коррективы касательно продолжительности терапии.
Желудочно-кишечные кровотечения
Желудочно-кишечное (ЖК) кровотечение является относительно распространенным геморрагическим осложнением длительной терапии ПАК. Антикоагулянтная терапия постоянно прекращается у значительной части пациентов, несмотря на то что они подтверждают преимущества повторного назначения ПАК. При систематическом обзоре обсервационных исследований пациенты с ЖК кровотечениями, развившимися на фоне приема ПАК, которые впоследствии возобновляли антикоагулянтную терапию, имели более низкий риск развития ТО (9,9 по сравнению с 16,4 %; отношение рисков (ОР) 0,68; 95% ДИ 0,52–0,88) и смерти (24,6 по сравнению с 39,2 %; ОР 0,76; 95% ДИ 0,66–0,88) по сравнению с теми, кто не возобновлял данную терапию, при этом риск рецидивирующего кровотечения повышался незначительно (10,1 по сравнению с 5,5 %; ОР 1,20; 95% ДИ 0,97–1,48) [95]. Недавнее ретроспективное исследование показало снижение риска развития ТО (ОР 0,19; 95% ДИ 0,07–0,55) и смерти (ОР 0,61; 95% ДИ 0,39–0,94) и повышение риска рецидивирующего ЖК кровотечения (ОР 2,5; 95% ДИ 1,4–4,5) у пациентов, которые возобновляли терапию АВK, по сравнению с теми, кто не возобновлял такую терапию [96]. Частота возобновления антикоагулянтной терапии целенаправленно не изучалась и сильно варьировала, хотя проспективное исследование, в котором антикоагулянтная терапия возобновлялась у пациентов во время выписки со средней продолжительностью пребывания в стационаре 5 дней (включая лиц, у которых не был установлен источник кровотечения), продемонстрировало снижение частоты ТО в течение 90 дней без увеличения частоты кровотечений; у пациентов с ФП возобновление приема варфарина спустя > 7 дней после купирования кровотечения было связано с более высокой выживаемостью и снижением частоты ТО без повышения риска рецидивирующего ЖК кровотечения [97, 98]. Таким образом, в большинстве случаев ЖК кровотечения авторский коллектив рекомендует после его остановки возобновление антикоагулянтной терапии у пациентов при наличии показаний к ПАК (включая лиц, у которых не был выявлен источник кровотечения).
Внутричерепное кровоизлияние
Внутричерепное кровоизлияние является наиболее опасным осложнением антикоагулянтной терапии. Несмотря на то что внутричерепное кровоизлияние встречается редко, во время приема ПАК оно может иметь катастрофические последствия, при этом частота 30-дневной смертности приближается к 50 % [99]. Примерно 20 % спонтанных внутричерепных кровоизлияний возникает на фоне антикоагулянтной терапии. Таким образом, оправданным является осторожный индивидуальный подход к возобновлению ПАК после внутричерепного кровоизлияния. Факторы, связанные с более высоким риском рецидива кровотечения, включают механизм внутричерепного кровоизлияния (спонтанное или травматическое), лобарное расположение первоначального эпизода кровотечения (предполагающее амилоидную ангиопатию), наличие и количество геморрагических микроочагов на МРТ и продолжающуюся антикоагулянтную терапию [100].
Данные о возобновлении ПАК после внутричерепного кровоизлияния ограниченны. В зависимости от характеристик кровотечения, модификации фактора риска и показаний к антикоагулянтной терапии после нелобарного внутричерепного кровоизлияния можно рассматривать возобновление приема ПАК [100]. В обсервационных исследованиях пациентов с внутричерепным кровоизлиянием, возникшим на фоне приема варфарина, возобновление антикоагулянтной терапии, по всей вероятности, приводит к снижению риска развития ТО на 50–70 % и снижению риска смерти на 50–70 % без выраженного увеличения риска развития рецидивирующего кровотечения по сравнению с прекращением приема ПАК [101–108]. Перед возобновлением приема ПАК важно оптимизировать модифицируемые факторы сердечно-сосудистого риска (такие как АГ). Лобарное внутричерепное кровоизлияние, вторичное по отношению к развитию амилоидной ангиопатии (спонтанное или возникшее на фоне применения варфарина), а также спонтанные субдуральные гематомы являются факторами крайне высокого риска рецидива кровотечения. Возобновление антикоагулянтной терапии в этих условиях должно проводиться крайне осторожно, при необходимости должны осуществляться консультации с неврологами или нейрохирургами. Прием ПАПД ассоциируется с более низким риском развития внутричерепного кровоизлияния, чем варфарин, однако безопасность перехода пациента с внутричерепным кровоизлиянием на ПАПД в исследованиях не оценивалась [100, 109].
Сроки возобновления антикоагулянтной терапии после внутричерепного кровоизлияния целенаправленно не изучались, и в обсервационных исследованиях они варьировали в широком диапазоне (от 72 ч до 30 недель), что говорит об отсутствии единого согласованного мнения. Однако у пациентов при отсутствии искусственных клапанов сердца, согласно рекомендациям, следует избегать приема антикоагулянтов в течение не менее 4 недель, а при наличии показаний через несколько дней после внутричерепного кровоизлияния можно возобновить монотерапию аспирином [100]. В крупном ретроспективном исследовании, которое продемонстрировало пользу возобновления приема ПАК, средний срок возобновления терапии ПАК составил приблизительно 1 месяц после купирования кровотечения [101]. Поэтому у пациентов без высокого риска ТО авторский коллектив рекомендует откладывать возобновление антикоагулянтной терапии как минимум на 4 недели.
Возобновление антикоагулянтной терапии после хирургических операций/вмешательств
Если антикоагулянтная терапия была отменена по причине проведения ургентной хирургической операции/вмешательства без предшествующего кровотечения и в послеоперационном периоде был достигнут адекватный гемостаз, следует незамедлительно возобновить антикоагулянтную терапию. Для хирургических вмешательств, которые имеют низкий риск развития кровотечения в послеоперационном периоде, антикоагулянтная терапия может быть возобновлена через 24 часа после вмешательства. Если в послеоперационном периоде риск развития кровотечения является высоким, антикоагулянтную терапию следует отсрочить на 48–72 часа [10]. Следует отметить, что у пациентов с неклапанной ФП после временного прекращения терапии ПАК с целью проведения хирургических операций/вмешательств, связанных с повышенным риском развития кровотечений, и при отсутствии низкого риска развития ТО перед возобновлением терапии АВK следует применять парентеральную антикоагулянтную терапию (так называемую переходную антикоагуляцию) [110]. Имеются ограниченные данные об эффективности и безопасности переходной антикоагуляции у подгруппы пациентов с высоким риском развития ТО, которые планируют возобновление терапии АВK. У этих пациентов переходная антикоагуляция парентеральными антикоагулянтами может быть рассмотрена после достижения гемостаза и совместно с консультацией хирурга или специалиста по выполнению инвазивных процедур. Если в послеоперационном периоде используется ПАПД, то переходную антикоагуляцию использовать не следует.
Если хирургическая операция/вмешательство выполняется с целью контроля кровотечения, то возобновление антикоагулянтной терапии в послеоперационном периоде может иметь более высокий риск рецидива кровотечения. Это зависит от характеристик кровотечения и хирургического лечения. Если источник кровотечения был диагностирован, кровотечение было полностью купировано и был достигнут адекватный гемостаз, то целесообразным может быть возобновление антикоагулянтной терапии аналогично обсуждению в предыдущем разделе. У пациентов, у которых кровотечение не было успешно купировано хирургическим/инвазивным методом, следует применять индивидуальные стратегии с тщательным контролем их клинического состояния.
6. Обсуждение протокола и его внедрение в клиническую практику
Основная цель настоящего протокола экспертного заключения — предоставить клинически применимую, удобно представленную в виде таблиц концептуальную основу для поддержки принятия решений клиническим специалистом по оказанию медицинской помощи пациентам с осложнениями в виде кровотечений, развившимися на фоне терапии ПАК. Для расширения возможных показаний для клинического использования и внедрения в клиническую практику настоящего протокола экспертного заключения авторский коллектив учитывал пациентов, принимающих антикоагулянтную терапию по любым показаниям. По мере возможности рекомендации основаны на количественных данных клинических исследований. Однако существуют большие пробелы в знаниях, и поэтому большая часть того, что делают клиницисты для ухода за этими пациентами, основана на ограниченной информации. Предполагается, что по мере старения населения все большее число людей будут получать терапию ПАК. Поскольку текущие исследования и клиническая практика предоставляет все большее количество доказательств, настоящий протокол экспертного заключения будет нуждаться в дополнительной доработке. На данный момент авторский коллектив надеется, что настоящий протокол экспертного заключения поможет мультидисциплинарной группе врачей, которые оказывают медицинскую помощь пациентам с кровотечением, развившимся на фоне терапии ПАК.
С полным текстом документа можно ознакомиться в Journal of the American College of Cardiology. — 2017. — Vol. 70 (24). — 3042-3067