Газета «Новости медицины и фармации» №14 (709), 2019
Вернуться к номеру
Огляд міжнародного консенсусу з алергії та ринології: Алергічний риніт (частина ІІ)
Разделы: Руководства
Версия для печати
VIII.F. Методи діагностики in vitro
VIII.F.1. Загальний рівень IgE у сироватці (IgE)
Літературні дані щодо ролі загального рівня IgE у сироватці крові для оцінки та діагностики алергічних захворювань суперечливі та розбіжливі. Загалом у цих джерелах міститься інформація, яка може допомогти у прийнятті рішень, пов’язаних зі значимістю загального IgE у веденні хворих.
Скоріше за все, найбільш вірогідним твердженням щодо загального рівня IgE є те, що за його допомогою можна визначити пацієнтів або їх популяцію з атопічними або алергічними захворюваннями взагалі. Наприклад, Ando і Shima [892] повідомили, що загальний IgE вище у дітей з АР, ніж у однолітків із неалергічним ринітом (НАР). Marinho та співавт. [893] виявили сумнівний зв’язок між загальним IgE та поточним ринітом. У ретроспективному дослідженні Kalpaklioglu і Kavut [894] повідомили, що загальний рівень IgE є вищим при АР, ніж при НАР. Jung та співавт. [895] провели проспективне дослідження, яке показало, що гранична концентрація загального IgE 98,7 МО/мл є сильним предиктором АР. Salo та співавт. [454] провели поперечне дослідження, яке повідомило про зв’язок між рівнем загального IgE та поточним сезонним алергічним ринітом у різних вікових групах. Demirjian та співавт. [896] продемонстрували, що рівень загального IgE понад 140 МО/мл свідчить про атопічну етіологію у пацієнтів із клінічними симптомами АР. Hatcher та співавт. [897] показали, що підвищений загальний IgE при негативному результаті скринінгу на специфічні IgE до інгаляційних антигенів може свідчити про наявність сенсибілізації іншими інгаляційними алергенами або хронічного запального захворювання дихальних шляхів, окрім AР. Karli та співавт. [898] повідомили, що загальний IgE є корисним для підтвердження діагнозу, але він не може бути рекомендований для рутинного використання через його високу вартість і час для проведення тесту. Chung та співавт. [899] повідомили, що загальний IgE (граничне значення 150 МО/мл) є надійним біомаркером для діагностики АР. Jacobs та співавт. [900] повідомили про сприятливу роль визначення загального IgE в діагностиці АР, головним чином, якщо рівні вище 100 МО/мл. Li та співавт. [901] зауважили у ретроспективному дослідженні, що загальний IgE є вищим при АР, ніж при НАР. Нарешті, у 2–річному дослідженні Park та співавт. [902] показали, що в осіб без алергічної сенсибілізації при первинному обстеженні рівень загального IgE понад 17,7 МО/мл був пов’язаний із ризиком алергічної сенсибілізації, в той час як у пацієнтів із симптомами алергії, але негативним результатом прик–тесту при первинному обстеженні, рівень загального IgE понад 17,4 МО/мл був пов’язаний з розвинутою нещодавно алергічною сенсибілізацією.
На противагу цьому є 4 дослідження, які не підтверджують зв’язок між загальним IgE та АР/алергією. Satwani та співавт. [903] повідомили про відсутність зв’язку між рівнем загального IgE та діагностикою АР. Tu та співавт. [904] продемонстрували недостатню точність визначення загального IgE для виявлення алергічних захворювань, незалежно від того, яким є граничний рівень; загальний IgE був пов’язаний лише з фактом наявності атопії, ніж безпосередньо з симптомами. У тому ж дослідженні, зазначеному вище, Park та співавт. [902] повідомляли, що в осіб без алергічної сенсибілізації при первинному обстеженні рівень загального IgE менше 17,7 МО/мл не був пов’язаний з алергічними назальними симптомами, що розвинулися нещодавно. Нарешті, Tay та співавт. [905] провели ретроспективний аналіз у пацієнтів із високим рівнем загального IgE (> 1000 МО/мл) і дійшли висновку, що підвищений рівень загального IgE при АР має обмежене клінічне/діагностичне значення.
Іншим можливим методом діагностики, пов’я–заним із загальним рівнем IgE, є співвідношення між рівнем алерген–специфічного і загального IgE. Повідомлялося, що це співвідношення може бути корисним для прогнозування ефективності АСІТ [906–908], що було нещодавно висвітлено в Меморандумі EAACI [909].
Підсумовуючи, варто сказати, що рівень загального IgE є часто підвищеним при АР, але його клінічна цінність є незначною для рутинної практики. Фактично, дані літератури представлені суперечливими результатами досліджень, які не в змозі знайти послідовну роль або значення рівня загального IgE у веденні пацієнтів з АР.
Загальний рівень доказовості: C (рівень 2b: 5 досліджень; рівень 3b: 10 досліджень).
Користь: можливість запідозрити алергію при скринінгових дослідженнях.
Шкода: низький рівень не виключає алергії.
Вартість: невисока вартість тесту.
Оцінка співвідношення користь/шкода: незначне переважання користі над шкодою. Крім того, може бути корисним співвідношення загального IgE до антиген–специфічного IgE.
Висновки про цінність: докази не підтримують застосування в рутинній практиці.
Рівень впровадження: є можливим методом діагностики.
Втручання: рівень загального IgE є методом для оцінки наявності атопії.
VIII.F.2. Сироватковий рівень антиген–специфічного IgE (sIgE)
Визначення sIgE стало комерційно доступним у 1967 році з використанням аналізу, заснованого на маркуванні IgE в сироватці крові радіоактивними антитілами до IgE [910, 911]. Ця радіоактивна техніка, відома як РАСТ, була значною мірою замінена іншими технологіями, що використовують реакції ферментативної дії для отримання хемілюмінесцентної, колориметричної, або флуориметричної реакції, що кількісно визначається або «прочитується» за допомогою аутоаналізатора [910, 912]. Процес такий: алергени зв’язуються із субстратом (зазвичай у твердій або рідкій формі), до якого додають сироватку пацієнта. Специфічний IgE в сироватці пацієнта потім зв’язується з алергеном на субстраті. Надлишок сироватки змивають, а разом з ним — будь–який незв’язаний IgE. Потім додають негуманізовані марковані антитіла до IgE, що зв’язують будь–який відповідний іммобілізований sIgE. Надлишок антитіл анти–IgE потім змивається і аутоаналізатор зчитує інтенсивність радіоактивної, хемілюмінесцентної, колориметричної або флуориметричної реакції. Інтенсивність реакції пропорційна кількості sIgE в сироватці, так і генерується її результат. Всі тести, затверджені FDA, калібровані відповідно до стандартної сироватки Всесвітньої організації охорони здоров’я (ВООЗ) [913]. Різні одиниці вимірювання використовуються залежно від системи аналізу, але багато постачальників пропонують коефіцієнти переводу одних одиниць в інші.
Визначення сироваткового рівня sIgE має ряд переваг. Профіль безпеки визначення сироваткового рівня sIgE є найкращим з усіх наявних алергічних тестів, оскільки не існує ризику анафілаксії. Крім того, використання шкірних алергологічних проб обмежується наявністю певних захворювань. Пацієнтам, яким протипоказане проведення шкірних алергологічних проб або є ризик хибних результатів через вплив медикаментів або наявність захворювань шкіри, визначення рівня специфічних IgE забезпечує безпечний та ефективний метод діагностики наявності сенсибілізації як біомаркера IgE–опосередкованої гіперчутливості та підтвердження специфічних тригерних алергенів.
Є певні важливі подібності та відмінності між шкірними алергологічними пробами та визначенням sIgE, що вимагає обговорення. По–перше, дослідження показали, якщо є можливість виконати діагностику як in vitro, так і in vivo, шкірні алергологічні проби є кращим варіантом, оскільки вони дозволяють негайно оцінити видимі результати [914]. По–друге, ні шкірні алергологічні проби, ні сироватковий рівень sIgE не можуть остаточно передбачити тяжкість сенсибілізації пацієнта до аероалергена. По–третє, алергени з перехресною реакцією та полісенсибілізацією можуть сприяти виникненню хибнопозитивних результатів як шкірних проб, так і діагностики in vitro [915]. На відміну від шкірних алергологічних проб для визначення рівня sIgE використовують більш високоякісні алергени і точні контролі сироватки. У той час як результат шкірних алергологічних проб залежить від того, як лікар їх проводить і інтерпретує, тести sIgE мають коефіцієнти варіації менше 15 %, затверджені під час перевірки методів діагностики алергії в Коледжі американських патологів, що проводиться 3 рази на рік в усіх клінічних імунологічних лабораторіях, ліцензованих законом про вдосконалення клінічних лабораторій 1988 року. Проте кілька повідомлень продемонстрували непослідовність результатів тестування тих самих сироваток різними комерційно доступними тест–системами [916, 917]. Як і у випадку шкірних алергологічних проб, результати sIgE слід інтерпретувати в контексті анамнезу захворювання пацієнта.
Одним із показань до застосування технології sIgE є мультиалергенний скринінг на 10–15 алергенів. У ситуаціях, коли лікар бажає підтвердити або виключити алергію як причину появи симптомів, не витрачаючи час пацієнта на повні алергологічні панелі, скринінг на sIgE є можливим. Зазвичай, надається загальний або негативний, або позитивний результат. Скринінг на 10–12 алергенів (наприклад, цвіль, місцеві пилкові антигени, антигени котів і кліщів), є позитивним у 95 % пацієнтів, які мали позитивні результати на більшій панелі [912, 918]. Таким чином, вони є ефективними для виявлення пацієнтів з алергією. І навпаки, якщо тест є негативним, то є докази того, що це точно вказує на відсутність алергії [910]. Друге показання засноване на тому, що рівні sIgE можуть корелювати з тяжкістю симптомів AР [919–923]. Зважаючи на те, що пацієнти з більш тяжкими симптомами краще відповідають на АІТ, ніж ті, які мають більш легкий перебіг, sIgE можуть допомогти у виборі кандидатів для АІТ і передбачити відповідь [919, 924]. По–третє, у полісенсибілізованих пацієнтів може бути важко визначити найбільш клінічно важливий алерген під час прик–тесту. У цих ситуаціях рівні sIgE можуть допомогти визначити найважливіші алергени і розробити стратегію AIT [920].
Дослідження показали, що рівень sIgE має чутливість між 67 і 96 % і специфічність між 80 і 100 % [793, 822, 835, 925, 926]. Крім того, було продемонстровано, що sIgE корелює з результатами назальних провокаційних проб і прик–тестів в діагностиці АР [793, 822, 835, 857, 911]. Є якісні докази того, що sIgE багато в чому еквівалентний шкірному прик–тесту [218, 818, 925]. Рішення про проведення визначення рівня sIgE повинно базуватися на ретельному анамнезі та результатах фізикального обстеження для підтвердження наявності алергії та корекції терапії при необхідності. Важливо зазначити, що в той час як рівні sIgE є біомаркером алергічної сенсибілізації, цей тест сам по собі не може забезпечити остаточного діагнозу алергії через високу частоту клінічно невідповідних (хибнопозитивних) результатів без клінічних даних. Зважаючи на оглянуту літературу, визначення рівня sIgE є прийнятною альтернативою шкірним алергологічним пробам і є безпечним для використання у пацієнтів, які не є кандидатами для проведення шкірних проб (табл. VIII.F.2).
Загальний рівень доказовості: B (рівень 3b: 7 досліджень).
Користь: підтверджує сенсибілізацію для діагностики АР, надає можливість вибрати найкращий варіант терапії і уникнути непотрібного/неефективного лікування; спрямовує заходи щодо уникнення алергенів, спрямовує АІТ.
Шкода: несприятливі ефекти від проведення аналізу, включаючи дискомфорт під час забору крові, неточні результати досліджень, хибнопозитивні результати досліджень, неправильно інтерпретовані результати досліджень.
Вартість: помірна вартість аналізу.
Оцінка співвідношення користь/шкода: користь переважає над шкодою.
Висновки про цінність: пацієнти можуть отримати користь від визначення їх специфічної сенсибілізації. Крім того, для деяких хворих, яким не показано проведення шкірних алергологічних проб, визначення рівня sIgE є безпечною ефективною альтернативою.
Рівень впровадження: рекомендація.
Втручання: визначення рівня sIgE у сироватці може бути використано при оцінці АР. Використання стандартизованих алергенів і ретельний контроль лабораторій може підвищити точність.
VIII.F.3. Взаємозв’язок між шкірними алергологічними пробами та діагностикою in vitro
Шкірні алергологічні проби застосовуються для діагностики алергії з моменту їх створення Blackley 140 років тому [791, 928]. Відкриття IgE у 1969 році дозволило розробити серологічну діагностику in vitro, яку почали широко використовувати [929]. Однак шкірні проби та визначення сироваткового рівня sIgE мають різне біологічне значення. Тому ці 2 тести не є повністю взаємозамінними.
Сучасні прик–тести з аероалергенами можуть бути до 25 % більш чутливими, ніж сироватковий рівень sIgE, залежно від популяції пацієнтів і методики, що застосовується [793, 930–934]. Крім того, у США вартість прик–тесту загалом становить половину вартості серологічних тестів на визначення рівня sIgE (6,82 долара проти 12,50 долара за кожний алерген) [935]. Інші фактори, на які слід зважати, включають доступ до лабораторної діагностики, супутні захворювання та вік пацієнта. Діагностика in vitro дає можливість уникнути необхідності відмінити ліки, які впливають на результат шкірних алергологічних проб, і дозволяє проводити діагностику в осіб із дермографізмом або іншими поширеними захворюваннями шкіри. Інтерпретацію прик–тесту можна проводити через 20 хвилин, що зазвичай набагато швидше, ніж при лабораторній діагностиці. Як серологічний метод, так і прик–тест вважаються дуже безпечними методами; однак при виконанні прик–тесту є незначний ризик анафілаксії.
Чутливість і специфічність прик–тесту залежить від алергену, який досліджується, якості реагентів, конкретної методики виконання, кваліфікації лікаря і демографічної характеристики пацієнтів [928, 937–942]. Наприклад, розмір папули і чутливість прик–тесту залежить від вибору пристрою та конт–рольних реагентів, що використовуються для виконання проби [928, 938]. Незважаючи на це, проведений нещодавно метааналіз продемонстрував, що прик–тест вважається точним тестом, який у поєднанні з ретельним анамнезом хвороби допомагає підтвердити діагноз АР [830].
Проведення та точність визначення рівня sIgE у сироватці також залежать від декількох факторів, включаючи вибір реагентів, модернізацію обладнання та демографічні показники пацієнтів [932]. Граничне значення для позитивного результату впливає як на чутливість, так і на специфічність [943]. Серед корейської популяції було виявлено, що прик–тест є кращим за алергочіп ImmunoCAP для визначення сенсибілізації до кліщів домашнього пилу у пацієнтів віком до 30 років [792]. Для групи старше 50 років ImmunoCAP був більш чутливим [792]. Внутрішньо–шкірні або аплікаційні проби демонструють більш високу чутливість, але меншу специфічність порівняно зі шкірними скарифікаційними пробами для ряду алергенів [793, 856, 931, 932, 944]. На підставі цього шкірні проби необхідно вибирати ретельно. Є докази того, що позитивний результат внутрішньошкірної проби на пилок трави при негативному результаті прик–тесту не має клінічного значення [793, 856].
Останніми роками були розроблені системи алергологічних мікрочіпів, такі як ImmunoCAP ISAC (Thermo Fisher Scientific/Phadia AB, Уппсала, Швеція) для спроби забезпечення повної панелі алергодіагностики in vitro [794]. Точність і цінність мікрочіпів потребує суворого контролю для того, щоб їх можна було би висвітлити у керівних принципах [794, 945]. Вартість одного тесту ImmunoCAP ISAC, що включає 112 компонентів від 51 алергенів, становить приблизно від 500 до 600 доларів у США [794, 945].
Різні дослідження порівнювали визначення сироваткового рівня sIgE з прик–тестом [793, 943, 946, 947]. Обидва методи є чутливими та зазвичай їх результат збігається; однак інтерпретація результатів залежить від золотого стандарту, що використовується для визначення алергічного статусу. Для визначення діагностичної точності методів визначення алергенів, як правило, використовуються кліматичні камери, назальні проби і затверджені анкети. Табл. VIII.F.3–2 підсумовує кілька порівняльних досліджень шкірних проб на аероалергени, серологічного визначення рівня sIgE та інших методів діагностики in vitro.
Важливо розуміти, що вибір методики та інтерпретація алергічних проб не ґрунтуються лише на чутливості та специфічності. Необхідно також зважати на передбачуваний фізіологічний механізм. Як прик–тест, так і внутрішньошкірна проба засновані на визначенні патологічного механізму, пов’язаного зі зв’язуванням sIgE з поверхнею тучних клітин. Навпаки, визначення рівня сироваткових sIgE і мікрочіпи підходять для оцінки кількості циркулюючого IgE, який може бути або не бути пов’язаним із наявними симптомами. Як внутрішньошкірні проби, так і прик–тести значною мірою залежать від технічних навичок для інтерпретації реакції з боку шкіри [856, 928, 937]. У випадку проведення діагностики в осіб із вираженим дерматографізмом (або іншими запальними захворюваннями шкіри у ділянці постановки проби), руками з підвищеним оволосінням або темним кольором шкіри, інтерпретація прик–тестів може виявитися тяжкою [942]. Спеціалізовані системи були розроблені для автоматичного вимірювання папули як у світлошкірих, так і у темношкірих осіб, але вони потребують додаткової перевірки. Доти, поки ці автоматизовані системи не набудуть широкого застосування, діагностика in vitro віддає переваги тимчасовій та багатоцентровій відтворюваності результатів.
Середня загальна чутливість прик–тестів становить 85 %, що часто є дещо вищою, ніж у сироваткових тестів [830]; однак не є універсальною та залежить від алергена і характеристик пацієнта. З огляду на точність, зручність, вартість та швидкість отримання результату прик–тест часто вибирають як метод діагностики першої лінії для виявлення чутливості до аероалергенів. Внутрішньошкірні проби можна використовувати як метод другої лінії для виключення реактивності, якщо клінічна підозра є дуже високою. У тих випадках, коли наявний виражений дермографізм і/або пацієнти не можуть відмовитися від ліків, що впливають на результат шкірних алергологічних проб, визначення рівня sIgE може бути кращим вибором. Необхідні додаткові дослідження для визначення ролі досліджень малого обсягу крові за допомогою нових мікрочіпів, таких як ImmunoCAP ISAC.
Загальний рівень доказовості: B (рівень 1a: 1 дослідження; рівень 1b: 7 досліджень; рівень 1с: 1 дослідження; рівень 2а: 1 дослідження; рівень 2b: 6 досліджень; рівень 3а: 2 дослідження; рівень 5: 1 дослідження).
VIII.F.4. Назальний специфічний IgE
АР зазвичай діагностується на підставі анамнезу захворювання та об’єктивного підтвердження, як правило, за допомогою прик–тесту або діагностикою in vitro з визначенням сироваткового рівня sIgE [301]. Було доведено, що окрім позитивного сироваткового sIgE, пацієнти з АР мають його в слизовій оболонці носа з доказом того, що продукція антитіл відбувається локально [309–312, 377, 950, 951]. Однак деякі пацієнти мають негативний результат прик–тесту або сироватковий sIgE, незважаючи на анамнез, що нагадує AP, і відповідають клінічним критеріям ARIA [101, 300]. Цим пацієнтам зазвичай встановлюють діагноз ідіопатичного риніту, вазомоторного риніту або НAP [300]. Проте було продемонстровано, що багато з цих пацієнтів можуть мати місцеві алергічні явища або локальний алергічний риніт (ЛАР), такий тип риніту, що характеризується наявністю локалізованої алергічної реакції в тканинах носа, з місцевою продукцією sIgE і позитивною реакцією на назальну провокаційну пробу без позитивного прик–тесту або підвищення сироваткового рівня sIgE [107]. ЛАР може бути істинною причиною риніту у більше ніж 45 % пацієнтів, яким встановлюють діагноз НАР [296, 302, 952], і у 25 % пацієнтів, які звернулися до медичного закладу з підозрою на АР [291]. Як і класичний АР, ЛАР можна класифікувати як цілорічний або сезонний, і подібні результати в слизовій оболонці носа були зареєстровані в обох цих групах [300, 301, 953]. Було запропоновано, що деякі пацієнти з професійним ринітом можуть страждати від ЛАР [107]. Недавно проведені дослідження показали низьку частоту переходу ЛАР у системний АР [296, 302]. Перші 5 років довгострокового дослідження, що проводиться у когорті 194 пацієнтів із ЛАР і 130 здорових пацієнтів групи контролю, виявили, що у пацієнтів з нещодавно встановленим ЛАР (менше ніж 18 місяців від встановлення діагнозу) відбувся перехід у системний АР аналогічно до контрольної групи [296]. У невеликому ретроспективному дослідженні 19 пацієнтів із тривалим анамнезом ЛАР (більше ніж 7 років з моменту встановлення діагнозу) і негативним прик–тестом до широкого ряду алергенів мали аналогічну швидкість розвитку системного АР [302] порівняно з епідеміологічними даними поширеності атопії у здорового населення цього географічного регіону [954]. Майбутні результати 10–річного спостереження повинні допомогти з’ясувати частоту довгострокового переходу до системного АР у пацієнтів із ЛАР. Насправді ЛАР може пізніше маніфестувати, а у пацієнтів літнього віку з ринітом частота ЛАР досягає 21 % [304].
Діагноз ЛАР підтверджується позитивним результатом назальної провокаційної проби і наявністю sIgE в носовому секреті. Таким чином були протестовані різноманітні алергени, включаючи алергени кліщів домашнього пилу, трави, пилку і цвілі [300, 301, 306, 307, 955]. Продукція назальних мастоцитів, еозинофілів і sIgE швидко зростає після алерген–специфічної стимуляції слизової оболонки носової порожнини [288, 294, 307]. Повідомлялося про багато методів, що спрямовані на найкраще визначення назальних sIgE, включаючи промивання носа, целюлозні диски, біопсію слизової оболонки та чистку (табл. VIII.F.4). Хоча золотий стандарт відсутній, більшість цих методів надають подібні результати у виявленні назального sIgE у пацієнтів із ЛАР. Крім того, нормативні дані щодо рівня назального sIgE та їх клінічні кореляції ще не визначені та не узгоджені, але роботу в цій сфері розпочато [956].
При оцінці пацієнта з ринітом при негативних результатах системних тестів диференціація ЛАР від НАР може надати важливу інформацію для ведення хворого. Хоча обидва типи риніту, як правило, відповідають на фармакологічне лікування, визначення алергенів, що спричинюють ЛАР, може дозволити уникнути алергенів і вибрати стратегію імунотерапії [107]. Пацієнти, яким встановлено діагноз НАР, зазвичай не є кандидатами на AIT. Однак, як зазначалося раніше, приблизно 50 % пацієнтів із негативним результатом системного аналізу мали ЛАР. Ранні результати дослідження у подібній популяції свідчать про те, що AIT може зменшувати симптоми та використання ліків, а також покращувати якість життя [288, 957].
Загальний рівень доказовості: C (рівень 2b: 13 досліджень; рівень 3b: 3 дослідження; рівень 4: 8 досліджень).
Користь: визначення пацієнтів з ЛАР дає можливість лікувати підгрупу пацієнтів, які можуть реагувати на елімінаційну стратегію або AIT. Визначення назальних специфічних IgE дозволяє встановити діагноз і АІТ.
Шкода: визначення назального рівня sIgE є мінімально інвазивним, і жодних побічних ефектів не повідомлялося.
Вартість: пов’язані витрати складаються з прямих витрат на проведення аналізу, а також непрямих витрат на збільшення часу та зусиль для проведення діагностичного тесту.
Оцінка співвідношення користь/шкода: користь визначення пацієнтів з алергічним компонентом переважає над будь–якими, пов’язаними з цим, ризиками.
Висновки про цінність: у пацієнтів із симптомами риніту та негативними системними тестами визначення назальних антитіл може допомогти з призначенням відповідного лікування. Стандарти для підвищених рівнів назального sIgE не були встановлені і не корелювали з клінічними результатами.
Рівень політики: є можливим варіантом діагностики.
Втручання: рівні назального sIgE є можливим методом діагностики у пацієнтів із підозрою або відомим ЛАР, а також для допомоги в діагностиці або проведенні алерген–специфічної імунотерапії.
VIII.F.5. Тест активації базофілів (ТАБ)
Тест активації базофілів (ТАБ) — це аналіз периферичної крові ex vivo, який виявився корисним у діагностиці алергії на продукти харчування та лікарські засоби, а також інших синдромів гіперчутливості, коли тести першої лінії (прик–тест і сироватковий рівень sIgE) не відповідають клінічним даним або не розроблені, і для моніторингу AIT [966]. В межах тематики АР існують немасштабні дослідження, в яких оцінюють користь і надійність ТАБ для визначення специфічних алергенів, пов’язаних із симптомами АР, та моніторингом терапії.
Методологія TАБ виявилася неоднорідною в різних дослідженнях. У більшості найбільш точних досліджень використовували тетраспанін CD63 (лізосом–асоційований мембранний глікопротеїн–3 (LAMP–3)) як маркер активації [967–971]. CD203c (ектонуклеотидна пірофосфатаза/фосфодіестераза–3) застосовувалася рідше [968, 972]. В одному дослідженні вона мала потенціал більш чутливого і специфічного методу діагностики АР порівняно з CD63 [968].
Діагноз АР — клінічне рішення, засноване на результатах шкірних проб або сироваткових аналізів; тест активації базофілів ex vivo потрібен рідко. Однак, як було показано, TАБ виявився аналогічним до традиційних методів визначення алергенів [967, 970, 973, 974]. Було показано, що TАБ є корисним при визначенні алергену, що спричиняє ЛАР у пацієнтів, які мали хибнонегативні результати тестів першої лінії і високу підозру щодо клінічно значущої алергії [308, 318].
Реактивність базофілів (% CD63+ клітин, визначених при застосуванні концентрації одного алергену) не відображає ефект імунотерапії алергеном. Існують якісні докази того, що чутливість базофілів (EC50, або концентрація, яка спричинює реакцію 50 % базофілів, також називається CD–sens, її співвідношення, помножене на 100), є маркером ефективності лікування AIT [969–971, 975–977] і анти–IgE [975].
Загалом ТАБ може бути корисним методом діагностики ex vivo, коли діагноз АР викликає сумніви, або алерген, що спричинює клінічні симптоми, невідомий. Чутливість базофілів також корисна для визначення відповіді на АІТ. Коли методологія ТАБ стане більш стандартизованою, вона може стати більш корисним тестом другої лінії в діагностиці АР, оскільки використання методу ex vivo є корисним з точки зору часу, необхідного для проведення аналізу, і симптомів, що виникають під час діагностики. Більшість досліджень включали невеликі розміри вибірки (менше ніж 100 пацієнтів). Існує необхідність у проведенні метааналізу цих досліджень або більш масштабного дослідження для підтвердження результатів досліджень, що були включені до цього огляду.
Загальний рівень доказовості: B (рівень 1b: 2 дослідження; рівень 2b: 2 дослідження; рівень 3b: 8 досліджень; рівень 4: 3 дослідження).
Користь: метод ех vivo, мінімальний дискомфорт пацієнта, потребує менше часу, ніж назальна провокаційна проба та прик–тест, вірогідна кореляція між клінічними симптомами та чутливістю базофілів при визначенні відповіді на терапію, ніякого ризику анафілаксії порівняно з провокаційними пробами.
Шкода: дані відсутні.
Вартість: потребує близькості лабораторії, де можливим є проведення тесту активації базофілів. Вартість аналізу.
Оцінка співвідношення користь/шкода: баланс користі та шкоди.
Висновки про цінність: чутливість базофілів може бути корисним маркером для оцінки відповіді на імунотерапію. Відмінності у методології ТАБ для діагностики АР і рідкісна потреба у лабораторних тестах для діагностики АР обумовлюють його застосування лише для діагностики в центрах третинного рівня надання допомоги.
Рівень політики: є можливим варіантом діагностики.
Втручання: ТАБ є методом діагностики АР, коли тести першої лінії є безрезультатними, або для оцінки відповіді на АІТ. Було проведено багато невеликих досліджень. Існує потреба у проведенні метааналізу і більш масштабних досліджень.
VIII.F.6. Компонентна діагностика (КД)
Молекулярна діагностика (МД) або компонентна діагностика (КД) застосовується при алергії для визначення алергенної сенсибілізації пацієнта на індивідуальному рівні шляхом вимірювання sIgE до очищених природних або рекомбінантних алергенів, що дозволяє виявити потенційні молекули, що спричинюють появу симптомів. У цілому, МД може потенційно підвищити точність (специфічність) діагностики, віддиференціювати явища перехресної реактивності від справжньої косенсибілізації, відділити маркери низького ризику від маркерів високого ризику активності хвороби, і може покращити вибір відповідних алергенів для AIT порівняно з діагностикою на підставі прик–тесту та/або рівня sIgE з використанням сирих комерційних екстрактів [980–984]. Насправді, зміни у призначенні імунотерапії, що керуються результатами МД, показали, що вони є економічно ефективними в деяких випадках [985]. Деякі схеми сенсибілізації до алергенів пилку трави чи оливи можуть також визначити пацієнтів з підвищеним ризиком побічних реакцій під час імунотерапії [986, 987]. Проте всі результати діагностики in vitro повинні оцінюватися разом з анамнезом хвороби, оскільки сенсибілізація до алергенів не обов’язково передбачає клінічну відповідь.
IgE до очищених або рекомбінантних алергенів зазвичай визначають за допомогою імуноферментного аналізу в односекційних платформах. Однак мультисекційна платформа зі 112 алергенами також доступна (ISAC, Thermo Fisher Scientific, Уппсала, Швеція). Результати односекційних і мультисекційних платформ не є взаємозамінними. При порівнянні односекційних і мультисекційних аналізів узгодженість результатів варіює залежно від алергену, і чутливість мультисекційної платформи нижча, ніж у односекційної, особливо при низьких рівнях sIgE [983]. Односекційні платформи є кількісними, а мультисекційні напівкількісними.
Специфічні антигени. У випадку сенсибілізації до кліща маркери специфічної сенсибілізації включають Der p 1 і Der p 2 для Dermatophagoides pteronyssinus і Dermatophagoides farinaе [988], Lep d 2 для Lepidoglyphus destructor (амбарні кліщі з обмеженою перехресною реактивністю з іншими кліщами домашнього пилу) [989] і Blo t 5 для Blomia tropicalis (кліщ, що не належить до родини Pyroglyphidae) [909]. Було показано, що Der p 10, тропоміозин з D. pteronyssinus, є хорошим маркером клінічної чутливості до ракоподібних, але не є маркером сенсибілізації до кліщів [991, 992].
Can f 1, Can f 2 і Can f 5 — це специфічні алергенні компоненти, що вказують на специфічну сенсибілізацію до собаки [993]. Цікаво, що Can f 5, калікреїн простати, що продукується тільки собаками чоловічої статі, відповідальний за моносенсибілізацію у 25–38 % пацієнтів з алергією на собак [994, 995]. У цих випадках пацієнти можуть переносити вплив собак жіночої статі. Fel d 1 є основним алергенним компонентом алергії на котів, що свідчить про специфічну сенсибілізацію [996]. Інші алергени котів мають певну взаємноперехресну реакцію з алергенами з інших джерел; наприклад, Fel d 2, ймовірно, перехресно реагує з альбумінами інших ссавців, такими як собачий Can f 3, кінський Ecu c 3, PSA свиней Sus s, коров’ячий Bos d 6 [997], а Fel d 4 перехресно реагує з основними алергенами коней Equ c 1, собак або корів [998]. Таким чином, КД алергії на котів надає більше інформації про перехресну реактивність і специфіку діагнозу. Equ c 1, основний алерген коней, має деяку взаємну реактивність з мишачими Mus m 1 та Fel d 4 котів [999]. Equ c 3 — сироватковий альбумін, що демонструє перехресну реактивність із сироватковими альбумінами інших ссавців (тобто Fel d 2). Отже, КД у пацієнтів з алергією на собак, котів і коней є не тільки прогностичними маркерами алергії, але також може допомогти лікарям прогнозувати клінічні симптоми та їх тяжкість, оскільки деякі моделі сенсибілізації пов’язані з більш тяжким ринітом та астмою [994, 995].
Алергенами, пов’язаними з сенсибілізацією до тарганів, є Bla g 1, Bla g 2, Bla g 4 і Bla g 5, хоча в певних популяціях тропоміозини (Bla g 7 та/або Per a 7) можуть бути важливі [1000]. Alt a 1 є основним алергеном, який визначається приблизно у 80–100 % пацієнтів з алергією до Alternaria [1001]. Маркери сенсибілізації до декількох антигенів пилку підсумовані в табл. VIII.F.6. Сенсибілізація до профіліну була пов’язана з більш тяжкими респіраторними симптомами у пацієнтів з алергією до алергенів трав, а також з сенсибілізацією до малих алергенів оливи Ole e 7 та Ole e 9 [987, 1002]. Антитіла IgE до Phl p 1 та/або Phl p 5 визнані специфічними маркерами сенсибілізації до пилку трави і Phl p 4 маркером сенсибілізації до рослин, що не належать до родини Тонконогових. Однак Phl p 6 міститься тільки в рослинах родини Тонконогових. Алергени з груп 1, 2, 5 і 6 експресуються тільки в травах, але не в інших рослинах, тому вони виявляють справжню сенсибілізацію до трав’яних алергенів [981].
Загалом, КД у пацієнтів з АР може допомогти краще визначити сенсибілізацію до інгаляційних алергенів, особливо у полісенсибілізованих пацієнтів або таких, які мають невиражені симптоми та/або анамнез сенсибілізації, або які не відповідають на лікування. З іншого боку, моносенсибілізовані пацієнти з чітким анамнезом та профілем симптомів можуть не отримати користь від КД порівняно з традиційними діагностичними тестами. Проте КД залишається діагностичним тестом третього рівня, а не використовується як метод скринінгу в рутинній практиці. Одним із найбільш корисних аспектів КД є те, що вона може допомогти лікарям краще вибрати пацієнтів і алергени для призначення AIT [1003], а в деяких випадках і передбачити ризик побічних реакцій. Характер сенсибілізації до алергенів може прогнозувати тяжкість захворювання і потенційно може прогнозувати ефективність АІТ, за умови, що препарати для імунотерапії містять достатню кількість алергену. Оскільки існує декілька індивідуальних алергенів для КД і декілька різних показань для КД, то у цьому документі не проводиться загальна класифікація доказів.
VIII.G. Сенсибілізація чи симптоматична алергія?
Сенсибілізація проти алергії
Хоча IgE–опосередкована сенсибілізація була визнана важливим фактором ризику для риніту [520, 1004], однак дані про силу цього зв’язку непослідовні [1005, 1006]. В епідеміології та клінічній практиці пацієнтів зазвичай вважають «сенсибілізованими» на основі позитивного прик–тесту (як правило, діаметром 3 мм), або позитивного специфічного сироваткового IgE (як правило, 0,35 кОд/л (специфічні IgE визначаються в різних одиницях, в тому числі, кОд)) [1007, 1008]. Однак обидва ці тести можуть бути позитивні за відсутності будь–яких симптомів, і ні позитивний результат прик–тесту, ні позитивні IgE не можуть підтвердити вираженість симптомів риніту після впливу алергену [1009, 1010]. Тому прийнято розрізняти поняття сенсибілізації (тобто позитивний результат алергічних тестів без клінічної симптоматики) і симптоматичне алергічне захворювання, таке як АР, що визначається як наявність сенсибілізації та пов’язаних із нею клінічних симптомів.
«Позитивний» тест на алергію проти титру sIgE або розміру реакції на прик–тест
Кількісна оцінка атопічної сенсибілізації з використанням рівня sIgE або розміру реакції прик–тесту підвищує специфічність алергічних тестів щодо наявності та тяжкості риніту [893, 1004]. Це змінило спосіб інтерпретації результатів алергічних тестів, зумовило перехід від дихотомізації (маркування пацієнтів як сенсибілізованих на основі «позитивного» тесту з використанням довільних критеріїв) до кількісного визначення титру sIgE або оцінки шкірних алергічних тестів [893, 1010–1012].
Екстракт цільного алергену або окремих молекул алергену
Гомологічні білки, наявні в екстрактах цільних алергенів різного походження, можуть спричиняти перехресні реакції (наприклад, профіліни і білки PR–10 у різних рослинах, або тропоміозин, наявний у кліщах, комахах і креветках). Таким чином, позитивний тест на екстракт цільного алергену може відображати сенсибілізацію до перехресно реагуючого компонента [1013]. Визначення рівня сенсибілізації до окремих молекул алергену методом КД може бути більш інформативним, ніж стандартні тести з використанням екстрактів цільного алергену [470, 1014–1016]. Наявні на сьогодні мультисекційні платформи КД дозволяють проводити тестування на компонент–специфічний IgE до більше ніж 100 алергенних молекул в одному аналізі, а також у невеликому об’ємі сироватки [1013, 1015]. Результати визначення специфічних IgE до кількох алергенних білків мають достатню роздільну здатність у випадку ринокон’юнктивіту [1017] і чіткі закономірності відповідності специфічних до різних груп білків IgE з різними клінічними симптомами. Наприклад, сенсибілізація до білків рослинного походження вказує на вірогідність АР, а сенсибілізація до тваринних ліпокалінів є прогностичною ознакою астми. Важливо підкреслити, що вік початку сенсибілізації є надзвичайно важливим, і що розвиток АР може бути передбачений унікальною молекулярною природою специфічних IgE до окремих компонентів алергенів [1018, 1019].
Диференціація атопічної сенсибілізації
Стає все більш очевидним, що «атопічна сенсибілізація» є не єдиним фенотипом, а спільним терміном для декількох різних типів атопічної сенсибілізації до різних алергенів, що відрізняються при риніті та астмі [1021, 1022]. Різні підтипи атопії пов’язані з унікальною комбінацією реакцій на комплекс алергенів і термінами появи алергенспецифічної сенсибілізації [1023]. Використання цих знахідок у клінічній практиці потребує розробки біомаркерів, які допоможуть розрізняти різні підтипи сенсибілізації і можуть бути виміряні під час клінічної оцінки.
Окрім IgE
Останні дані свідчать про те, що серед осіб, сенсибілізованих до пилку трави, зменшення співвідношення специфічних до антигенів трави IgG/IgE пов’язане зі збільшенням ризику симптоматичного САР [1024], що свідчить про те, що співвідношення IgG/IgE може допомогти розрізнити «доброякісну» сенсибілізацію (сенсибілізацію без симптомів) і «патологічну» сенсибілізацію [1024]. Однак визначення алергенспецифічних IgG поки що не може бути рекомендовано для рутинної клінічної практики [1009, 1010].
VIII.H. Діагностика за допомогою провокації алергеном
VIII.H.1. Камери для провокації алергенами (КПА)
Камери провокації навколишнім середовищем (КПНС) використовувалися протягом десятиліть для контрольованого впливу на пацієнтів різноманітних речовин, таких як алергени, тверді та газоподібні забруднювачі повітря, хімічні речовини або кліматичні умови у контрольованих умовах. Розробка подібних умов впливу з високою стабільністю часу і простору є технічно вимогливою, і в усьому світі існує обмежена кількість КПНС. Окрім можливості використання КПНС для досліджень впливу забруднювачів навколишнього середовища на здоров’я людини, провокація алергеном в камері з індукцією симптомів у пацієнтів з алергічним захворюванням є потенційним методом для тестування ефективності нових препаратів. Таким чином, останніми роками було встановлено декілька подібних камер з акцентом на дослідження впливу алергенів, внаслідок чого в даний час нараховується 15 камер для провокації алергенами (КПА) по всьому світу [1025].
Дослідження за допомогою КПА сприяли нашому розумінню патофізіології алергічних захворювань. Наприклад, було продемонстровано, що контрольований вплив алергенів посилює прояви атопічного дерматиту [1026]. Також було показано вплив експозиції фрагментами алергену пилку на симптоми АР [1027]. Крім того, важливість цілісності епітеліального бар’єра для індукції місцевих та системних запальних відповідей досліджувалася у пацієнтів з алергічним ринокон’юнктивітом із використанням КПА [1028].
Використання КПА у клінічних дослідженнях для визначення ефективності нових досліджуваних препаратів і їх затвердження та схвалення безумовно залежить від технічної та клінічної перевірки КПА. Багато КПА були ретельно перевірені щодо специфічності та дозування впливу чинників для індукції симптомів, а також технічних аспектів, таких як часова стабільність і просторова гомогенність впливу алергенів [1029–1037]. Крім того, відтворюваність результатів, отриманих в КПА, досліджувалася систематично, і за допомогою загальної шкали назальних симптомів (TNSS) було підтверджено відмінну відтворюваність [1038]. З огляду на даний рівень технічної та клінічної перевірки КПА часто використовуються у клінічних дослідженнях лікарських засобів для вивчення фармакологічних властивостей під час досліджень фази II, таких як визначення дози [1039–1041], часу початку дії [1042–1046] і тривалості дії [1047–1049]. Щодо цього були проведені численні рандомізовані плацебо–контрольовані клінічні дослідження з використанням паралельних або перехресних конструкцій для перевірки ефективності ліків із негайною терапевтичною активністю, наприклад антигістамінних препаратів [1050–1053], або з профілактичним терапевтичним потенціалом, таких як місцеві стероїди [1054–1056], нові протизапальні сполуки [1057–1060] або пробіотики [1061]. Основними перевагами встановлення КПА порівняно з дослідженнями у природних умовах є краще співвідношення сигнал/шум, визначений мінімальний рівень симптомів, що виникають у КПА, і їх повторюваність, що дозволяє проводити індивідуальні порівняння.
З огляду на можливість дозування впливу перевірених алергенів у камерах [1029, 1030, 1034, 1035] тестування ефективності дозозалежної АІТ також було проведено в РКД [1062–1066]. У той час як використання КПА проходить процедуру схвалення для можливості їх застосування у дослідженнях фази ІІ розробки ліків [1067, 1068], їх було неохоче схвалено для застосування у дослідженнях фази III, оскільки клінічна перевірка все ще недосконала. Існують відмінності між природним впливом у польових дослідженнях та дослідженнями в КПА, наприклад, щодо часу експозиції (безперервний проти переривчастого), складу атмосфери опромінення (природна суміш проти штучної чистоти), або вибору досліджуваної популяції (загальна популяція або люди, яким проводять АІТ). Отже, оцінка ефективності в польових дослідженнях фази III є ще обов’язковою. Проте нещодавні спільні дії EAACI з експертами з академічних кіл, власників камер та керівниками охорони здоров’я визначили найбільш відповідні незадоволені потреби та передумови для клінічної перевірки і подальшого розвитку використання та схвалення КПА для основних досліджень фази III.
У підсумку численні якісно розроблені РКД, що використовують технічно схвалені КПА для тестування ефективності досліджуваних нових препаратів з детальним аналізом дозозалежної відповіді, початку дії та тривалості дії, свідчать про можливість використання КПА у II фазі розвитку клінічних лікарських засобів.
VIII.H.2. Місцеві провокаційні проби
Провокація органів–мішеней респіраторної алергії (наприклад, носа, бронхів, очей) підозрюваним алергеном спрямована на демонстрацію реальної клінічної реактивності, коли результати первинних тестів на алергію (шкірні проби, in vitro вимірювання рівня sIgE) є безрезультатними. Назальна провокаційна проба (НПП) призначена для АР, у той час як кон’юнктивальна провокаційна проба (КПП) може бути використана у пацієнтів з ринокон’юнктивітом або ізольованим АР [1069, 1070].
Назальна проба. Метою назальної провокаційної проби є відтворення реакції верхніх дихальних шляхів при назальному впливі алергенів [1071, 1072]. Однак на сьогодні єдиною технікою, що задовольняє цю мету, є КПНС (описані у попередньому розділі), тоді як кількість алергенів, що вводяться протягом НПП, звичайно перевищує природні рівні експозиції, іноді значно. Алерген для НПП може вводитися різними пристроями, включаючи шприци, крапельниці для носа, мікропіпетки, назальні спреї або просочені диски, жоден з яких не має обмежень або недоліків [1071]. Результат провокаційної проби можна виміряти багатьма методами, зокрема за шкалою симптомів (особливо, TNSS), риноманометрією, акустичною ринометрією, оптичною ринометрією, піковим потоком носового вдиху, маркерами запалення у змивах з носа, і концентрацією NO у носовій порожнині [1072]. Протипоказаннями до проведення НПП є гострий бактеріальний або вірусний риносинусит, загострення АР, анафілаксія, спричинена досліджуваним алергеном, в анамнезі, тяжкі загальні захворювання та вагітність [1073]. Результати проведених нещодавно досліджень, що оцінюють чутливість і специфічність різних методів з використанням специфічних алергенів, є доступними (табл. VIII.H.2). Із контрастуючих висновків очевидно, що стандартизована методика НПП поки не доступна. Насправді, найближчими роками використання НПП у діагностиці АР, швидше за все, зменшиться через діагностичну цінність нових інструментів, таких як КД [1074] і ТАБ [1075], які здатні виявити алерген, що спричинює симптоми, у пацієнтів із сумнівними результатами первинного аналізу.
Незважаючи на свої обмеження, ключова роль НПП на сьогодні полягає в діагностиці професійного риніту і ЛАР. Згідно з позиційним документом EAACI, діагноз професійного риніту може бути встановлений тільки шляхом об’єктивної демонстрації причинно–наслідкового зв’язку між ринітом і робочим середовищем через НПП із підозрюваним агентом(–ами) у лабораторії, що вважається золотим стандартом його діагностики [84]. Найкращим часом для проведення НПП є ранок для того, щоб обмежити наслідки впливу повсякденних подразників. Початкова оцінка симптомів і функції носа повинна проводитися після адаптації до кімнатної температури. Необхідно виконати контрольний тест, щоб переконатися, що реакція є специфічною для досліджуваного агента [1076]. Позитивний результат контрольного тесту свідчить про риніт, спричинений подразниками або неспецифічною гіперреактивністю.
Що стосується ЛАР, то відсутність sIgE в сироватці крові та у шкірі вимагає підтвердження місцевої наявності IgE за допомогою НПП [1077]. Незважаючи на те, що методи виявлення IgE у слизовій носа були розроблені в 1970–х роках [1078], можливості вимірювання кількості місцевого IgE в клінічних умовах на сьогодні немає. Цей факт робить НПП надзвичайно важливою, хоча дані з цього приводу різняться. НПП з кліщами, пилком та Alternaria була позитивною у 100 % серед 22 дорослих із раніше діагностованим ЛАР [1079], але в контрольованому проспективному дослідженні 28 дітей із діагнозом НАР НПП з алергенами кліщів та пилку трави була позитивною у 25 % осіб [293].
Кон’юнктивальна проба. У той час як існує кілька різних методів проведення НПП, КПП, зазвичай, виконується шляхом введення від 20 до 30 мкл розчину алергену в нижній зовнішній квадрант кон’юнктиви ока з використанням розчинника у контралатеральному оці як контроль [1069]. Також позитивний результат проби легко оцінити, оскільки він полягає у розвитку негайної реакції (від 5 до 20 хвилин від уведення) зі свербіжем, сльозотечею, почервонінням і, можливо, набряком кон’юнктиви. 1984 року в дослідженні 20 дітей із сезонним ринокон’юнктивітом, яким 3 рази виконували КПП, засвідчено про добру відтворюваність результатів [1080]. У 2001 році діагностичну чутливість і специфічність в 90 і 100 % відповідно було зареєстровано у хворих на алергію на кліщів [1081]. Нещодавно було проведено систематичний огляд, результати якого опубліковані у керівництві EAACI з рутинної практики КПП із рівнем доказовості B про здатність КПП визначати тригерні алергени [1082]. У висновку було підкреслено, що алергологи повинні бути більш ознайомленими з КПП через простоту її проведення. Проте шкали для оцінки симптомів повинні бути перевірені, стандартизація екстрактів алергенів — покращена, а показання до виконання КПП у пацієнтів з іншими формами кон’юнктивіту, окрім алергічного, залишаються невизначеними.
Загальний рівень доказовості для назальних провокаційних проб: C (рівень 2b: 4 дослідження). Проте, з огляду на різноманітність техніки проведення НПП і оцінки результатів, важко визначити точний рівень доказовості НПП.
VIII.I. Цитологічне та гістологічне дослідження назального секрету
Цитологічне дослідження назального секрету (назальна цитологія — НЦ) — це проста діагностична процедура, що дозволяє оцінити стан слизової оболонки носа шляхом визначення типів клітин та їх морфології і кількості [1087]. НЦ включає 3 кроки. Перший являє собою забір зразка поверхневих клітин слизової оболонки носа за допомогою відповідного пристрою під час передньої риноскопії. Найбільш часто для забору використовують прилад Rhino–probe (Arlington Scientific, Springville, UT, США) [1088]. Другий етап — забарвлення за методом Романовського — Гімзи, що дозволяє ідентифікувати всі запальні клітини, наявні у слизовій оболонці носа (тобто нейтрофіли, еозинофіли, лімфоцити і тучні клітини), а також нормальні клітини слизової оболонки (війчасті та муцинозні), і навіть бактерії або гриби. Третій крок — дослідження через оптичний мікроскоп зі збільшенням до 1000×. Принаймні 50 мікроскопічних полів повинні бути проаналізовані для впевненості у виявленні всіх клітин у зразку [1087]. За допомогою НЦ можна виявити віруси, гриби і бактерії (включаючи нальоти) в носовій порожнині, що дозволяє діагностувати інфекційний риніт [1089]. Специфічні цитологічні особливості можуть допомогти у диференціації різних форм риніту, включаючи АР, НАР, ідіопатичний риніт і змішані форми. АР зазвичай діагностується за поєднанням анамнезу хвороби та результатами in vivo та/або in vitro тестів на специфічні антитіла IgE [1090]. При НЦ переважним типом клітин є еозинофіли, за якими слідують тучні клітини і базофіли [1091–1094]. Згідно з моделлю логістичної регресії, при підвищеній кількості назальних еозинофілів при цитологічному дослідженні відношення шансів становить 1,14 (95% ДІ від 1,10 до 1,18) для виявлення АР [1092]. Було описано, що НЦ у полісенсибілізованих пацієнтів виявляє більш інтенсивний запальний інфільтрат, ніж у моносенсибілізованих пацієнтів [1093]. Цитологічне дослідження також продемонструвало сезонні зміни запальних клітин слизової носа, що, можливо, віддзеркалює зміни алергенів у пацієнтів з ринітом, індукованим кліщами [1095]. Негативні результати алергологічних проб у пацієнтів з персистуючим ринітом зазвичай передбачають діагноз НАР [1096]. Перший варіант НАР, відомий як НАРЕС (неалергічний риніт з еозинофільним синдромом), був описаний після ідентифікації підгрупи пацієнтів із багаторічним ринітом, негативними шкірними тестами і вираженою еозинофілією в носовому секреті [174]. Останнім часом були ідентифіковані й інші варіанти, включаючи НАР із тучними клітинами (НАРТК), нейтрофілами (НАРН), еозинофілами і тучними клітинами (НАРЕТК) [1097]. Ідіопатичний риніт також характеризується високим рівнем еозинофілів і тучних клітин у деяких пацієнтів [1098]. Можуть виникати змішані форми [1099].
НЦ є першим методом діагностики НАР і використовується для диференціації його різних варіантів в експериментах [1100]. Проте існує мало досліджень, в яких досліджували діагностичну цінність НК для АР або НАР.
Загальний рівень доказовості: C (рівень 3b: 3 дослідження; рівень 4: 1 дослідження).
Гістологічне дослідження біоптатів слизової носової порожнини було єдиною методикою, за допомогою якої можна було дослідити тканини і клітини у пацієнтів з АР протягом багатьох десятиліть. У 1990–х роках дослідження, засновані на біопсії, дозволили дослідникам визначити роль різних запальних клітин у патогенезі АР [379]. Оригінальна методика починається з розпилення місцевого анестезуючого і топічного судинозвужувального засобу в носові ходи. Після того, як анестезія почала діяти, шматочок тканини видаляється з середньої носової раковини за допомогою малого пінцета для біопсії. Після негайної фіксації зразка тканини в буферному формаліні кожен зразок може бути забарвлений різними реагентами для виявлення різних компонентів тканини і клітин [1101]. Реагенти, що використовуються, включають реагент Гімзи, гематоксилін/еозин, реактив Шиффа, трихром за Масоном, лазур A і хлорацетат естеразу [299, 415, 1101]. Після забарвлення препарати досліджують за допомогою оптичного бінокулярного світлового мікроскопа, використовуючи сітку, розділену на 100 квадратів, для кількісного визначення клітин і тканини на квадратний міліметр.
Впровадження НЦ дало можливість отримати подібну до гістологічного дослідження інформацію, але без дискомфорту і потенційного ризику кровотечі. Крім того, НЦ дозволяє проводити послідовний відбір зразків, а гістологія не дозволяє. Крім того, коли Lim та співавт. [415] порівнювали гістологію слизової оболонки носової порожнини з цитологією у пацієнтів із цілорічним і сезонним ринітом проти пацієнтів групи контролю, то результати вказували на те, що носові секрети і слизові оболонки носа являють собою 2 окремих клітинних відсіки. Особливо це було зрозуміло, коли під час цитологічного дослідження зареєстровано збільшення кількості запальних клітин після впливу алергену, в той час як епітеліальний шар, оцінений за допомогою гістологічного дослідження, не змінювався порівняно з початковим складом [415]. У 2005 році Howarth та співавт. [1102] стверджували, що порівняно з простими методами, як–от НЦ або назальний лаваж, біопсія слизової носової порожнини вимагає обізнаності не тільки у зразках тканин, а й у проведенні біопсії, тому застосовується тільки в спеціалізованих центрах. Цей недолік, як і раніше зазначені, робить цей метод цінним з наукової точки зору у дослідженнях із патофізіології АР, але навряд чи є можливим для звичайної клінічної практики.
Загальний рівень доказовості: B (рівень 1b: 8 досліджень; рівень 3b: 3 дослідження).
IX. Лікування
IX.A. Уникнення алергенів
Уникнення алергенів та екологічний контроль часто обговорюються як частина стратегії лікування АР разом із фармакологічним лікуванням та алергенспецифічною імунотерапією. Пацієнти з АР зацікавлені в тому, щоб знати про ефективні заходи щодо уникнення дії алергенів та екологічний контроль, особливо ті, хто хоче уникнути прийому ліків або не можуть прийняти режим алергенспецифічної імунотерапії. Зважаючи на це, важливо знати заходи щодо уникнення алергену та заходи екологічного контролю для хворого з алергічним захворюванням.
IX.A.1. Домашній пиловий кліщ (ДПК)
ДПК є одним із найбільш поширених тригерів АР, і заходи екологічного контролю були запропоновані як стратегія управління з оцінкою як фізичних бар’єрів, так і хімічної обробки. Різні фізичні методи (наприклад, нагрівання, вентиляція, заморожування, бар’єрні методи, фільтрація повітря, вакуумування та іонізатори) були оцінені для лікування АР із різними висновками. Хоча кілька досліджень демонстрували зниження концентрації антигенів ДПК у навколишньому середовищі, відповідного зниження клінічних симптомів не було вірогідно продемонстровано. Незважаючи на зниження концентрації антигену ДПК, Ghazala та ін. та Terreehorst та ін. не виявили клінічних переваг використання непроникного постільного покриття як ізольованої рекомендації. Аналогічні висновки повідомили Antonicelli та ін. після дослідження високоефективної фільтрації повітряних частинок (HEPA). Хімічні методики включають використання акарицидів у побутових очисниках для зниження концентрації ДПК. Geller-Bernstein та ін. оцінили використання спрею акарициду в спальнях пацієнтів із сенсибілізацією ДПК, демонструючи поліпшену середню оцінку симптомів порівняно з контрольними пацієнтами без акарициду. Подібні результати були повідомлені Kniest та ін. Ніяких серйозних побічних ефектів не повідомлялося в жодному дослідженні, але жодне дослідження не оцінило ефективність витрат як показник результату.
У 2010 році в кокранівському огляді було досліджено ефективність екологічних заходів для елімінації ДПК, включаючи непроникні кришки, фільтри HEPA, акарициди або комбіновані заходи. Цей систематичний огляд виявив, що акарициди є найбільш ефективним заходом як монозахід або в комбінації з іншими заходами для зниження рівнів ДПК і поліпшення симптомів АР.
Загальний рівень доказовості: B (рівень 1a: 1 дослідження; рівень 1b: 3 дослідження; рівень 2a: 1 дослідження; рівень 2b: 7 досліджень).
Користь: зниження концентрації антигенів ДПК у навколишньому середовищі з потенційним поліпшенням показників симптомів та якості життя.
Шкода: немає.
Вартість: від низького до помірного, однак економічна ефективність не оцінювалася.
Оцінка співвідношення користь/шкода: вигода перевищує шкоду.
Висновки про цінність: заходи із використанням акарицидів та/або програм «контролю спальні на основі зниження концентрації ДПК» є перспективними, але для оцінки клінічних результатів необхідні високоякісні дослідження.
IX.A.2. Таргани
Частота інвазії та алергенів тарганів часто є високою в багатоквартирних житлових будинках в густонаселених районах міста, незважаючи на те, що підвищений рівень алергенів у тарганів також зустрічається в будинках у теплих, сільських регіонах. Систематичний огляд Le Cann і його колег визначив три ключові стратегії для домашніх екологічних заходів: 1) освітні методи, які включали в себе інструкції з прибирання будинків й усунення тріщин і щілин у місцях, де відбувається зараження (наприклад, кухні); 2) фізичні методи з використанням інсектицидів або пасток-приманок; 3) комбіновані заходи, що містять як навчальні заходи, так і фізичні методи.
Більшість досліджень включали один або кілька заходів, спрямованих на зменшення кількості тарганів та рівня алергенів (Bla g 1 і Bla g 2), але деякі з них зосереджувалися на усуненні кількох алергенів (наприклад, домашній пиловий кліщ, тарган, гризун, кішка, собака). Найбільш ефективним методом для усунення тарганів та зниження алергенного навантаження була професійна боротьба зі шкідниками. Sever на ін. виявили, що розміщення пасток інсектицидних приманок є більш ефективним в зменшенні популяцій тарганів із супутнім зменшенням алергенів тарганів порівняно з будинками, де проводилась обробка інсектицидами плінтусів, тріщин і щілин протягом 12-місячного періоду.
Коли враховувалися витрати, ціни на пастки для приманки, а також витрати на оплату праці та моніторингу виявилися менш дорогими, ніж декілька комерційних застосувань інсектицидних спреїв для плінтусів і тріщин.
Загальний рівень доказовості: B (рівень 1a: 1 дослідження; рівень 1b: 8 досліджень; рівень 2b: 1 дослідження; рівень 3b: 1 дослідження).
Користь: зменшення кількості тарганів, рівень алергену (Bla g 1 і Bla g 2) часто перевищує допустимі рівні для клінічних переваг. Жодні дослідження не включали клінічні кінцеві точки, пов’язані з АР.
Шкода: не повідомляється.
Вартість: помірна. Необхідно використовувати декілька методів, а також застосовувати ці програми багаторазово.
Оцінка співвідношення користь/шкода: баланс вигод та шкоди, враховуючи відсутність чіткої клінічної користі.
Висновки про цінність: контроль популяцій тарганів, особливо в густонаселених багатоквартирних будинках важливий для контролю рівня алергенів.
Рівень впровадження: необов’язково.
Втручання: поєднання фізичних заходів (таких як пастки із використанням інсектиців, прибирання будинку) та освітніх методів є варіантами в управлінні АР, пов’язаного з наявністю тарганів.
IX.A.3. Домашні тварини
Уникнення перебування з домашніми тваринами й екологічний контроль становлять собою варіанти лікування АР. Уникнення домашніх тварин — це загальноприйнята стратегія, але без високоякісної оцінки результатів. Sánchez та ін. оцінили показники відповідності серед сенсибілізованих пацієнтів (n = 288), знайшовши у 4 % пацієнтів із прямим впливом домашніх тварин рекомендації щодо уникнення домашніх улюбленців. Таким чином, ЕК оцінювався як зниження експозиції антигену зі змішаними результатами.
Björnsdottir зі співавт. оцінили результати запровадження заходів екологічного контролю серед 40 пацієнтів із діагностованою сенсибілізацією кишки (Fel d 1), виявивши значне поліпшення потоку повітря в носі і зменшення клінічних симптомів.
Wood зі співавт. оцінювали ефективність фільтрації із застосуванням HEPA у високоякісному рандомізованому контрольованому дослідженні 35 пацієнтів із сенсибілізацією Fel d 1, спостерігаючи без поліпшення показники носових симптомів, порушення сну, частоту використання рятувальних ліків та показання спірометрії після 3-місячного випробування.
Кілька низькоякісних досліджень оцінили тривалість відновлення антигену після миття тварин, виявивши, що миття котів і собак повинно проводитись щонайменше двічі на тиждень, щоб забезпечити значне зменшення антигенів у навколишньому середовищі. Крім того, видалення з будинку домашніх тварин може призвести до зниження рівня алергенів лише через кілька місяців, а рівень Can f 1 в будинках із гіпоалергенними тваринами, як правило, схожий на такий, що реєструється в будинках із негіпоалергенними видами. Додаткове дослідження визначило переваги уникнення домашніх тварин у вторинній профілактиці астми серед раніше сенсибілізованих людей.
Аналогічно, діючі вказівки щодо лікування астми рекомендують видаляти домашніх тварин із дому сенсибілізованого індивіда.
Загальний рівень доказовості: B (рівень 1b: 1 дослідження; рівень 2b: 2 дослідження).
Користь: зменшення впливу антигену навколишнього середовища з можливим зменшенням назальних симптомів та вторинною профілактикою астми.
Шкода: емоційний стрес, спричинений видаленням домашніх вихованців. Фінансові та часові витрати потенційно неефективного втручання.
Вартість: від низької до середньої.
Висновки про цінність: хоча декілька досліджень продемонстрували зв’язок між екологічним контролем та зниженням антигенів навколишнього середовища, лише один, багатомодальний РЦТ, продемонстрував клінічне поліпшення назальних симптомів серед пацієнтів із чутливістю до Fel d 1. Слід враховувати також вторинну профілактику та лікування астми в сенсибілізованих осіб.
Рівень впровадження: варіант.
Втручання: стратегія уникнення домашніх тварин та екологічний контроль, особливо багатомодальний екологічний контроль серед пацієнтів із діагностованою чутливістю до Fel d 1, є варіантом лікування АР, пов’язаного з домашніми тваринами.
IX.A.4. Інші фактори (пилок, професійні алергени)
Для пацієнтів із пилковою алергією заходи уникнення спрямовані на мінімізацію впливу алергенів протягом відповідного сезону пилку.
Однак пилок — це глобальне природне явище, яке періодично виникає, що робить майже неможливим ретельне уникнення впливу. Існують деякі практичні методи мінімізації впливу пилку за допомогою заходів екологічного контролю. Однак існує недостатня кількість клінічних випробувань, що оцінюють клінічну ефективність терапевтичних стратегій. Більшість рекомендованих стратегій базуються на консенсусі експертів та клінічному досвіді.
Однією з потенційних стратегій екологічного контролю є обмеження впливу на територію житла в періоди високої концентрації пилку в повітрі (тобто відпочинок у географічних регіонах зі зниженою інтенсивністю місцевої концентрації пилку).
Пацієнти можуть отримати додаткову інформацію про поточну кількість пилку у відповідному регіоні через інтернет-джерела (тобто через базу даних Європейської аероалергенної мережі (EAN) (https://ean.polleninfo.eu/); Фонд німецької інформаційної служби з пилку (www.pollenstiftung.de); Американська академія алергії, астми та імунології (AAAAI) (www.aaaai.org/global/nab-pollen-counts)). Ця інформація може бути використана, наприклад, для уникнення великої фізичної активності на свіжому повітрі під час пікових рівнів пилку або проведення медикаментозних профілактичних заходів. Хоча думка експертів схвалює ці стратегії, немає жодних доказів, які б підтверджували їх клінічну ефективність.
Крім того, пацієнти можуть відкривати вікна вдома, коли кількість пилку низька, або тримати вікна закритими та використовувати кондиціонер під час високого запилення. У автомобілях можуть застосовуватися спеціальні фільтри пилу та пилку для зменшення концентрації пилку в автомобілі. Крім того, пацієнтів з алергією на пилок можна навчати знімати одяг та мити волосся перед входом у спальню під час пилкового сезону, оскільки пилкові зерна прилипають і до волосся, і до одягу. Знову ж таки думка експертів схвалює ці стратегії, але немає доказів, які б підтверджували їх клінічну ефективність.
Інша стратегія екологічного контролю використовує фізичні бар’єри для мінімізації впливу слизової оболонки алергенами в повітрі. У перспективному дослідженні 70 пацієнтів із пилковим АР, спричиненим пилком трави, були рандомізовані у 2 групи: 1) пацієнти використовували спеціальні антиалергічні окуляри на додаток до стандартної медичної допомоги (перша дослідницька група), 2) пацієнти, яким застосовувалась стандартна медична допомога (друга група досліджень) протягом трьох сезонів поспіль із пилком трави. Цікаво, що автори виявили значне поліпшення очних та носових симптомів за даними анкети Rhinoconjunctivitis Quality of Life у групі, забезпеченій спеціальними окулярами, порівняно з контрольною групою. Інший підхід — активний назальний фільтр за допомогою мембрани, що видаляє частинки з повітря, яке вдихається. У перспективному одноцентровому рандомізованому подвійному сліпому плацебо-конт-рольованому перехресному дослідженні, проведеному в камері з алергеном, 24 дорослі пацієнти із сезонним АР, спричиненим трав’яним пилком, були випадково віднесені або до групи, яка використовувала цей мембранний фільтр для носа, або до групи, яка не використовувала цього засобу. При повторному впливі в камері з алергеном пацієнти з мембранним фільтром відмітили зменшення деяких зі своїх назальних симптомів. Однак первинна кінцева точка, що вимірює максимальний рівень за шкалою загальної тяжкості симптомів риніту (Total Nasal Symptom Score), у цьому випробуванні була незначною. Таким чином, значущі висновки складно зробити з цього дослідження. Невеликий розмір вибірки був помітним обмеженням щодо оцінки результатів. Одноцентрове подвійне сліпе перехресне випробування 65 пацієнтів тими ж дослідниками виявило значне зниження назальних симптомів при використанні назальних фільтрів у сезон пилку порівняно з плацебо за результатами щоденного оцінювання за шкалою загальної тяжкості симптомів риніту (Total Nasal Symptom Score) та при оцінюванні максимального загального рівня назальних симптомів.
Уникнення впливу професійних інгаляційних алергенів можливе в основному для пацієнтів із професійною алергією. У літературі описані декілька способів зменшення впливу професійного аерозолю на працівників, таких як інженерний контроль та адміністративний контроль. Перший включає заміну небезпечної хімічної речовини безпечною або менш небезпечною альтернативою, ізоляцію цієї небезпечної хімічної речовини або застосування ефективної вентиляції, щоб зменшити вплив на працівників. Адміністративний контроль включає освіту працівників та засоби індивідуального захисту. Перспективне контрольоване дослідження 20 пацієнтів із підтвердженим діагнозом професійної алергії продемонструвало, що припинення впливу причинного алергену на робочому місці призвело до значного поліпшення показників носових симптомів пацієнтів, а також до поліпшення якості життя.
Загальний рівень доказовості: B (рівень 1b: 3 дослідження; рівень 2b: 1 дослідження).
Користь: зменшення впливу алергенів із можливим зменшенням симптомів та потреби в ліках від алергії, а також покращання якості життя.
Шкода: фінансові та часові витрати від потенційно неефективного втручання.
Вартість: низька, але залежна від стратегії екологічного контролю (тобто при запровадженні системи вентиляції та інших інженерних засобів контролю може бути високою).
Висновки про цінність: обмежена кількість досліджень показує клінічний ефект досліджуваних заходів екологічного контролю. Загальні рекомендації екологічного контролю в основному базуються на висновках експертів, а не на доказах.
Рівень впровадження: варіант.
Втручання: уникнення пилку та професійного алергену за стратегіями екологічного контрою є варіантом лікування АР, однак клінічна ефективність остаточно не продемонстрована. Більшість рандомізованих контрольованих досліджень із більшою кількістю спостережень гарантує в перспективі оцінку клінічної ефективності.
IX.B. Фармакотерапія
Незалежно від того, чи вибираються пацієнтами, чи призначені медичним персоналом, ліки є основним способом контролю алергічних симптомів. Існує чимало варіантів перорального або системного застосування, місцевого інтраназального застосування та альтернативних методів терапії, які можна розглянути. Отже, необхідно розуміти, які дані підтверджують ефективність цих ліків та, відповідно, як використовувати ці варіанти фармакотерапії.
IX.B.1. Антигістамінні препарати
IХ.B.1.а. Пероральні антигістамінні препарати Н1
Гістамін є основним медіатором, пов’язаним із симптоматикою АР. Пероральні антигістамінні препарати Н1 блокують дію гістаміну, зв’язуючи рецептор Н1-гістаміну тим самим гальмуючи прозапальну дію гістаміну. Антигістамінні засоби, як правило, класифікуються за поколінням: препарати першого або другого покоління. Старші препарати – препарати першого покоління (дифенгідрамін, хлорфенірамін, бромфенірамін) були ліпофільними і легко переходили гематоенцефалічний бар’єр. Це спричиняло небажані побічні ефекти, такі як заспокійливість, сонливість, втома та порушення концентрації та пам’яті, а також антимускаринові ефекти. Антигістамінні засоби першого покоління також є інгібіторами печінкових ферментів CYP2D6. Тому вони можуть змінювати метаболізм інших лікарських засобів, залежних від метаболізму CYP2D6, таких як трициклічні антидепресанти, деякі антипсихотичні засоби, β-блокатори, антиаритмічні засоби та трамадол. Через ці значні побічні ефекти в опублікованих раніше керівництвах та інших працях антигістамінні засоби першого покоління не рекомендувались для лікування АР.
Для мінімізації несприятливих наслідків попередніх препаратів були розроблені засоби нового покоління (такі як лоратадин, дезлоратадин, фексофенадин, цетиризин, левоцетиризин). Вони є високоселективними щодо Н1-рецептора, вони ліпофобні і мають обмежене проникнення через гематоенцефалічний бар’єр.
Антигістамінні препарати нового покоління, крім цетиризину, левоцетиризину, біластину та фексофенадину, метаболізуються в печінці цитохромом P450 CYP3A4. Практикуючі лікарі повинні знати, що одночасне використання інших лікарських засобів (наприклад, макролідів, протигрибкових препаратів або блокаторів кальцієвих каналів), які інгібують CYP3A4, може призвести до накопичення ліків та підвищити ризик виникнення побічних ефектів та токсичності. Крім того, несприятливі серцеві ефекти (torsades de pointes, аритмія та подовження інтервалу QT) були зафіксовані при застосуванні астемізолу та терфенадину, що призвело до їх остаточного виходу з ринку. Рандомізовані контрольовані дослідження встановили довгострокову безпеку й ефективність антигістамінних препаратів H1 нового покоління: цетиризину, дезлоратадину, фексофенадину, левоцетиризину та лоратадину.
Оскільки пероральні антигістамінні препарати використовувались із початку 1940-х років, було багато рандомізованих контрольованих досліджень, в яких рекомендували пероральні антигістамінні препарати як відповідну фармакотерапію для АР. Таким чином, у цьому розділі не буде перераховане кожне опубліковане дослідження, а узагальнені найважливіші докази, що були опубліковані. Опубліковані рекомендації щодо АР, включаючи рекомендації American Academy of Otolaryngology — Head and Neck Surgery та групи Allergic Rhinitis and its Impact on Asthma. American Academy of Otolaryngology — Head and Neck Surgery, обґрунтували на основі рандомізованих контрольованих досліджень переваги та користі над шкодою настійну рекомендацію щодо застосування пероральних антигістамінних препаратів H1 нового покоління для пацієнтів з АР. Аналогічний консенсус надійшов від ARIA, де була надана настійна рекомендація щодо пероральних антигістамінних препаратів H1 проти АР. Крім того, ARIA та European Academy of Allergy & Clinical Immunology (EAACI) опублікували набір рекомендацій, які визначають фармакологічні критерії, яким повинні відповідати ліки, які зазвичай застосовуються при лікуванні АР. Основним напрямком критеріїв ARIA/EAACI було оцінити ефективність, безпеку та фармакологію пероральних антигістамінних препаратів H1 нового покоління за допомогою досліджень рівня 1а. Використовуючи ці критерії, було встановлене сприятливе співвідношення ризику та користі для використання пероральних антигістамінних препаратів нового покоління перед пероральними антигістамінними препаратами першого покоління. Докази були додатково підкріплені кількома метааналізами.
Вибір певного перорального антигістамінного препарату Н1 часто ґрунтується на дозуванні, швидкості настання ефекту, взаємодії лікарських засобів та потенційній вартості. Систематичні огляди, що оцінюють багаторазові пероральні антигістамінні препарати, відзначають переваги певних препаратів, які можуть бути важливими при визначенні медикаментозного призначення. Прямі витрати, пов’язані з антигістамінними препаратами нового покоління, аналогічні з урахуванням наявності багатьох цих препаратів та їх безрецептурного використання. На противагу цьому вартість препаратів, що відпускаються за рецептом (левоцетиризин та дезлоратадин), значно вища. Очікується, що непрямі витрати будуть подібними серед пероральних антигістамінних препаратів новішого покоління, що мають подібні профілі побічних ефектів.
Загальний рівень доказовості: A (рівень 1a: 21 дослідження). Існує перевага високоякісних досліджень, які досліджували пероральні антигістамінні препарати H1.
Користь: зменшення свербежу в носі, чхання, ринореї та непрохідності носа.
Шкода: легка сонливість, втома, головний біль, нудота та сухість у роті.
Вартість: прямі витрати низькі (у середньому 2 долари за добову дозу). Непрямі витрати на препарати нового покоління нижчі, ніж на засоби першого покоління.
Оцінка співвідношення користь/шкода: переваги перевищують шкоду для використання пероральних антигістамінних препаратів нового покоління.
Висновки про цінність: через побічні ефекти на ЦНС першого покоління пероральних антигістамінних препаратів їх застосування не рекомендується для типових АР.
Рівень впровадження: суворі рекомендації щодо використання пероральних антигістамінних препаратів нового покоління для лікування АР.
Втручання: призначення пероральних антигістамінних препаратів нового покоління пацієнтам з АР слід розглянути на початку лікування.
IХ.B.1.b. Пероральні антигістамінні препарати Н2
Роль H2-рецепторів в опосередкуванні гістамінових симптомів при АР є суперечливою. Кілька невеликих досліджень вивчали вплив антагонізму Н2-рецепторів із різноманітними результатами. Крім того, не існує даних, що порівнюють ефективність антагонізму Н2-рецепторів із звичайною сучасною терапією першої лінії, такою як місцеві кортикостероїди у вигляді носових крапель. Клінічна значущість змін, пов’язаних з антигістамінними препаратами H2, не була чітко визначена. Незважаючи на ці застереження, деякі дослідження підтримують додавання H2-антигістамінного препарату для пацієнтів із непрохідною обструкцією носових дихальних шляхів під час прийому пероральних антигістамінних препаратів H1. Існують лікарські взаємодії, які можуть виникнути з антигістамінними препаратами H2 через зниження шлункової кислотності та інгібування системи цитохрому P450. Однак через низьку вартість цих ліків можуть виникнути клінічні ситуації, які виправдовують їх використання.
Wood-Baker зі співавт. порівнювали пероральний цетиризин із пероральним ранітидином. Об’єктивні заходи з вимірювання обструкції носових дихальних шляхів показали більше поліпшення після застосування ранітидину, проте цетиризин знижував об’єктивні показники назальної секреції більше, ніж ранітидин. Тейлор-Кларк та ін. виявили подібне покращання прохідності носових дихальних шляхів між цетиризином та ранітидином, а суттєве покращання виявлене при застосуванні комбінованої терапії. Також було показано, що комбінована терапія покращує носовий потік повітря, коли до цетиризину додавали циметидин. Два дослідження не виявили покращання в показниках носової прохідності при додаванні антигістамінного засобу Н2. Клінічна значущість цих об’єктивних знахідок неясна, і дослідження, в яких застосовували суб’єктивні дані при оцінці ефективності, не продемонстрували поліпшення прохідності носа.
У чотирьох дослідженнях був виявлений вплив H2-антигістамінних препаратів на симптоми, однак у цих дослідженнях не було використано стандартизованих критеріїв оцінки результатів. Пацієнтам було запропоновано повідомити про певну комбінацію закладеності носу, свербежу, дренажу, чхання, симптомів очей та астми з категорійним вимірюванням вираженості. У трьох із чотирьох досліджень ефективність препаратів досліджували після застосування алергену, і жодне не продемонструвало ефективність антигістамінних препаратів H2 самостійно або спільно з антигістамінним засобом H1 для зменшення алергічних симптомів. Одне дослідження з 23 суб’єктів досліджувало вплив циметидину спільно з хлорфеніраміном у реальних умовах. Суб’єкти з відомим AР у кінці літа були рандомізовані для отримання двотижневих курсів або хлорфеніраміну плюс плацебо, або хлорфеніраміну плюс циметидину, і показники симптомів реєструвались двічі на день разом із допоміжними медикаментозними терапіями (зокрема, пероральними кортикостероїдами). Пацієнти, які отримували антигістамінні препарати H1 та H2, повідомляли про зменшення споживання ліків (28 кортикостероїдних днів проти 44 кортикостероїдних днів, р < 0,02) та зниження показників симптомів протягом одного з восьми тижнів, коли кількість пилку бур’янів була високою. Застереженням цього дослідження є використання антигістамінного препарату першого покоління, який більше не рекомендується як лікування АР першого ряду.
Дані щодо застосування антигістамінних препаратів H2 при АР обмежені за обсягом та якістю. Об’єктивні результати поліпшення прохідності носових дихальних шляхів дозволяють припустити, що рецептор гістаміну Н2 модулює реакцію тканини носа на гістамін. Однак клінічне значення цього механізму не зрозуміле, особливо в контексті сучасних алгоритмів лікування. Відносно керований профіль побічної дії та вартість H2-антигістамінних препаратів надають пацієнтам із резистентними симптомами АР додатковий варіант лікування.
Загальний рівень доказовості: B (рівень 1b: 6 досліджень).
Користь: зниження об’єктивної прохідності носа та покращений контроль симптомів в одному дослідженні при застосуванні в комбінації з антагоністами H1.
Шкода: взаємодія лікарських препаратів (інгібування цитохрому Р450, пригнічена шлункова секреція та абсорбція).
Вартість: збільшена вартість, пов’язана з антагоністом H2.
Оцінка співвідношення користь/шкода: неясна користь та можлива шкода.
Висновки про цінність: немає досліджень, що оцінювали ефективність антигістамінних препаратів H2 у контексті актуальних назальних кортикостероїдів.
Рівень впровадження: немає рекомендацій. Наявні дані недостатньою мірою вирішують питання щодо користі антигістамінних препаратів H2 як складових сучасних протоколів лікування АР.
Втручання: додавання перорального антагоніста Н2 до перорального антагоніста Н1 може покращити контроль симптомів при АР, однак докази, які підтверджують це, не є надійними.
IX.B.1.c. Інтраназальні антигістамінні препарати
Застосування інтраназального антигістамінного спрею для АР добре вивчено. На сьогодні в Північній Америці доступні два засоби для інтраназального застосування у вигляді спреїв для місцевого застосування: азеластину гідрохлорид та олопатадину гідрохлорид. Систематичний огляд англомовної літератури проводився для клінічних випробувань азеластину або олопатадину для лікування АР. Усього було виявлено 44 документи, які повідомляли про результати досліджень внутрішньоназальної антигістамінної монотерапії порівняно з плацебо чи активним контролем. З них 11 досліджень включали порівняння різних доз інтраназального антигістамінного препарату та 29 досліджень із використанням неактивного плацебо. Загалом було 38 досліджень азеластину та 10 досліджень олопатадину як монотерапії.
Вихідні дані були переважно показниками симптомів, які були зареєстровані пацієнтом або отримані при оцінці якості життя. Найпоширенішим показником результатів була шкала загальних назальних симптомів (Total Nasal Symptom Score) (23 дослідження), яка реєструє ступінь тяжкості нежитю, чхання, свербежу та закладеності носа. Інші критерії оцінки включали опитувальник якості життя при ринокон’юнктивітах (7 досліджень), загальний показник очної симптоматики (5 досліджень), опитувальник щодо задоволення лікувальною терапією (2 дослідження), анкети щодо якості життя при ринокон’юнктивіті в дітей (1 дослідження), коротку форму-36 (1 дослідження), шкалу сонливості Epworth (ESS, 1 дослідження), показник тяжкості риніту (1 дослідження) та суб’єктивну глобальну оцінку (1 дослідження). У декількох дослідженнях, особливо в опублікованих до 2002 р., було використано цілу низку неперевірених систем оцінювання симптомів — від 5 до 13 пунктів у кожному (19 досліджень). Об’єктивні заходи включали промивання носа (3 дослідження), реакцію на метахолін (2 дослідження), швидкість носового потоку (2 дослідження) та риноманометрію
(1 дослідження).
Тривалість дослідження становила від 2 днів до 8 тижнів, найчастіша тривалість лікування — 14 днів. Кількість суб’єктів у кожному дослідженні становила від 20 до 1188. Інтраназальний антигістамінний препарат порівнювали з плацебо в 29 дослідженнях, при цьому первинні результати показували перевагу перед плацебо у всіх дослідженнях. Інтраназальний антигістамінний препарат був випробуваний проти порівняльного препарату активного лікування іншого класу медикаментів у 24 дослідженнях. Хоча це не повідомлялося у всіх дослідженнях, інтраназальний антигістамінний спрей послідовно мав швидший початок дії — вже через 15 хвилин після введення. Азеластин та олопатадин безпосередньо порівнювались у 3 дослідженнях без суттєвої різниці в полегшенні симптомів між препаратами. У двох додаткових дослідженнях азеластин порівнювали з експериментальним препаратом інтраназальним левокабастином із порівнянними або кращими результатами азеластину.
Інтраназальний антигістамінний препарат порівнювали з інтраназальним кортикостероїдом у 12 дослідженнях, причому первинний результат був на користь антигістамінного препарату у 2 дослідженнях, інтраназального кортикостероїду — у 3 дослідженнях та еквівалентність препаратів — у 7 дослідженнях. У 2 дослідженнях, що показали еквівалентність, антигістамінний препарат був кращим у купіруванні очних симптомів. Три дослідження, що показують перевагу кортикостероїдів, були проведені до 2000 року, і в них використовували гетерогенні результати невалідованих симптомів як первинні результати. Інтраназальний антигістамінний препарат порівнювали з монотерапією пероральним антигістамінним препаратом у 8 дослідженнях, при цьому первинний результат сприяв інтраназальному антигістамінному засобу в 3 дослідженнях та виявляв еквівалентність у 5 дослідженнях. Одне дослідження включало в себе групу лікування пероральним хлорфеніраміном як позитивний контроль без наміру порівнювати ефективність з азеластином. Одне дослідження, в якому порівнювались азеластиновий спрей із пероральним лоратадином плюс інтраназальний беклометазон, виявило, що монотерапія азеластином була принаймні такою ж ефективною, як і комбінована терапія. Два дослідження, що порівнювали інтраназальний азеластин плюс пероральний антигістамінний препарат з інтраназальною монотерапією азеластином, не показали додаткової користі для комбінованої терапії. Мінімальний вік випробовуваних у включених дослідженнях, як правило, становив 12 років або більше. Дітей віком від 6 до 12 років було включено у 3-тє дослідження, які в сукупності показали перевагу інтраназального антигістамінного препарату перед плацебо в покращанні симптомів та якості життя.
Про серйозні побічні ефекти не повідомлялося в жодному дослідженні. Інтраназальний антигістамінний препарат, як правило, добре переноситься, і найбільш часто повідомляється про неприємний смак. Одне дослідження, яке порівнювало наявну в продажу форму азеластину з переформульованим носієм, не виявило різниці у відразі до смаку. В одному дослідженні, що безпосередньо порівнювало олопатадин з азеластином, повідомлялося про кращі сенсорні властивості олопатадину. Інші повідомлення про побічні ефекти включали сонливість, головний біль, носові кровотечі та дискомфорт у носі, всі вони виникали менше ніж у 10 % випадків у будь-якому дослідженні.
Загальний рівень доказовості: A (рівень 1b: 43 дослідження; рівень 2b: 1 дослідження). Через велику кількість досліджень з високим рівнем доказів, дослідження нижчих рівнів доказів тут не розглядаються.
Користь: інтраназальні антигістамінні препарати мають швидкий початок дії, ефективніші при закладеності носа, ніж пероральні антигістамінні засоби, ефективніші при очних симптомах, ніж інтраназальні кортикостероїди, і демонструють постійне зменшення симптомів та поліпшення якості життя в рандомізованих контрольованих дослідженнях порівняно з плацебо.
Шкода: побоювання щодо толерантності пацієнтів до лікування, особливо через смак. Інтраназальні антигістамінні препарати менш ефективні при закладеності, ніж інгаляційні кортикостероїди.
Вартість: низька — середній фінансовий тягар; доступний лише за рецептом.
Оцінка співвідношення користь/шкода: перевага користі перед шкодою. Інтраназальний антигістамінний препарат як монотерапія стабільно ефективніший, ніж плацебо. Більшість досліджень показують, що інтраназальні антигістамінні препарати перевершують інгаляційні кортикостероїди при чханні, свербежу, ринореї та очних симптомах. Побічні ефекти незначні та нечасті.
Висновки про цінність: великі докази рівня 1, що порівнюють інтраназальну антигістамінну монотерапію з активним контролем та плацебо-контролем, демонструють загальну ефективність та безпеку.
Рівень впровадження: рекомендація.
Втручання: інтраназальні антигістамінні засоби можуть використовуватися як терапія першої чи другої лінії при лікуванні АР.
IX.B.2. Кортикостероїди
IX.B.2.a. Пероральні кортикостероїди
Протизапальний ефект пероральних кортикостероїдів при АР добре відомий і був продемонстрований експериментально при використанні провокаційних тестів та клінічно в умовах сезонного захворювання. Порівняно з плацебо премедикація пероральним преднізолоном за 2 дні до провокативного тесту з алергеном показала зменшення чхання, а також рівня гістаміну та медіаторів судинної проникності в промивних водах носа під час реакції пізньої фази. Крім того, активне лікування призвело до зменшення реакції на алерген. Також показано, що преднізолон зменшує приплив еозинофілів та рівнів медіаторів еозинофілів (основний базальний протеїн та еозинофільний нейротоксин) у носові секрети під час реакції пізньої фази порівняно з плацебо. Плацебо-неконтрольовані дослідження показали ефективність пероральних кортикостероїдів для сезонного алергічного риніту. Schwartz та ін. продемонстрували, що 15 днів кортизону по 25 мг чотири рази на день протягом сезону амброзії призводили до значного полегшення симптомів у 21/25 пацієнтів. Аналогічно 100 мг кортизону курсом щодня протягом чотирьох діб під час пилкового сезону показали полегшення симптомів риніту в 42 із 51 пацієнта, при цьому у 20 пацієнтів симптоми рецидували протягом 7 днів після припинення терапії. Також показано, що пероральний гідрокортизон 40–80 мг щодня зменшує симптоми алергії на амброзію. Brooks та ін. проводили плацебо-контрольоване дослідження, порівнюючи ефективність метилпреднізолону 6, 12 або 24 мг перорально щодня протягом 5 днів порівняно з плацебо з оцінкою контроля назальних симптомів протягом сезону цвітіння амброзії. У той час, коли дози 6 та 12 мг призвели до значного зменшення деяких симптомів порівняно з плацебо (застій у носі та очні симптоми), доза 24 мг призвела до значного зменшення всіх симптомів (закладеність, нежить, чхання, свербіж та очні симптоми).
Через визнані системні побічні явища, пов’язані з пероральними кортикостероїдами, їх застосування значною мірою замінене інтраназальними препаратами. У подвійному сліпому плацебо-контрольованому дослідженні ефект інтраназального флунізоліду та його біоеквівалентної пероральної дози (пероральна доза, що призведе до подібних системних рівнів) порівнювали в пацієнтів із сезонним алергічним ринітом, спричиненим амброзією. Показано, що інтраназальний препарат є ефективним для зменшення симптомів риніту, тоді як пероральне дозування такої ефективності не показало. Це свідчить про те, що інтраназальні кортикостероїди досягають своєї ефективності насамперед за рахунок місцевої активності на відміну від системних препаратів. Під час порівняння ефективності інтраназальних та системних стероїдів Karaki зі співавт. проводили відкрите паралельне рандомізоване дослідження протягом сезону пилку кедра в Японії. Пацієнти були розподілені на декілька груп: перша група отримувала монотерапію лоратадином у дозі 10 мг щодня, друга — лоратадин та інтраназально мометазону фуроат (200 мкг один раз на день) і третя — лоратадин із пероральним бетаметазоном 0,25 мг двічі на день протягом 1 тижня. У груп, які отримували певну форму стероїду на додаток до лоратадину, були значно менш виражені симптоми чхання, ринореї та непрохідності носа порівняно з лоратадином, без суттєвої різниці між інтраназальними та пероральними препаратами. Пероральний стероїд виявився більш ефективним, ніж інгаляційний кортикостероїд, у купіруванні очних симптомів.
Наведені вище дані свідчать про те, що пероральні кортикостероїди ефективні для лікування АР. Однак, враховуючи значні системні побічні ефекти, пов’язані з використанням пероральних кортикостероїдів протягом тривалого періоду часу, ці засоби не рекомендуються для звичайного лікування АР.
Загальний рівень доказовості: B (рівень 1b: 5 досліджень; рівень 2b: 1 дослідження; рівень 4: 3 дослідження).
Користь: пероральні кортикостероїди можуть послабити симптоми АР.
Шкода: пероральні кортикостероїди мають небажані побічні ефекти. До них належать вплив на гіпоталамо-гіпофізарну систему, ріст й опорно-руховий апарат, шлунково-кишковий тракт, розвиток гіпертонії, підвищений рівень глікемії, розлади психічного/емоційного стану та інші.
Вартість: низька.
Оцінка співвідношення користь/шкода: ризики використання пероральних кортикостероїдів перевищують переваги порівняно з аналогічним поліпшенням симптомів при застосуванні інтраназальних кортико-стероїдів.
Висновки про цінність: за наявності ефективного контролю симптомів із застосуванням інгаляційних кортикостероїдів ризик побічних ефектів від використання пероральних кортикостероїдів для АР перевищує потенційну користь.
Рівень впровадження: не рекомендоване рутинне використання пероральних кортикостероїдів при АР.
Втручання: хоча це не рекомендується для рутинного використання при АР, певні клінічні сценарії вимагають використання коротких курсів системних кортикостероїдів після обговорення ризику та користі з пацієнтом. Сюди можна віднести пацієнтів зі значною непрохідністю носа, яка б перешкоджала проникненню інтраназальних засобів (інтраназальних кортикостероїдів або антигістамінних препаратів). У цих випадках короткий курс системних пероральних кортикостероїдів може покращити застій і полегшити доступ та ефективність місцевих препаратів.
IX.B.2.b. Ін’єкційні кортикостероїди
Кортикостероїди шляхом ін’єкції вводять внутріш-ньом’язово або інтраназально для лікування АР. Спочатку будуть розглянуті докази, що оцінюють глибокі внутрішньом’язові ін’єкції. Загалом кілька ранніх досліджень показали клінічну ефективність в покращанні алергічних симптомів, однак результати безпеки показали ризик небажаних системних побічних кортикостероїдів. Більш свіжі дані підтверджують підвищений ризик стримування вироблення ендогенного кортизолу разом з іншими несприятливими наслідками, пов’язаними з кортикостероїдами, такими як остеопороз та гіперглікемія.
Kronholmу в дослідженні продемонстрував, що одноразова ін’єкція бетаметазону дипропіонату/бетаметазону фосфату або метилпреднізолону ацетату, що вводиться на початку сезону сінної лихоманки, призвела до значного зменшення як назальних, так і очних симптомів протягом п’яти тижнів дослідження, при цьому комбінація бетаметазону була більш ефективною. Ohlander зі співавт. порівнювали три ін’єкції кортикостероїдів тривалої дії, зроблені на початку сезону, і показали, що всі методи лікування призводили до значного зменшення назальних та очних симптомів протягом сезону без різниці між групами. Однак усі препарати також пригнічували продукцію ендогенного кортизолу, в деяких випадках — протягом більше 14 днів після ін’єкції, а дві з трьох ін’єкцій призводили до підвищення рівня цукру в крові.
Якщо порівнювати з іншими засобами, кортикостероїди, які вводили ін’єкційно, демонстрували подібні результати ефективності. Зокрема, були подібні клінічні результати при порівнянні передсезонних ін’єкцій стероїдів як щоденного перорального преднізолону, так і щоденного інтраназального бепрометанового спрею беклометазону. Тест надниркових кортикотропних гормонів (АКТГ), проведений через 3 тижні, показав значне пригнічення функції надниркових залоз у групі пероральної терапії стероїдами та відсутність ознак супресії в групі ін’єкційних кортикостероїдів або при місцевому інтраназальному застосуванні кортикостероїдів. Це, мабуть, було пов’язане з короткою тривалістю пригнічення надниркових залоз, що очікується після одноразового введення кортикостероїдів порівняно з безперервним введенням.
Оцінюючи терміни терапії ін’єкційними кортико-стероїдами, Borum та ін. порівнювали ефекти одноразової ін’єкції метилпреднізолону, що була на початку алергічного сезону або пізніше, коли кількість пилку досягла піку. Порівняно з плацебо внутрішньом’язовий метилпреднізолон був ефективним проти закладеності носа з менш вираженими ефектами проти симптомів ринореї та чхання. Автори стверджують, що депо-ін’єкційні стероїди можуть бути розглянуті після того, як інша безпечна медикаментозна терапія неефективна, і можуть забезпечити ефективне альтернативне лікування, навіть якщо воно буде надане пізніше, вже в сезон алергії.
Препарати ін’єкційних кортикостеростероїдів можуть мати значні побічні ефекти, які включають пригнічення надниркових залоз та затримку росту. У великому ретроспективному дослідженні з національного реєстру Данії відносний ризик та захворюваність як на остеопороз, так і на діабет були вищими в осіб, які страждають від алергії, які отримували принаймні одну ін’єкцію кортикостероїдів протягом сезону алергії, порівняно з особами, які отримували імунотерапію. У кількох ранніх звітах детально спостерігається значне поліпшення симптомів АР у значної частки пацієнтів, які отримували ін’єкції кортизону в носові ходи, гідрокортизону ацетату або преднізолону. Подібні, некеровані, дослідження показали поліпшення симптомів АР після такого способу ведення.
Більш недавнє рандомізоване плацебо-контрольоване односліпове випробування Yang зі співавт. порівняло ефективність інтраназальної ін’єкції або анатоксину токсину А, або тріамцинолону, або ізотонічного сольового розчину в пацієнтів із сезонним алергічним ринітом. Як ботуліновий токсин А, так і терапія тріамцинолоном показали кращий контроль над носовими симптомами, ніж плацебо, а дія ботулінового токсину А тривала довше.
Повідомлялося про орбітальні ускладнення при інтраназальних ін’єкціях. З огляду на великий клінічний досвід Mabry наводить оцінку частоти втрати зору після інтраназальних ін’єкцій у 0,006 % осіб. Інші ускладнення включають минущу втрату зору та диплопію, помутніння зору та тимчасову сліпоту, тимчасове викривлення зору, зниження гостроти зору та парез медіальної прямої кишки. Martin повідомив про швидке виникнення очного болю, помутніння зору та зниження гостроти зору після інтраназальної ін’єкції тріамцинолону ацетоніду. Причиною цього було визнано емболію судинної та ретинольної артерій сітківки, і ці явища повністю усунулися протягом 24 годин. Механізм емболізації, ймовірно, пов’язаний із ретроградним потоком від переднього кінця нижньої носової раковини в очну артерію з подальшою антероградною течією з накопиченням згустків у хоріоїдних артеріях і судинах сітківки. Вважається, що стероїди із більшим розміром частинок (наприклад, метилпреднізолон) становлять більш високий ризик, ніж частинки меншого розміру (наприклад, тріамцинолон).
Загальний рівень доказовості: B (рівень 1b: 3 дослідження; рівень 2b: 3 дослідження, рівень 4: 7 досліджень).
Користь: ін’єкційні кортикостероїди покращують симптоми АР за даними клінічних досліджень.
Шкода: добре відомі побічні явища ін’єкційних кортикостероїдів, такі як несприятливий вплив на вісь гіпоталамо-гіпофізу, пригнічення росту, остеопороз, гіперглікемія та інші системні несприятливі ефекти. Інтраназальні ін’єкції кортикостероїдів мають невеликий, але потенційно серйозний ризик виникнення очних побічних ефектів, включаючи зниження чи втрату зору.
Вартість: низька.
Оцінка співвідношення користь/шкода: при рутинному лікуванні АР ризик серйозних побічних ефектів переважає продемонстровану клінічну користь.
Висновки про цінність: ін’єкційні кортикостероїди ефективні для лікування АР. Однак, зважаючи на ризик значних системних побічних ефектів, ризик серйозних очних побічних ефектів та наявність ефективних альтернативних варіантів (тобто місцевої терапії інтраназальними кортикостероїдами), ін’єкційні кортикостероїди не рекомендуються для звичайного лікування АР.
Рівень впровадження: рекомендація проти застосування ін’єкційних кортикостероїдів при АР.
Втручання: немає.
IX.B.2.c. Інтраназальні кортикостероїди
Інтраназальні кортикостероїди ефективні для лікування АР. Їх потужні протизапальні властивості безпосередньо впливають на патофізіологічні механізми запалення носа при АР. Як при провокаційних тестах, так і при сезонних захворюваннях лікування інтраназальними кортикостероїдами призводить до значного зменшення вивільнення медіатора та цитокінів, а також до значного пригнічення міграції базофілів, еозинофілів, нейтрофілів та мононуклеарних клітин до слизової носа та секрету. Інтраназальні кортикостероїди також зменшують викликану антигеном гіперреактивність слизової оболонки носа до наступного моменту взаємодії між антигеном та гістаміном.
Багаторазові плацебо-контрольовані клінічні дослідження в дорослих та дітей продемонстрували ефективність інтраназальних кортикостероїдів у зменшенні носових симптомів при АР, включаючи чхання, свербіж, ринорею та закладеність. При зменшенні носових симптомів інтраназальний кортикостероїд значно покращує рівень якості життя та сну цих пацієнтів. У досліджуваних групах не було виявлено суттєвих відмінностей у ефективності між наявними препаратами; отже, сенсорні ознаки можуть бути важливим фактором для дотримання терапії пацієнтом. Ці сенсорні ознаки включають у себе післясмак, виділення з носа та запах. Деякі з цих проблем стосуються двох інтраназальних неводних препаратів з аерозолями гідрофтор-алкану, нещодавно затверджених для лікування АР у США. До них належать затверджені беклометазону дипропіонат та циклозонід, які ефективні для багаторічного та сезонного алергічного риніту в дорослих та дітей 12 років і більше. Початок дії для ІНКС починається від 3–5 годин до 60 годин після першого прийому. Хоча рекомендований безперервний щоденний прийом інтраназальних кортикостероїдів перевершує інші стратегії дозування, дослідження продемонстрували ефективність застосування за потреби інтраназального флутиказону пропіонату порівняно з плацебо.
Разом із поліпшенням носових симптомів інтраназальні кортикостероїди сприятливо впливають на зменшення алергічних симптомів очей, включаючи свербіж, сльозотечу, почервоніння та набряклість. Це є вторинним наслідком зменшення носоокулярного рефлексу, що сприяє появі цих очних симптомів. Більшість інтраназальних кортикостероїдів призводять до поліпшення очних симптомів, але дані свідчать про те, що ефекти не є рівними серед різних препаратів цієї групи. Деякі дослідження припускають, що вони покращують результати лікування хворих, які страждають як від АР, так і від астми.
У порівняльних дослідженнях інтраназальні кортикостероїди показали кращу ефективність, ніж антигістамінні препарати H1, для контролю назальних симптомів, включаючи закладеність носа, без суттєвої різниці в полегшенні очних симптомів. Інтраназальні кортикостероїди ефективніші, ніж антагоністи лейкотрієнових рецепторів.
Найпоширеніші побічні ефекти інтраназальних кортикостероїдів є наслідком місцевого подразнення і включають сухість, печіння, виділення з відтінком крові та набряк. Частота носових кровотеч із різними препаратами коливається від 4 до 8 % протягом коротких періодів лікування (2–12 тижнів) без відмінностей між плацебо та активною терапією. У дослідженнях, проведених протягом одного року, частота носових кровотеч досягає 20 %. Перфорація перегородки є рідкісним ускладненням застосування інтраназальних кортико-стероїдів. Систематичний огляд опублікованих статей, в яких розглядаються дослідження біопсії в пацієнтів з АР або з хронічним риносинуситом, які використовують інтраназальні кортикостероїди, виявив 34 дослідження. З них 21 дослідження включало пацієнтів з АР, змішаним ринітом та неалергічним ринітом, а 13 досліджень включали пацієнтів із неалергічним ринітом з поліпозом та без нього. В жодному дослідженні, в якому вивчалась атрофія слизової оболонки носа, не повідомлялося про будь-яку атрофію, пов’язану з інтраназальними кортикостероїдами. Метааналіз підгрупи досліджень не показав значних шансів на розвиток атрофії під час прийому інтраназальних кортикостероїдів, і немає різниці між активними та контрольними групами за характеристиками базальної мембрани. Огляд також виявив значне зменшення коефіцієнта шансів на 1 для розвитку плоскоклітинної метаплазії в пацієнтів, які застосовують інтраназальні кортикостероїди, що говорить про сприятливий ефект. Дослідженнями в дорослих та дітей, що оцінювали вплив інтраназальних кортикостероїдів на гіпоталамо-гіпофізарну систему, було оцінено ранкову концентрацію кортизолу, стимуляцію косинтропіну, 24-годинну сироватку кортизолу та 24-годинну екскрецію кортизолу із сечею. Вони не виявляють побічних ефектів. Хоча надійшло повідомлення про зв’язок між застосуванням інтраназальних кортикостероїдів та розвитком задньої субкапсулярної катаракти, систематичний огляд конт-рольованих випробувань не продемонстрував клінічно значущого впливу інтраназальних кортикостероїдів на очний тиск, глаукому, непрозорість кришталика або утворення катаракти. Вплив інтраназальних кортико-стероїдів на ріст у дітей був досліджений як у конт-рольованих короткотермінових дослідженнях (2–4 тижні), так і в тривалих (12 місяців) дослідженнях. Метааналіз 8 рандомізованих контрольованих досліджень із відповідним контролем показав, що порівняно з дітьми, які використовують плацебо, середній приріст був значно нижчим серед дітей, які застосовували інтраназальні кортикостероїди в короткотривалих випробуваннях (n = 4), і що не було суттєвої різниці в зростанні в дослідженнях при тривалих дослідженнях (n = 4). Дані говорять про те, що інтраназальні кортикостероїди можуть мати шкідливий вплив на короткочасний ріст у дітей, але неоднорідність тривалих досліджень змушує зробити висновок, що вплив інтраназальних кортикостероїдів на ріст незрозумілий.
Інтраназальні кортикостероїди — це терапія першої лінії для лікування АР завдяки їх кращій ефективності для контролю закладеності носа та інших симптомів цього запального стану. Пацієнти з відомим сезонним АР повинні розпочати профілактичне лікування інтраназальними кортикостероїдами за кілька днів до сезону пилку з оцінкою реакції пацієнта на препарат через 2 тижні. Окрім внесення змін до режиму лікування залежно від відповіді пацієнта, необхідно оцінити ознаки місцевого подразнення через лікарський засіб або механічну травму від самого аплікатора. Направлення спрею подалі від носової перегородки також може зменшити подразнення в цій ділянці. Дітям, які отримують інтраназальні кортикостероїди, слід застосовувати найменшу ефективну дозу, щоб уникнути негативних наслідків на ріст.
Загальний рівень доказовості: A (рівень 1a: 15 досліджень; рівень 1b: 33 дослідження; рівень 2a: 3 дослідження; рівень 2b: 1 дослідження; рівень 5: 1 дослідження).
Користь: інтраназальні кортикостероїди ефективні для зменшення назальних та очних симптомів AР. Вони мають кращу ефективність порівняно з пероральними антигістамінними препаратами та антагоністами лейкотрієнових рецепторів.
Шкода: інтраназальні кортикостероїди відомі небажаними місцевими побічними ефектами, такими як носові кровотечі з деякою підвищеною частотою порівняно з плацебо при тривалих дослідженнях. Явних негативних впливів на гіпоталамо-гіпофізарну систему немає. Можуть бути певні негативні наслідки для короткострокового росту в дітей, але незрозуміло, чи перетворюються вони на тривале порушення росту.
Вартість: низька.
Оцінка співвідношення користь/шкода: переваги використання інтраназальних кортикостероїдів перевищують ризики при використанні для лікування сезонного та багаторічного АР.
Висновки про цінність: відсутні.
Рівень впровадження: сильна рекомендація щодо використання інтраназальних кортикостероїдів для лікування АР.
Втручання: добре доведена ефективність інтраназальних кортикостероїдів, а також їх перевага над іншими препаратами роблять їх першою лінією терапії при лікуванні АР.
ІХ.B.3. Деконгестанти
ІХ.B.3.а. Пероральні деконгестанти
Пероральні деконгестанти, такі як псевдоефедрин, діють на адренергічні рецептори і призводять до звуження судин, що може полегшити симптом закладеності носа в пацієнтів з АР. При пероральному застосуванні деконгестантів їх ефект може тривати до 24 годин. Пероральні деконгестанти доступні для використання окремо або в поєднанні з пероральними антигістамінними препаратами.
Доступність псевдоефедрину в США обмежена через більш жорсткий контроль за поширенням та реалізацією препаратів, які можуть бути використані для виробництва метамфетаміну. У дослідженні Mucha та співавт.
псевдоефедрин у дорослих осіб призвів до значного поліпшення всіх симптомів, спричинених пов’язаною з амброзією АР. Фенілефрин продається без рецепта як замінник псевдоефедрину як назальний деконгестант. Однак рандомізоване дослідження Horak та співавт. встановило, що хоча псевдоефедрин був значно ефективнішим у зменшенні закладеності носа, ніж плацебо, однак не було суттєвої різниці між фенілефрином та плацебо. Крім того, Meltzer та співавт. провели рандомізоване відкрите випробування діапазону доз у 539 пацієнтів із сезонним АР та виявили, що фенілефрин не є більш ефективним, ніж плацебо, для зменшення симптоматичної закладеності носа.
Відомі побічні ефекти цього класу ліків включають безсоння, нервозність, тривожність, тремор, серцебиття та підвищення артеріального тиску. Два систематичні огляди Салерно та ін. розглядали вплив пероральних деконгестантів на артеріальний тиск. Перше дослідження показало, що фенілпропаноламін значно підвищив систолічний артеріальний тиск (САТ) на 5,5 мм рт.ст. (95% ДІ 3,1–8,0) та діастолічний артеріальний тиск (ДАТ) на 4,1 (95% ДІ 2,2–6,0), не впливаючи на частоту серцевих скорочень порівняно з плацебо. Друге дослідження виявило, що псевдоефедрин також спричинив невелике, але значуще збільшення САТ на 0,99 мм рт.ст. (95% ДІ 0,08–1,9) та ЧСС на 2,83 уд/хв (95% ДІ 2,0–3,6), не впливаючи на ДАТ. Крім цього, більш високі дози та препарати негайного вивільнення псевдоефедрину були пов’язані з більшим підвищенням рівня АТ. Крім того, у дослідженні Kernan та співавт. вживання фенілпропаноламіну в жінок було незалежним фактором ризику геморагічного інсульту. Фенілпропаноламін більше не доступний на ринку. З огляду на ці серцево-судинні побічні ефекти пероральні деконгестанти слід застосовувати з обережністю пацієнтам, які мають високий ризик гіпертонії та її ускладнень (наприклад, ішемічна хвороба серця, захворювання судин головного мозку, гіпертиреоз, аритмія). Кров’яний тиск слід ретельно контролювати на предмет будь-яких змін при застосуванні пероральних деконгестантів у цій популяції.
Пероральні деконгестанти, як відомо, ефективні в дітей, старших від 6 років. Однак слід бути обережними в дітей молодшої вікової групи (молодші 2 років), оскільки ця популяція більш схильна до токсичних небажаних побічних ефектів, а рекомендації щодо безпечного дозування ще не встановлені для цієї вікової групи. У немовлят та маленьких дітей пероральні деконгестанти можуть мати стимулюючу дію на ЦНС, відомі випадки розвитку психозу, атаксії та галюцинацій при прийомі всередину. Оцінювання ризику та переваг слід проводити пацієнтам віком до 6 років.
Загальний рівень доказовості: B (рівень 1a: 2 дослідження; рівень 1b: 3 дослідження; рівень 3b: 2 дослідження; рівень 4: 2 дослідження).
Користь: зменшення закладеності носа псевдоефедрином. Немає користі при застосуванні фенілефрину.
Шкода: побічні ефекти включають безсоння, втрату апетиту, дратівливість, серцебиття та підвищення артеріального тиску. Небезпека токсичності в дітей раннього віку.
Вартість: низька.
Оцінка співвідношення користь/шкода: баланс користі та шкоди для псевдоефедрину: шкода, ймовірно, перевищує користь для фенілефрину.
Висновки про цінність: перед використанням слід враховувати інші супутні захворювання та вік пацієнта.
Рівень впровадження: вибір псевдоефедрину. Рекомендація не використовувати фенілефрин.
Втручання: псевдоефедрин як пероральний деконгестант може бути ефективним для зменшення симптомів закладеності носа в пацієнтів з АР; застосовується для короткочасного купірування симптомів. Перед застосуванням слід враховувати побічні ефекти, супутні захворювання та вік пацієнта.
ІХ.B.3.b. Інтраназальні деконгестанти
Місцеві деконгестанти, такі як ксилометазолін та оксиметазолін, є альфа-адренергічними стимуляторами, що надходять безпосередньо до слизової тканини носа, що призводить до звуження судин і зменшення товщини слизової. У 18-денному дослідженні Barnes зі співавт. установлено, що назальний ксилометазолін був сильнішим протинабряковим засобом, ніж назальні кортикостероїди.
Медикаментозний риніт (МР) — стан, який вважається наслідком тривалого використання місцевих деконгестантів, передбачає посилення симптоматичної закладеності носа, тим самим виключаючи рекомендації щодо тривалого застосування цього препарату. Дослідження для виявлення тривалості застосування місцевого деконгестанту, що призводить до медикаментозного риніту, показали різні результати. Деякі дослідження показують, що тривале використання до 8 тижнів не викликає жодних симптомів закладеності носа, а інші відзначають розвиток МР протягом 3 днів після використання. Відомі несприятливі ефекти місцевих деконгестантів включають печіння в носі, різь, сухість, носові кровотечі та виразку слизової оболонки. Хоча місцеві деконгестанти ефективні для зменшення закладеності носа, рекомендується короткочасне використання подібних препаратів, 3 доби або менше, щоб уникнути ймовірності відновлення закладеності носа та впливу на мукоциліарну активність.
Загальний рівень доказовості: B (рівень 1b: 3 дослідження; рівень 2b: 1 дослідження).
Користь: зменшення закладеності носа місцевими деконгестантами.
Шкода: побічні ефекти включають печіння в носі, печіння, сухість і виразку слизової. Потенціал для відскоку перевантажень при тривалій експлуатації.
Вартість: низька.
Оцінка співвідношення користь/шкода: шкода, ймовірно, перевищує користь, якщо застосовувати препарат більше 3 днів.
Висновки про цінність: місцеві деконгестанти можуть бути корисними для короткочасного полегшення закладеності носа.
Рівень впровадження: варіант.
Втручання: місцеві деконгестанти можуть забезпечити ефективне короткочасне зменшення закладеності носа в пацієнтів з АР, але не рекомендовано використовувати ці препарати для тривалого застосування через ризик розвитку МР.
IX.B.4. Антагоністи лейкотрієнових рецепторів
Антагоністи лейкотрієнових рецепторів (АЛР) добре вивчені і використовуються при лікуванні АР. Монтелукаст затверджений FDA США для лікування сезонного АР у дорослих та дітей, старших від 2 років, а для багаторічного алергічного риніту — у дорослих та дітей, старших від 6 місяців. Кілька систематичних оглядів та метааналізів рандомізованих контрольованих досліджень продемонстрували зменшення симптомів та покращання якості життя пацієнтів, які отримували монотерапію АЛР порівняно з плацебо. Однак у настановах клінічної практики щодо АР від Американської асоціації отоларингологів та щелепно-лицьових хірургів була рекомендація проти монотерапії АЛР із вказанням на зниження ефективності порівняно з іншими препаратами першого ряду.
Систематичний огляд виявив 28 досліджень із вивчення застосування монотерапії АЛР при АР, з яких19 вважали доказами рівня 1. Багаторазові систематичні огляди та РКД показали, що монотерапія АЛР перевершує плацебо при поліпшенні стану пацієнта, симптомів та якості життя. Цей ефект був узгоджений у дослідженнях сезонного АР, багаторічного АР та впливу штучного алергену. Крім того, у подвійному сліпому РКД Philip та ін. повідомили, що монтелукаст покращив якість життя у пацієнтів як з АР, так і з бронхіальною астмою із супутнім сезонним АР.
Незважаючи на численні дослідження, що демонструють чудовий ефект монотерапії AЛР порівняно з плацебо при лікуванні АР, існують стійкі докази того, що АЛР поступається інтраназальним кортикостероїдам. Багато систематичних оглядів та метааналізів показали, що інтраназальні кортикостероїди більше зменшують симптоми та поліпшують якість життя пацієнтів порівняно з АЛР. Подвійне сліпе рандомізоване контрольоване дослідження Pullerits зі співавт. показало зменшення кількості активованих еозинофілів у тканинах у біопсіях слизової оболонки носа в пацієнтів, які отримували інтраназальний беклометазон порівняно із зафірлукастом та плацебо. Існують суперечливі докази відносного ефекту АЛР порівняно з пероральними антигістамінними препаратами, а два систематичні огляди показують, що пероральні антигістамінні препарати демонструють більш виражене зменшення симптомів та поліпшення якості життя, третє дослідження вказує на рівноцінний ефект. Монтелукаст і псевдоефедрин давали еквівалентне зменшення симптомів і поліпшення якості життя. У цьому дослідженні об’єктивне вимірювання пікового назального потоку в носі не відрізнялося між групами лікування з монтелукастом та псевдоефедрином.
На додаток до меншої відносної ефективності порівняно з іншими препаратами керівництво клінічної практики Американської асоціації отоларингологів та щелепно-лицьових хірургів щодо AР зазначало збільшення витрат на АЛР у рекомендації щодо цього класу лікарських препаратів як монотерапію в пацієнтів з АР без астми. Goodman зі співавт. досліджували відносну економічну ефективність монтелукасту порівняно з кількома пероральними антигістамінними препаратами другого покоління. Установлено, що монтелукаст збільшив вартість відносної ефективності порівняно з левоцетиризином, дезлоратадином та брендовим та загальним фексофенадином. Щорічні витрати на ліки та понесені медичні витрати на монтелукаст були оцінені в $631.
Монотерапія АЛР може бути корисною альтернативою для рідкісних пацієнтів, які мають протипоказання до прийому як інтраназальних кортикостероїдів, так і пероральних антигістамінних препаратів, але це обмежує рекомендації або варіанти застосування цих препаратів. У пацієнтів з одночасним АР та астмою АЛР можуть сприяти лікуванню симптомів обох респіраторних захворювань. Монотерапія АЛР не рекомендується як лікування на першому рівні для пацієнтів з одночасним АР та астмою, хоча треба враховувати пацієнтів із протипоказаннями до застосування інтраназальних кортикостероїдів.
Загальний рівень доказовості: A (рівень 1a: 6 досліджень; рівень 1b: 17 досліджень; 1 рівень 2a: 2 дослідження; рівень 2b: 3 дослідження; рівень 4: 3 дослідження).
Користь: постійне зменшення симптомів та поліпшення рівня якості життя порівняно з плацебо, як показано в рандомізованих контрольованих дослідженнях та систематичному огляді.
Шкода: стабільно поступається порівняно з інтраназальними кортикостероїдами при зменшенні симптомів та поліпшенні якості життя в рандомізованих контрольованих дослідженнях та систематичних оглядах. Еквівалентний до нижчого ефекту порівняно з пероральними антигістамінними препаратами щодо зменшення симптомів та покращання якості життя.
Вартість: щорічні витрати на ліки та медичні препарати, які оцінюються в $631 США, на генерик монтелукаст.
Оцінка співвідношення користь/шкода: перевага користі перед шкодою. АЛР ефективні як монотерапія порівняно з плацебо. Однак незмінно поступається чи еквівалентний ефект іншим, менш дорогим засобам, які використовуються як монотерапія. Однак існують дані про послідовно гірший або еквівалентний ефект порівняно з іншими, менш дорогими засобами, які використовуються як монотерапія.
Висновки про цінність: АЛР еквівалентні пероральним антигістамінним препаратам та ефективніші, ніж плацебо, при контролі як симптомів астми, так і АР у пацієнтів з обома станами. Контроль симптомів АР за допомогою АЛР, однак, менш ефективний, ніж при використанні інтраназальних кортикостероїдів, і поступається або еквівалентний пероральним антигістамінним засобам. Тому немає доказів, щоб рекомендувати АЛР як монотерапію першої чи другої лінії при лікуванні АР самостійно або в поєднанні з астмою.
Рівень впровадження: рекомендація проти терапії першої лінії АР.
Втручання: антагоністи лейкотрієнових рецепторів не слід застосовувати як монотерапію при лікуванні АР, але вони можуть розглядатися як терапія другої лінії, наприклад, коли інтраназальні кортикостероїди протипоказані.
Список літератури знаходиться в редакції
Матеріал публікується в скороченні

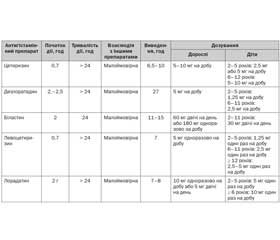
/43-1.jpg)
/46-1.jpg)
/49-1.jpg)
/57-1.jpg)