Журнал «Актуальная инфектология» Том 8, №1, 2020
Вернуться к номеру
Хронічний вірусний гепатит С. Ефективність противірусної терапії. Дані методичних рекомендацій ВООЗ (огляд літератури)
Авторы: Трихліб В.І.
Українська військово-медична академія, м. Київ, Україна
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
У статті поданий огляд літератури стосовно ефективності противірусної терапії при хронічному вірусному гепатиті С. Наведені дані рекомендацій ВООЗ щодо алгоритму діагностики, лікування й моніторингу вірусного гепатиту С.
В статье представлен обзор литературы относительно эффективности противовирусной терапии при хроническом вирусном гепатите С. Представлены данные рекомендаций ВОЗ по алгоритмам диагностики, лечения и мониторинга вирусного гепатита С.
The article reviews the literature on the effectiveness of antiviral therapy in chronic viral hepatitis C. Data presented by World Health Organization recommendations for the algorithm for the diagnosis, treatment and monitoring of viral hepatitis C.
хронічний вірусний гепатит С; противірусна терапія; огляд
хронический вирусный гепатит С; противовирусная терапия; обзор
chronic viral hepatitis C; antiviral therapy; review
Хронічний вірусний гепатит С (ХВГС) поширений у країнах світу [1], у тому числі високорозвинутих європейських, і зберігає свою актуальність у сучасних умовах, незважаючи на значні успіхи, досягнуті завдяки застосуванню сучасних препаратів.
Поширеність антитіл до вірусу гепатиту С (анти-ВГС) у країнах Європи подана в табл. 1 [2].
У Європейському Союзі/Європейському економічному просторі (ЄС/ЄЕП) приблизно в 7,4 млн осіб визначається позитивний результат анти-ВГС. Поширеність гепатиту — від 0,9 % у Західній Європі до 3,3 % у Східній Європі. За результатами проведеного дослідження поширеність анти-ВГС за межами ЄС/ЄЕП була вища, ніж у ЄС/ЄЕП серед населення в цілому (0,50–13,00 % проти 0,54–1,50 %) і серед донорів крові (0,03–6,40 % проти 0,03–0,09 %), але нижча — серед осіб, які вживають ін’єкційні наркотики (5,30–73,00 % проти 7,90–82,00 %). У ЄС/ЄЕП понад 14 млн людей живуть із ХВГС. Менше за 15 % осіб із ХВГС знають про свій діагноз [3].
Відомо, що приблизно в 75 % хворих після гострого вірусного гепатиту розвивається хронічний вірусний гепатит, а протягом 2 десятиліть після зараження у 27 % розвивається цироз печінки, у 25 % — гепатоцелюлярна карцинома (ГЦК), причому річний ризик розвитку ГЦК у пацієнтів із цирозом становить приблизно 1–4 % [3].
Довгострокове ретроспективне когортне дослідження в японських пацієнтів із ХГС показало, що в нелікованих пацієнтів з F0/F1 щорічний ризик розвитку ГЦК становить 0,5 %, у пацієнтів із F4 — до 7,9 %. У систематичному огляді пацієнтів з ХГС в Азії, включно з Китаєм, 5-річне виживання в пацієнтів із цирозом, обумовленим ВГС, становило 73,8 %, але після прогресування до термінальної стадії захворювання печінки виживання падає до 39,2 %, тому потрібна трансплантація печінки. Дослідження, проведене в Шанхаї, показало, що в пацієнтів із GT3 відбувається більш швидке прогресування захворювання, у даних хворих у віці до 50 років відзначається значно більш виражений фіброз, ніж у хворих з не-GT3 [4].
Далі подані результати досліджень з ефективності противірусного лікування.
Відбуваються розробка, пошук різних препаратів і схем лікуванні хворих із хронічними вірусними гепатитами. В одному дослідженні були обстежені 304 пацієнти із ХВГС, із них 172 (56,6 %) мали цироз печінки. Ці хворі були проліковані за різними схемами, що включали інтерферони (ІНФ), препарати прямої противірусної дії (ПППД). Після лікування на 24-му тижні щільність печінки знизилася з 16,9 (11,8–27,7) кПа до 11,9 (8,2–20,9) кПа (P < 0,0001). Серед 304 пацієнтів у 198 (65,1 %) щільність печінки зменшилася щонайменше на 20 %. У той же час, незважаючи на зниження вихідної щільності печінки, у більше ніж половини пацієнтів із цирозом показники цирозу залишалися на тому ж рівні на 24-му тижні після лікування [5].
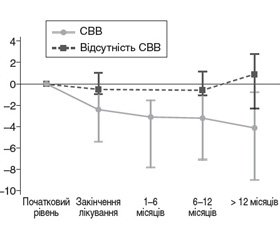
В іншому рандомізованому контрольованому дослідженні дорослих із ХВГС, проведеному у 2016 р., у якому хворі отримували противірусну терапію за допомогою противірусних препаратів прямої дії або на основі інтерферону, було встановлено: в осіб, які досягли стійкої вірусологічної відповіді (СВВ), щільність печінки знизилася: на 2,4 кПа в кінці терапії (95% довірчий інтервал (ДІ) від –1,7 до –3,0); на 3,1 кПа — через 1–6 міс. після терапії (95% ДІ від –1,6 до –4,7); на 3,2 кПа — через 6–12 міс. після терапії (95% ДІ від –2,6 до –3,9); на 4,1 кПа — через 12 міс. або більше після терапії (95% ДІ від –3,3 до –4,9); у той же час не було значної зміни щільності печінки в пацієнтів, які не досягли стійкої вірусологічної відповіді (через 6–12 місяців після терапії — зниження на 0,6 кПа; 95% ДІ від –1,7 до 0,5). Було встановлено, що зниження щільності печінки було значно більшим у пацієнтів, які отримували противірусні препарати прямої противірусної дії, ніж при терапії на основі ІНФ (зниження на 4,5 кПа проти зниження на 2,6 кПа; p = 0,03), за наявності цирозу печінки (на 5,1 кПа порівняно зі зниженням на 2,8 кПа у пацієнтів без цирозу; p = 0,02), при високому рівні АлАТ перед лікуванням (p < 0,01). Серед пацієнтів із вихідною щільністю печінки понад 9,5 кПа 47 % осіб (95% ДІ 27–68 %) після лікування досягли щільності печінки менше за 9,5 кПа. Аналіз підгруп за величиною зниження щільності печінки через 6–12 місяців після терапії в пацієнтів, які досягли стійкої вірусологічної відповіді, поданий у табл. 2 [6].
Динаміка щільності печінки з плином часу в пацієнтів із ВГС, які досягають стійкої вірусологічної відповіді, порівняно з пацієнтами, які не досягають СВВ, подана на рис. 1 [6].
В іншому дослідженні, у якому було проліковано 256 пацієнтів із ХВГС (121 (47,3 %) чоловік, середній вік 54 роки), 163 з них (63,7 %) були інфіковані генотипами 1, 4, 5, 6 і 93 (36,3 %) — генотипами 2 і 3. Із даної групи 108 (42,2 %) і 103 (40,2 %) особи отримували пегільований ІНФ із рибавірином протягом 24 і 48 тижнів відповідно і 45 (17,6 %) отримували терапію на основі препаратів прямої дії, з яких у 9 (20 %) додавався рибавірин. За даними METAVIR, у 93 (36,6 %) осіб був — F1, у 110 (43,3 %) — F2, у 29 (11,4 %) — F3, у 22 (8,7 %) — F4. Також було виявлено: у 43 (16,9 %) — A0, у 162 (63,8 %) — A1, у 44 (17,3 %) — A2, у 5 (2 %) — А3.
Після проведеного лікування 256 пацієнтів 150 (60,9 %) хворих досягли ранньої вірусологічної відповіді і 219 (85,5 %) досягли стійкої вірусологічної відповіді. Із 45 пацієнтів, які отримували терапію на основі ПППД, 44 (97,8 %) досягли СВВ. Зниження щільності печінки було більш вираженим на стадіях із більш вираженим фіброзом за METAVIR (F3 і F4), ніж при менш виражених стадіях (F1 і F2) у групі з СВВ або без СВВ. У цілому приблизно у 80 % було отримано зниження парних значень щільності печінки. Встановлено, що частка пацієнтів зі зниженням щільності вірогідно не відрізнялася між групами: із СВВ (80,8 %), рецидивами (77,8 %) і групою без відповіді (80,0 %) [7].
За даними Wei-Fan Hsu зі співавт. (2019), із 395 пацієнтів у 388 (98,2 %) осіб була досягнута стійка вірусологічна відповідь через 12 тижнів після противірусної терапії за допомогою ПППД. Індекс АсАТ/тромбоцити (APRI) знизився: з 1,19 (0,62–2,44) на початку дослідження до 0,50 (0,32–0,95) на 2-му тижні; до 0,51 (0,31–0,92) — 4-му тижні; до 0,48 (0,31–0,88) — у кінці терапії; до 0,52 (0,33–0,92) — на 12-му тижні після терапії (р < 0,001). Середнє значення FIB-4 знизилося: з 2,88 (1,56–5,60) на початку дослідження до 2,10 (1,30–3,65) на 2-му тижні; до 2,15 (1,30–3,65) — на 4-му тижні; до 2,11 (1,37–3,76) — у кінці терапії; до 2,22 (1,45–3,82) — на 12-му тижні після терапії (р < 0,001). Щільність печінки (за даними фіброскану) знизилася з 1,78 (1,25–2,30) до 1,38 (1,14–1,88) на 12-му тижні після терапії. Середній рівень АлАТ значно знизився з 2-го до 12-го тижня після терапії (р < 0,001). Кількість тромбоцитів значно збільшилася з 2-го тижня після початку противірусної терапії до 12-го тижня після терапії (р < 0,001); проте кількість тромбоцитів була зниженою. Автори дійшли висновку, що швидке зниження значень APRI і FIB-4 може бути переважно обумовлене зменшенням некрозапального процесу [8].
Також і Ya-Chao Tao зі співавт. (2018) встановили, що середні показники FIB-4 значно знизилися до 24-го тижня після завершення терапії як у пацієнтів із цирозом (з 6,51 до 3,44, р = 0,009), так і в пацієнтів без цирозу (з 2,84 до 1,44, р < 0,001). Показники APRI також знизилися у пацієнтів із цирозом (з 3,52 до 1,10; р = 0,003) і без цирозу (з 1,49 до 0,48; р < 0,001). Серед пацієнтів зі СВВ і рецидивом показник FIB-4 значно знизився порівняно з вихідним рівнем до 24-го тижня після завершення лікування в обох групах (з 3,399 до 1,863; р < 0,001, у пацієнтів із СВВ через 12 тижнів (СВВ12) і з 9,801 до 4,123; р = 0,002, у пацієнтів із рецидивами). Показник APRI знизився від 1,834 до 0,619 (р < 0,001) для пацієнтів зі СВВ12 і з 5,026 до 1,248 (р = 0,002) — у пацієнтів з рецидивами [9].
У дослідженні Masaru Enomoto зі співавт. (2018) за даними гістологічних досліджень у 20 пацієнтів із парної біопсією ступінь запалення значно регресував (р = 0,0043), але фіброз — ні (р = 0,45), також значно регресував ступінь накопичення заліза (р = 0,0093), але стеатоз — ні (р = 0,10). Хворі з ХВГС генотипу 1b отримували лікування: ледипасвір/софосбувір, даклатасвір/асунапревір, ельбасвір/гразопревір; а пацієнти з ХВГС генотипів 2a, 2b отримували: софосбувір/рибавірин. Контрольна біопсія проводилась через 44 ± 22 тижні після закінчення лікування [10].
Для порівняння з Україною далі наведені дані стосовно кількості пролікованих хворих противірусними препаратами з приводу ХВГС у країнах світу (табл. 3, 4) [11].
На рис. 2 наведені дані рекомендацій ВООЗ щодо алгоритму діагностики, лікування й моніторингу вірусного гепатиту С від 2018 року.
Коли починати лікування дорослих і підлітків?
ВООЗ рекомендує пропонувати лікування всім особам, у яких діагностовано інфекцію ВГС, віком від 12 років1 незалежно від стадії захворювання (cильна рекомендація, середня якість доказів).
Яке лікування застосовувати дорослим і підліткам?
ВООЗ рекомендує використовувати пангенотипні схеми з противірусними препаратами прямої дії для лікування осіб із хронічною ВГС-інфекцією віком від 18 років2 (умовна рекомендація, середня якість доказів).
Для лікування підлітків віком 12–17 років або вагою не менше за 35 кг із хронічною інфекцією ВГС ВООЗ рекомендує:
— софосбувір/ледипасвір протягом 12 тижнів для генотипів 1, 4, 5 і 6;
— софосбувір/рибавірин протягом 12 тижнів для генотипу 2;
— софосбувір/рибавірин протягом 24 тижнів для генотипу 3 (сильна рекомендація, дуже низька якість доказів).
Пангенотипні схеми, що зараз доступні для застосування дорослим віком від 18 років
Для лікування дорослих без цирозу можна застосовувати такі пангенотипні схеми:
— софосбувір/велпатасвір (не зареєстрований в Україні) — 12 тижнів;
— софосбувір/даклатасвір (Софген/Вірдак 60) — 12 тижнів;
— глекапревір/пібрентасвір (не зареєстровані в Україні) — 8 тижнів3.
Для лікування дорослих із компенсованим цирозом можна застосовувати такі пангенотипні схеми:
— софосбувір/велпатасвір (не зареєстрований в Україні) — 12 тижнів;
— глекапревір/пібрентасвір (не зареєстрований в Україні— 12 тижнів3;
— софосбувір/даклатасвір (Софген/Вірдак 60) — 24 тижні;
— софосбувір/даклатасвір (Софген/Вірдак 60) — 12 тижнів4.
Лікування дорослих пацієнтів противірусними препаратами прямої дії: вибір препаратів
ВООЗ рекомендує використовувати для лікування осіб із хронічною ВГС-інфекцією віком від 18 років пангенотипні схеми ПППД5 (сильна рекомендація, середній ступінь доказів).
ПППД розглядаються як пангенотипні, якщо вони забезпечують високу ефективність лікування за всіма шістьма основними генотипами ВГС.
Софосбувір/даклатасвір (Вірдак 60)
Даклатасвір, інгібітор NS5A, який було оцінено у комбінації з софосбувіром, був схвалений на рівні EMA у 2014 р. і FDA у 2015 р. Клінічні випробування показали високу ефективність комбінації даклатасвіру й софосбувіру проти інфекцій з генотипами 1–4 в осіб із некомпенсованим ураженням печінки, під час станів після трансплантації печінки й у разі коінфекції ВІЛ/ВГС. Нещодавно отримані дані демонструють, що комбінація софосбувір/даклатасвір є також ефективною проти інфекцій з генотипами 5 і 6 (демонстраційний проект організації «Лікарі без кордонів» [MSF]).
Пангенотипні ПППД у ВГС-інфікованих дорослих пацієнтів без цирозу печінки
Наявні на даний час пангенотипні ПППД для лікування ВГС-інфікованих осіб без цирозу печінки подано в табл. 6.
Докази ефективності пангенотипних ПППД при ВГС-інфекції
Систематичний огляд, виконаний на замовлення ВООЗ, виявив 142 клінічних дослідження, у яких оцінювалися безпека й ефективність різних схем ПППД, схвалених FDA та EMA. Ці схеми включали софосбувір/велпатасвір, глекапревір/пібрентасвір, софосбувір/даклатасвір, даклатасвір/асунапревір, елбасвір/гразопревір, ледипасвір/софосбувір, паритапревір/ритонавір/омбітасвір/дасабувір, софосбувір/рибавірин, софосбувір/велпатасвір/воксилапревір, софосбувір/даклатасвір/рибавірин.
Софосбувір/даклатасвір (Софген/Вірдак 60)
В об’єднаній групі пацієнтів, які раніше лікувалися або не лікувалися і які отримували терапію софосбувіром/даклатасвіром, зведені рівні СВВ перевищили 92 % для інфекції з генотипами 1, 2, 3 і 4. В одному з обсерваційних досліджень (публікація на стадії підготовки, демонстраційний проект MSF) наведені дані про менш широко описані генотипи 5 і 6. У цьому дослідженні вісім пацієнтів, інфікованих генотипом 5, і 123 пацієнти, інфіковані генотипом 6, отримували лікування із застосуванням схеми софосбувір/даклатасвір протягом 12 тижнів. Рівні СВВ становили 88 і 94 % відповідно.
Пангенотипні ПППД у ВГС-інфікованих дорослих пацієнтів із компенсованим цирозом печінки
Наявні на даний час пангенотипні ПППД для лікування ВГС-інфікованих осіб із компенсованим цирозом печінки подано в табл. 7.
Софосбувір/даклатасвір (Софген/Вірдак 60)
В об’єднаній групі пацієнтів, які раніше лікувалися або не лікувалися і які отримували терапію софосбувіром/даклатасвіром протягом 12 тижнів, зведені рівні СВВ перевищили 93 % для інфекції з генотипами 1 і 2. Рівні СВВ у випадку інфекції з генотипом 3 були низькими — від 79 % до 82 %. Однак після 24 тижнів лікування рівні СВВ підвищилися до 90 %. В одному з обсерваційних досліджень (публікація на стадії підготовки, демонстраційний проект MSF) наведені дані про генотипи 5 і 6, а в клінічних описах з Єгипту наведена інформація про генотип 4. В одного пацієнта із цирозом печінки й інфекцією генотипу 5, який отримував лікування софосбувіром/даклатасвіром протягом 12 тижнів, вдалося досягти СВВ. Серед 185 пацієнтів із цирозом печінки й інфекцією генотипу 6, які отримували софосбувір/даклатасвір протягом 12 тижнів, СВВ вдалося досягти в 92 % випадків. Особи з цирозом печінки й інфекцією генотипу 4 мали рівні СВВ, що перевищували 98 % після 12 тижнів лікування.
Моніторинг відповіді на лікування
У 2017 р. ВООЗ рекомендувала оцінювати СВВ через 12 тижнів після завершення курсу лікування ПППД з використанням полімеразної ланцюгової реакції на РНК ВГС.
Конфлікт інтересів. Не заявлений.
1. https://www.cdc.gov/hepatitis/global/index.htm
2. Falla A.M., Ahmad A.A., Duffell Е., Noori T., Veldhuijzen I.K. Estimating the scale of chronic hepatitis C virus infection in the EU/EEA: a focus on migrants from anti-HCV endemic countries. BMC Infect. Dis. 2018. Vol. 18. P42.
3. Han Ru, Zhou J., François С., Toumi М. Prevalence of hepatitis C infection among the general population and high-risk groups in the EU/EEA: a systematic review update. BMC Infect. Dis. 2019. Vol. 19. P. 655.
4. Xie Qing, Jian-Wei Xuan, Hong Tang, Xiao-Guang Ye, Peng Xu, I-Heng Lee, Shan-Lian Hu. Hepatitis C virus cure with direct acting antivirals: Clinical, economic, societal and patient value for China. World J. Hepatol. 2019. Vol. 11(5). P. 421-441.
5. Dolmazashvili E., Abutidze А., Chkhartishvili С., Karchava М., Sharvadze L., Tsertsvadze T. Regression of liver fibrosis over a 24-week period after completing direct-acting antiviral therapy in patients with chronic hepatitis C receiving care within the national hepatitis C elimination program in Georgia: results of hepatology clinic HEPA experience. Eur. J. Gastroenterol. Hepatol. 2017. Vol. 29(11). P. 1223-1230.
6. Siddharth Singh, Facciorusso А., Loomba R., Falck-Ytter Y.T. Magnitude and Kinetics of Decrease in Liver Stiffness After Anti-viral Therapy in Patients With Chronic Hepatitis C: A Systematic Review and Meta-analysis. Clin. Gastroenterol. Hepatol. 2018. Vol. 16(1). P. 27-38.
7. Chen Sheng-Hung, Lai Hsueh-Chou, Chiang I-Ping et al. Changes in liver stiffness measurement using acoustic radiation force impulse elastography after antiviral therapy in patients with chronic hepatitis C. PLoS One. 2018. Vol. 13(1). e0190455.
8. Hsu Wei-Fan, Lai Hsueh-Chou, Su Wen-Pang et al. Rapid decline of noninvasive fibrosis index values in patients with hepatitis C receiving treatment with direct-acting antiviral agents. BMC Gastroenterol. 2019. Vol. 19. P. 63.
9. Ya-Chao Tao, Deng Rong, Wang Meng-Lan et al. Satisfactory virological response and fibrosis improvement of sofosbuvir-based regimens for Chinese patients with hepatitis C virus genotype 3 infection: results of a real-world cohort study. Virol. J. 2018. Vol. 15. P. 150.
10. Enomoto M., Ikura Y., Tamori А. et al. Short-term histological evaluations after achieving a sustained virologic response to direct-acting antiviral treatment for chronic hepatitis C. United European Gastroenterol. J. 2018. Vol. 6(9). P. 1391-1400.
11. https://cdafound.org/just-12-countries-worldwide-on-track-to-eliminate-hepatitis-c-infection-by-2030-with-united-kingdom-italy-and-spain-among-those-joining-the-list/ ?platform=hootsuite

/11-1.jpg)
/11-2.jpg)
/12-2.jpg)
/12-1.jpg)
/13-1.jpg)
/14-1.jpg)
/15-1.jpg)