Журнал «Почки» Том 9, №1, 2020
Вернуться к номеру
Клінічна оцінка порушень мелатонінутворювальної функції епіфіза й анемії у хворих на хронічну хворобу нирок 5-ї стадії, які лікуються гемодіалізом
Авторы: Кондратюк В.Є., Петрова А.С., Карпенко О.В.
Національний медичний університет імені О.О. Богомольця МОЗ України, м. Київ, Україна
Рубрики: Нефрология
Разделы: Клинические исследования
Версия для печати
Актуальність. Результати низки наукових досліджень довели наявність взаємозв’язку між функціональним станом епіфіза та функцією нирок. Проте порушення мелатонінутворювальної функції епіфіза (МФЕ) у хворих на хронічну хворобу нирок (ХХН), які перебувають на гемодіалізі (ГД), та його зв’язок із розвитком анемії в даної когорти пацієнтів є маловивченим питанням. Мета: провести клінічну оцінку анемії у хворих на ХХН 5-ї стадії, які лікуються ГД, залежно від клініко-демографічних показників та визначити її зв’язок із порушенням МФЕ. Матеріали та методи. Обстежені 130 пацієнтів (50 % чоловіків) із ХХН 5-ї стадії, які перебувають на лікуванні гемодіалізом. З урахуванням рівня мелатоніну (МТ) у слині хворих, які лікуються ГД, розподілили на дві групи: група І — 110 хворих із порушеною МФЕ, група ІІ — 20 пацієнтів із нормальною МФЕ. Контрольну групу становили 20 здорових осіб, порівнянних за віком і статтю. Усім хворим проведені клініко-лабораторні дослідження: загальний і біохімічний аналізи крові з визначенням всіх показників обміну заліза крові, ліпідного профілю, вимірювання артеріального тиску, розрахунок індексу маси тіла, визначення концентрації МТ у слині в різні періоди доби та паратгормона. Результати. Виявлено значну поширеність порушення МФЕ у хворих на ХХН 5-ї стадії, які лікуються ГД, та його зв’язок із розвитком анемії. Аналіз циркадних рівнів МТ залежно від ступеня тяжкості анемії продемонстрував найглибші їх порушення в пацієнтів із середнім ступенем тяжкості анемії, при якому вірогідна різниця визначалася за рівнем МТ у нічний період (р = 0,004). Аналіз кореляційних зв’язків показав слабкий негативний кореляційний зв’язок між рівнем гемоглобіну (Нb) і тривалістю лікування ГД (r = –0,217; р < 0,05), що може свідчити про прогресування анемії при збільшенні стажу нирково-замісної терапії (НЗТ). Установлені позитивні кореляції між Нb і рівнем денного МТ (r = 0,193; р < 0,05) та більш тісні — із рівнем нічного МТ (r = 0,278; р < 0,05), що відображає взаємозв’язок між порушенням МФЕ і синтезом Нb. Продемонстровано негативний кореляційний зв’язок феритину з Нb (r = –0,31; р < 0,05), із рівнем сироваткового заліза (r = –0,202; р < 0,05) та рівнем трансферину (r = –0,234; р < 0,05). Негативний кореляційний зв’язок визначається між рівнем феритину і денним рівнем МТ у слині (r = –0,202; р < 0,05), та зв’язок середньої сили — з нічним рівнем МТ (r = –0,396; р < 0,05) у слині. При аналізі рівня трансферину визначалися позитивні кореляційні зв’язки останнього з денним рівнем МТ (r = –0,332; р < 0,05) та середні кореляційні зв’язки — з нічним (r = 0,447; р < 0,05). Визначався обернений слабкий кореляційний зв’язок трансферину зі стажем ГД (r = –0,191; р < 0,05). Висновки. Продемонстрована висока частота порушення МФЕ (84,6 %), що асоціюється зі значною поширеністю анемії та дефіциту заліза у хворих на ХХН 5-ї стадії, які перебувають на лікуванні гемодіалізом. У хворих на НЗТ установлений взаємозв’язок між ступенем дисфункції епіфіза та тяжкістю анемії, при цьому він посилюється зі зростанням терміну лікування гемодіалізом, тривалості АГ. У хворих на гемодіалізі концентрація феритину відображає активність запалення, що зростає при порушенні МФЕ. Дисфункція епіфіза й анемія мають вікзалежний характер: найбільш виражені в похилому віці.
Актуальность. Результаты ряда исследований доказали наличие взаимосвязи между функциональным состоянием эпифиза и функцией почек. Однако нарушение мелатонинобразующей функции эпифиза (МФЭ) у больных хронической болезнью почек (ХБП), находящихся на гемодиализе (ГД), и его связь с развитием анемии у данной популяции пациентов являются малоизученным вопросом. Цель: провести клиническую оценку анемии у больных ХБП 5-й стадии, которые лечатся ГД, в зависимости от клинико-демографических показателей и определить ее связь с нарушением МФЭ. Материалы и методы. Обследованы 130 пациентов (50 % мужчин) с ХБП 5-й стадии, находящихся на лечении гемодиализом. С учетом уровня мелатонина (МТ) в слюне больных, которые лечатся ГД, разделили на две группы: группа I — 110 больных с нарушенной МФЭ, группа II — 20 пациентов с нормальной МФЭ. Контрольную группу составили 20 здоровых лиц, сопоставимых по возрасту и полу. Всем больным проведены клинико-лабораторные исследования: общий и биохимический анализы крови с определением всех показателей обмена железа крови, липидного профиля, измерение артериального давления, расчет индекса массы тела, определение концентрации мелатонина в слюне в разные периоды суток и паратгормона. Результаты. Обнаружена значительная распространенность нарушения МФЭ у больных ХБП 5-й стадии, которые лечатся ГД, и его связь с развитием анемии. Анализ циркадных уровней МТ в зависимости от степени тяжести анемии продемонстрировал глубокие их нарушения у пациентов со средней степенью тяжести анемии, при котором достоверная разница определялась по уровню МТ в ночное время (р = 0,004). Анализ корреляционных связей показал слабую отрицательную корреляционною связь между уровнем гемоглобина (Нb) и продолжительностью лечения ГД (r = –0,217; р < 0,05), что может свидетельствовать о прогрессировании анемии при увеличении стажа почечно-заместительной терапии (ПЗТ). Установлены положительные корреляции между Нb и уровнем дневного МТ (r = 0,193; р < 0,05) и более тесные — с уровнем ночного МТ (r = 0,278; р < 0,05), что отражает взаимосвязь между нарушением МФЭ и синтезом Нb. Продемонстрирована отрицательная корреляционная связь ферритина с Нb (r = –0,31; р < 0,05), с уровнем сывороточного железа (r = –0,202; р < 0,05) и уровнем трансферрина (r = –0,234 р < 0,05). Отрицательная корреляционная связь определяется между уровнем ферритина и дневным уровнем МТ в слюне (r = –0,202; р < 0,05), связь средней силы — с ночным уровнем МТ (r = –0,396; р < 0,05). При анализе уровня трансферрина определялись положительные корреляционные связи последнего с дневным уровнем МТ (r = –0,332; р < 0,05) и средние корреляционные связи — с ночным (r = 0,447; р < 0,05). Определялась обратная слабая корреляционная связь трансферрина со стажем ГД (r = –0,191; р < 0,05). Выводы. Продемонстрирована высокая частота нарушения МФЭ (84,6 %), что ассоциируется со значительной распространенностью анемии и дефицита железа у больных ХБП 5-й стадии, находящихся на лечении ГД. У больных на ПЗТ установлена взаимосвязь между степенью дисфункции эпифиза и тяжестью анемии, при этом она усиливается с увеличением срока лечения ГД, продолжительности АГ. У больных на ГД концентрация ферритина отражает активность воспаления, возрастает при нарушении МФЭ. Дисфункция эпифиза и анемия имеют возрастзависимый характер: наиболее выражены в пожилом возрасте.
Background. The results of a number of studies have proved the relationship between the functional state of the pineal gland and renal function. However, violations of the melatonin-forming function (MFF) of the pineal gland in patients with chronic kidney disease (CKD) undergoing hemodialysis and its relationship with the development of anemia in this population is a poorly understood issue. The purpose: to conduct a clinical assessment of anemia in patients with stage 5 CKD who are treated with hemodialysis depending on clinical and demographic parameters, and to determine its correlation with the violation of MFF. Materials and methods. We examined 130 people (50 % of men) with stage 5 CKD undergoing hemodialysis treatment. Based on the level of melatonin in saliva, patients treated with hemodialysis were divided into two groups: group I — 110 individuals with impaired MFF, group II — 20 people with normal MFF. The control group included 20 healthy individuals matched for age and gender. All patients underwent clinical and laboratory studies: general and biochemical blood tests with determination of all indicators of blood iron metabolism, lipid profile, blood pressure measurement, body mass index calculation, evaluation of the salivary melatonin concentration at different periods of the day, as well as parathyroid hormone. Results. A significant prevalence of MFF disturbance was found in patients with stage 5 CKD, which are treated with hemodialysis, and its relationship with the development of anemia. Analysis of circadian melatonin levels depending on the severity of anemia demonstrated their profound impairment in patients with moderate severity of anemia, in which a significant difference was determined by the level of melatonin at night (p = 0.004). Correlation analysis showed a weak negative correlation between the level of hemoglobin and the duration of hemodialysis (r = –0.217; p < 0.05) that may indicate the progression of anemia with an increase in the duration of renal replacement treatment. Positive correlations were established between hemoglobin concentration and the level of daytime melatonin (r = 0.193; p < 0.05), and closer relationship — with the level of nighttime melatonin (r = 0.278; p < 0.05), which reflects the correlation between the violation of MFF and hemoglobin synthesis. A negative correlation was demonstrated between ferritin and hemoglobin level (r = –0.31; p < 0.05), as well as with serum iron concentration (r = –0.202; p < 0.05) and the level of transferrin (r = –0.234; p < 0.05). A negative correlation is determined between the level of ferritin and the daytime salivary melatonin (r = –0.202; p < 0.05), and the relationship of average strength — with salivary melatonin at night (r = –0.396; p < 0.05). When analyzing the level of transferrin, we determined the positive correlation of the latter with the daytime melatonin (r = –0.332; p < 0.05), and average correlation — with melatonin level at night (r = 0.447; p < 0.05). The inverse weak correlation was found between transferrin concentration and hemodialysis duration (r = –0.191; p < 0.05). Conclusions. A high frequency of MFF disturbance was demonstrated (84.6 %), which is associated with a significant prevalence of anemia and iron deficiency in patients with stage 5 CKD undergoing hemodialysis treatment. In people receiving renal replacement treatment, a relationship was established between the degree of pineal gland dysfunction and the severity of anemia; at that, it increases with an increase in the duration of hemodialysis treatment and the duration of hypertension. In hemodialysis patients, the concentration of ferritin reflects the activity of inflammation that increases with a violation of MFF. Pineal gland dysfunction and anemia have age-dependent nature: they are most severe in old age.
мелатонін; гемодіаліз; мелатонінутворювальна функція епіфіза; хронічна хвороба нирок; залізодефіцитна анемія
мелатонин; гемодиализ; мелатонинобразующая функция эпифиза; хроническая болезнь почек; железодефицитная анемия
melatonin; hemodialysis; melatonin-forming function of the pineal gland; chronic kidney disease; iron deficiency anemia
Вступ
Анемія у хворих на хронічну хворобу нирок (ХХН) є частим ускладненням, що супроводжує дану патологію на ранніх стадіях хвороби та стає більш вираженою з прогресуванням захворювання, досягаючи свого максимуму в популяції хворих на діалізі. Проведені міжнародні дослідження на підставі даних DOPPS продемонстрували наявність анемії у 23–77 % хворих на ХХН 5-ї стадії, які лікуються гемодіалізом (ГД). За даними United States Renal Data System (USRDS), частота анемії серед пацієнтів, які отримують нирково-замісну терапію (НЗТ), у США становить 58 % [1, 2].
За даними Національного реєстру хворих на ХХН станом на 2017 рік, в Україні у пацієнтів на НЗТ рівень гемоглобіну (Hb), нижчий за цільове значення, зафіксований у 51,7 % хворих на ГД та в 40,5 % хворих, які отримували лікування методом гемодіафільтрації (ГДФ) [3]. Найпоширенішими причинами анемії у хворих на НЗТ є зменшений синтез ендогенного еритропоетину, абсолютний або функціональний дефіцит заліза, запалення та низька комплаєнтність пацієнта [4]. Слід зауважити, що причинами анемії у хворих на ГД є періодичні крововтрати, обумовлені втратою крові в діалізному контурі, часті лабораторні дообстеження, а також неадекватний діаліз, гіперпаратиреоз, виснаження запасів заліза внаслідок застосування еритропоетинстимулюючих препаратів, порушення абсорбції гепсидину, дефіцит карнітину та вітамінів [5, 6].
Останнім часом все більшу увагу вчених привертає мелатонін (МТ) — гормон епіфіза, ритмам продукції якого підпорядковані всі ендогенні біоритми організму. МТ знижує утворення прозапальних цитокінів та запобігає процесам оксидативного стресу, котрий розвивається на тлі хронічної інтоксикації та запалення при ХХН [7, 8].
Проведені дослідження демонструють хронобіологічну дію МТ, що обумовлено нівелюванням порушень сну та покращенням метаболізму заліза в пацієнтів на ГД, що має важливе значення при лікуванні залізодефіцитної анемії [9]. Завдяки клінічним дослідженням останніх років доведено, що пацієнтам із ХХН притаманні запалення та високий рівень окислювального стресу, що призводить до деградації ниркової тканини та з часом до втрати функцій, а МТ, зі свого боку, має антиоксидантні, апоптозрегулюючі, протизапальні й імуномодулюючі ефекти [10–12]. Karien van der Putten, Birgit Koch et al. висловили гіпотезу щодо взаємозв’язку між ритмами утворення МТ, зниженням швидкості клубочкової фільтрації та циркадними змінами рівня ендогенного еритропоетину. Проте дана гіпотеза не є до кінця підтвердженою та потребує подальших досліджень [13].
Порушення мелатонінутворювальної функції епіфіза (МФЕ) у хворих на ХХН є маловивченим питанням та потребує глибокого дослідження, скринінгу та впровадження в практику нефролога, адже МТ бере участь у регуляції багатьох процесів, тому патогенетично обґрунтованою є корекція його рівнів, що може значно покращувати якість життя хворого на ХХН.
Мета дослідження: провести клінічну оцінку анемії у хворих на ХХН 5-ї стадії, які лікуються ГД, залежно від клініко-демографічних показників та визначити її взаємозв’язок із порушенням МФЕ.
Матеріали та методи
Нами проведено проспективне обсерваційне дослідження із залученням 130 хворих (чоловіки — 65, жінки — 65) із ХХН 5-ї стадії, які перебували на лікуванні ГД в умовах комунального некомерційного підприємства «Київський міський центр нефрології та діалізу». Середній вік обстежених хворих становив 58,5 (43; 66) року.
Критерії включення: вік старше 18 років, лікування ГД, тривалість НЗТ ≥ 3 місяців, тижневий діалізний час не менше 12 годин, показник ефективності адекватності гемодіалізу за eKt/v ≥ 1,4, потік крові на рівні 200–300 мл/хв, добровільна інформована письмова згода на участь у дослідженні, відсутність ендокринологічних, онкологічних, ревматологічних захворювань та гострих інфекційних процесів будь-якої етіології.
У дослідження також включені 20 здорових осіб (чоловіки —10, жінки — 10), які розглядалися як група контролю.
Дослідження виконані згідно з міжнародними стандартами щодо погодженої участі обстежених, етичної складової виконання досліджень та взяття біоматеріалу. Протокол дослідження схвалений комісією з питань біоетичної експертизи та етики наукових досліджень Національного медичного університету імені О.О. Богомольця (протокол № 112 від 31.05.2018 р.). Усі пацієнти надали письмову інформовану згоду на участь у дослідженні.
Під час дослідження всім пацієнтам виконувалось стандартне обстеження, що включало загальноклінічні, біохімічні та інструментальні методи дослідження. Біохімічні дослідження проводились у лабораторії біохімії київської міської клінічної лікарні № 3 (сертифікат визнання вимірювальних можливостей № ПТ-284/18 від 17.08.2018 чинний до 16.08.2020 р.). Обмін заліза (загальне залізо, феритин, сатурація трансферину, трансферин) визначався на анализаторі Vitalab Flexor Junior.
Концентрацію МТ визначали імуноферментним методом із використанням набору Human MS (Melatonin Sulfate) ELISA Kit, Elabscience. Забір матеріалу проводили в денний та нічний час, переважно у весняно-літній період, при мінімальному освітленні 30 lx. Використовували нестимульовану слину, що збирали в капсулу типу Eppendorf в об’ємі 1 мл, що заморожувалася та зберігалася при температурі –20 °С. Дослідження проводилося на базі Науково-дослідного інституту експериментальної та клінічної медицини Національного медичного університету імені О.О. Богомольця.
Цільовим вважали гемоглобін (Hb) на рівні 110–120 г/л, анемію діагностували при рівні Hb < 110 г/л [14]. Оптимальним вважали значення феритину на рівні 200–500 мкг/л, насичення трансферину залізом сироватки (%TSAT) — 30–40 %. Лікування анемії здійснювали згідно з Уніфікованим клінічним протоколом вторинної та третинної медичної допомоги «Лікування пацієнтів з хронічною хворобою нирок V стадії з анемією», затвердженим Наказом МОЗ України № 89 від 11.02.2016 року [15].
Демографічні дані та клінічна характеристика включених у дослідження хворих наведені в табл. 1.
За віковим розподілом серед пацієнтів із ХХН 5-ї стадії, які лікуються ГД, превалювали пацієнти середнього віку (44–60 років) — 39%, частка пацієнтів похилого віку (60–75 років) становила 32 %, найменше було пацієнтів молодого віку (25–44 роки) — 29 %.
Статистичну обробку отриманих результатів проведено за допомогою програми Microsoft Office Excel (2010) та IBM Statistics Spss 22. Неперервні дані представлені медіаною та міжквартильним розмахом (Me (Q25–Q75)), категоріальні виражені у відсотках (%). Для порівняння нормально розподілених даних використовували критерій Стьюдента, за невідповідності закону нормального розподілу застосовували непараметричний (U-критерій) Манна — Уїтні. Кореляційний зв’язок визначали за методами Пірсона (r) та Спірмена залежно від розподілу показників.
Результати та обговорення
При аналізі частоти порушення МФЕ у хворих на ХХН 5-ї стадії, які лікуються ГД, та практично здорових осіб звертають на себе увагу вірогідно нижчі показники МТ як у денний, так і у нічний час у хворих на НЗТ. У пацієнтів із ГД порівняно з групою контролю рівень МТ у денний період доби нижчий за 50,6 % (р < 0,001) та більш значно — у нічний період — на 84,2 % (р < 0,001) (рис. 1), що збігається з результатами інших досліджень, де продемонстровано взаємозв’язок порушення функції нирок із погіршенням МФЕ [7].
При аналізі анемії обстежуваних осіб виявлено відмінності між групою контролю та пацієнтами на НЗТ за рівнем Нb, загального сироваткового заліза, феритину та %TSAT. Пацієнти на ГД мають вірогідно нижчий рівень Нb на 36,6 % (р < 0,001), рівень загального заліза — на 53,2 % (р < 0,001), трансферину — на 23,5 % (р < 0,001) та нижчий рівень %TSAT і феритину — на 21,4 % (р = 0,04) (табл. 2).
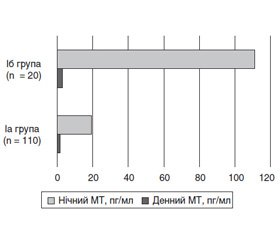
Під час аналізу показників МТ порушення МФЕ виявлено в більшості хворих на ХХН 5-ї стадії на ГД, що дало змогу розподілити хворих на дві групи: Іа група (основна) — хворі на ХХН 5-ї стадії на ГД з порушеною МФЕ (n = 110) та Іб група — хворі на ХХН 5-ї стадії на ГД з нормальною МФЕ (n = 20).
За добовим профілем МТ виявлено, що хворі основної групи порівняно з хворими групи порівняння мають вірогідно (обидва р < 0,001) нижчий рівень МТ у слині, що більш виражено в нічний період (на 82,4 %), ніж у денний (на 41,9 %) (рис. 2).
Хворі з порушеною МФЕ порівняно з хворими групи Іб вірогідно відрізнялися за тривалістю НЗТ: в Іа групі стаж ГД становив 11,5 (6; 14) року проти 7,5 (4,5; 11) року групи зі збереженою МФЕ (р = 0,01). Тривалість артеріальної гіпертензії у хворих із порушеною МФЕ становила 14,5 (8; 17) року проти 10 (6; 14) років (р = 0,04). Індекс маси тіла та окружність талії були більшими у хворих із порушеною МФЕ та становили 21,43 (20,3; 22,8) кг/м2 та 89 (80; 93) см проти 20 (19,84; 21,21) кг/м2 та 80 (77,5; 90) см відповідно (обидва р < 0,05). Значення офісного середнього систолічного та діастолічного тиску також вірогідно вищі в групи Іа та становили 158 (142; 162) мм рт.ст. і 90 (80; 96) мм рт.ст. проти 134 (130; 137) мм рт.ст. та 80 (70; 87) мм рт.ст. відповідно (обидва р < 0,001). Значення С-реактивного білка виявилися вищі в групі Іа та становили 18 (12; 24) г/л проти 5,5 (4,5; 8) г/л в групі Іб (р < 0,001). Рівень альбуміну хворих із порушеною МФЕ нижчий за показник групи Іб та становив 34 (32; 37) г/л проти 36 (35; 37) г/л (р = 0,006).
Аналіз на анемію у хворих на ХХН 5-ї стадії на ГД продемонстрував низькі показники Нb та обміну заліза, проте глибші ці зміни в пацієнтів із порушеною МФЕ, що може свідчити про зв’язок дисфункції епіфіза з прогресуванням анемії у хворих на НЗТ, що подано в табл. 3. Вірогідна різниця між основною групою та групою порівняння спостерігалась за значенням %TSAT.
Результат аналізу Нb та обміну заліза у хворих на ХХН 5-ї стадії на ГД за статевою ознакою продемонстрував вірогідну різницю лише за %TSAT. Так, у чоловіків його рівень становив 33,5 (26,42; 40,09) проти отриманого значення в жінок 29,3 (21,7; 34,65) (р < 0,05).
Наступним етапом роботи є аналіз порушення МФЕ у хворих основної групи залежно від віку, котрий виявив, що найбільш виражені порушення МФЕ притаманні хворим похилого віку. Результат показників рівня МТ хворих похилого віку порівняно з групою пацієнтів молодого віку нижчий як у нічний час (на 35 %), так і в денний (на 31,1 %). Рівень нічного МТ у пацієнтів похилого віку на 7 % нижчий за рівень МТ пацієнтів середнього віку, показник денного рівня МТ нижчий на 16,2 %. Аналіз рівня Нb та показників обміну заліза різних вікових груп продемонстрував найнижчий їх рівень у хворих із найглибшим порушеннями МФЕ, тобто в пацієнтів похилого віку. Так, рівень Нb хворих похилого віку на 8 % нижчий за результат хворих молодого віку та на 5,3 % — за значення пацієнтів середнього віку (табл. 4). Рівень трансферину осіб похилого віку на 5,2 % нижчий за значення осіб середнього віку та 1,5 % — за отриманий результат осіб молодого віку. Показник %TSAT у пацієнтів похилого віку на 9,1 % нижчий за результат осіб середнього віку та 3,7 % — за дані хворих молодого віку. Цікавим є аналіз отриманих результатів феритину, значення котрого найвищими визначалися в осіб похилого віку — на 41,9 % перевищував значення хворих молодого віку та на 2,8 % осіб середнього віку. Як відомо, феритин використовують у клінічній практиці як інструмент скринінгу для виявлення дефіциту заліза та залізодефіцитної анемії, проте, за результатами нещодавніх досліджень, наявність запалення в організмі різко збільшує синтез феритину і зменшує кількість доступного заліза [16]. Аналізуючи отримані результати, можна припустити, що в пацієнтів із дисфункцією епіфіза частіше діагностуються ознаки хронічного запалення, адже, як відомо, МТ має протизапальні властивості [17].
Для аналізу отриманих результатів залежно від стажу лікування гемодіалізом пацієнтів із ХХН 5-ї стадії на ГД розподілено на 3 групи: І група (n = 24) — лікування ГД від 1 до 5 років, ІІ група (n = 20) — лікування ГД від 5 до 10 років, ІІІ група (n = 66) — лікування ГД більше 10 років.
Варто зазначити, що в пацієнтів ІІІ групи рівень денного та нічного МТ у слині вірогідно нижчий за отримані результати груп І та ІІ (р < 0,05), що наведено на рис. 3.
Отримані результати свідчать про асоціацію тривалості лікуванні ГД та вираженості порушення МФЕ.
Найнижчий рівень Нb, загального заліза, трансферину та найвищий рівень феритину спостерігалися в групі з найбільшим стажем лікування ГД, що наведено в табл. 5.
Отримані дані свідчать про взаємозв’язок порушення МФЕ з тривалістю лікування НЗТ та їх вплив на рівень Нb та показники обміну заліза у хворих на ХХН 5-ї стадії, які лікуються ГД.
Аналіз циркадних рівнів МТ залежно від ступеня тяжкості анемії продемонстрував найглибші їх порушення в пацієнтів із середнім ступенем тяжкості анемії, що наведено в табл. 6. Вірогідною різниця визначалася за нічним рівнем МТ, що в групі хворих із середнім ступенем тяжкості анемії нижчий за аналогічний показник у групі хворих з анемією легкого ступеня на 7,3 % (р = 0,004).
Аналіз порушення МФЕ хворих на НЗТ, дав змогу визначити мінімальні та максимальні значення денного та нічного рівня МТ у слині, завдяки чому хворих розподілили на групи.
За денним рівнем МТ хворих розподілили на 3 групи: І група (n = 26): рівень денного МТ становив 2,6–3,9 пг/мл, ІІ група (n = 68): рівень денного МТ — 1,3–2,6 пг/мл, ІІІ група (n = 16): рівень денного МТ — < 1,3 пг/мл. Аналіз рівнів Нb та показників обміну заліза продемонстрував найнижчий рівень Нb та найвищий рівень феритину у хворих ІІІ групи, що наведено в табл. 7.
За рівнем нічного рівня МТ хворих також розподілили на 3 групи: І група (n = 9): рівень нічного МТ становив 39–49,1 пг/мл, ІІ група (n = 27): рівень нічного МТ — 26–39 пг/мл, ІІІ група, (n = 74): рівень нічного МТ 12,6–25 пг/мл. Аналіз даних рівня Нb продемонстрував найнижчі його значення у хворих із найглибшими порушеннями МФЕ. Так, рівень Нb ІІІ групи на 7,9 % нижчий за показник ІІ групи та на 5,7 % — за результат І групи. Цікаві отримані результати з обміну заліза: найнижчий рівень %TSAT та найвище значення феритину визначалися у хворих ІІІ групи, що наведено в табл. 8.
Аналіз кореляційних зв’язків продемонстрував слабкий негативний кореляційний зв’язок рівня Нb із тривалістю лікування ГД (r = –0,217; р < 0,05), що може свідчити про прогресування анемії зі збільшенням стажу НЗТ.
Установлено позитивний кореляційний зв’язок Нb із рівнем денного МТ (r = 0,193; р < 0,05) та більш тісний — із рівнем нічного МТ (r = 0,278; р < 0,05), що свідчить про взаємозв’язок МФЕ з Нb, що подано на рис. 4.
Аналіз даних продемонстрував обернений кореляційний зв’язок між феритином і Нb (r = –0,31; р < 0,05), рівнем сироваткового заліза (r = –0,202; р < 0,05) та рівнем трансферину (r = –0,234; р < 0,05). Слабкий обернений кореляційний зв’язок визначається між рівнем феритину і денним рівнем МТ (r = –0,202; р < 0,05) та зв’язок середньої сили з нічним рівнем МТ (r = –0,396; р < 0,05) у слині, що подано на рис. 5. Це збігається з результатами інших досліджень, в яких продемонстровано, що наявність запалення різко збільшує синтез феритину та зменшує кількість доступного заліза. Механізмом дисоціації рівня феритину та запасів заліза в організмі є посилення синтезу гепсидину [18] за участю запальних та протизапальних цитокінів [19], а МТ, як відомо, має протизапальні, антиоксидантні, імуномодулюючі й антистресові властивості [20].
При аналізі рівня трансферину визначалися позитивні кореляційні зв’язки останнього з денним (r = –0,332; р < 0,05) та кореляційні зв’язки середньої сили — із нічним (r = 0,447; р < 0,05) рівнем МТ. Установлений від’ємний кореляційний зв’язок між рівнем трансферину та стажем ГД (r = –0,191; р < 0,05).
Висновки
Продемонстрована висока частота порушення МФЕ (84,6 %), що асоціюється зі значною поширеністю анемії та дефіциту заліза, у хворих на ХХН 5-ї стадії, які перебувають на лікуванні гемодіалізом. У хворих на НЗТ установлений взаємозв’язок між ступенем дисфункції епіфіза та тяжкістю анемії, при цьому він посилюється зі зростанням терміну лікування гемодіалізом, тривалості АГ. У хворих на гемодіалізі концентрація феритину відображає активність запалення, що зростає при порушенні МФЕ. Дисфункція епіфіза та анемія мають вікзалежний характер: найбільш виражені в похилому віці.
Перспективи подальших досліджень. Можливість корекції функції епіфіза в пацієнтів з анемією та ХХН 5-ї стадії є патогенетично обґрунтованою та потребує подальшого вивчення, що буде представлено в наступних повідомленнях.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Участь авторів у підготовці статті: В.Є. Кондратюк — науковий керівник проєкту, розробка наукової ідеї, дизайну дослідження, редагування статті; А.С. Петрова — основний виконавець, пошук літератури, збір матеріалу, відбір хворих, статистична обробка даних, написання статті; О.В. Карпенко — аналіз даних.
1. Pisoni R.L. Anemia management and outcomes from 12 countries in the Dialysis Outcomes and Practice Patterns Study (DOPPS). Am. J. Kidney Dis. 2004. № 44. P. 94-111.
2. U.S. Renal Data System, USRDS 2013 Annual Data Report: Atlas of Chronic Kidney Disease and EndStage Renal Disease in the United States, National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases, Bethesda, MD, 2013.
3. Колеснік М.О. Національний реєстр хворих на хронічну хворобу нирок та пацієнтів з гострим пошкодженням нирок: 2017 рік. Уклад. Н.І. Козлюк, С.С. Ніколаєнко, О.О. Разважаєва; ДУ «Інститут нефрології НАМН України», Київ, 2018. 183 с.
4. Sica D.A., Mannino R. Antihypertensive Medications and Anemia. The Journal of Clinical Hypertension. 2007. 9. Р. 723-727.
5. Besarab A. Optimization of epoetin therapy with intravenous iron therapy in hemodialysis patients. J. Am. Soc. Nephrol. 2000. № 11. P. 530-538.
6. Zaritsky J. et al. Hepcidin — a potential novel biomarker for iron status in chronic kidney disease. Clin. J. Am. Soc. Nephrol. 2009. № 4. P. 1051-1056.
7. Labonia W., Rubio D., Arias C. Melatonin corrects reticuloendothelial blockade and iron status in haemodialysed patients. Article in Nephrology. 2005. 10(6).
8. Кондратюк В.Є., Петрова А.С., Карпенко О.В. Характеристика мелатонінутворювальної функції епіфізу і пацієнтів з хронічною хворобою нирок у термінальній стадії. Клінічна ендокринологія та ендокринна хірургія. 2019. 4(68). С. 94-102.
9. Hrenak J., Paulis L., Repova K. et al. Melatonin and Renal Protection: Novel Perspectives from Animal Experiments and Human Studies (review ). Curr. Pharm. 2014. Р. 936-949.
10. Russcher M., Koch B., Nagtegaal E. et al. The role of melatonin treatment in chronic kidney disease. Front. Biosci. (Landmark Ed). 2012. № 17. Р. 2644-2656.
11. Li D.Y., Smith D.G., Hardeland R., Yang M.Y., Xu H.L., Zhang L., Yin H.D., Zhu Q. Melatonin receptor genes in vertebrates. Int. J. Mol. Sci. 2013. 14(6). Р. 11208-11223.
12. Liu J., Clough S.J., Hutchinson A.J., Adamah-Biassi E.B., Popovska-Gorevski M., Dubocovich M.L. MT1 and MT2 melatonin receptors: a therapeutic perspective. Annu. Rev. Pharmacol. Toxicol. 2016. 56. Р. 361-383.
13. van der Putten K., Koch B., van Someren E., Wielder J., Wee P.T., Nagtegaal E., Gaillard C. The role of renal function loss on circadian misalignment of cytokines EPO, IGF-1, IL-6 and TNF-alfa in chronic renal disease. Neuroendocrinology Letters. 2011. № 32(2). P. 148-153.
14. Icardi A., Paoletti E., De Nicola L., Mazzaferro S., Russo R., Cozzolino M. Renal anaemia and EPO hyporesponsiveness associated with vitamin D deficiency: the potential role of inflammation. Nephrol. Dial. Transplant. 2013. Р. 1672-9.
15. Лікування хворих на хронічну хворобу нирок V ГД стадії. Адаптована клінічна настанова, заснована на доказах, та уніфіковані клінічні протоколи. Kиїв: Поліграф Плюс, 2016. 228 с.
16. Weiss G., Goodnough L.T. Anemia of chronic disease. N. Engl. J. Med. 2005. №. 352. Р. 1011-1023.
17. Nabavi S.M., Nabavi S.F., Sureda A., Xiao J. et al. Anti-inflammatory effects of Melatonin: A mechanistic review. Crit. Rev. Food Sci. Nutr. 2019. 59(Suppl. 1). Р. 4-16.
18. Ashby D.R., Gale D.P., Busbridge M. Plasma hepcidin levels are elevated but responsive to erythropoietin therapy in renal disease. Kidney International. 2009. № 75. Р. 976-981.
19. Wei Peng, Mengtong Lei, Jun Zhang, Yong Zhang. The protective effect of melatonin on the in vitro development of yak embryos against hydrogen peroxide-induced oxidative injury. Cambridge University Press, 2019. Р. 118-125.
20. Reiter R.J., Tan D.X., Korkmaz A., Rosales-Corral S.A. Melatonin and stable circadian rhythms optimize maternal, placental and fetal physiology. Hum. Reprod. Update. 2014. 20(2).Р. 293-307.

/33-1.jpg)
/33-2.jpg)
/34-2.jpg)
/34-1.jpg)
/35-2.jpg)
/35-1.jpg)
/36-1.jpg)
/36-2.jpg)
/37-1.jpg)