Журнал «Актуальная инфектология» Том 8, №2, 2020
Вернуться к номеру
Место азитромицина при лечении инфекционных заболеваний у детей
Авторы: Крамарев С.А., Закордонец Л.В.
Национальный медицинский университет имени А.А. Богомольца, г. Киев, Украина
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
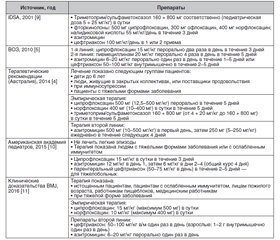
Азитроміцин залишається одним із найбільш призначуваних антибіотиків у світі при лікуванні інфекцій дихальних шляхів, шлунково-кишкового тракту, урогенітального тракту і шкіри. В останні роки відзначається зростання резистентних до антибіотиків штамів серед збудників інфекційних хвороб. Азитроміцин вигідно відрізняється від більшості антибіотиків багатогранністю дії, яка, крім антимікробної активності, включає протизапальний та імуномодулюючий ефекти, що забезпечує високу клінічну ефективність препарату при лікуванні гострих і хронічних інфекцій. У статті представлені дані міжнародних рекомендацій щодо лікування інфекційної діареї різної етіології, хвороби Лайма, коклюшу. Азитроміцин рекомендується як препарат вибору для емпіричної і селективної терапії основних бактеріальних кишкових інфекцій у дітей, для етіотропного лікування коклюшу, хвороби Лайма.
Азитромицин остается одним из наиболее часто назначаемых антибиотиков в мире при лечении инфекций дыхательных путей, желудочно-кишечного тракта, урогенитального тракта и кожи. В последние годы отмечается рост резистентных к антибиотикам штаммов среди возбудителей инфекционных болезней. Азитромицин выгодно отличается от большинства антибиотиков многогранностью действия, которое, кроме антимикробной активности, включает противовоспалительный и иммуномодулирующий эффекты, что обеспечивает высокую клиническую эффективность препарата при лечении острых и хронических инфекций. В статье представлены данные международных рекомендаций по лечению инфекционной диареи различной этиологии, болезни Лайма, коклюша. Азитромицин рекомендуется в качестве препарата выбора для эмпирической и селективной терапии основных бактериальных кишечных инфекций у детей, для этиотропного лечения коклюша, болезни Лайма.
Azithromycin remains one of the most prescribed antibiotics in the world for the treatment of infections of the respiratory system, gastrointestinal tract, urogenital system and skin. In recent years, there has been an increase in antibiotic-resistant strains among pathogens of infectious diseases. Azithromycin compares favorably with most antibiotics by its multifaceted action, which, in addition to antimicrobial activity, includes anti-inflammatory and immunomodulating effects that ensures high clinical efficacy of the drug in the treatment of acute and chronic infections. The article presents data of international recommendations for the treatment of infectious diarrhea of various etiologies, Lyme disease, pertussis. Azithromycin is recommended as the drug of choice for empirical and selective therapy of major bacterial intestinal infections in children, for the etiotropic treatment of pertussis, Lyme disease.
азитроміцин; інфекції; лікування
азитромицин; инфекции; лечение
azithromycin; infections; treatment
Инфекционная диарея
Болезнь Лайма
Коклюш
Заболевания дыхательных путей
1. Wang P., Yang J., Yang Y. et al. Effect of azithromycin in combination with simvastatin in the treatment of chronic obstructive pulmonary disease complicated by pulmonary arterial hypertension. Pak. J. Med. Sci. 2017. 33 (2). 260-264. doi: 10.12669/pjms.332.1171.
2. Wouters E., Groenewegen K., Dentener M. et al. Systemic inflammation in chronic obstructive pulmonary disease. Proc. Am. Thorac. Soc. 2007. 4 (8). 626-634. doi: 10.1513/pats.200706-071T.
3. Shane A.L., Mody R.K., Crump J.A. et al. Infectious Diseases Society of America Clinical Practice Guidelines for the –Diagnosis and Management of Infectious Diarrhea. Clin. Infect. Dis. 2017 Nov 29. 65 (12). 1963-1973.
4. Williams P.C.M., Berkley J.A. Guidelines for the treatment of dysentery (shigellosis): a systematic review of the evidence. Paediatr. Int. Child Health. 2018 Nov. 38 (Suppl. 1). S50-S65.
5. World Health Organization Pocket book of hospital care for children. 2nd ed. Geneva: WHO; 2013.
6. Das S.K., Ahmed S., Ferdous F., Farzana F.D., Chisti M.J., Latham J.R., Talukder K.A., Rahman M., Begum Y.A., Qadri F., Faruque A.S., Ahmed T. Etiological diversity of diarrhoeal disease in Bangladesh. J. Infect. Dev. Ctries. 2013 Dec 15. 7 (12). 900-9.
7. Fluoroquinolones-resistant Shigella species in Iranian children: a meta-analysis. World J. Pediatr. 2019 Oct. 15 (5). 441-453. doi: 10.1007/s12519-019-00263-1. Epub 2019 Jun 1.
8. Darton T., Thanh Tuyen H., Chung The H. et al. Azithromycin resistance in Shigella spp. in Southeast Asia. Antimicrob. Agents Chemother. 27 Mar 2018. Vol. 62. № 4. Р. e01748-17.
9. Guerrant T., Steiner T., Thielman N. et al. Practice guidelines for the management of infectious diarrhea. Clin. Infect. Dis. 2001. 32. 331-350.
10. Kimberlin M., Jackson M., Long S. et al. Shigellosis. Red Book: report of the committee on infectious diseases. 30th ed. Elk. Grove Village (IL): American Academy of Pediatrics, 2015. Р. 706-709.
11. Keshav A., Acheson D., Allerberger F. et al. BMJ best practice: Shigella infection. 2016. [Online]. http. //bestpractice.bmj.com.acs.hcn.com.au/best-practice/monograph-pdf/1174.pdf
12. Phoebe C.M., Williams A., Berkley J.A. Guidelines for the management of paediatric cholera infection: a systematic review of the evidence. Paediatr. Int. Child Health. 2018. 38 (Suppl. 1). S16-S31.
13. Cholera. eTG complete [Internet]. Melbourne: Therapeutic Guidelines Limited; [revised November 2014], 2015.
14. Green M., Sack D., Alam N. et al. Cholera. Br. Med. J. Best Practice. 2017. Available from: http. //bestpractice.bmj.com/best-practice/monograph/451.html
15. Centers for Disease Control and Prevention Recommendations for the use of antibiotics for the treatment of cholera. 2015. Available from: http. //www.cdc.gov/cholera/treatment/antibiotic-treatment.html
16. Guerrant R.L., Van Gilder T., Steiner T.S. et al. Practice guidelines for the management of infectious diarrhea. Clin. Infect. Dis. 2001. 32. 331-351. 10.1086/318514
17. World Gastroenterology Guidelines Acute diarrhoea in adults and children. 2012. Available from: http. //www.worldgastroenterology.org/guidelines/global-guidelines/acute-diarrhea/acute-diarrhea-english
18. Siddique A.K., Nasim S.M.A. Guidelines for operating makeshift treatment centres in cholera epidemics. ICDDR. B. Cent. Popul. Heal. Res. 1997. Available from: http. //dspace.icddrb.org/jspui/bitstream/123456789/4021/1/ICDDRBSpecialPub-61.pdf
19. Zhan Z., Xu X., Gu Z., Meng J., Wufuer X., Wang M., Huang M., Chen J., Jing C., Xiong Z., Zeng M., Liao M., Zhang J. Molecular epidemiology and antimicrobial resistance of invasive non-typhoidal Salmonella in China, 2007–2016. Infect. Drug Resist. 2019 Sep 12. 12. 2885-2897. doi: 10.2147/IDR.S210961. eCollection 2019.
20. Vlieghe E., Phe T., De Smet B., Veng C., Kham C., Bertrand S., Vanhoof R., Lynen L., Peetermans W., Jacobs J. Azithromycin and Ciprofloxacin Resistance in Salmonella Bloodstream Infections in Cambodian Adults. PLoS Neglected Tropical Diseases. 2012. Vol. 6. № 12. Р. e1933.
21. Hassing R.-J., Goessens W.H., van Pelt W. et al. Salmonella Subtypes with Increased MICs for Azithromycin in Travelers Returned to the Netherlands. Emerging Infectious Diseases. 2014. Vol. 20. № 4. Р. 705-708.
22. Mukherjee P., Ramamurthy T., Mitra U., Mukhopadhyay A. Emergence of high-level azithromycin resistance in Campylobacter jejuni isolates from pediatric diarrhea patients in Kolkata, India. Antimicrobial agents and chemotherapy. 2014. Vol. 58. № 7. Р. 4248.
23. Wormser G.P., Dattwyler R.J., Shapiro E.D., Halperin J.J., Steere A.C., Klempner M.S., Krause P.J., Bakken J.S., Strle F., Stanek G., Bockenstedt L., Fish D., Dumler J.S., Nadelman R.B. The clinical assessment, treatment, and prevention of lyme disease, human granulocytic anaplasmosis, and babesiosis: clinical practice guidelines by the Infectious Diseases Society of America. Clin. Infect. Dis. 2006 Nov. 43 (9). 1089-134.
24. Cameron D.J., Johnson L.B., Maloney E.L. Evidence assessments and guideline recommendations in Lyme disease: the clinical management of known tick bites, erythema migrans rashes and persistent disease. Expert Rev. Anti-infect. Ther. 2014 Sep. 12 (9). 1103-35.
25. AWMF Guideline of the German Dermatology Society, Working Group for Dermatological Infectiology; Cutaneous Manifestations of Lyme Borreliosis http. //www.derma.de/fileadmin/derma/pdfs/ll_kutane_lyme_borreliose.pdf
26. Fingerle Volker, Hunfeld Klaus-Peter, Huppertz Hans-Iko et al. Cutaneous Lyme borreliosis: Guideline of the German Dermatology Society Heidelore Hofmann. Ger. Med. Sci. 2017. 15. 14.
27. The National Institute for Health and Care Excellence. Lyme disease. NICE guideline [NG95] 2018. https. //www.nice.org.uk/guidance/ng95/chapter/Recommendations#management
28. Paul E. Kilgore, Abdulbaset M. Salim, Marcus J. Zervos, Heinz-Josef Schmitt. Pertussis: Microbiology, Disease, Treatment, and Prevention. Clinical Microbiology Reviews. July 2016. Vol. 29. № 3.
29. Guidelines for the Public Health Management of Pertussis. London, 2018. https. //assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/762766/Guidelines_for_the_Public_Health_management_of_Pertussis_in_England.pdf
30. Centers for Disease Control and Prevention. Recommended antimicrobial agents for the treatment and postexposure prophylaxis of pertussis: 2005 CDC guidelines. MMWR. 2005. 54 (№ RR-14).
31. Chang P.V., Hao L., Offermanns S., Medzhitov R. The microbial metabolite butyrate regulates intestinal macrophage function via histone deacetylase inhibition. Proc. Natl. Acad. Sci USA. 2014. 111. 2247-2252. doi: 10.1073/pnas.1322269111
32. Donde S., Mishra A., Kochhar P. Azithromycin in acute bacterial upper respiratory tract infections: an Indian non-interventional study. Indian Journal of Otolaryngology and Head and Neck Surgery: Official Publication of the Association of Otolaryngologists of India. 07 Jan 2012. 66 (Suppl. 1). 225-230.
33. Hum S.W., Shaikh K.J., Musa S.S., Shaikh N. Adverse Events of Antibiotics Used to Treat Acute Otitis Media in Children: A Systematic Meta-Analysis. J. Pediatr. 2019 Dec. 215. 139-143.e7.
34. Катосова Л.К., Лазарева А.В., Хохлова Т.А. Распространение и механизмы устойчивости к макролидам Streptococcus pyogenes, выделенных у детей. Антибиотики и химиотерапия. 2016. Т. 61. № 3–4. С. 23-29.
35. Beigelman A., Mikols C.L., Gunsten S.P. et al. Azithromycin attenuates airway inflammation in a mouse model of viral bronchiolitis. Respir. Res. 2010. Vol. 11. P. 90.
36. Esposito S., Cohen R., Domingo J.D. et al. Antibiotic therapy for pediatric community-acquired pneumonia: do we know when, what and for how long to treat? Pediatr. Infect. Dis. J. 2012. Vol. 31. P. 78-85.
37. Bradley J.S., Byington C.L., Shah S.S. et al. The management of community-acquired pneumonia in infants and children older than 3 months of age: clinical practice guidelines by the Pediatric Infectious Diseases Society and the Infectious Diseases Society of America. Clin. Infect. Dis. 2011. Vol. 53. P. 25-76.
38. Le Saux N., Robinson J.L. Canadian Paediatric Society for Infectious Diseases. Uncomplicated pneumonia in healthy Canadian children and youth: practice points for management. Pediatr. Child Health. 2015. Vol. 20. P. 441-450.
39. Starner T.D., Shrout J.D., Parsek M.R. et al. Subinhibitory concentrations of azithromycin decrease nontypeable haemophilus influenzae biofilm formation and diminish established biofilms. Antimicrob Agents Chemother. 2008. 1 (52). 137-145. doi: 10.1128/AAC.00607-07
40. Yueqin Cao, Shurui Xuan, Yunhui Wu, Xin Yao. Effects of long-term macrolide therapy at low doses in stable COPD. Int. J. Chron. Obstruct. Pulmon. Dis. 2019. 14. 1289-1298.
41. Зупанец И., Безуглая Н., Либина В. и др. Оценка взаимозаменяемости Азимеда: биоэквивалентность доказана! Ліки України. 2013. Т. 1. C. 57-60.

/12.jpg)
/13.jpg)
/14.jpg)
/16.jpg)