Архив офтальмологии Украины Том 8, №1, 2020
Вернуться к номеру
Особливості оклюзій судин сітківки після кардіохірургічних втручань із використанням штучного кровообігу
Авторы: Риков С.О., Венедіктова О.А., Могилевський С.Ю.
Національна медична академія післядипломної освіти імені П.Л. Шупика МОЗ України, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
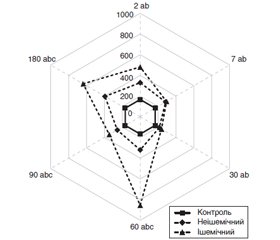
Актуальність. Незважаючи на високу ефективність кардіологічних операцій з використанням штучного кровообігу (ШК), досить часто виникають ускладнення з боку центральної нервової системи й органа зору. До останніх належить оклюзія судин сітківки, зокрема центральної вени (ЦВС) або її гілок. Метою даного дослідження було встановити особливості оклюзій судин сітківки після кардіохірургічних втручань із застосуванням ШК. Матеріали та методи. У дослідження відібрані дані 137 очей (126 пацієнтів, основна група) з оклюзією ЦВС або її гілок, що виникла після операції з ШК протягом 180 днів. У контролі (18 очей; 9 пацієнтів) оклюзії судин сітківки за вказаний період не було. Типи оклюзій вен сітківки (неішемічний і ішемічний) оцінювались згідно з міжнародною класифікацією S. Bloom і А. Brucker (1991). Статистичну обробку даних проводили з використанням програми Statistica 10 (StatSoft, Inc., USA). Результати. Неішемічний тип був встановлений у 96 (70,0 %) випадках оклюзії, ішемічний — у 41 (30,0 %). За віком і статтю різниці між цими пацієнтами не було, співвідношення чоловіків і жінок становило 1 : 1. Частота оклюзії гілок ЦВС переважала над частотою оклюзії ЦВС у співвідношенні 5 : 1. За анатомічною локалізацією переважала верхньотемпоральна оклюзія (58,33 % при неішемічному типі, 65,85 % — при ішемічному). При ішемічному типі переважала оклюзія гілок 1-го порядку (87,88 %), а при неішемічному поряд з нею відмічені оклюзії гілок ЦВС 2-го (34,18 %) і 3-го (12,66 %) порядків. За наявності оклюзії всі показники оптичної когерентної томографії були вищими за контрольні (p < 0,05), що відображало розвиток набряку сітківки й більшою мірою було виражене при ішемічному типі починаючи з 30–60 діб спостереження. Дискримінантний аналіз показав, що тип оклюзії визначали вік, нижча гострота зору, порядок оклюзії гілок ЦВС і збільшення об’єму сітківки за даними оптичної когерентної томографії. Регресійна модель прогнозу типу оклюзії за гостротою зору, порядком оклюзії гілок ЦВС і віком мала точність 82,5 %. Висновки. У даному дослідженні подано клінічну характеристику неішемічного й ішемічного типу оклюзії вен сітківки, виявлених упродовж 180 діб після кардіохірургічних втручань із ШК, і показані різні механізми її формування на ранніх і пізніх термінах.
Актуальность. Несмотря на высокую эффективность кардиологических операций с использованием искусственного кровообращения (ИК), достаточно часто возникают осложнения со стороны ЦНС и органа зрения. К последним относится и окклюзия сосудов сетчатки, в частности центральной вены (ЦВС) и ее ветвей. Целью данного исследования было установить особенности окклюзий ЦВС и ее ветвей после кардиохирургических вмешательств с применением ИК. Материалы и методы. В исследование отобраны данные 137 глаз (126 пациентов, основная группа) с окклюзией ЦВС или ее ветвей после операций с ИК. В контроле (18 глаз; 9 пациентов) окклюзии сосудов сетчатки не было. Пациенты осматривались офтальмологом после кардиохирургического вмешательства на протяжении 180 дней. Типы окклюзий вен сетчатки (неишемический и ишемический) оценивали согласно международной классификации S. Bloom и А. Brucker (1991). Статистическую обработку проводили с использованием программы Statistica 10 (StatSoft, Inc., USA). Результаты. Неишемический тип был установлен в 96 (70,0 %) случаях окклюзии, ишемический — в 41 (30,0 %). По возрасту и полу разницы между этими пациентами не было, соотношение мужчин и женщин составило 1 : 1. Частота окклюзии ветвей ЦВС преобладала над частотой окклюзии ЦВС в соотношении 5 : 1. По анатомической локализации преобладала верхнетемпоральная окклюзия (58,33 % — при неишемическом типе, 65,85 % — при ишемическом). При ишемическом типе преобладала окклюзия ветвей 1-го порядка (87,88 %), а при неишемическом типе кроме нее отмечены окклюзии ветвей ЦВС 2-го (34,18 %) и 3-го (12,66 %) порядков. При наличии окклюзии все показатели оптической когерентной томографии были выше контрольных (p < 0,05), что отражало развитие отека сетчатки и в большей степени было выражено при ишемическом типе начиная с 30–60 суток наблюдения. Дискриминантный анализ показал, что тип окклюзии определяли возраст, меньшая острота зрения, порядок окклюзии ветвей ЦВС и увеличение объема сетчатки по данным оптической когерентной томографии. Регрессионная модель прогноза типа окклюзии по остроте зрения, порядку окклюзии ветвей ЦВС и возрасту имела точность 82,5 %. Выводы. В данном исследовании представлена клиническая характеристика неишемического и ишемического типа окклюзии вен сетчатки, выявленных в течение 180 суток после кардиохирургических вмешательств с ИК, и показаны различные механизмы ее формирования на ранних и поздних сроках.
Background. Despite the high efficiency of cardiac surgeries using artificial circulation, complications in the central nervous system and the organ of vision are quite often. The latter include retinal vascular occlusion, in particular of central retinal vein or its branches. The purpose of this study was to establish the clinical features of retinal vascular occlusion after cardiac surgeries using artificial circulation. Materials and methods. The study materials were 137 eyes (126 patients, the main group) with occlusion of the central retinal vein or its branches after cardiac surgery with artificial circulation. In the control group (18 eyes; 9 patients), there was no retinal occlusion. Patients were examined by an ophthalmologist within 180 days after cardiac surgery. The types of retinal vein occlusion (non-ischemic and ischemic) were evaluated according to the international classification of S. Bloom and A. Brucker (1991). Statistical data processing was performed using Statistica 10 (StatSoft, Inc., USA). Results. Non-ischemic type was detected in 96 (70.0 %) cases of occlusion, ischemic type — in 41 (30.0 %). There were no differences in terms of age and gender between these patients; the male/female ratio was 1 : 1. The frequency of occlusion of central retinal vein branches exceeded the incidence of central retinal vein occlusion — the ratio was 5 : 1. In terms of anatomic localization, the upper temporal occlusion dominated (58.33 % for non-ischemic type and 65.85 % — for ischemic). In the ischemic type, occlusion of the branches of the first order (87.88 %) was predominant, and in the non-ischemic type, the occlusions of the branches of the second (34.18 %) and third (12.66 %) orders were also noted. In the presence of occlusion, all optical coherence tomography parameters were higher than that of controls (p < 0.05), which reflected the development of retinal edema and was more pronounced in the ischemic type starting from 30–60 days. Discriminant analysis showed that the type of occlusion was determined by age, lower visual acuity, the order of occlusion of the central retinal vein branches and increased retinal volume according to optical coherence tomography. The regression model for the prediction of occlusion type by visual acuity, the order of occlusion of central retinal vein branches and age had an accuracy of 82.5 %. Conclusions. This study provided a clinical description of the non-ischemic and ischemic types of retinal vein occlusion detected within 180 days after cardiac surgery with artificial circulation and showed the possibility of different mechanisms of its formation in the early and late terms.
оклюзії судин сітківки; кардіохірургічні операції; штучний кровообіг; ускладнення
окклюзии сосудов сетчатки; кардиохирургические операции; искусственное кровообращение; осложнения
retinal vascular occlusion; cardiac surgeries; artificial circulation; complications
Вступ
Матеріали та методи
Результати та обговорення
/63.jpg)
Висновки
1. Коваленко В.М., Корнацький В.М. Регіональні медико-соціальні проблеми хвороб системи кровообігу. Динаміка та аналіз: аналітично-статистичний посібник. К., 2013. 239 с.
2. Риков С.О., Венедіктова О.А. Оклюзії судин сітківки після кардіохірургічних втручань з використанням штучного кровообігу. Архів офтальмології України. 2018. 2. 32-38.
3. Риков С.О., Венедіктова О.А. Оклюзії судин сітківки після кардіохірургічних втручань: 6 місяців спостереження. Архів офтальмології України. 2018. 3. 32-36.
4. Nenekidis I., Pournaras C., Tsironi E., Tsilimingas N. Vision impairment during cardiac surgery and extracorporeal circulation: current understanding and the need for further investigation. Acta Ophthalmologica. 2012. 90(3). 168-72.
5. Rainio A., Hautala N., Pelkonen O. Risk of retinal microembolism after off-pump and on-pump coronary artery bypass surgery. J. Cardiovasc. Surg (Torino). 2007. 48. 773-9.
6. Nuttall G., Garrity J. Risk factors for ischaemic opticneuropathy after cardiopulmonary bypass: a matched case /control study. Anesth. Analg. 2001. 93. 1410-6.
7. Rogers S., McIntosh R.L., Cheung N., Lim L., Wang J.J., Mitchell P. International Eye Disease Consortium. The prevalence of retinal vein occlusion: Pooled data from population studies from the United States, Europe, Asia, and Australia. Ophthalmology. 2010. 117. 313-9.
8. Cugati S., Wang J.J., Rochtchina E., Mitchell P. Ten-year incidence of retinal vein occlusion in an older population: the Blue Mountains Eye Study. Arch. Ophthalmol. 2006 May. 124(5). 726-32.
9. Астахов Ю.С., Тульцева С.Н.. Окклюзии вен сетчатки: методические рекомендации. СПб.: Эко-Вектор, 2017. 82 с.
10. Park S., Choi N., Seo K., Park K., Woo S. Nationwide incidence of clinically diagnosed central retinal artery occlusion in Korea, 2008 to 2011. Ophthalmology. 2014. 121(10). 1933-8.
11. Shapira O., Kimmel W., Lindsey P., Shahian D. Anterior ischemic optic neuropathy after open heart operations. Ann. Thorac. Surg. 1996. 61. 660-6.
12. Paunel-Görgülü A., Wacker M., El Aita M., Hassan S., Schlachtenberger G., Deppe A., Choi Y.H., Kuhn E., Mehler T.O., Wahlers T. cfDNA correlates with endothelial damage after cardiac surgery with prolonged cardiopulmonary bypass and amplifies NETosis in an intracellular TLR9-independent manner. Sci Rep. 2017 Dec 12. 7(1). 17421. doi: 10.1038/s41598-017-17561-1.
13. Brettner F., Chappell D., Schwartz L., Lukasz A., Kümpers P., Becker B.F., Reichart B., Rehm M., Bruegger D. Vascular Endothelial Dysfunction during Cardiac Surgery: On-Pump versus Off-Pump Coronary Surgery. Eur. Surg. Res. 2017. 58(5-6). 354-368. doi: 10.1159/000480431.
14. Feng J., Liu Y., Singh A.K., Ehsan A., Sellke N., Liang J., Sellke F.W. Effects of diabetes and cardiopulmonary bypass on expression of adherens junction proteins in human peripheral tissue. Surgery. 2017 Mar. 161(3). 823-829. doi: 10.1016/j.surg.2016.08.057.
15. Jongman R.M., Zijlstra J.G., Kok W.F., van Harten A.E., Mariani M.A., Moser J., Struys M.M., Absalom A.R., Molema G., Scheeren T.W., van Meurs M. Off-pump CABG surgery reduces systemic inflammation compared with on-pump surgery but does not change systemic endothelial responses: a prospective randomized study. Shock. 2014 Aug. 42(2). 121-8. doi: 10.1097/SHK.0000000000000190.
16. Warren O.J., Smith A.J., Alexiou C., Rogers P.L., Jawad N., Vincent C., Darzi A.W., Athanasiou T. The inflammatory response to cardiopulmonary bypass: part 1 — mechanisms of pathogenesis. J. Cardiothorac. Vasc. Anesth. 2009 Apr. 23(2). 223-31. doi: 10.1053/j.jvca.2008.08.007.
17. Rossaint J., Berger C., Van Aken H., Scheld H.H., Zahn P.K., Rukosujew A., Zarbock A. Cardiopulmonary bypass during cardiac surgery modulates systemic inflammation by affecting different steps of the leukocyte recruitment cascade. PLoS One. 2012. 7(9). e45738. doi: 10.1371/journal.pone.0045738.

/62.jpg)
/63_2.jpg)
/64.jpg)
/64_2.jpg)