Антинейтрофильные цитоплазматические антитела (АНЦА)-ассоциированные васкулиты (AAВ) представляют собой гетерогенную группу системных некротизирующих васкулитов с преимущественным поражением сосудов мелкого калибра [1]. Более 90 % пациентов с AAВ имеют циркулирующие АНЦА [2]. AAВ включают гранулематоз с полиангиитом (ГПА), микроскопический полиангиит (МПА) и эозинофильный гранулематоз с полиангиитом (ЭГПА) [1]. Несколько значительных исследований за последние два десятилетия гармонизировали и оптимизировали лечение AAВ, которые ранее считались смертельными заболеваниями. С имплементацией терапии глюкокортикоидами (ГК) и циклофосфамидом (ЦФ) летальность от ААВ значительно снизилась, однако опасения касались кумулятивной токсичности этих агентов и проблем ведения хронического рецидивирующего заболевания. В результате недавних высокодоказательных клинических исследований появились более эффективные и безопасные схемы индукционной и поддерживающей терапии.
В этом обзоре литературы мы провели сравнение 4 международных руководств по менеджменту пациентов с ААВ, опубликованных на английском языке: 1) Британского общества ревматологов (BSR) и Британского общества специалистов, оказывающих помощь в области ревматологии (BHPR) (2014) [3]; 2) Канадской исследовательской группы по изучению васкулитов CanVasc (2015) [4]; 3) Европейской антиревматической лиги (EULAR)/Европейской почечной ассоциации — Европейской ассоциации диализа и трансплантации (ERA-EDTA) (2016) [5], разработанных международной целевой группой EULAR, ERA и Европейским обществом по изучению васкулитов (EUVAS); 4) Бразильским обществом ревматологов (SBR) (2017), которое предоставило рекомендации только по индукционной терапии ААВ [6] (табл. 1).
/57.jpg)
В США нет опубликованных рекомендаций, но представители Американского колледжа ревматологов внесли вклад в создание рекомендаций EULAR/ERA-EDTA. Сила рекомендаций и выводов, сделанных BSR/BHPR, EULAR/ERA-EDTA и CanVasc, базируется на категориях доказательств рабочей группы по разработке, оценке и экспертизе степени обоснованности клинических рекомендаций [7] — от A (наивысший уровень) до D (наименьший). Наша цель состояла в том, чтобы определить точки соприкосновения между рекомендациями и выделить различия между ними, а также ознакомить широкую врачебную общественность с данными рекомендациями.
Диагностика ААВ
CanVasc и EULAR/ERA-EDTA рекомендуют по возможности проводить биопсию ткани при постановке диагноза системного васкулита и поражения почек; EULAR/ERA-EDTA рекомендует проведение биопсии на стартовом диагностическом этапе и при рецидиве. BSR/BHPR и CanVasc особо отмечают, что тестирование АНЦА должно проводиться при помощи реакции непрямой иммунофлуоресценции и твердофазного иммуноферментного анализа; BSR/BHPR рекомендуют проводить тестирование на АНЦА также при рецидиве, при смене терапии, каждые 6 месяцев во время лечения и ежегодно при отсутствии лечения. Исследования только при помощи реакции непрямой иммунофлуоресценции недостаточны для диагностики AАВ из-за способности аутоантител, отличных от протеиназы 3 (ПР-3) и миелопероксидазы (МПО), иметь сходную картину окрашивания. В новом международном консенсусном заявлении по тестированию АНЦА при подозрении на AAВ рекомендуется провести первоначальное тестирование при помощи иммуноферментного анализа для ПР-3-АНЦА и МПО-АНЦА, что заменяет тестирование реакцией непрямой иммунофлуоресценции [8].
Классификация заболеваний
Все 4 руководства делят пациентов на тех, кто имеет и не имеет жизнеугрожающие поражения органов. CanVasc и EULAR дифференцируют эти группы пациентов как с тяжелыми и нетяжелыми проявлениями. Определения этих двух категорий несколько различаются. Например, CanVasc определяет тяжелое заболевание как «наличие жизнеугрожающих поражений органов, включая тяжелое и прогрессирующее поражение почек; тяжелое альвеолярное кровотечение; значительные поражения желудочно-кишечного тракта, сердца, центральной нервной системы и/или глаз; или любые другие проявления, которые считаются достаточно серьезными, чтобы потребовать индукционного лечения с помощью ЦФ или ритуксимаба (РТК)» [4]. В отличие от этого, BSR/BHPR определяет пациентов с нетяжелыми проявлениями заболеваний как «те, у кого нет признаков повреждения органов, которые могут рассматриваться для терапии индукции ремиссии с помощью метотрексата (MTХ) или мофетила микофенолата (MMФ)», а все остальные пациенты должны быть отнесены к группе с тяжелым заболеванием и лечиться ЦФ или РТК [4]. В дополнение к этим категориям CanVasc предлагает использование 5-факторной оценки прогноза ЭГПА и МПА.
Индукция ремиссии при тяжелых заболеваниях
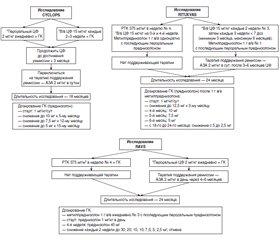
Рекомендации по индукции ремиссии, представленные в 4 руководствах, обобщены в табл. 2. Протоколы трех основных исследований, используемые для индукционной терапии, приведены на рис. 1. ЦФ в качестве препарата выбора для индукции ремиссии получил оценку класса A во всех 4 рекомендациях. Предпочтение для внутривенного (в/в) ЦФ в BSR/BHPR основано на результатах исследования CYCLOPS (циклофосфамид пероральный по сравнению с пульс-терапией) [9], в котором продемонстрировано более низкое кумулятивное воздействие в/в ЦФ, как и в других рандомизированных контролируемых исследованиях [10]. EULAR/ERA-EDTA также одобрили в/в ЦФ из-за низкого накопительного индекса токсичности и из-за снижения риска осложнений ЦФ-ассоциированного поражения мочевого пузыря [11].
/58.jpg)
/59.jpg)
Однако SBR и CanVasc рекомендуют либо пероральный ЦФ, либо в/в пульс-терапию ЦФ. А CanVasc отмечает потенциальную более низкую частоту рецидивов при длительном назначении перорального ЦФ. Стандартная дозировка перорального ЦФ составляет 2 мг/кг в день (максимум 200 мг/сут), а дозировка для в/в ЦФ составляет 15 мг/кг (максимум 1,2 г/пульс) с 3-кратным введением с интервалом в 2 недели, а затем один раз в/в каждые 3 недели в течение от 3 до 6 месяцев (CYCLOPS) [9].
РТК обычно рекомендуется в качестве альтернативы ЦФ для терапии индукции ремиссии ААВ. BSR/BHPR (рекомендация уровня B) и EULAR/ERA-EDTA (рекомендация класса A) предлагают РТК в качестве альтернативы терапии первой линии без особых ограничений, хотя EULAR отмечает, что данные остаются самыми слабыми среди пациентов с ЭГПА. SBR также рекомендует РТК в качестве альтернативы, подчеркивая особую роль этого агента у пациентов, которым ЦФ противопоказан или не является предпочтительным для сохранения фертильности или других проблем, или у пациентов с рецидивирующим заболеванием. Рекомендации CanVasc являются наиболее ограничительными в этом вопросе и определяют РТК в качестве терапии индукции ремиссии первой линии только у пациентов с тяжелым ГПА/МПА, которым ЦФ противопоказан и/или не является предпочтительным. Ни одно из руководств не представляет указаний или инструкций против применения РТК в качестве препарата для индукционного лечения первой линии. В качестве основных недостатков широкого использования РТК приводятся ограничения доступа и/или стоимости.
ГК являются обязательной частью индукционной терапии пациентов с ААВ. Пациентам с тяжелым заболеванием изначально можно назначать в/в пульс-терапию метилпреднизолоном. Все инструкции указывают на ограничение преимуществ в/в метилпреднизолона. BSR/BHPR рекомендуют пульс-терапию 250–500 мг метидпреднизолоном до или одновременно с первыми двумя инфузиями ЦФ. CanVasc и SBR советуют использовать в/в метилпреднизолон 500–1000 мг/сут в течение 3 дней с последующим переходом на пероральные формы. CanVasc дает рекомендацию класса B, а SBR — класса C для использования в/в метилпреднизолона. EULAR не дает конкретных инструкций по использованию в/в метилпреднизолона.
Пациентам следует начинать прием перорального преднизолона в дозе от 0,5 до 1 мг/кг в день с максимальной дозой 60–80 мг/день, с последующим снижением. В CanVasc обсуждаются протоколы снижения дозы преднизолона согласно исследованию RAVE (ритуксимаб для АНЦА-ассоциированного васкулита) [12, 13] и RITUXVAS (ритуксимаб против циклофосфамида при АНЦА-ассоциированном васкулите) [14], и рекомендуется, чтобы доза преднизолона составляла 1 мг/кг в день в течение максимум 1 месяца с постепенным снижением и корректировкой дозы в зависимости от клинического течения заболевания (рекомендация класса C) (рис. 1).
/60.jpg)
EULAR/ERA-EDTA рекомендуют снижать преднизолон до целевой дозы 10–15 мг в день к 12-й неделе лечения. BSR рекомендует более быстрое снижение преднизолона: до 15 мг/сут на 12-й неделе. SBR, наоборот, предлагает «медленный режим» уменьшения преднизолона, с начальной суточной дозой от 0,5 до 1,0 мг/кг в день (максимум 80 мг/сут) в течение от 1 до 4 недель и последующим снижением на 10 мг каждые 2–4 недели до 20 мг/сут. После этого предлагается уменьшать дозу на 2,5–5,0 мг каждые 2–4 недели до полной отмены. Начальная стартовая доза преднизолона получила рекомендацию класса B во всех руководствах, тогда как режим снижения ГК имеет класс C от CanVasc и BSR/BHPR и класс D — от SBR.
Что касается продолжительности ГК-терапии при ААВ, в руководствах имеются различия. CanVasc заявляет, что низкодозированные ГК должны быть частью начальной поддерживающей стратегии, и отмечает, что пока недостаточно доказательств для подтверждения оптимальной продолжительности низкодозированной терапии преднизолоном. EULAR не дает рекомендаций по продолжительности ГК. SBR указывает, чтобы продолжительность терапии ГК составляла не менее 6 месяцев, а в некоторых случаях она может составлять до 1 или 2 лет. У пациентов с рецидивирующим заболеванием может быть необходима более длительная продолжительность приема ГК (рекомендация класса A в BSR/BHPR и класса B — в BSR).
CanVasc заявляет, что плазмаферез может быть приемлемой адъювантной терапией для пациентов, у которых, несмотря на продолжающуюся индукционную терапию ремиссии высокими дозами ГК плюс ЦФ или РТК, происходит ухудшение состояния вследствие активного васкулита. Однако нет достаточных данных для окончательных рекомендаций включения плазмафереза в качестве терапии первой линии у любого пациента с ААВ (рекомендация класса D).
BSR/BHPR и EULAR/ERA-EDTA одобряют использование плазмафереза вместе с ЦФ и ГК у пациентов с тяжелой почечной недостаточностью с сывороточным креатинином > 500 ммоль/л (рекомендация класса B) или с опасными для жизни проявлениями, например такими, как легочное кровотечение (рекомендация класса С). SBR высказывается за проведение плазмафереза вместе с ГК и ЦФ у пациентов с сывороточным креатинином > 5,8 мг/дл (рекомендация класса A) и отмечает, что нет достаточных доказательств в поддержку плазмафереза для лечения пациентов с ААВ, которые имеют альвеолярное кровоизлияние (табл. 3) [15].
/61.jpg)
Исследование PEXIVAS, результаты которого обнародованы в 2020 г., показало отсутствие преимуществ использования плазмафереза при АНЦА-ассоциированном васкулите [16]. Добавление плазмафереза к стандартной терапии не снижало риск смертности от всех причин или терминальной стадии почечной недостаточности у пациентов с тяжелым ААВ. Исследование также продемонстрировало, что режим быстрого снижения дозы ГК не уступал стандартному протоколу приема, но снижал риск серьезных инфекций. Пациенты в группах с уменьшенной дозой (первая) и стандартной дозой (вторая) ГК получали идентичное лечение в течение первой недели, в начале второй недели доза гормонов в первой группе была снижена приблизительно на 50 %, а во второй — снижалась постепенно начиная с 3-й недели. Через 6 месяцев суммарная доза пероральных ГК в группе с уменьшенной дозой составляла менее 60 % от дозы в группе со стандартной терапией. Через 22 недели обе группы получали 5 мг преднизолона в день до 52-й недели. Однако выводы этого исследования еще не включены ни в одни рекомендации.
Индукция ремиссии при нетяжелом течении ААВ
Метотрексат и мофетила микофенолат
Как правило, пациентам с нетяжелым заболеванием и без жизнеугрожающих поражений органов рекомендуется более мягкий режим лечения, чем применение ЦФ или РТК. BSR/BHPR и EULAR рекомендуют системные ГК с метотрексатом или ММФ (рекомендация класса B для МТХ и рекомендация класса C для MMФ), тогда как CanVasc и SBR рекомендуют только ГК с МТХ (рекомендация класса A). В руководящих принципах EULAR/ERA-EDTA подчеркивается, что нетяжелые и нежизнеугрожающие поражения имеют различные значения для определения прогноза, перечислены специфические поражения органов, когда использование МТХ нецелесообразно.
Все руководства рекомендуют корректировать дозу МТХ в зависимости от скорости клубочковой фильтрации (СКФ). EULAR/ERA-EDTA заявляют, что МТХ можно использовать при отсутствии поражения почек; BSR/BHPR утверждают, что МТХ не следует использовать у пациентов с поражением почек средней или тяжелой степени тяжести (рекомендация класса B). CanVasc указывает на необходимость скорректировать дозу МТХ, когда СКФ составляет 50–80 мл/мин/м2, рассмотреть альтернативную терапию при СКФ < 50 мл/мин/м2 и избегать использования МТХ в случае СКФ < 10 мл/мин/м2. SBR высказывается за уменьшение дозы МТХ на 50 % у пациентов с СКФ 10–50 мл/мин/м2 и избегание использования при СКФ < 10 мл/мин/м2 (рекомендация класса D).
Пациенты с нетяжелым ЭГПА или МПА без поражения почек
CanVasc заявляет, что лечение пациентов с нетяжелым ЭГПА или МПА без поражения почек должно проводиться только ГК. Приводятся 2 исследования из французской исследовательской группы по васкулитам, которые показали, что только ГК вызывали ремиссию у значительной части пациентов: 93 % пациентов с ЭГПА [17] и 79 % пациентов с МПА или узелковым полиартериитом [18], хотя были отмечены значительные рецидивы. В этих исследованиях пациентам, у которых ГК были неэффективными или развивался рецидив, назначали азатиоприн (АЗА) или ЦФ, оба из которых проявили свою эффективность. Ни одно из других руководств не рекомендует использование только ГК при ведении пациентов с нетяжелым течением ААВ.
Терапия поддержания ремиссии
В табл. 4 представлены общие и отличительные положения между рекомендациями касательно терапии поддержания ремиссии и рецидивов при ААВ.
Популяции пациентов
Для пациентов с тяжелой формой AAВ, которые находятся в состоянии ремиссии после успешной индукционной терапии с помощью ГК + ЦФ, во всех руководствах рекомендуется поддерживающая терапия как обязательный следующий шаг терапии. Исключением являются рекомендации SBR, где представлена только индукционная терапия. CanVasc — это единственное руководство, в котором конкретно обсуждаются пациенты, которые получают ГК + РТК в качестве индукционной терапии, утверждая, что пока нет достаточных доказательств для рекомендации какого-либо конкретного подхода для последующей терапии.
Выбор поддерживающей терапии
EULAR/EUVAS определяют ремиссию как полное отсутствие клинической активности заболевания, включая васкулитные и гранулематозные проявления, независимо от того, получают пациенты иммуносупрессивную терапию или нет. EULAR/ERA-EDTA рекомендуют использовать низкие дозы ГК в сочетании с АЗА, РТК, МТХ или MMФ (в порядке предпочтения) для поддержания ремиссии. Использование этих агентов для поддержания ремиссии получило рекомендацию класса A для ГПА и МПА и класса C — для ЭГПА.
Лефлуномид был рекомендован в качестве терапии второй линии поддержания ремиссии из-за побочных эффектов, упомянутых EULAR/ERA-EDTA. BSR/BHPR и CanVasc рекомендуют использовать низкие дозы ГК в сочетании с АЗА или МТХ в качестве терапии первой линии для поддержания ремиссии (рекомендация класса A), MMФ (рекомендация класса C в BSR/BHPR и рекомендация класса B в CanVasc) или лефлуномид (рекомендация класса B в BSR/BHPR и CanVasc). Лефлуномид используют в качестве альтернативы при непереносимости, невосприимчивости или противопоказаниях к AЗA и МТХ. РТК также рекомендуется в качестве альтернативного средства в BSR/BHPR (рекомендация класса C). Руководство CanVasc пояснило, что нет никаких убедительных доказательств для принятия решений относительно поддерживающей терапии после индукции ремиссии с помощью РТК. Сообщество рекомендует использовать РТК в качестве альтернативы АЗА для терапии поддержания ремиссии у ПР-3-АНЦА-положительных пациентов (рекомендация класса А).
Продолжительность поддерживающей терапии
BSR/BHPR и EULAR рекомендуют по меньшей мере 24 месяца иммуносупрессивной терапии после успешной индукции ремиссии (BSR/BHPR — рекомендация класса B и EULAR — рекомендация класса D), тогда как CanVasc предлагает по меньшей мере 18 месяцев поддерживающей терапии, после чего лечение прекращается по усмотрению врача в соответствии с индивидуальными характеристиками, толерантностью к лечению и оценкой/пониманием риска рецидива у пациентов (рекомендация класса C).
Тем не менее пациенты с ПР-3-ААВ имеют более высокую вероятность рецидива [13], им обычно рекомендуют более длительный курс поддерживающей терапии (согласно EULAR — 36 месяцев; согласно BSR/BHPR — до 5 лет). BSR/BHPR — единственное руководство, представляющее рекомендации по продолжительности приема РТК для поддерживающей терапии: каждые 4–6 месяцев в течение 2 лет (рекомендация класса B). CanVasc — единственное руководство, которое акцентирует внимание на отсутствии достаточного количества доказательных исследований для определения оптимальной продолжительности ГК-терапии.
CanVasc также рассматривает применение триметоприма/сульфаметоксазола (TMП/СMК) в качестве адъюванта к иммунодепрессантам или после прекращения иммуносупрессивной терапии у пациентов с ГПА (рекомендация класса C).
Отмена терапии
BSR/BHPR рекомендуют рассмотреть снижение дозы ГК у пациентов с длительностью ремиссии в течение не менее 1 года на поддерживающей терапии. После отмены ГК другая иммуносупрессивная терапия может быть прекращена через 6 месяцев (рекомендация класса D). Положения руководств EULAR, CanVasc и SBR не дают никаких рекомендаций относительно отмены иммуносупрессивного лечения.
Лечение рефрактерного заболевания
BSR/BHPR, EULAR и CanVasc предоставляют рекомендации для лечения рефрактерного заболевания, в то время как SBR не рассматривает это состояние вообще. Во всех руководствах подчеркивается, что пациентов с рефрактерной болезнью следует госпитализировать в специализированный центр по лечению васкулитов. Определение рефрактерного ААВ отличается в разных руководствах. EULAR определяет рефрактерное заболевание как неизмененную или повышенную активность заболевания после 4 недель соответствующей терапии ЦФ + ГК; отсутствие ответа, определяемое как снижение показателя активности заболевания менее чем на 50 % после 4–6 недель лечения; или хроническое персистирующее заболевание, определяемое как наличие по меньшей мере 1 основного или 3 второстепенных элементов в шкале Бирмингемского индекса активности васкулитов (BVAS), несмотря на 8 недель лечения.
CanVasc определяет рефрактерное заболевание как неизмененное или ухудшающееся, несмотря на 6 недель соответствующей терапии индукции ремиссии, или наличие постоянной активности заболевания после 3 месяцев соответствующей терапии. BSR/BHPR определяют рефрактерное заболевание как прогрессирующее заболевание, которое не реагирует на текущую терапию, рекомендуют искать причины резистентного заболевания и пересмотреть клинический диагноз. EULAR и CanVasc также рекомендуют убедиться в правильности диагноза, исключить альтернативные инфекционные и/или неопластические причины.
Ритуксимаб и циклофосфамид
Пациенты с тяжелым ААВ, у которых терапия индукции ремиссии препаратами первого ряда ЦФ + ГК не увенчалась успехом, должны получать РТК (BSR/BHPR — рекомендация класса A, EULAR и CanVasc — рекомендация класса C). CanVasc подчеркивает необходимость перехода на РТК для пациентов с тяжелым ГПА и МПА, но отмечает, что для пациентов с ЭГПА такая терапия является менее доказательной. Поскольку все больше пациентов получают РТК в качестве терапии первой линии, EULAR отмечает, что те, кто получил РТК без эффекта, должны поменять его на ЦФ (рекомендация C).
Другие методы лечения рефрактерного заболевания
Существует ряд других экспериментальных методов лечения при рефрактерном ААВ. В/в иммуноглобулин (ИГ) рекомендуется в качестве адъювантной терапии при резистентных ААВ (BSR/BHPR, EULAR и CanVasc — рекомендация класса C). BSR/BHPR и CanVasc отмечают возможность использования алемтузумаба при рефрактерном течении болезни (рекомендация класса D). Другие агенты, предлагаемые для использования при рефрактерном AAВ согласно BSR/BHPR, включают гусперимус и лефлуномид. BSR/BHPR и CanVasc рекомендуют не использовать этанерцепт (ингибитор фактора некроза опухоли) из-за повышенного риска инфицированности и потенциального риска малигнизации (рекомендация класса А). CanVasc и BSR/BHPR рекомендуют к применению меполизумаб для рефрактерного ЭГПА.
Лечение рецидива заболевания
Тяжелый рецидив
Лечение рецидива проводится аналогично стартовому индукционному лечению и, как правило, включает применение высоких доз ГК, РТК или ЦФ (уровень A — BSR/BHPR, EULAR/ERA-EDTA и CanVasc), причем в случае рецидива РТК является более предпочтительным агентом. В исследовании RAVE [12] среди подгрупп пациентов с рецидивом РТК превосходил ЦФ по эффективности через 6 и 12 месяцев, но разница не была значимой через 18 месяцев.
CanVasc рекомендует использовать РТК преимущественно у пациентов, которые получали ЦФ для начальной терапии индукции ремиссии или предыдущего обострения заболевания. EULAR/ERA-EDTA одобрили использование РТК для лечения рецидивирования заболевания, но не ЦФ из-за его токсичности, связанной с кумулятивным действием. BSR/BHPR рекомендуют добавить в/в метилпреднизолон или плазмаферез при тяжелых и/или серьезных рецидивах (рекомендация класса С) [19]. СanVasc подчеркивает, что нет достаточных доказательств в поддержку рекомендации использовать плазмаферез в качестве терапии первой линии, но предполагает, что этот метод лечения может быть разумной дополнительной терапией для пациентов с рецидивами, у которых наблюдается клиническое ухудшение состояния, несмотря на продолжающееся лечение ГК + ЦФ или РТК (рекомендация класса D).
Для пациентов, которые получают второй курс ЦФ, BSR/BHPR рекомендуют увеличить дозу ГК. ЦФ также может быть подходящим терапевтическим агентом для пациентов, которые получили РТК в качестве терапии первой линии или которые не могут получить РТК из-за наличия противопоказаний.
Нетяжелый рецидив
Пациентам с нетяжелым рецидивом необходимо оптимизировать иммуносупрессивный режим и/или увеличить дозу ГК. BSR/BHPR, EULAR/ERA-EDTA и CanVasc рекомендуют оптимизировать терапию нетяжелых рецидивов с помощью увеличения дозы ГК в дополнение к изменению режима поддерживающей ремиссии (рекомендация класса C) без предоставления конкретных рекомендаций по выбору или изменению иммуносупрессантов и продолжительности терапии после нетяжелого рецидива.
Менеджмент специфических проявлений ААВ
Поражение уха, носа, горла и субглоточный стеноз
Пациентам с ГПА и поражением уха, носа и горла может потребоваться дополнительная местная терапия. Лечение локальным мупироцином рекомендуется для пациентов, у которых высеян золотистый стафилококк (BSR/BHPR и EULAR/ERAEDTA). BSR настоятельно рекомендует проводить бактериальный мазок в начале исследования и каждые 6–12 месяцев для выявления колонизации S.aureus, что связано с повышенным риском рецидива. Тем не менее CanVasc отмечает, что этот метод исследования имеет ограниченную пользу и не показан для снижения риска рецидивов или прогрессирования ГПА. SBR рекомендует, чтобы пациенты с изолированным субглоточным стенозом получали только местную терапию, такую как механическое расширение с инъекцией ГК длительного действия (рекомендация класса С).
Профилактика пневмоцистной инфекции
Все 4 руководства рекомендуют профилактику пневмоцистной инфекции у пациентов с AAВ, получающих индукционную терапию ЦФ или РТК. SBR указывает, что всем пациентам с общим количеством лимфоцитов < 300 клеток/мм3 должна быть назначена профилактическая терапия независимо от вида иммуносупрессивной терапии. Рекомендуемый профилактический агент первой линии во всех рекомендациях при отсутствии аллергии — это триметоприм/сульфаметоксазол в дозе 400/80 мг в день или 800/160 мг 3 раза в неделю. SBR указывает на необходимость корректировки дозы при снижении СКФ. CanVasc рекомендует продолжать профилактику P.jirovecii через 3 месяца после окончания терапии ЦФ, однако отмечает, что оптимальная продолжительность профилактики P.jirovecii после терапии индукции ремиссии с помощью РТК неизвестна. CanVasc подчеркивает, что нет единого мнения о необходимости профилактики P.jirovecii для пациентов с AAВ, которые получают монотерапию высокими дозами ГК. BSR и Canvasc одновременно отмечают, что TMП/СMК обычно безопасен в профилактической дозе.
МТХ взаимодействует с TMП/СMК, поэтому BSR рекомендует принимать TMП/СMК и МТХ в отдельные дни. Альтернативная терапия TMП/СMК немного варьирует среди руководящих принципов. SBR рекомендует отдавать предпочтение ингаляционному пентамидину; BSR/BHPR — ингаляционному пентамидину или дапсону; CanVasc и EULAR/ERA-EDTA отдают предпочтение дапсону или атоваквону, а не ингаляционному пентамидину. Предложения CanVasc базируются на исследовании 2008 года, исходя из которого аэрозольный пентамидин менее эффективен, чем TMП/СMК, для предотвращения P.jirovecii [20], а EULAR заявляет, что ингаляционный пентамидин наименее экономически выгоден.
Мониторинг и менеджмент побочных эффектов лечения
Пациенты, получающие циклофосфамид
BSR/BHPR, CanVasc и EULAR/ERA-EDTA обсуждают ряд мер предосторожности для пациентов, получающих ЦФ. Во время лечения ЦФ пациенты должны проходить регулярный мониторинг показателей крови, особенно на предмет наличия лейкопении и/или нейтропении. Необходим также регулярный мониторинг функции печени и почек с возможной коррекцией терапии по мере необходимости. Пациенты, которые получают в/в ЦФ, должны параллельно получать адекватную гидратацию и противорвотные препараты. BSR и EULAR/ERA-EDTA отмечают, что назначение месны может рассматриваться как профилактическое средство для предотвращения возникновения цистита у пациентов, получающих в/в и пероральный ЦФ. Пациентам с возникшей гематурией на фоне терапии ЦФ должна в обязательном порядке быть проведена цистоскопия. BSR и CanVasc подчеркивают необходимость проведения общего анализа мочи каждые 3–6 месяцев в течение всей жизни пациентам, получавшим ЦФ, для мониторинга гематурии. Что касается фертильности, то все 4 руководства обсуждают влияние ЦФ на фертильную функцию у пациентов репродуктивного возраста, отмечая важность рассмотрения вопроса о замене его на РТК при необходимости. Кроме того, BSR рекомендует пациентам, которым планируется проведение терапии ЦФ, предлагать криоконсервацию сперматозоидов и ооцитов, проводить гормональную стимуляцию яичников, использовать аналоги гонадотропин-рилизинг-гормона.
Пациенты, получающие ритуксимаб
BSR/BHPR, EULAR/ERA-EDTA и SBR обсуждают важность измерения уровней сывороточного ИГ на исходном уровне и перед каждым курсом РТК с возможной модификацией терапии или проведением заместительной терапии по мере необходимости. BSR/BHPR и SBR специально дают рекомендации по проведению вакцинации, включая вакцинацию против гепатита B, пневмококка и ежегодные прививки от гриппа [20]. BSR/BHPR рекомендует вакцинировать пациентов как минимум за 2 недели до начала терапии, но в идеале — за 4–6 недель, тогда как SBR рекомендует интервал в 3 недели. SBR предлагает обследования на ВИЧ, вирус гепатита B и С и сифилис до начала лечения РТК и возможное одновременное противовирусное лечение в сотрудничестве со специалистом по инфекционным заболеваниям.
Другие побочные эффекты, связанные с иммуносупрессией
BSR/BHPR и CanVasc указывают, что пациентам с ААВ необходимо периодически проводить оценку факторов риска остеопороза с соответствующей профилактикой и лечением. BSR/BHPR перечисляют несколько других проблем, таких как скрининг и соответствующее лечение кандидоза полости рта, инвазивной цервикальной неоплазии и/или вируса папилломы человека среди женщин, туберкулез, тромбоэмболический риск и титры возбудителя ветряной оспы.
Особые группы населения
Беременные
В руководстве CanVasc пациенткам не рекомендуется беременеть ранее чем через 6 месяцев после наступления стойкой ремиссии, и их следует направлять к акушеру-гинекологу, специализирующемуся на беременностях высокого риска.
Общий уход и последующее наблюдение
Большинство руководств (BSR/BHPR, CanVasc и EULAR) рекомендуют направлять или лечить всех пациентов с ААВ в сотрудничестве со специалистами, работающими в специализированных ревматологических центрах, особенно если заболевание является тяжелым, рефрактерным и/или рецидивирующим. BSR/BHPR отмечают необходимость сотрудничества с врачом первичной медико-санитарной помощи для улучшения мониторинга состояния пациента и соблюдения им рекомендаций по лечению, хотя фактическая оценка течения ААВ должна все же проводиться ревматологами.
Пациенты с ААВ должны получить четкое представление о своем заболевании, вариантах лечения, побочных эффектах и прогнозе (BSR, EULAR). BSR рекомендует использовать проверенные инструменты для оценки не только активности и/или степени заболевания, но и качества жизни.
В большинстве руководств (BSR/BHPR, CanVasc, EULAR) указано, что пациенты с ААВ должны периодически проходить систематическую оценку факторов риска сердечно-сосудистых заболеваний.
Инструменты оценки заболеваний
BSR/BHPR рекомендуют использовать проверенные инструменты для оценки активности заболевания и степени заболевания. Версия 3 BVAS [22] была рекомендована для оценки активности заболевания, а индекс повреждения васкулита (VDI) [23] был рекомендован для определения степени необратимого повреждения, вызванного как заболеванием, так и связанным с лечением повреждением. Также подчеркивается, чтобы BVAS и VDI использовались специалистами, обученными их применению. Оценка качества жизни с использованием SF-36 рекомендована BSR/BHPR. Хотя эти инструменты применяются в клинических испытаниях, BSR/BHPR предлагают использовать эти шкалы в повседневной практике для обеспечения хорошего качества медицинской помощи и проведения оценки исходов заболевания. EULAR, CanVasc и SBR не упоминают об использовании этих инструментов для оценки активности болезни.
Частота оценки заболеваний
BSR/BHPR рекомендуют проводить оценку заболевания ежемесячно во время индукции ремиссии, каждые 3 месяца во время первоначального поддерживающего лечения ремиссии, затем каждые 6 месяцев, а потом ежегодно. CanVasc рекомендует пациентам, получающим индукционную ремиссию и поддерживающую терапию, регулярно проходить клиническую оценку для мониторинга их реакции на лечение, течения заболевания и побочных эффектов. Частота мониторинга, предложенная CanVasc, составляет 1 раз в месяц во время индукции ремиссии и каждые 3 месяца в течение 2 лет во время терапии поддержания ремиссии, а затем ежегодно. EULAR или SBR не дают рекомендаций по частоте оценки заболеваний.
Выводы
Несмотря на наличие множества общих консенсусных подходов в менеджменте ААВ согласно 4 сравниваемым руководящим принципам, существуют и фундаментальные различия между ними. Эти различия наблюдаются в значительной степени из-за отсутствия достаточного количества контролируемых исследований по рассматриваемой проблеме с различными мнениями экспертов, несмотря на увеличение активности клинических исследований за последние два десятилетия. Некоторые из различий, отмеченные в руководствах, могут быть отнесены к различным возможностям доступа к препаратам и/или стоимости лечения. Большие успехи были сделаны в усовершенствовании индукционной терапии для ААВ. Нужно признать, что терапия ГК, являясь одним из 2 центральных столпов индукционной терапии, связана с большой токсичностью, но изначальные дозы и режим снижения преднизолона, описанный в рекомендациях, разнится и не основан на фактических данных. Существуют и другие области, в которых отсутствуют доказательства, в том числе лечение тяжелого и рефрактерного ААВ, поскольку такие пациенты преимущественно исключены из клинических исследований; выявление фенотипов ААВ, где лечение бесполезно; лечение ААВ при наличии инфекции и менеджмент ЭГПА. Поскольку использование РТК для индукции ремиссии и поддерживающей терапии расширяется, необходимы дополнительные рекомендации для оценки риска инфекции и рекомендации по ее профилактике. Кроме того, необходимо последующее наблюдение за пациентами с ААВ, включая качество жизни, риск терминальной стадии почечной недостаточности и сердечно-сосудистой смертности, так как данные в этом отношении скудны. Однако всегда нужно помнить, что каждый пациент уникален, и, хотя рекомендации могут помочь врачам в принятии решений, они не заменяют опыт ревматолога в разработке терапевтического режима с учетом индивидуальности пациента.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.

/57.jpg)
/58.jpg)
/59.jpg)
/60.jpg)
/61.jpg)
/62.jpg)