Газета «Новости медицины и фармации» №7 (725), 2020
Вернуться к номеру
Профілактика порушень нутрицієнтного обміну в жінок репродуктивного віку
Авторы: Огородник А.О., Тарнавська А.О., Нерознак Ю.П.
ДУ «Інститут педіатрії, акушерства і гінекології ім. акад. О.М. Лук’янової НАМНУ», м. Київ, Україна
Рубрики: Акушерство и гинекология
Рубрики: Акушерство и гинекология
Версия для печати
Дефекти нервової трубки (ДНТ) є одними із поширених і небезпечних вроджених вад розвитку центральної нервової системи. Дві найпоширеніші — аненцефалія (повна або часткова відсутність мозкової тканини, черепа та шкіри голови) та spina bifida (випинання спинного мозку, менінгеальних оболонок або обох разом через дефект хребта) становлять > 90 % випадків. Обидва виникають через неповне закриття нервової трубки на початку гестації, часто до того, як жінка навіть усвідомлює, що може бути вагітна [1]. ДНТ є проблемою в усьому світі, щорічно народжується близько 300 000 дітей з ДНТ, лише в США 3000 випадків на рік [2]. У доповіді Центру з контролю за захворюваннями (CDC) за 2005 р. оцінено показники рівня spina bifida та аненцефалії на рівні 17,96 та 11,11 на 100 000 живонароджених відповідно [3].
ДНТ спричиняє значну захворюваність та смертність новонароджених і призводить до величезних фінансових та емоційних витрат. Пренатальна діагностика зараз широко доступна та впроваджена в акушерських протоколах спостереження за вагітністю, а аналіз на альфа-фетопротеїни в матері у другому триместрі та ультразвукове дослідження плода дозволяють виявити > 80 % випадків. Аненцефалія призводить до внутрішньоутробної смерті або смерті протягом кількох днів від народження. Діти зі spina bifida страждають від фізичних вад, включаючи параліч, нетримання калу та сечі, мають складнощі в навчанні та збільшений показник смертності в дитячому та дорослому віці, незважаючи на досягнення медичної та хірургічної допомоги [4]. Фінансові витрати на ДНТ, головним чином на медичну та хірургічну допомогу при лікуванні spina bifida, є високими, за оцінками, приблизно 250 000 доларів на випадок у США [2].
У 1991 році Medical Research Council вперше проведене міжнародне подвійне сліпе рандомізоване контрольоване дослідження, у якому було виявлено зв’язок між вживанням фолієвої кислоти та зниженням виникнення ДНТ. Відмічено зниження на 72 % ДНТ у жінок, які вживали фолієву кислоту [1]. Автори стверджували, що хоча у дослідженні оцінювалось зниження рівня ДНТ у пацієнтів, які мали ДНТ у попередню вагітність, не було жодних підстав очікувати, що фолієва кислота не матиме такого ж впливу на ДНТ, що можуть виникнути при першій вагітності [1]. Дійсно, після того, як було проведене наступне рандомізоване клінічне дослідження в Угорщині, підтвердився той факт, що фолієва кислота також має захисну дію під час першої вагітності. Було підраховано, що частка ДНТ, чутливих до фолатів, у всьому світі становить 75 %, а у США — 50 %.
У 1992 році Центр із контролю за захворюваннями рекомендував додати до харчування 400 мг фолієвої кислоти всім жінкам, які можуть завагітніти. З огляду на той факт, що 50 % всіх вагітностей у США є незапланованими, після проведення інформаційної кампанії менше ніж за рік вдалося знизити на 27 % ДНТ, у Канаді ДНТ, діагностовані під час вагітності, скоротились на 46 %.
У 1992 році міністерство охорони здоров’я США випустило рекомендацію про те, що потрібно приймати 400 мкг фолієвої кислоти на добу протягом периконцепційного періоду: до зачаття та протягом перших 12 тижнів вагітності. Було збільшено дозування до 5 мг на добу для жінок із ризиком дефіциту фолатів або попереднім випадком ДНТ, а також для жінок, хворих на діабет або епілепсію. Під час аудиту дотримання жінками цієї поради було встановлено, що лише 3 % жінок у досліджуваній вибірці приймали препарати фолієвої кислоти в період перед зачаттям [9]. Це призвело до того, що в лютому 1996 р. була розпочата освітня кампанія виконавчим органом управління освітою в галузі охорони здоров’я. Основними складовими цієї кампанії було підвищення рівня обізнаності про важливість прийому фолієвої кислоти, поширення цих знань серед медичних працівників та сприяння добровільному прийому фолієвої кислоти. Аудит у 1996–1997 рр. показав, що хоча знання про корисні ефекти фолієвої кислоти зросли, дотримання норм все ще залишається низьким. Незважаючи на ці висновки, у Сполученому Королівстві рішення про запровадження обов’язкового насичення продуктів харчування фолієвою кислотою не було виконано.
Незрозуміло, чи знизилися показники ДНТ у США після 1992 року, коли було запроваджено політику щодо додавання фолієвої кислоти до харчового раціону. Botto та ін. (2005) повідомили, що політика щодо фолієвої кислоти в декількох країнах, включаючи Великобританію, схоже, не вплинула на тенденції щодо розвитку ДНТ протягом 6 років після її запровадження. У той же час Busby та ін. (2005) встановили, що поширеність ДНТ у США та Ірландії знизилася на 32 %. У Сполученому Королівстві або в Європі досі не впроваджено обов’язкове насичення харчових продуктів фолієвою кислотою, тому вдосконалення знань про необхідність прийому та добровільне використання фолієвої кислоти залишається важливим пріоритетом.
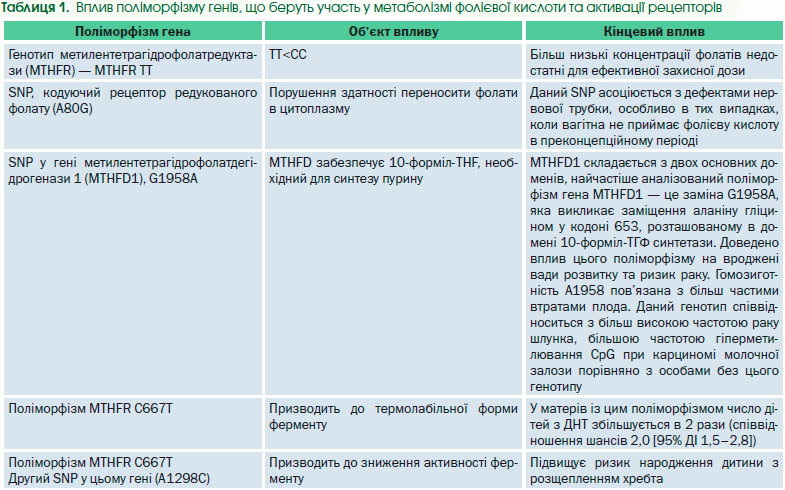
Узагалі точна етіологія цих вад ще не до кінця з’ясована. Вона, ймовірно, багатофакторна, що включає складну взаємодію генетичних та екологічних компонентів. На підтримку генетичної складової свідчить той факт, що більш високий рівень ДНТ спостерігається серед сімей з ДНТ під час попередньої вагітності, а також серед близнюків [5]. Виявлено специфічні поліморфізми (single nucleotide polymorphism, SNP), які можуть під–вищувати цей ризик [6], але більш високий ризик, що спостерігається у певних етнічних групах, таких як ірландці [7] та мексиканці [8], надає додаткові докази, що свідчать про генетичну складову (табл. 1) [17–19].
Нарешті, пари з ДНТ при попередній вагітності мають ризик розвитку ДНТ при наступній вагітності, що у 3–5 разів перевищує ризики для пар, які не мають ДНТ в анамнезі [9]. Доказом впливу факторів оточуючого середовища є зміна ризику при зміні соціально-економічного статусу та умов сусідства [10, 11], сезонних змінах [12] та географії [7, 13–15].
Із численних потенційних факторів оточуючого середовища, які сприяють виникненню ДНТ, найбільш добре вивчений захисний ефект фолієвої кислоти, що надходить у преконцепційний період. Фолати — це водорозчинний вітамін групи В, який діє як кофактор у реакціях перенесення вуглецю та відіграє центральну роль у біосинтезі нуклеїнових кислот [16]. Як саме працює фолієва кислота для запобігання ДНТ, у даний час незрозуміло; залишається багато питань щодо процесів, що лежать в основі нормального і ненормального нервового розвитку [17]. Однак добре вивчено, що споживання фолієвої кислоти матір’ю протягом преконцепційного періоду є ефективним для зменшення як рецидивів, так і перших випадків виникнення ДНТ [16].
На жаль, здійснити профілактику на практиці набагато складніше, ніж спочатку передбачалося, і існує чимало супе–речок щодо деяких найважливіших проблем, пов’язаних із фолієвою кислотою, з якими стикаються жінки та органи охорони здоров’я в усьому світі.
Рекомендована добова норма фолієвої кислоти для профілактики ДНТ залежить від акушерського анамнезу. Для жінок із попередніми випадками вагітності з ДНТ щоденна доза становить 4,0 мг, починаючи щонайменше за місяць до зачаття, і її прийом повинен тривати протягом першого триместру — це чинна рекомендація в США [15]. Хоча можливо, що нижча доза може забезпечити достатній рівень захисту, рандомізовані контрольовані дослідження, які оцінюватимуть різні дози, ймовірно, ніколи не будуть виконані через етичні обмеження.
Незважаючи на те, що багато країн світу мають подібні рекомендації, міжнародного консенсусу не було розроблено, а деякі країни досі не мають офіційних рекомендацій. Наприклад, одне дослідження європейської політики щодо фолієвої кислоти, проведене в 2005 році, показало, що хоча 13 країн проводили інформаційну політику щодо фолієвої кислоти, деякі з цих рекомендацій були поширені лише через десять років після рекомендацій, виданих Центром із конт–ролю за захворюваннями. Дві країни, Мальта та Фінляндія, рекомендували лише харчові джерела фолатів (несинтетична, дієтична форма), а п’ять інших не мали офіційних рекомендацій [14]. Цікаво, що програма Канади «Motherisk», що була розроблена у лікарні для хворих дітей, Онтаріо, нещодавно змінила свої рекомендації щодо фолієвої кислоти на 5 мг/добу для всіх жінок. Зміни були впроваджені після недавнього дослідження, у якому визначено, що 40 % жінок в Онта–ріо не досягають оптимального рівня захисту, незважаючи на насичення продуктів фолієвою кислотою та вживання харчових добавок [14]. Крім того, рекомендації 2007 року в програмі «Motherisk» та Товариства акушерів-гінекологів Канади передбачають збільшення до 5 мг/добу для жінок з різними медичними та соціальними показаннями, включаючи статус меншин, епілепсію, ожиріння, зловживання наркотичними речовинами, неправильне дозування ліків тощо [13].
При вивченні сімей, у яких виявлені випадки ДНТ, доведена ефективність застосування фолієвої кислоти в дозі 4 мг/добу. У масштабному дослідженні сімей, у яких не виявлено випадків ДНТ, продемонстрована ефективність дози 0,8 мг/добу в програмі преконцепційної профілактики [14]. У результаті даних досліджень багатьма національними організаціями, такими як FDA, Health Canada тощо, розроблені рекомендації з фортифікації борошна фолієвою кислотою в 1997–1998 рр. На сьогодні понад 50 країн використовують фортифікацію борошна та інших продуктів фолієвою кислотою, що сприяє зниженню частоти ДНТ. Разом з тим тривають подальші дослідження з оптимального дозування і тривалості прийому препаратів фолієвої кислоти жінками репродуктивного віку.
Якщо в 1995 р. Daly et al. доведено, що оптимальною дозою для профілактики ДНТ є концентрація фолієвої кислоти в материнських еритроцитах 906 нмоль/л, а подальше збільшення дози препарату не призводить до зниження частоти ДНТ, то через 20 років отримані зовсім інші дані [5]. Так, У 2014 р. Crider et al. опубліковані результати двох когортних досліджень у Китаї з вивчення ефективності дози фолієвої кислоти 0,1; 0,4; 4 мг/добу і 4 мг/тиждень. У даному дослідженні доведено, що ефективна для профілактики ДНТ концентрація фолієвої кислоти в еритроцитах матері становить 1500 нмоль/л, що на 66 % вище, ніж у дослідженнях Daly et al. [3, 5]. На сьогодні доведено, що метаболізм (і вплив на нього фолієвої кислоти) залежить від безлічі різних факторів, тому цілком реально, що для максимізації протективного впливу на плід необхідно більше ніж 0,4 мг/добу [1, 2, 6].
На окрему увагу в дослідженнях останніх років заслуговує тривалість прийому препаратів фолієвої кислоти для досягнення ефективної концентрації. Так, у декількох дослідженнях показано, що жінкам, які не отримували раніше достатньої кількості фолієвої кислоти, для досягнення її стабільної ефективної концентрації в еритроцитах необхідно приблизно протягом року приймати препарат фолієвої кислоти або споживати її з продуктами харчування [4, 8, 10].
Які ми бачимо проблеми порушення комплаєнсу щодо профілактичного прийому фолієвої кислоти? По-перше, це відсутність планування вагітності. Так, за різними оцінками, близько 50 % жінок не планують вагітність і, отже, часто не приймають фолієву кислоту до зачаття. З огляду на те, що закриття нервової трубки завершується до 28-го дня після зачаття, мало часу з моменту, коли жінка дізнається про свою вагітність, і до закінчення вікна профілактичної дії прийому фолієвої кислоти в авральному режимі [26].
З фармакологічної точки зору доцільно призначати фолієву кислоту в дозі 0,8 мг/добу, а якщо жінка відноситься до групи вкрай високого ризику (ДНТ в анамнезі), то в більш високій дозі (5 мг/добу), з метою досягнення високих концентрацій фолієвої кислоти в сироватці крові для нервової трубки, що розвивається [2, 7, 15, 24].
По-друге, потрібно обов’язково підкреслити, що багато жінок не вживають достатньої кількості фолієвої кислоти в своєму раціоні. Як правило, вони недостатньо їдять овочів, багатих на фолат, таких як боби, сочевиця, шпинат та інші листові овочі з органічних джерел без будь-якої кулінарної обробки. Крім того, натуральні харчові фолати є нестабільними сполуками, і під час обробки їжі втрачається активність вітамінів. Таким чином, до 70 % фолатів можуть бути знищені шляхом подрібнення і випікання [9, 12, 15, 23, 25].
По-третє, є ще такий важливий факт, як зменшення споживання багатьма жінками вуглеводів, а отже, уникнення споживання хліба і виробів на основі борошна, збагаченого фолієвою кислотою. Також збільшується кількість жінок, які уникають глютену при таких захворюваннях, як целіакія; а відмова від глютен–умісних борошняних продуктів означає, що ці жінки не отримують переваги від збагачення борошна фолієвою кислотою [10, 15, 24].
З огляду на загальне збільшення хворобливих станів у жінок, у тому числі захворювань, при яких змінюється всмоктування фолатів з їжі, необхідно проводити широку інформаційну кампанію щодо важливості застосування фолієвої кислоти 0,4 мг/добу для забезпечення ефективної захисної концентрації в крові жінок, які планують вагітність.
Беручи до уваги відсутність планування вагітності в половині випадків і стислість вікна потенційного позитивного впливу для профілактики дефектів нервової трубки при настанні вагітності, доцільно застосовувати медичний комплекс з умістом фолієвої кислоти 200 мкг та L-метилфолату 208 мкг (ЕМБРіЯ фол) в преконцепційному періоді або відразу після встановлення діагнозу маткової вагітності. Слід звернути увагу на те, що препарат містить фолієву кислоту, яка пов’язана з молекулами 5-MTHF. Вважається, що 5-метилтетрагідрофолат є єдиною формою, яка має біологічну –активність щодо впливу на синтез ДНК, реплікацію клітин та метилювання [27].
Крім того, слід звернути увагу на те, що ЕМБРіЯ фол містить такий важливий мікроелемент, як йод. Йод — важлива поживна речовина для людини, а важливість забезпечення йодом у жінок репродуктивно віку безсумнівна, тому що метаболізм тиронінів безпосередньо впливає на обмін статевих стероїдів, а його порушення призводять до багатьох порушень фертильності, у тому числі до недостатності лютеїнової фази менструального циклу, зниження числа овуляторних циклів, безплідності. Йод необхідний в організмі для вироблення тиреоїдних гормонів. У людини йод накопичується у щитоподібній залозі, а під час вагітності щитоподібна залоза дуже активна, виробляє приблизно на 50 % більше тиронінів. Жінки потребують додаткового йоду під час вагітності з метою забезпечення зростаючих потреб організму матері та плода. Крім того, слід звернути увагу, що цільове значення тиреотропного гормона має бути в межах 2,5 мкОд/мл [21].
Активність щитоподібної залози при грудному вигодовуванні повертається до норми, але рекомендується добавка йоду, оскільки єдиним джерелом йоду для немовляти є грудне молоко.
Вважається, що може знадобитися час, щоб накопичити більш високий рівень поживних речовин, необхідних для здорового розвитку дитини, тому біологічно активна добавка з йодом також рекомендується, коли жінки планують вагітність. Якщо жінка не отримує достатню кількість йоду до вагітності, вона може не мати достатніх запасів для підтримки потреб плода на пізніх термінах вагітності. Гормони щитоподібної залози важливі для регуляції росту та здорового розвитку нервової системи, координації, органів чуття: зору, слуху, нюху, смаку та дотику.
Достатня кількість материнських тиронінів має важливе значення для швидкого росту мозку дитини, що відбувається в перші 1000 днів життя. У Великобрита–нії проведене дослідження, результати якого свідчать, що додавання йоду вагітним потенційно може підвищити IQ немовлят на 1,22 бала і заощадити 199 фунтів стерлінгів на одну вагітну жінку. Більші заощадження в суспільстві, такі як покращення навчальних досягнень, що призводять до зростання доходів у подальшому житті, були ще більшими — приблизно 4476 фунтів стерлінгів на одну вагітність. Більшість людей можуть отримати достатню кількість йоду за допомогою здорового харчування. Вагітним і жінкам, які годують груддю, потрібно більше йоду, ніж середньостатистичній людині. Щоденна добавка, що включає 150 мкг йоду, рекомендується жінкам при плануванні вагітності, під час вагітності та під час годування груддю [20, 22].
Необхідно звернути увагу на те, що жінкам, які мають захворювання щитоподібної залози, слід проконсультуватись з ендокринологом із приводу доцільності прийому йодовмісних біодобавок.
Національна рада з питань охорони здоров’я та медичних досліджень рекомендує жінкам приймати 220 мкг йоду на день при вагітності та 270 мкг на добу при грудному вигодовуванні. Оскільки дієтичне харчування навряд чи буде достатнім, ЕМБРіЯ фол, що включає 200 мкг йоду, рекомендується жінкам при плануванні вагітності, під час вагітності та під час годування груддю [21].
Пріоритетним напрямком профілактики акушерських, перинатальних ускладнень та віддалених наслідків гестаційних порушень має бути поширення інформації про необхідність прийому фолієвої кислоти та йоду жінками, які планують вагітність або потенційно можуть завагітніти, серед лікарів первинної ланки, а також при профілактичних оглядах або зверненні за гінекологічною допомогою до акушерів-гінекологів.