Архив офтальмологии Украины Том 8, №2, 2020
Вернуться к номеру
Исследование клинической эффективности аналогов простагландинов в фармакотерапии глаукомы
Авторы: Макаренко И.А.
Национальная медицинская академия последипломного образования имени П.Л. Шупика, г. Киев, Украина
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
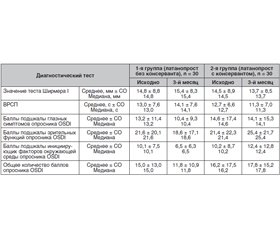
Аналоги простагландинів є препаратами першої лінії в лікуванні первинної відкритокутової глаукоми. Останнім часом більший інтерес становить вивчення очних крапель, що не містять консервантів. У роботі вивчали клінічну ефективність препаратів аналогів простагландинів (латанопрост 0,005%), що містять і не містять консервант. Згідно з дослідженням латанопрост ефективно знижував рівень внутрішньоочного тиску (ВОТ): препарат, що не містить консерванту (Монопрост), знизив ВОТ на 43,51 % від вихідного рівня, латанопрост, який містить консервант, — на 38,99 %, що позитивно впливало на динаміку зорових функцій. Відзначено збільшення сумарного поля зору в пацієнтів, які приймали латанопрост 0,005% без консерванту протягом 3 місяців, на 10–30°, у пацієнтів 2-ї групи, які приймали латанопрост 0,005% із консервантом, — на 5–10°. Отримані результати і переваги в пацієнтів у 1-й групі можна пояснити відсутністю токсичної дії консерванту на трабекулу і нейропротекторними властивостями латанопросту. Результати проведених нами досліджень — тесту Ширмера I, профарбування поверхні кон’юнктиви і рогівки, визначення часу розриву слізної плівки, загальна кількість балів OSDI-опитувальника свідчать про переваги застосування латанопросту 0,005% без консерванту в пацієнтів із первинною відкритокутовою глаукомою у зв’язку з відсутністю токсичної дії на очну поверхню, що відкриває великі перспективи його застосування.
Аналоги простагландинов являются препаратами первой линии в лечении первичной открытоугольной глаукомы. В последнее время больший интерес представляет изучение глазных капель, не содержащих консервантов. В работе изучали клиническую эффективность препаратов аналогов простагландинов (латанопрост 0,005%), содержащих и не содержащих консервант. Согласно исследованию латанопрост эффективно снижал уровень внутриглазного давления (ВГД): препарат, не содержащий консерванта (Монопрост), снизил ВГД на 43,51 % от исходного уровня, латанопрост, содержащий консервант, — на 38,99 %, что положительно влияло на динамику зрительных функций. Отмечено увеличение суммарного поля зрения у пациентов, принимавших латанопрост 0,005% без консерванта в течение 3 месяцев, на 10–30°, у пациентов 2-й группы, принимавших латанопрост 0,005% с консервантом, — на 5–10°. Полученные результаты и преимущества у пациентов в 1-й группе можно объяснить отсутствием токсического действия консерванта на трабекулу и нейропротекторными свойствами латанопроста. Результаты проведенных нами исследований — теста Ширмера I, прокрашивания поверхности конъюнктивы и роговицы, определения времени разрыва слезной пленки, общее количество баллов OSDI-опросника свидетельствуют о преимуществах применения латанопроста 0,005% без консерванта у пациентов с первичной открытоугольной глаукомой в связи с отсутствием токсического действия на глазную поверхность, что открывает большие перспективы его применения.
Prostaglandin analogues are used as the first-line therapy for primary open-angle glaucoma. Recently, the study of preservative-free eye drops has been of greater interest. We studied the clinical efficacy of preparations of prostaglandin analogues (latanoprost 0.005%), with and without a preservative. The study results demonstrated that latanoprost effectively reduced the level of intraocular pressure (IOP): a preservative-free drug (Monoprost) reduced IOP by 43.51 % of the initial level, latanoprost, which contains a preservative, by 38.99%, that had a positive effect on the dynamics of visual functions. There was an increase in the total field of view in patients who took latanoprost 0.005% without preservatives for 3 months by 10–30°, in patients of group 2 (latanoprost 0.005% with a preservative) by 5–10°. The obtained results and advantages in patients in group 1 can be explained by the absence of the toxic effect of preservatives on the trabecula and the neuroprotective properties of latanoprost. The results of our studies — Schirmer’s I test, staining of the conjunctiva and cornea surface, determination of the tear film rupture time, the total number of OSDI scores of the questionnaire indicate the advantages of using latanoprost 0.005% without preservative in patients with primary open-angle glaucomadue to the absence of toxic effects on the ocular surface, which opens up great prospects for its application.
первинна відкритокутова глаукома; внутрішньоочний тиск; простагландини; латанопрост; Монопрост; консерванти; очна поверхня
первичная открытоугольная глаукома; внутриглазное давление; простагландины; латанопрост; Монопрост; консерванты; глазная поверхность
primary open-angle glaucoma; intraocular pressure; prostaglandins; latanoprost; Monoprost; preservatives; ocular surface
Введение
Материал и методы
Результаты и обсуждение
Выводы
- https://dec.gov.ua/wp-content/uploads/images/dodatki/816/ 816dod4_2.pdf
- Quigley H.A., Broman A.T. The number of people with glaucoma worldwide in 2010 and 2020. Br. J. Ophthalmol. 2006. 90. 3. P. 262-267.
- Tham Y.S. et al. Global Prevalence of Glaucoma and Projection of Glaucoma Burden through 2040. A Systematic Rewiev and Meta-analysis. Ophthalmology. 2014. 121(11). Р. 2081-2090. doi: 10.1061/j.ophtha.2014.05.013.
- https://cyberleninka.ru/article/n/analogi-prostaglandinov-proshloe-nastoyaschee-i-buduschee/viewer
- Stjernschantz J., Alm A. Latanoprost as a new horizon in the medical management of glaucoma. Curr. Opin. Ophthalmol. 1996, Apr. 7(2). Р. 11-17. doi: 10.1097/00055735-19960400000003.
- Stjernschantz J., Resul B. Phenyl substituted prostaglandin analogs for glaucoma treatment. Drugs Future. 1992. 17. Р. 691-704. doi: 10.1358/dof.1992.017.08.187766.
- Walters T.R., DuBiner H.B., Carpenter S.P. et al. 24-Hour IOP control with once-daily bimatoprost, timolol gel-forming solution, or latanoprost: a 1-month, randomized, comparative clinical trial. Surv. Ophthalmol. 2004. 49. Suppl 1. Р. 26-35. doi: 10.1016/j.sur-vophthal.2003.12.017.
- Bill A. Conventional and uveoscleral drainage of aqueous humour in the cynomolgus monkey (Macacairus) at normal and high intraocular pressures. Exp. Eye Res. 1966. 5. Р. 45-54. doi: 10.1016/ S0014-4835(66)80019-2.
- Bill A. Movement of albumin and dextran through the sclera. Arch. Ophthalmol. 1965. 74. Р. 248-252. doi: 10.1001/archopht.1965.00970040250024.
- Bill A. The aqueous humour drainage mechanism in the cynomolgus monkey (Macacairus) with evidence for unconventional routes. Invest. Ophthalmol. Vis. Sci. 1965. 4. Р. 911-919.
- Bill A., Barany E.H. Gross facility, facility of conventional routes, and pseudofacility of aqueous humor outflow in the cynomolgus monkey. Arch. Ophthalmol. 1966. 75(5). Р. 665-673. doi: 10.1001/archopht.1966.00970050667017.
- Bill A., Phillips C.I. Uveoscleral drainage of aqueous humour in human eyes. Exp. Eye Res. 1971. 12(3). Р. 275-281. doi: 10.1016/0014-4835(71)90149-7.
- Uusitalo H., Egorov E., Kaarniranta K. et al. Benefits of switching from latanoprost to preservative-free tafluprost eye drops: a metaanalysis of two Phase IIIb clinical trials. Clin. Ophthalmol. 2016, Mar 15. 10. Р. 445-454. doi: 10.2147/0PTH.S91402.
- Oh D.J., Martin J.L., Williams A.J. et al. Effect of latanoprost on the expression of matrix metalloproteinases and their tissue inhibitors in human trabecular meshwork cells. Invest. Ophthalmol. Vis. Sci. 2006. 47. Р. 3887-3895. doi: 10.1167/iovs.06-0036.
- Richter M., Krauss A.H., Woodward D.F., Lutjen-Drecoll E. Morphological changes in the anterior eye segment after long-term treatment with different receptor selective prostaglandin agonists and a prostamide. Invest. Ophthalmol. Vis. Sci. 2003. 44. Р. 4419-4426. doi: 10.1167/iovs.02-1281.
- Patel S.S., Spencer C.M. Latanoprost: A Review of its Pharmacological Properties, Clinical Efficacy and Tolerability in the Management of Primary Open-Angle Glaucoma and Ocular Hypertension. Drugs&Aging. 1996. Nov. 9(5). Р. 363-378. doi: 10.2165/00002512-199609050-00007.
- Завгородняя Н.Г., Пасечникова Н.В. Первичная глаукома. Новый взгляд на старую проблему. Запорожье; Одесса: Агентство «Орбита-Юг», 2010. 192 с.
- Alm A., Villumsen J., Tornquist P. et al. Intraocular pressure-reducing effect of PhXA41 in patients with increased eye pressure: a one-month study. Ophthalmology. 1993, Sep. 100. Р. 1312-1317. doi: 10.1016/S0161-6420(93)31482-X.
- Hotehama Y., Mishima H.K., Kitazawa Y. et al. Ocular hypotensive effect of phXA41 in patients with ocular hypertension or primary open-angle glaucoma. Jpn J. Ophthalmol. 1993. 37(3). Р. 270-274.
- Nagasubramanian S., Sheth G.P., Hitchings R.A. et al. Intraocular pressure-reducing effect of PhXA41 in ocular hypertension: comparison of dose regimens. Ophthalmology. 1993, Sep. 100. Р. 1305-1311. doi: 10.1016/S0161-6420(13)31817-X.
- Racz P., Ruzsonyi M.R., Nagy Z.T. et al. Maintained intraocular pressure reduction with once-a-day application of a new prostaglandin F2a analogue (PhXA41). An in-hospital, placebo-controlled study. Arch. Ophthalmol. 1993, May. III. Р. 657-661. doi: 10.1001/ar-chopht.1993.01090050091036.
- Patel S.S., Spencer C.M. Latanoprost: A Review of its Pharmacological Properties, Clinical Efficacy and Tolerability in the Management of Primary Open-Angle Glaucoma and Ocular Hypertension. Drugs & Aging. 1996, Nov. 9(5). Р. 363-378. doi: 10.2165/00002512-199609050-00007.
- Alm A., Grierson I., Shields M.B. Side effects associated with prostaglandin analog therapy. Surv. Ophthalmol. 2008. 53. Suppl 1. Р. 93-105. doi: 10.1016/j.survophthal.2008.08.004.
- Aptel F., Cucherat M., Denis P. Efficacy and tolerability of prostaglandin analogs: a meta-analysis of randomized controlled clinical trials. J. Glaucoma. 2008. 17. Р. 667-673. doi: 10.1097/ IJG.0b013e3181666557.
- Cheng J.W., Wei R.L. Meta-analysis of 13 randomized controlled trials comparing bimatoprost with latanoprost in patients with elevated intraocular pressure. Clin. Ther. 2008. 30. Р. 622-632. doi: 10.1016/j.clinthera.2008.04.006.
- Cucherat M., Stalmans I., Rouland J.F. Relative efficacy and safety of preservative-free latanoprost (T2345) for the treatment of open-angle glaucoma and ocular hypertension: an adjusted indirect comparison meta-analysis of randomized clinical trials. J. Glaucoma. 2014. 23. Р. 69-75. doi: 10.1097/IJG.0b013e3182a075e6.
- Eyawo O., Nachega J., Lefebvre P. et al. Efficacy and safety of prostaglandin analogues in patients with predominantly primary open-angle glaucoma or ocular hypertension: a meta-analysis. Clin. Ophthalmol. 2009. 3. Р. 447-456.
- Gandolfi S., Simmons S.T., Sturm R. et al. Three-month comparison of bimatoprost and latanoprost in patients with glaucoma and ocular hypertension. Adv. Ther. 2001. 18. Р. 110-121. doi: 10.1007/ BF02850299.
- Honrubia F., Garcia-Sanchez J., Polo V. et al. Conjunctivalhy-peraemia with the use of latanoprost versus other prostaglandin analogues in patients with ocular hypertension or glaucoma: a meta-analysis of randomised clinical trials. Br. J. Ophthalmol. 2009. 93. Р. 316-321. doi: 10.1136/bjo.2007.135111.
- Konstas A.G., Katsimbris J.M., Lallos N. et al. Latanoprost 0.005% versus bimatoprost 0.03% in primary open-angle glaucoma patients. Ophthalmology. 2005. 112. Р. 262-266. doi: 10.1016/j.oph-tha.2004.08.022.
- Noecker R.S., Dirks M.S., Choplin N.T. et al. A six-month randomized clinical trial comparing the intraocular pressure-lowering efficacy of bimatoprost and latanoprost inpatients with ocular hypertension or glaucoma. Am. J. Ophthalmol. 2003. 135. Р. 55-63. doi: 10.1016/S0002-9394(02)01827-5.
- Orme M., Collins S., Dakin H. et al. Mixed treatment comparison and meta-regression of the efficacy and safety of prostaglandin analogues and comparators for primary open-angle glaucoma and ocular hypertension. Curr. Med. Res. Opin. 2010. 26. Р. 511-528. doi: 10.1185/03007990903498786.
- Parrish R.K., Palmberg P., Sheu W.P., XLT Study Group. A comparison of latanoprost, bimatoprost, and travoprost in patients with elevated intraocular pressure: a 12-week, randomized, masked-evaluator multicenter study. Am. J. Ophthalmol. 2003. 135. Р. 688-703. doi: 10.1016/S0002-9394(03)00098-9.
- Stewart W.C., Kolker A.E., Stewart J.A. et al. Conjunctival hyperemia in healthy subjects after short-term dosing with latanoprost, bimatoprost, and travoprost. Am. J. Ophthalmol. 2003. 135. Р. 314-320. doi: 10.1016/S0002-9394(02)01980-3.
- Walters T.R., DuBiner H.B., Carpenter S.P. et al. 24-Hour IOP control with once-daily bimatoprost, timolol gel-forming solution, or latanoprost: a 1-month, randomized, comparative clinical trial. Surv. Ophthalmol. 2004. 49. Suppl 1. Р. 26-35. doi: 10.1016/j.sur-vophthal.2003.12.017.
- Traverso C.E., Ropo A., Papadia M., Uusitalo H. A phase II study on the duration and stability of the intraocular pressure-lowering effect and tolerability of ta uprost compared with latanoprost. J. Ocul. Pharmacol. Ther. 2010. 26. Р. 97-104. doi: 10.1089/jop.2009.0066.
- Uusitalo H., Pillunat L.E., Ropo A. Phase III Study Investigators. Efficacy and safety of ta uprost 0.0015% versus latanoprost 0.005% eye drops in open-angle glaucoma and ocular hypertension: 24-month results of a randomized, double-masked phase III study. Acta Ophthalmol. 2010. 88. Р. 12-19. doi: 10.1111/j.1755-3768.2010.01862.x.
- Bandeen-Roche K., Munoz B., Tielsch J.M., West S.K., Schein O.D. Self-reported assessment of dry eye in a populationbased setting. Invest. Ophthalmol. Vis. Sci. 1997. 38. Р. 2469-2475.
- Erb C., Gast U., Schremmer D. German register for glaucoma patients with dry eye. I. Basic outcome with respect to dry eye. Graefe’s Arch. Clin. Exp. Ophthalmol. 2008. 246(11). Р. 1593-1601.
- Lemp M.A. Report of the National Eye Institute/Industry workshop on Clinical Trials in Dry Eyes. The CLAO Journal. 1995. 21(4). Р. 221-232.
- https://www.aao.org/image/oxford-grading-system
- DEWS. Methodologies to diagnose and monitor dry eyedisease. Report of the Diagnostic Methodology Subcomitteeofthe International Dry Eye Workshop. Ocul. Surf. 2007. 5. Р. 108-152.
- https://eprovide.mapi-trust.org/instruments/ocular-surface-disease-index
- Walt J.G., Rowe M.M., Stern K.L. Evaluating the functional impact of dry eye: the ocular surface disease index (abstract). Drug. Inf. J. 1997. 31. Р. 1436.
- Miller K.L., Walt J.G., Mink D.R., Satram-Hoang S., Wilson S.E., Perry H.D., Asbell P.A., Pflugfelder S.C. Minimal clinically important difference for the ocular surface disease index. Archives of Ophthalmology. 2010. 128(1). Р. 94-101.
- https://doi.org/10.1001/archophthalmol.2009.356
- http://www.supereyecare.com/resources/OSDI.pdf
- Terminology and guidelines for glaucoma. European glaucoma society. 4 ed. 2014.

/24.jpg)
/25.jpg)