Газета «Новости медицины и фармации» №8 (726), 2020
Вернуться к номеру
Механизмы нарушения системы гемостаза у пациентов с COVID-19 и мониторинг маркеров коагуляции
Авторы: Мельник А.А., к.б.н.,
руководитель проекта специализированного медицинского центра «Оптима-фарм», г. Киев, Украина
Разделы: Справочник специалиста
Версия для печати
К настоящему времени подтверждена связь между инфекциями и нарушением системы гемостаза [1]. Так, в частности, бактериальные инфекции, вызванные грамотрицательными микроорганизмами, способны активировать систему свертывания путем высвобождения тканевого фактора с последующей активацией внешнего пути и индуцировать активацию тромбина клеточной стенкой бактерий [2]. Ранняя фаза бактериальной инфекции приводит к состоянию гиперкоагуляции, которая характеризуется повышением уровня D-димера и может привести к синдрому диссеминированного внутрисосудистого свертывания (ДВС-синдром) [3]. С другой стороны, вирусные инфекции также могут вызвать такие серьезные осложнения, как острый респираторный дистресс-синдром (ОРДС) и полиорганная недостаточность (ПОН), являющиеся состояниями, связанными с гиперкоагуляцией [4]. Появление нового вируса под названием SARS-CoV-2 в конце декабря 2019 г. привело к пандемии в мире [5]. Болезнь, которую вызывает данный вирус, или COVID-19, затронула более 10 миллионов человек, по состоянию на конец июня 2020 года умерло около 500 000 человек. Заболевание может иметь бессимптомное или легкое течение, а может протекать в тяжелой форме с полиорганной недостаточностью и летальным исходом [6–8].
Коагулопатия в форме венозной и артериальной тромбоэмболии является одним самых тяжелых последствий заболевания с неблагоприятным прогнозом [9–12]. Несмотря на применение в профилактических и терапевтических целях антикоагулянтов, остается повышенным риск тромбоза, что может свидетельствовать о специфических патофизиологических механизмах нарушения гемостаза при COVID-19 [13, 14]. У пациентов с тяжелой формой COVID-19 (5–10 %) развивается не только гипоксия и чрезмерное воспаление, но и частые тромботические проявления, такие как тромбоэмболия легочной артерии (ТЭЛА) в 20–30 % случаев, тромбоз глубоких вен (ТГВ), катетер-связанный и артериальный тромбоз, ишемический инсульт [15–18]. Кроме этого, наблюдается микрососудистый тромбоз, акросиндром, синдром капиллярной утечки с поражением легких, почек и сердца, что приводит к полиорганной недостаточности.
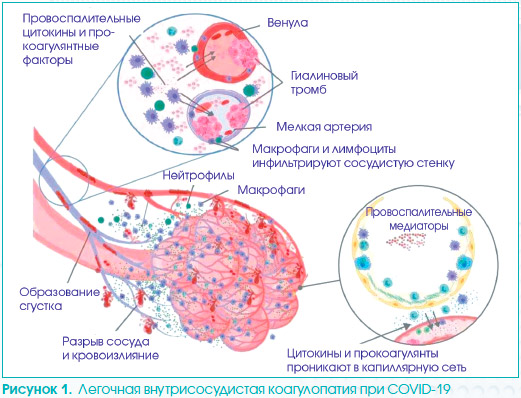
На рис. 1 схематически представлена легочная внутрисосудистая коагулопатия при COVID-19. Провоспалительные и прокоагулянтные агенты получают доступ к капиллярной сети (нижний круг). Низкое давление сосудистой системы и тонких стенок сосудов в проксимальном направлении к альвеолярной сети запускает иммунотромбоз с помощью различных механизмов, таких как локальное повышение провоспалительных цитокинов, повреждение ткани стенки сосуда с продуцированием тканевого фактора и прямое повреждение мелких сосудов. Усиленная фибринолитическая активность (обнаруживается на ранних стадиях повышением уровня D-димера) может не контролировать формирование обширного микротромбоза, что приводит к развитию легочного инфаркта, кровоизлиянию и легочной внутрисосудистой коагулопатии, вызванной COVID-19.
«Цитокиновый шторм» как индуктор синдрома системного воспалительного ответа
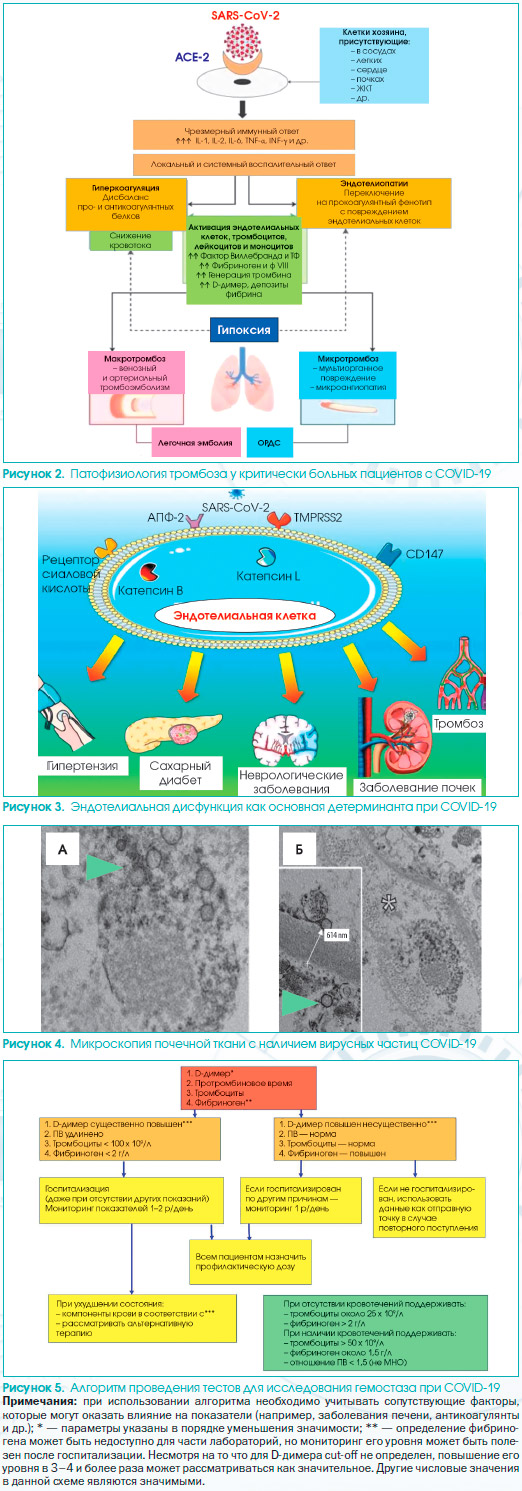
Вирус SARS-CoV-2 проникает в клетки хозяина, связываясь с ангиотензинпревращающим ферментом (АПФ), который экспрессируется в альвеолярных эпителиальных клетках легких, миоцитах сердца, сосудистом эндотелии и других клетках (рис. 2) [19, 20].
При агрессивном проникновении SARS-CоV-2 в легкие происходит нарушение функционирования эпителиальных и эндотелиальных клеток, что приводит к высвобождению провоспалительных цитокинов (IL-1b, IL-6 и TNF-a) [21, 22].
Связь между SARS-CОV-2-ассоциированной гипоксией, воспалительным ответом и гиперкоагуляцией с эндотелиопатией
В этой концепции центральная роль принадлежит эндотелию. Во-первых, COVID-19-ассоциированная гипоксия приводит к сужению сосудов и замедлению кровотока, что способствует эндотелиальной дисфункции. Во-вторых, гипоксия может сдвигать базальный антитромботический и противовоспалительный фенотип эндотелия в направлении прокоагулянтного и провоспалительного фенотипа путем изменения факторов транскрипции, таких как ген роста раннего ответа 1 (Egr1) и фактор, индуцируемый гипоксией, 1 (HIF-1). В третьих, COVID-19-связанные провоспалительные цитокины вызывают повреждение эндотелия в результате высвобождения сверхбольших мультимеров фактора Вилле–бранда (ULVWF), участвующих в первичном гемостазе, и сверхэкспрессию тканевого фактора [23]. Сверхбольшие мультимеры фактора Виллебранда действуют как мост между активированными тромбоцитами, поврежденными эндотели–альными клетками и субэндотелием. Циркулирующие моноциты, нейтро–филы, тромбоциты и микрочастицы связываются с активированным эндотелием и тем самым предоставляют возможность тканевому фактору и нейтрофильным вне–клеточным ловушкам (NETs) инициировать коагуляцию через TF/FVIIa. Это приводит к генерированию чрезмерного количества тромбина с последующим состоянием гиперкоагуляции [24] и усилению дисбаланса между прокоагулянтными факторами (FV, FVIII, фибриноген) и природными антикоагулянтами (антитромбин III, протеины С и S).
Макро- и микротромбозы при гиперкоагуляции и эндотелиопатии
Снижение кровотока, вызванное вазоконстрикцией и стазом вместе с эндотелиальным повреждением и гиперкоагуляцией (триада Вирхова), приводит к повышенному риску тромбоза у пациентов с тяжелой формой COVID-19 [25, 26]. Возникновение венозного макро–тромбоза (тромбоз глубоких вен и легочная эмболия) усиливается при чрезмерном образовании тромбина и усугубляется дисбалансом между про- и антикоагулянтными факторами, тогда как при артериальном макротромбозе (инсульт) наблюдается повышение уровней ULVWF [27]. Интересно, что патофизиология COVID-19-связанного системного микротромбоза может быть специфична и, в частности, отличаться от диссеминированной внутри–сосудистой коагуляции. Действительно, в отличие от сепсис-индуцированной коагулопатии, изменение количества тромбоцитов, коагуляционных факторов и фибриногена очень редко приводит к кровотечениям у пациентов с тяжелой формой COVID-19, что свидетельствует о том, что ДВС-синдром является нечастым осложнением при COVID-19 [28]. Микротромбоз легких является патофизиологической основой COVID-19-связанного острого респираторного дистресс-синдрома. У критических пациентов с COVID-19 наблюдаются изменение альвеол и легочные микроваскулиты, связанные с образованием комплекса «тромбоцит — ULVWF», которые прикрепляются к поврежденному эндотелию и приводят к внутриальвеолярному отложению фибрина, образуя локализованный диссеминированный микротромб [29]. Это связано с локальным нарушением тонкого баланса между системой свертывания у пациента и фибринолитическими путями в альвеолярных пространствах. Этот микротромботический вазоокклюзивный процесс будет значительно усиливать сужение сосудов и снижать кровоток, индуцированный глубокой гипоксемией в легочных капиллярах.
Эндотелий сосудов и COVID-19
Эндотелий сосудов является активным паракринным, эндокринным и аутокринным органом, который необходим для регуляции тонуса сосудов в поддержании их гомеостаза [30]. Эндотелиальная дисфункция приводит к смещению сосудистого равновесия в сторону вазоконстрикции с последующей ишемией органов, воспалением тканей и прокоагулянтному состоянию [31]. Вирус SARS-CoV-2 использует рецептор АПФ-2, экспрессируемый пневмоцитами и эпителиальной альвеолярной оболочкой, для заражения хозяина, тем самым вызывая повреждение легких, но в то же время рецептор АПФ-2 экспрессируется на эндотелиальных клетках многих органов, что приводит к их повреждению (рис. 3).
Коронавирус SARS-CoV-2 получает доступ к клеткам-хозяевам посредством связывания его с АПФ-2, рецептором сиаловой кислоты, трансмембранной сериновой протеазой 2 (TMPRSS2), индуктором металлопротеиназы внеклеточного матрикса (CD147). В проникновении вируса также участвуют катепсины B и L. Эндотелиальная дисфункция является общей чертой клинического проявления, наблюдаемой у больных с COVID-19.
Механизм активации эндотелия после «цитокинового шторма» включает мобилизацию кальция, окислительный стресс, снижение регуляции эндотелиальной нитрит–оксидсинтазы, необходимой для образования оксида азота, ремоде–лирование плазматической мембраны, экспозицию таких прокоа–гулянтов, как фосфатилсерин, микрочастицы, экспрессию тканевого фактора, нарушение экспрессии аннексина-5, молекулы адгезии сосуди–стых клеток 1, молекул межклеточной адгезии 1 и высвобождение цитокинов (хемоаттрактант белка-1 моноцитов).
В качестве примера на рис. 4 представлена микроскопия почечной ткани, которая показывает наличие вирусных частиц в перитубулярном пространстве и в эндотелиальных клетках клубочковых капиллярных петель. Агрегаты вирусных частиц (показаны стрелкой) отображаются как плотная круглая поверхность со светлым центром. Звездочкой на рис. 2Б обозначено перитубулярное пространство, соответствующее капилляру, содержащему вирусные частицы, а также клубочковая базальная мембрана с эндотелиальной клеткой и вирусной частицей (стрелка; около 150 нм в диаметре).
Таким образом, механизм гиперкоагуляции у пациентов с COVID-19 может быть связан с выраженной эндотелиальной дисфункцией.
Антифосфолипидные антитела
Опубликованы отдельные серии работ, в которых отмечается, что у пациентов с COVID-19 и массивным тромбозом выявлено повышение титров антител к фосфолипидам. Однако подобные транзиторные изменения могут носить неспецифический характер, поскольку часто выявляются при выраженной воспалительной реакции [32–37].
Мониторинг маркеров коагуляции
Для мониторинга маркеров гемостаза у пациентов с COVID-19 рекомендовано проводить следующие тесты [38]:
1. Определение количества тромбоцитов.
2. Протромбиновое время.
3. Активированное частичное тромбопластиновое время.
4. D-димер.
5. Фибриноген.
Клиническое значение параметров тромбоэластографии при COVID-19-ассоциированной коагулопатии продолжает изучаться, но она не должна использоваться рутинно при лечении пациентов.
У пациентов с COVID-19 отмечается нарастание уровня D-димера и продуктов деградации фибрина, удлинение протромбинового времени (с), а также снижение концентрации фибриногена и антитромбина III.
На рис. 5 представлен рекомендуемый алгоритм проведения тестов для исследования гемостаза при COVID-19 (ISTH, Международное общество по тромбозам и гемостазу) [39].
Заключение
Нарушение системы гемостаза у пациентов с COVID-19 связано с повышенным риском смерти. Актуальность этого становится все более очевидной, так как у значительной части пациентов с тяжелой формой COVID-19 развиваются, одна–ко иногда не распознаются артериальные и тромбоэмболические осложнения. –Среди изменений показателей, характеризующих состояние системы гемостаза и связанных с тяжестью заболевания и его прогнозом, при COVID-19 отмечаются повышение в крови уровня D-димера, увеличение протромбинового времени, а также тромбинового и активированного частичного тромбопластинового времени. Тромбоцитопения также связана с тяжестью и прогнозом заболевания, однако редко бывает выраженной.
Список литературы
находится в редакции