Журнал «Боль. Суставы. Позвоночник» Том 10, №3, 2020
Вернуться к номеру
Якість кісткової тканини та її мінеральна щільність у хворих на хронічне обструктивне захворювання легень
Авторы: Поворознюк В.В.(1), Масік Н.П.(2), Дзерович Н.І.(1)
(1) — ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України», м. Київ, Україна
(2) — Вінницький національний медичний університет ім. М.І. Пирогова, м. Вінниця, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
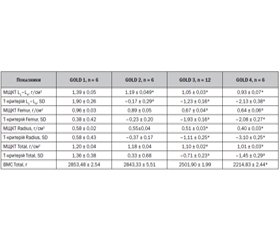
Мета — вивчення впливу хронічного обструктивного захворювання легень (ХОЗЛ) на мінеральну щільність кісткової тканини (МЩКТ) та її якість залежно від тяжкості захворювання та віку жінок. Матеріали та методи. Обстежено 30 жінок віком 57,43 ± 7,87 року, хворих на ХОЗЛ різної тяжкості (GOLD 1–4). Досліджували МЩКТ усього скелета, поперекового відділу хребта, шийки стегнової кістки та дистального відділу кісток передпліччя за допомогою двохенергетичної рентгенівської абсорбціометрії (DЕХА). Показник trabecular bone score (TBS) поперекового відділу хребта (L1–L4) визначали за допомогою методики TBS iNsight (Med-Imaps, Pessac, Франція). Результати. Установлено вірогідне зменшення МЩКТ усіх досліджуваних ділянок скелета, починаючи з GOLD 3, тоді як на рівні L1–L4 МЩКТ починала знижуватись із GOLD 2 та в загальній групі хворих віком 45–59 років порівняно з більш молодими особами. Установлено негативні кореляційні зв’язки тяжкості ХОЗЛ із МЩКТ стегнової (r = –0,75, p < 0,05), променевої кісток (r = –0,73, p < 0,05), L1–L4 (r = –0,80, p < 0,05) та усього скелета (r = –0,73, p < 0,05). Показник TBS, починаючи з GOLD 2, а також у жінок віком старше 45 років відповідав частковому порушенню якості кістки, прогресивно знижувався і при GOLD 4 та в осіб старше 60 років відповідав значній втраті якості кістки. Найбільш виражені зміни відбувались на рівні TBS L1 і відповідали значній втраті якості кістки вже при GOLD 2. Установлено кореляційні зв’язки тяжкості ХОЗЛ і TBS L1–L4 (r = –0,76, p < 0,05) і TBS L2–L4 (r = –0,75, p < 0,05). Висновки. Вік однаковою мірою впливає як на МЩКТ, так і на TBS хворих на ХОЗЛ жінок, і, починаючи з 45 років, дані показники прогресивно зменшуються. Вплив ХОЗЛ на кісткову тканину залежно від тяжкості хвороби є неоднорідним у різних сегментах аксіального скелета. Найперші зміни стосуються МЩКТ L1–L4 (1,19 ± 0,05) г/см2 порівняно з GOLD 1 (1,39 ± 0,05) г/см2 (p < 0,05) і TBS L1 (1,17 ± 0,06) порівняно з GOLD 1 (1,34 ± 0,06; p < 0,05), зниження яких відмічається вже при GOLD 2.
Цель — изучение влияния хронической обструктивной болезни легких (ХОБЛ) на минеральную плотность костной ткани (МПКТ) и ее качество в зависимости от тяжести заболевания и возраста женщин. Материалы и методы. Обследовано 30 женщин в возрасте 57,43 ± 7,87 года, больных ХОБЛ различной стадии (GOLD 1–4). Исследовали МПКТ всего скелета, поясничного отдела позвоночника (L1–L4), шейки бедренной кости и дистального отдела костей предплечья с помощью двухэнергетической рентгеновской абсорбциометрии (DЕХА). Показатель trabecular bone score (TBS) поясничного отдела позвоночника (L1–L4) определяли с помощью методики TBS iNsight (Med-Imaps, Pessac, Франция). Результаты. Установлено достоверное уменьшение МПКТ на всех исследуемых участках скелета у больных, начиная с GOLD 3, тогда как на уровне L1–L4 МПКТ начинала снижаться при GOLD 2 и в возрастной группе 45–59 лет по сравнению с более молодыми пациентами. Установлены корреляционные связи тяжести ХОБЛ и МПКТ бедренной кости (r = –0,75, p < 0,05), лучевой кости (r = –0 73, p < 0,05), L1–L4 (r = –0,80, p < 0,05), всего скелета (r = –0,73, p < 0,05). Значения TBS, начиная с GOLD 2, а также у женщин старше 45 лет соответствовали частичному нарушению качества кости. TBS прогрессивно снижалась и при GOLD 4 и у женщин старше 60 лет соответствовала значительной потере качества костной ткани. Наиболее выраженные изменения выявлены на уровне TBS L1 и соответствовали значительной потере качества костной ткани уже при GOLD 2. Установлены отрицательные корреляционные связи между тяжестью ХОБЛ и TBS L1–L4 (r = –0,76, p < 0,05) и TBS L2–L4 (r = –0,75, p < 0,05). Выводы. Возраст в равной степени влияет как на МПКТ, так и TBS больных ХОБЛ женщин, и, начиная с 45-летнего возраста, данные показатели прогрессивно снижаются. Влияние ХОБЛ на костную ткань в зависимости от тяжести заболевания неоднородно в разных сегментах аксиального скелета. Самые ранние изменения касаются МПКТ L1–L4 (1,19 ± 0,05) г/см2 по сравнению с GOLD 1 (1,39 ± 0,05) г/см2 (p < 0,05) и TBS L1 (1,17 ± 0,06) по сравнению с GOLD 1 (1,34 ± 0,06; p < 0,05), снижение которых наблюдается уже у больных с GOLD 2.
Background. The objective of the work is to study the effect of chronic obstructive pulmonary disease (COPD) on mineral density (BMD) and trabecular bone score (TBS), depending on the degree of severity and women's age. Materials and methods. We have examined 30 women aged 57.43 ± 7.87 years, patients with COPD of various stages (GOLD 1–4). We have studied the BMD Total, BMD the lumbar spine (L1–L4), BMD Femur, and BMD Radius by means of dual-energy X-ray absorptiometry (DEXA). TBS of the lumbar spine (L1–L4) was determined by the TBS iNsight method (Med-Imaps, Pessac, France). Results. A significant decrease of the BMD was found at every skeletal area starting from GOLD 3, whereas at the L1–L4 level the BMD began to decrease at GOLD 2. The correlation was found between the severity of COPD and BMD Femur (r = –0.75, p < 0.05), BMD Radius (r = –0 73, p < 0.05), BMD L1–L4 (r = –0.80, p < 0.05) BMD Total (r = –0.73, p < 0.05). Starting from GOLD 2, the values of TBS significantly decreased and corresponded to the partial bone quality loss. The most pronounced changes occurred at the level of TBS L1 and corresponded to a significant bone quality loss already at GOLD 2. The TBS progressively decreased and at GOLD 3–4 corresponded to a significant loss of bone quality. The correlation was found between the severity of COPD and TBS of the spine at the level of L1–L4 (r = –0.76, p<0.05), TBS of the spine at the level of L2–L4 (r = –0.75, p<0.05). Conclusions. Age equally affects both BMD and TBS in women with COPD, and from the age of 45, these rates progressively decrease. The effect of COPD on bone tissue according to the severity of the disease is heterogeneous at different segments of the axial skeleton. The earliest changes concern the decrease in BMD L1-L4 (1.19 ± 0.05) g/cm2 compared to GOLD 1 (1.39 ± 0.05) g/cm2 (p < 0.05) and TBS L1 (1.17 ± 0.06) in comparison with GOLD 1 (1.34 ± 0.06; p < 0.05), whose decrease is observed already at GOLD 2.
хронічне обструктивне захворювання легень; якість кісткової тканини; мінеральна щільність кісткової тканини
хроническая обструктивная болезнь легких; качество костной ткани; минеральная плотность костной ткани
chronic obstructive pulmonary disease; trabecular bone score; bone mineral density
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Mostovoy Y.M., Slepchenko N.S., Dmytriiev K.D., Sidorov A.A. Chronic obstructive pulmonary disease and the heart: achievments and current questions. Ukr. Pulmonol. J. 2018. 4. 56-61. doi: 10.31215/2306-4927-2018-102-4-56-61.
- Pertseva Т.О., Кnopkina L.І. Modern views on the diagnosis and treatment of chronic obstructive pulmonary disease. Ukr. Pulmonol. J. 2018. № 4. 13-15.
- Feshchenko Y.I. Urgent challenges of modern pulmonology. Ukr. Pulmonol. J. 2018. 4. 8-12.
- Feshchenko Y.I., Gavrysyuk V.K., Dziublyk A.Y. et al. Adapted clinical guideline: chronic obstructive pulmonary disease (part 1) Ukr. Pulmonol. J. 2019. 2. 5-18. doi: 10.31215/2306-4927-2019-104-2-5-18.
- Global Initiative for Chronic Obstructive Lung Disease. Workshop report, global strategy for diagnosis, ma–nagement, and prevention of COPD. Update 2007. Bethesda, National Institutes of Health, National Heart, Lung and Blood Institute, 2007.
- Masik N.P. Vitamin D metabolism disturbances: one more extrapulmonary effect of systemic inflammation in chronic obstructive pulmonary disease. Ukr. Pulmonol. J. 2015. 1. 39-43.
- Barabanova E.N. GOLD 2017: what change were made in global strategy of treatment of chronic obstructive pulmonary disease and why? Russian Pulmonology. 2017. 27(2). 274-282. doi: 10.18093/0869-0189-2017-27-2-274-282.
- Mullerova Н., Maselli D.J., Locantore N. et al. Hospitalized Exacerbations of COPD Risk Factors and Outcomes in the ECLIPSE Cohort. Chest. 2015. 147(4). 999-1007.
- Todoriko L.D. Formation of systemic manifestations and definition of progression predictors of chronic obstructive pulmonary disease using a factor analysis. Ukr. Pulmonol. J. 2019. 1. 49-54. doi: 10.312.15/2306-4927-2019-103-1-49-54.
- Gan W.Q., Man S.F., Senthilselvan A., Sin D.D. Association between chronic obstructive pulmonary disease and systemic inflammation: a systematic review and a meta-analysis. Thorax. 2004. 59(7). 574-580. doi: 10.1136/thx.2003.019588.
- Ovsyannikov E.S., Avdeev S.N., Budnevsky A.V. Systemic inflammation in patients with chronic obstructive pulmonary disease and obesity. Therapeutic Archive. 2020. 92(3). 13-18. doi: 10.26442/00403660.2020.03.000265.
- Jaramillo J.D., Wilson C., Stinson D.J. et al. Reduced bone density and vertebral fractures in smokers: men and COPD patients at increased risk. Annals of the American Thoracic Society. 2015. 5(12). 648-656. doi: 10.1513/AnnalsATS.201412-591OC.
- Global Strategy for the Diagnosis, Management and Prevention of Chronic Obstructive Pulmonary Disease: 2017 Report. http://goldcopd.org/gold-2017-global-strategy-diagnosis-managementprevention-copd.
- Gerych P.R. Clinic-functional features of motion of cardio-respiratory pathology for patients with the chronic obstructive pulmonary disease. Vіsnik problem bіologії і medicine. 2017. 4(139). 121-127.
- Barnes P.J., Celli B.R. Systemic manifestations and comorbidities of COPD. Eur. Respir. J. 2009. 33. 1165-1185.
- Povoroznyk V.V., Musiienko A.S., Dzerovych N.I. Trabecular Bone Score and Bone Mineral Density in Men with Vertebral Fractures. Pain. Joints. Spine. 2015. 1(17). 38-42.
- Povoroznyuk V.V., Dzerovych N.I., Orlyk T.V. Trabecular bone score in clinical practice: literature review and results of the own study. Problems of osteology. 2014. 17(2). 3-13.
- Povoroznyuk V.V., Hans D., Dzerovych, N.I. Trabecular bone score in clinical practice. Pain. Joints. Spine. 2014. 16(4). 14-22.
- Povoroznyuk V.V., Dzerovych N.I., Hans D. Trabecular bone score in clinical practice (review). Orthopedics, traumatology and prosthetics. 2015. 2. 126-136. doi: 10.15674/0030-598720152126-136.
- Malanchuk V.O., Kopchak O.V. Evaluation of the quality of facial bones and skull classification of its type on the basis of biomechanical parameters. Ukr. med. Chasopis. 2013. 1(93), I/II. 126-131.
- Brusko A.T. The biological law of compliance of quantity and function of bone tissue. Bulletin of orthopedics, traumatology and prosthetics. 2010. 1. 76-78.
- Orlyk T.V., Povoroznyuk V.V., Dzerovych N.I. The role of quality trabecular bone in the formation of vertebral pain in postmenopausal women. Problems of osteology. 2015. 18(1). 51-54.
- Order of the Ministry of Health of June 27, 2013 № 555 “Unified clinical protocol of primary, secondary (specialized), tertiary (highly specialized) medical care and medical rehabilitation. Chronic obstructive pulmonary disease”: http://mtd.dec.gov.ua/images/dodatki/2013_555_HOZL/2013_555hozl_ykpmd.pdf
- Silva B.C., Leslie W.D., Resch H. et al. Trabecular bone score: a noninvasive analytical method based upon the DXA image. J. Bone Mineral Res. 2014. 29(3). 518-530. doi: 10.1002/jbmr.2176.
- Harvey N.C., Glüer C.C., Binkley N. et al. Trabecular bone score (TBS) as a new complementary approach for osteoporosis evaluation in clinical practice. Bone. 2015. 78. 216-224. doi: 10.1016/j.bone.2015.05.016.
- Shevroja E., Lamy O., Kohlmeier L. et al. Use of Trabecular Bone Score (TBS) as a Complementary Approach to Dual-energy X-ray Absorptiometry (DXA) for Fracture Risk Assessment in Clinical Practice. J. Clin. Densitom. 2017. 20(3). 334-345. doi: 10.1016/j.jocd.2017.06.019.
- Labotsky V.V. Knowledge management (technologies, methods, means of presentation, extraction and measurement of knowledge). Mn.: Modern. school, 2006. 392 р.
- Casado E., Del Rio L., Gallego M. et al. Trabecular Bone Score Is Severely Affected in Male Patients with Chronic Obstructive Pulmonary Disease. Annals of the Rheumatic Diseases. 2016. 75. 1170. doi: 10.1136/annrheumdis-2016-eular.4752.
- González J., Rodríguez-Fraile M., Rivera P. et al. Trabecular bone score in active or former smokers with and without COPD. PLoS One. 2019. 14(2). e0209777. doi: 10.1371/journal.pone.0209777.
- Cheol-Woo Kim. Is Trabecular Bone Score a More Sensitive Marker for Osteoporosis in Asthmatics? Allergy Asthma Immunol Res. 2019. 11(3). 302-305. doi: 10.4168/aair.2019.11.3.302.
- Choi Y.J., Lee H.-Y., Yoon D. et al. Trabecular Bone Score Is More Sensitive to Asthma Severity and Glucocorticoid Treatment Than Bone Mineral Density in Asthmatics. Allergy Asthma Immunol. Res. 2019. 11(3). 343-356. doi: 10.4168/aair.2019.11.3.343.
- Watanabe R., Tai N., Hirano J. et al. Independent association of bone mineral density and trabecular bone score to vertebral fracture in male subjects with chronic obstructive pulmonary disease. Osteoporos. Int. 2018. 29(3). 615-623. doi: 10.1007/s00198-017-4314-7.
- Shevroja E., Lamy O., Kohlmeier L. et al. Use of Trabecular Bone Score (TBS) as a Complementary Approach to Dual-energy X-ray Absorptiometry (DXA) for Fracture Risk Assessment in Clinical Practice. J. Clin. Densitom. 2017. 20(3). 334-345. doi: 10.1016/j.jocd.2017.06.019.

/49.jpg)
/50.jpg)
/51.jpg)
/52.jpg)