Журнал «Боль. Суставы. Позвоночник» Том 10, №4, 2020
Вернуться к номеру
Ревматическая полимиалгия в клинических рекомендациях 2018–2020 годов. Часть I. Группы риска, адъювантная терапия
Авторы: Пузанова О.Г.
ЧВУЗ «Киевский медицинский университет», г. Киев, Украина
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
На початку Декади здорового старіння стала доступна низка клінічних настанов щодо ведення ревматичних хвороб у осіб літнього віку. Мета публікації — характеристика й обговорення настанови з ревматичної поліміалгії Італійського товариства ревматологів (2020) і настанови щодо застосування позитронно-емісійної томографії/комп’ютерної томографії при васкулітах крупних судин і ревматичній поліміалгії Європейської асоціації ядерної медицини, Товариства ядерної медицини та молекулярної візуалізації та Американського товариства ядерної кардіології (2018). Матеріали та методи. Зміст, першоджерела й методологію створення настанов вивчено за допомогою методів інформаційного аналізу та співставлено з настановами щодо ревматичної поліміалгії та гігантоклітинного артеріїту 2018–2020 рр. Європейської антиревматичної ліги, Американської колегії ревматологів, Німецького, Австрійського, Швейцарського, Британського товариств ревматологів, Європейської федерації головного болю та їх першоджерелами. Встановлено пріоритет консенсусного підходу в розробці сучасних настанов із ревматичної поліміалгії. Особливістю методології створення італійських настанов є звуження пошуку прототипів до двох баз даних доказової медицини й «сірої» літератури та відбір для адаптації трьох настанов, зокрема розробки товариств ядерної медицини. Актуалізовано питання ведення пацієнтів у первинній ланці (запропоновано алгоритм), спільного прийняття клінічних рішень, настороженості щодо гігантоклітинного артеріїту. Доказами підтримано лише стартові дози глюкокортикоїдів як терапії першої лінії, допускається альтернуючий режим їх зниження. Обґрунтовано неефективність гідроксихлорохіну, не обговорюються прийом азатіоприну й засоби альтернативної медицини. Слід визначити чинники ризику розвитку васкуліту, рецидивів, тривалого прийому глюкокортикоїдів і їх побічних ефектів. Уперше для виявлення васкуліту рекомендовано використання позитронно-емісійної томографії/комп’ютерної томографії. Найдоведенішою, найсильнішою й найбільш погодженою є рекомендація щодо ад’ювантної терапії метотрексатом і відмови від біологічних препаратів, найменш погодженою — позиція щодо направлення до ревматолога. Висновки. Розв’язання такої актуальної проблеми охорони здоров’я, як підвищення якості медичної допомоги при ревматичній поліміалгії, передбачає покращення медичних стандартів із більшості клінічно важливих питань, виявлення пацієнтів високого ризику, направлення їх до ревматологів і офтальмологів, розгляд переваг лікування метотрексатом тощо.
В начале Декады здорового старения стал доступен ряд клинических рекомендаций по ведению ревматических болезней у пожилых. Цель публикации — характеристика и обсуждение руководства по ревматической полимиалгии Итальянского общества ревматологов (2020) и рекомендаций по применению позитронно-эмиссионной томографии/компьютерной томографии при васкулитах крупных сосудов и ревматической полимиалгии Европейской ассоциации ядерной медицины, Общества ядерной медицины и молекулярной визуализации и Американского общества ядерной кардиологии (2018). Материалы и методы. Содержание, первоисточники и методология разработки руководств изучены с помощью методов информационного анализа и сопоставлены с рекомендациями 2018–2020 гг. по ревматической полимиалгии и гигантоклеточному артерииту Европейской антиревматической лиги, Американской коллегии ревматологов, Немецкого, Австрийского, Швейцарского, Британского обществ ревматологов, Европейской федерации головной боли и их первоисточниками. Установлен приоритет консенсусного подхода в разработке современных руководств по ревматической полимиалгии. Особенность методологии создания итальянских рекомендаций состоит в сужении поиска прототипов до двух баз данных доказательной медицины и «серой» литературы и в отборе для адаптации трех руководств, включая разработку обществ ядерной медицины. Актуализированы вопросы ведения пациентов в первичном звене (предложен алгоритм), совместного принятия клинических решений, настороженности в отношении гигантоклеточного артериита. Доказательствами поддержаны лишь начальные дозы глюкокортикоидов как терапии первой линии; допускается альтернирующий режим их снижения. Обоснована неэффективность гидроксихлорохина, не обсуждается прием азатиоприна и средств альтернативной медицины. Следует установить факторы риска развития васкулита, рецидивов, длительного приема глюкокортикоидов и их побочных эффектов. Впервые для выявления васкулита рекомендовано применение позитронно-эмиссионной томографии/компьютерной томографии. Самой доказанной, сильной, согласованной является рекомендация по адъювантной терапии метотрексатом и отказу от биологических препаратов, наименее согласованной — позиция по направлению к ревматологу. Выводы. Решение такой актуальной проблемы здравоохранения, как повышение качества медицинской помощи при ревматической полимиалгии, предполагает усовершенствование медицинских стандартов по большинству клинически важных вопросов, выявление пациентов высокого риска, направление их к ревматологам и офтальмологам и рассмотрение преимуществ лечения метотрексатом.
At the beginning of the Healthy Ageing Decade, a number of guidelines were published describing management of the rheumatic diseases of the elderly. The aim of the paper is to characterize and discuss the Italian Society of Rheumatology’s guideline for polymyalgia rheumatica (2020) and the European Association of Nuclear Medicine, the Society of Nuclear Medicine and Molecular Imaging, and the American Society of Nuclear Cardiology’s (2018) recommendation for positron-emission tomography/computed tomography imaging to diagnose the large vessel vasculitis and polymyalgia rheumatica. The following methods were used: original texts of recommedations, their content and methodology behind the development of both guidelines were studied by means of information analysis and compared with the recommendations for the management of polymyalgia rheumatica and giant cell arteritis elaborated in 2018–2020 by the European League Against Rheumatism, American College of Rheumatology; the German, Austrian, Swiss and British rheumatological societies; the European Headache Federation and their references. We’ve established the priority of consensus approach for the development of modern guidelines for polymyalgia rheumatica. The specific feature of the Italian guideline’s development is the search for prototypes restricted to the two evidence-based medicine databases and the grey literature as well as selection of three international guidelines for adaptation, one of them elaborated by the societies for nuclear medicine. The following issues were updated: the patient management in primary care (whose algorithm is proposed), including the conserted clinical decision-making and alertness to the giant cell arteritis. Out of the first-line therapy tools, only the initial doses of glucocorticoids are evidence-based, and their reduction is allowed as an alternating regimen. The ineffectiveness of hydroxichloroquine use is justified, while both azathioprine and alternative medical drugs are not subject to discussion. It is necessary to identify the risk factors for vasculitis and its relapses, longterm glucocorticoid use and their side effects. For the first time, the use of positron-emission tomography/computed tomography is recommended for detecting of vasculitis. The recommendation for adjuvant therapy with methotrexate and abstaining from the biologic agents is found the most evidence-based, strongest and consistent; referral to a rheumatologist being the least agreed-on position. Conclusion. Solving such an urgent healthcare problem as improving the quality of polymyalgia rheumatic management suggests the medical standards being raised on the most clinically important issues, the importance of at-risk patient identification and referral to rheumatologists and ophthalmologists, and consideration of the methotrexate’s benefits.
ревматична поліміалгія; гігантоклітинний артеріїт; ускладнення; діагностика; лікування; метотрексат; стандарти; огляд
ревматическая полимиалгия; гигантоклеточный артериит; осложнения; диагностика; лечение; метотрексат; стандарты; обзор
polymyalgia rheumatica; giant cell arteritis; complications; diagnosis; treatment; review
Введение
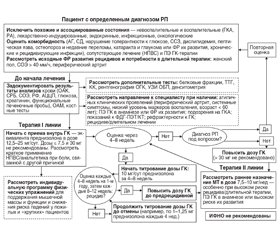
Руководство Итальянского ревматологического общества по ведению РП
Выводы
- World Health Organization. Executive Board 146th session on December 11, 2019. Provisional agenda item 17; EB146/23. Development of a proposal for a Decade of Healthy Ageing 2020-2030. URL: https://apps.who.int/gb/ebwha/pdf_files/EB146_23-en.pdf. (дата доступа: 18.10.2020).
- Lahaye C., Tatar Z., Dubost J.J. et al. Management of inflammatory rheumatic conditions in the elderly. Rheumatology. 2019. 58. 748-764. doi: 10.1093/rheumatology/key165.
- Partington R.J., Muller S., Helliwell T. et al. Incidence, prevalence, and treatment burden of polymyalgia rheumatica in the UK over two decades: a population-based study. Ann. Rheum. Dis. 2018. 77 (12). 1750-1756. doi: 10.1136/annrheumdis-2018-213883.
- Fardet L., Petersen I., Nazareth I. Prevalence of long-term oral glucocorticoid prescriptions in the UK over the past 20 years. Rheumatology. 2011. 50 (11). 1982-1990. doi: 10.1093/rheumatology/ker017.
- Shbeeb I., Challah D., Raheel S. et al. Comparable rates of glucocorticoid-associated adverse events in patients with polymyalgia rheumatica and comorbidities in the general population. Arthritis Care Res. 2018. 70. 643-647. doi: 10.1002/acr.23320.
- Dubost J.J., Pereira B., Fan A., Soubrier M. What is the starting dose of steroid prescribed by rheumatologist in the management of polymyalgia rheumatica? Ann. Rheum. Dis. 2019. 0. 1. doi: 10.1136/annrheumdis-2019-216050.
- Albrecht K., Callhoff J., Zink A. Long-term trends in rheumatology care. Achievements and deficits in 25 years of the German national rheumatology database. Z. Rheumatol. 2019. 78 (Suppl. 2). S65-S72. doi: 10.1007/s00393-019-0680-1.
- Сатыбалдыев А.М. Эволюция диагностики ревматической полимиалгии. Научно-практическая ревматология. 2019. 57 (6). 693-698. doi: 10.14412/1995-4484-2019-693-698.
- Twohig H., Mitchell C., Mallen C. et al. «I suddenly felt I’d aged»: A qualitative study of patient experiences of polymyalgia rheumatica (PMR). Patient Education and Counseling. 2015. 98 (5). 645-650. doi: 10.1016/j.pec.2014.12.013.
- González-Gay M.A., Matteson E.L., Castañeda S. Polymyalgia rheumatica. Lancet. 2017. 390. 1700-1712. doi: 10.1016/S0140-6736 (17)31825-1.
- Sobrero A., Manzo C., Stimamiglio A. The role of the general practitioner and the out-of-hospital public rheumatologist in the diagnosis and follow-up of patients with polymyalgia rheumatica. Reumatismo. 2018. 70 (1). 44-50. doi: 10.4081/reumatismo.2018.1036.
- Helliwell T., Hider S.L., Mallen C. Polymyalgia rheumatica: diagnosis, prescribing and monitoring in general practice. Br. J. Gen. Pract. 2013. 63 (610). e361-366. doi: 10.3399/bjgp13X667231.
- Manger B. Checkliste XXL Rheumatologie. [3. Aufl.] Stuttgart — New York: Georg Thieme Verlag, 2005. 576 p. ISBN: 3-13-763003-7.
- Faez S., Lobo A.M., Unizony S.H. et al. Ocular inflammatory disease in patients with polymyalgia rheumatica: A case series and review of the literature. Clin. Rheumatol. 2016. 35 (1). 251-258. doi: 10.1007/s10067-014-2558-6.
- Arai T., Tanaka R., Kaburaki T. Ocular inflammation associated with polymyalgia rheumatica without concomitant giant-cell arteritis: a report of three cases. Ocul. Immunol. Inflamm. 2018. 26 (5). 779-782. doi: 10.1080/09273948.2017.1278776.
- Hancock A.T., Mallen C.D., Muller S. et al. Risk of vascular events in patients with polymyalgia rheumatica. CMAJ. 2014. 186. E495-501. doi: 10.1503/cmaj.140266.
- Pujades-Rodriguez M., Duyx B., Thomas S.L. et al. Association between polymyalgia rheumatica and giant cell arteritis and 12 cardiovascular diseases. Heart. 2016. 102 (5). 383-389. doi: 10.1136/heartjnl-2015-308514.
- Bassendine M.F., Bridge S.H. Relapse of polymyalgia rheumatica following adjuvanted influenza vaccine: a case-based review. Eur. J. Rheumatol. 2020. 7 (1). 37-40. doi: 10.5152/eurjrheum.2019.19152.
- Hayward R.A., Rathod T., Muller S. et al. Association of polymyalgia rheumatica with socioeconomic status in primary care: a cross-sectional observational study. Arthritis Care Res. 2014. 66 (6). 956-960. doi: 10.1002/acr.2276.
- Salvarani С., Macchioni P., Rossi F. et al. Epidemiologic and immunogenetic aspects of polymyalgia rheumatica and giant cell arteritis in northern Italy. Arthritis Rheum. 1991. 34 (3). 351-356. doi: 10.1002/art.1780340313.
- Salaffi F., DeAngelis R., Grassi W.; MArche Pain Prevalence; INvestigation Group (MAPPING) study. Prevalence of musculoskeletal conditions in an Italian population sample: results of a regional community-based study. I. The MAPPING Study. Clin. Exp. Rheumatol. 2005. 23 (6). 819-828. PMID: 16396700.
- De Socio A., Perrotta F.M., Grasso G.M., Lubrano E. Incidence of rheumatoid arthritis, psoriatic arthritis and polymyalgia rheumatica in an inland area of central Italy: results of the CAMPO-RHE study. Postgrad. Med. 2018. 130 (1). 137-141. doi: 10.1080/00325481.2018.1399774.
- Dasgupta B., Cimmino M.A., Maradit-Kremers H. et al. 2012 provisional criteria for polymyalgia rheumatica: a European League Against Rheumatism/American College of Rheumatology collaborative initiative. Ann. Rheum. Dis. 2012. 71. 484-492. doi: 10.1136/annrheumdis-2011-200329.
- Dejaco C., Singh Y.P., Perel P. et al. European League Against Rheumatism; American College of Rheumatology. 2015 Recommendations for the management of polymyalgia rheumatica: a European League Against Rheumatism/American College of Rheumatology collaborative initiative. Ann. Rheum. Dis. 2015. 74. 1799-1807. doi: 10.1136/annrheumdis-2015-207492.
- Macchioni P., Boiardi L., Catanoso M. et al. Performance of the new 2012 EULAR/ACR classification criteria for polymyalgia rheumatica: comparison with the previous criteria in a single-centre study. Ann. Rheum. Dis. 2014. 73 (6). 1190-1193. doi: 10.1136/annrheumdis-2013-204167.
- Dejaco C., Ramiro S., Duftner C. et al. EULAR recommendations for the use of imaging in large vessels vasculitis in clinical practice. Ann. Rheum. Dis. 2018. 77 (5). 636-643. doi: 10.1136/annrheumdis-2017-212649.
- Slart R.H.J.A., Writing Group; Reviewer Group. FDG-PET/CT (A) imaging in large vessel vasculitis and polymyalgia rheumatica: joint procedural recommendation of the EANM, SNMMI, and the PET Interest Group (PIG), and endorsed by the ASNC. Eur. J. Nucl. Med. Mol. Imaging. 2018. 45 (7). 1250-1269. doi: 10.1007/s00259-018-3973-8.
- Buttgereit F., Brabant T., Dinges H. et al. S3-Leitlinie zur Behandlung der Polymyalgia rheumatica: Evidenzbasierte Leitlinie der Deutschen Gesellschaft für Rheumatologie (DGRh), der Österreichischen Gesellschaft für Rheumatologie und Rehabilitation (ÖGR) und der Schweizerischen Gesellschaft für Rheumatologie (SGR) und der beteiligten medizinisch-wissenschaftlichen Fachgesellschaften und weiterer Organisationen. Z. Rheumatol. 2018. 5. doi: 10.1007/s00393-018-0476-8.
- Пузанова О.Г., Мошковская Ю.О., Соболь В.О. Ревматическая полимиалгия: объединяя усилия европейских ревматологических обществ. Боль. Суставы. Позвоночник. 2020. 3. 118-126. doi: 10.22141/2224-1507.10.3.2020.212033.
- Ughi N., Sebastiani G.D., Gerli R. et al. The Italian Society of Rheumatology clinical practice guidelines for the management of polymyalgia rheumatica. Reumatismo. 2020. 72 (1). 1-15. doi: 10.4081/reumatismo.2020.1268.
- Salvarani C., Pipitone N., Versari A., Hunder G.G. Clinical features of polymyalgia rheumatica and giant cell arteritis. Nat. Rev. Rheumatol. 2012. 8 (9). 509-521. doi: 10.1038/nrrheum.2012.97.
- Brouwers M.C., Kho M.E., Browman G.P. et al.; for the AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting, and evaluation in clinical practice. CMAJ. 2010. 182 (18). E839-E842. doi: 10.1503/cmaj.090449.
- Fervers B., Burgers J.S., Voellinger R. et al.; the ADAPTE Collaboration. Guideline adaptation: an approach to enhance efficiency in guideline development and improve utilization. BMJ Qual. Saf. 2011. 20 (3). 228-236. doi: 10.1136/bmjqs.2010.043257.
- Oxford Centre for Evidence-based Medicine. Levels of Evidence. March 2009. URL: http://www.cebm.net/oxford-centre-evidence-based-medicine-levels-evidence-march-2009 (дата доступа: 17.07.2020).
- Campbell А.М., Martin J.R., Erstad B.L. Corticosteroid tapering regimens in rheumatic diseases: a systematic review. J. Clin. Rheumatol. 2020. 26 (2). 41-47. doi: 10.1097/RHU.0000000000000917.
- Лызиков A.Н., Пузанова О.Г., Лызиков A.A. Гигантоклеточный артериит: доказанные и дискуссионные аспекты лечения. Боль. Суставы. Позвоночник. 2020. 1. 17-38. doi: 10.22141/2224-1507.10.1.2020.199720.
- Albrecht K., Huscher D., Buttgereit F. et al. Long-term glucocorticoid treatment in patients with polymyalgia rheumatica, giant cell arteritis, or both diseases: results from a national rheumatology database. Rheumatol. Int. 2018. 38 (4). 569-577. doi: 10.1007/s00296-017-3874-3.
- Giollo A., Rossini M., Bettili F. et al. Permanent discontinuation of glucocorticoids in polymyalgia rheumatica is uncommon but may be enhanced by amino bisphosphonates. J. Rheumatol. 2019. 46. 318-322. doi: 10.3899/jrheum.180324.
- Lee J.H., Choi S.T., Kim J.S. et al. Clinical characteristics and prognostic factors for relapse in patients with polymyalgia rheumatica (PMR). Rheumatol. Int. 2013. 33. 1475-1480. doi: 10.1007/s00296-012-2580-4.
- Hattori K., Hirano Y., Kojima T. Predictors of glucocorticoid-free remission in patients with polymyalgia rheumatica treated with prednisolone. Int. J. Rheum. Dis. 2020. doi: 10.1111/1756-185X.13978.
- Quartuccio L., Gregoraci G., Isola M., De Vita S. Retrospective analysis of the usefullness of a protocol with high-dose methotrexate in polymyalgia rheumatica: results of a single-center cohort of 100 patients. Geriart. Gerontol. Int. 2018. 18. 1410-1414. doi: https://doi.org/10.1111/ggi.13460.
- Mazzantini M., Torre C., Miccoli M. et al. Adverse events during longterm low-dose glucocorticoid treatment of polymyalgia rheumatica: a retrospective study. J. Rheumatol. 2012. 39 (3). 552-557. doi: 10.3899/jrheum.110851.
- Müller-Ladner U., Rau R. Methotrexat bei Autoimmunerkrankungen — Moderne Therapiekonzepte in der Rheumatologie, dermatologie und gastroenterologie. [2. Auflage]. Bremen: UNI-MED, 2016. 118 p. ISBN: 978-3-8374-2360-0.
- Fredi M., Cavazzana I., Moschetti L. et al. Brescia Rheumatology COVID-19 Study Group. COVID-19 in patients with rheumatic diseases in northern Italy: a single-centre observational study. Lancet Rheumatol. 2020. 2. e549-556. doi: 10.1016/S2665-9913 (20)30169-7.
- Partington R., Helliwell T., Muller S. et al. Comorbidities in polymyalgia rheumatica: a systematic review. Arthritis Res. Ther. 2018. 20. 258. doi: 10.1136/annrheumdis-2018-213883. doi: 10.1186/s013075-018-1757-y.
- Koster M.J., Matteson E.L., Warrington K.J. Large-vessel giant cell arteritis: diagnosis, monitoring and management. Rheumatology. 2018. 57. ii32-ii42. doi: 10.1093/rheumatology.kex424.
- Нетяженко В.З., Пузанова О.Г. Гигантоклеточный артериит: эпидемиология, диагностика, прогноз. Боль. Суставы. Позвоночник. 2019. 9 (2). 90-107. doi: 10.22141/2224-1507.9.2.2019.172121.
- Camellino D., Dejaco C., Buttgereit F., Matteson E.L. Treat to target: a valid concept for management of polymyalgia rheumatica and giant cell arteritis? Rheum. Dis. Clin. North. Am. 2019. 45 (4). 549-567. doi: 10.1016/j.rdc.2019.07.005.

/21.jpg)
/22.jpg)
/23.jpg)
/28.jpg)