Резюме
Наведений опис клінічного випадку розвитку В-клітинної лімфоми в пацієнтки з оверлап-синдромом первинного синдрому Шегрена (ПСШ) і склередеми Бушке (СБ). Склередема Бушке — рідкісне захворювання, що характеризується дифузним індуративним набряком і ущільненням шкіри. Прийнята умовна класифікація цього захворювання залежно від етіологічного чинника: тип 1 — асоційований з інфекційним захворюванням; тип 2 — з парапротеїнемією і тип 3 — з цукровим діабетом. Існують дуже рідкісні випадки, пов’язані із злоякісними новоутвореннями або автоімунними захворюваннями. Даний клінічний випадок описує рідкісне поєднання СБ з автоімунним захворюванням — ПСШ, що підкреслює важливість вивчення інших асоціацій СБ, зокрема з автоімунними захворюваннями, для забезпечення належного ведення й лікування таких пацієнтів. Захворювання в пацієнтки 51 року дебютувало з щільного набряку обличчя, сухості шкіри, синдрому «сухого ока» й відчуття піску в очах, підвищення температури до субфебрильних цифр і щільних утворень шкіри в ділянці декольте, молочних залоз і міжлопатковій ділянці, що патогістологічно було розцінено як СБ. Виявлено лімфаденопатію, ксерофтальмію, сіалоаденіт, синдром Рейно, діагностовано ураження легень (альвеоліт і бронхіоліт), позитивні ANA, anti-SSa/La, anti-SSb/Ro. На підставі даного симптомокомплексу пацієнтці був виставлений діагноз «оверлап СБ із ПСШ». Застосування комбінованої терапії метотрексатом і метилпреднізолоном дозволило знизити активність захворювання, клінічні й лабораторні прояви хвороби. Однак через 9 місяців після появи перших шкірних симптомів виникло вибухання лівого ока, поширена лімфаденопатія. При патогістологічному обстеженні встановлено діагноз неходжкінської В-клітинної лімфоми. Застосування терапії ритуксимабом призвело до значного регресу пухлини орбіти. Актуальність даного клінічного спостереження — не тільки в рідкісності поєднаної патології, а й у необхідності проведення ранньої діагностики розвитку лімфоми на тлі ПСШ на підставі факторів ризику, до яких відносять низький рівень С4 і/або С3, збільшення привушних слинних залоз, кріоглобулінемію, спленомегалію, персистуючу системну активність і лімфаденопатію, оскільки частота даного захворювання досить висока в цій популяції пацієнтів.
Представлено описание клинического случая развития В-клеточной лимфомы у пациентки с оверлап-синдромом первичного синдрома Шегрена (ПСШ) и склередемы Бушке (СБ). Склередема Бушке — редкое заболевание, характеризующееся диффузным индуративным отеком и уплотнением кожи. Принята условная классификация этого заболевания в зависимости от этиологического фактора: тип 1 — ассоциированный с инфекционным заболеванием; тип 2 — с парапротеинемией и тип 3 — с сахарным диабетом. Существуют очень редкие случаи, связанные со злокачественными новообразованиями или аутоиммунными заболеваниями. Данный клинический случай описывает редкое сочетание СБ с аутоиммунным заболеванием — ПСШ, что подчеркивает важность изучения других ассоциаций СБ, в частности с аутоиммунными заболеваниями, для обеспечения надлежащего ведения и лечения таких пациентов. Заболевание у пациентки 51 года дебютировало с плотного отека лица, сухости кожи, синдрома «сухого глаза» и ощущения песка в глазах, повышения температуры до субфебрильных цифр и плотных образований кожи в области декольте, молочных желез и межлопаточной области, что патогистологически было расценено как СБ. Выявлены лимфаденопатия, ксерофтальмия, сиалоаденит, синдром Рейно, диагностировано поражение легких (альвеолит и бронхиолит), позитивные ANA, anti-SSa/La, anti-SSb/Ro. На основании данного симптомокомплекса пациентке был установлен диагноз «оверлап СБ с ПСШ». Применение комбинированной терапии метотрексатом и метилпреднизолоном позволило снизить активность заболевания, клинические и лабораторные проявления болезни. Однако через 9 месяцев после появления первых кожных симптомов возникло выбухание левого глаза, распространенная лимфаденопатия. При патогистологическом обследовании установлен диагноз неходжкинской В-клеточной лимфомы. Применение терапии ритуксимабом привело к значительному регрессу опухоли орбиты. Актуальность данного клинического наблюдения — не только в редкости сочетанной патологии, но и в необходимости проведения ранней диагностики развития лимфомы на фоне ПСШ, на основании факторов риска, к которым относят низкий уровень С4 и/или С3, увеличение околоушных слюнных желез, криоглобулинемию, спленомегалию, персистирующую системную активность и лимфаденопатию, так как частота данного заболевания достаточно высока в этой популяции пациентов.
This is a presentation of case report on B-cell lymphoma in a patient with overlapping primary Sjogren's syndrome (PSS) and scleredema adultorum of Buschke. Scleredema adultorum of Buschke (SB) is a rare disorder characterized by a diffuse indurative edema and skin tightening. A putative classification of this disease is based on the etiological factors and encompasses three types: Type 1 is associated with an infectious disease; Type 2 with paraproteinemia; Type 3 – with diabetes mellitus. There are very rare cases involving malignant neoplasms or autoimmune diseases. This clinical case describes a rare combination of SB with an autoimmune disease – PSS. It highlights the importance of studying other SB associations, in particular with autoimmune diseases, to ensure proper management and treatment of these patients. For a 51-year-old patient, the disease onset featured a dense facial edema, dry skin, dry eye syndrome and a feeling of sand in the eyes, subfebrile fever and dense skin formations in the low neckline, mammary glands and interscapular region, which was pathohistologically regarded as scleredema Buschke. Lymphadenopathy, xerophthalmia, sialodenitis, Raynaud's syndrome were revealed, lung damage (alveolitis and bronchiolitis), positive ANA, anti-SSa/La, antiSSb/Ro were diagnosed. Based on this symptom complex, the patient was diagnosed with an overlap syndrome of SB with PSS. The use of combined therapy with methotrexate and methylprednisolone allowed to reduce the disease activity, clinical and laboratory appearance of the disease. However, 9 months after the onset of the first skin symptoms, there was a bulging of the left eye, widespread lymphadenopathy. Histopathological examination revealed the diagnosis of non-Hodgkin B-cell lymphoma. The use of rituximab therapy resulted in a significant regression of the orbital tumor. The relevance of this clinical observation is not only due to the rarity of combined pathology, but also to the need for an early diagnostics of lymphoma developing against the background of PSS, based on the risk factors, which include low levels of C4 and/or C3, enlargement of the parotid salivary glands, cryoglobulinemia, persistent splenomegaly’s systemic activity and lymphadenopathy, since the frequency of this disease is quite high in this patient population.
Введение
Прогресс в изучении системной склеродермии и склеродермоподобных состояний с выделением различных клинических форм, процесс дифференцировки и уточнение сущности нозологий наряду с появлением новых форм индуцированной склеродермии привели к понятию о склеродермической группе болезней. Согласно современным представлениям, термин «склеродермия» объединяет широкий круг заболеваний склеродермической группы: системная и очаговая склеродермия, диффузный эозинофильный фасциит, индуцированная склеродермия — химическая, лекарственная, паранеопластическая или опухоль-ассоциированная склеродермия и псевдосклеродермии.
К группе склеродермоподобных заболеваний относится и редкое заболевание — склередема Бушке (СБ) (отечная склеродермия, прогрессирующая доброкачественная подкожная индурация, склередема взрослых) [1].
Склередема Бушке — редкое заболевание, характеризующееся диффузным индуративным отеком и уплотнением кожи, обычно протекающее с вовлечением кожи лица, шеи, плечевого пояса и верхней части туловища, с доминированием патологического процесса в подкожной клетчатке. Оно может разрешиться спонтанно в течение 2 лет или иметь прогрессирующее и стойкое течение с потенциальным летальным исходом [2]. Традиционно это заболевание в зависимости от этиологического фактора классифицируют на три типа: тип 1, которому обычно предшествует инфекционное заболевание с лихорадкой; тип 2 связан с парапротеинемией, а тип 3 связан с сахарным диабетом [2]. Очень редкие случаи связаны со злокачественными новообразованиями (рак желчного пузыря) или аутоиммунными заболеваниями) [3–5]. Среди аутоиммунных заболеваний, ассоциированных с СБ, выделяют ревматоидный артрит (РА), спондилоартриты и первичный синдром Шегрена (ПСШ).
Первичный синдром Шегрена — это системное аутоиммунное заболевание, которое имеет множество клинических проявлений, со спектром от сухого синдрома до системных экстрагландулярных поражений [6]. И если сухой синдром прежде всего влияет на качество жизни и может вызывать местные поражения с вовлечением слизистых оболочек, то системное поражение определяет прогноз заболевания. Риск развития лимфомы у пациентов с ПСШ увеличивается с 3 % в первые 5 лет до 9,8 % через 15 лет, то есть в 40 раз превышает популяционный риск [7]. Наличие лимфаденопатии, постоянное увеличение околоушной железы, пальпируемая пурпура, низкий уровень С4 в сыворотке и криоглобулинемия являются предикторами повышенного риска развития этого осложнения и могут повышать риск развития лимфомы в 5 раз [8]. Средний возраст начала заболевания — около 50 лет, и диагноз СШ обычно предшествует лимфоме в среднем на 7 лет [8]. Наиболее распространенные локализации включают околоушную железу и другие слюнные железы, за которыми следуют орбиты, желудок, щитовидная железа, легкие и верхние дыхательные пути и редко другие места [7].
Клинический случай
Представлен клинический случай развития В-лимфомы у больной с оверлап-синдромом ПСШ и СБ.
Пациентка 51 года обратилась на прием к ревматологу в клинику современной ревматологии 25.10.2019 с жалобами на плотный отек лица, сухость кожи, сухость в глазах, ощущение песка в них, повышение температуры до субфебрильных цифр, плотные образования кожи с гиперемией в области декольте, молочных желез, межлопаточной области диаметром до 10 см. Болеет в течение 3 месяцев. Пациентка была обследована: в общем анализе крови обращает на себя внимание тромбоцитопения до 110 • 1012/л, лейкопения 3,15 • 109/л, повышение скорости оседания эритроцитов (СОЭ) до 30 мм/час, биохимический анализ крови — без патологии. Проведено ультразвуковое исследование (УЗИ) слюнных желез и щитовидной железы 07.10.2019: все слюнные железы выраженно рыхлой структуры, крупноячеистые, по типу «губки», сиалоаденит всех групп слюнных желез, гиперплазия лимфатических узлов шеи, многоузловой зоб, лимфаденопатия шеи. УЗИ органов брюшной полости (ОБП) от 09.10.2019: спленомегалия, лимфаденопатия в брюшной полости — лоцируются лимфоузлы воспалительной эхоструктуры в воротах печени, наибольший под левой долей — 4–16 мм.
Рентгенография органов грудной клетки от 23.10.2019: внутригрудная лимфаденопатия (бифуркационные лимфатические узлы до 14 мм, другие группы до 10 мм). Проведена компьютерная томография (КТ) органов грудной клетки (ОГК) и органов брюшной полости, 25.10.2019: в легких преимущественно в S4, 5 билатерально определяются множественные мелкие очаги с нечеткими контурами размерами до 1 мм, окруженные изменениями по типу матового стекла, субплеврально справа в S1, 3, 4 — единичные узелковые уплотнения до 3 мм, по ходу междольковой плевры билатерально — узелковые уплотнения до 3,5 мм. Определяются единичные воздушные полости до 9 мм. Визуализируются единичные паратрахеальные, парааортальные и бифуркационные лимфатические узлы до 4–9 мм. Определяется уплотнение клетчатки в подмышечных областях с наличием лимфатических узлов до 7–13–15 мм. В верхнелатеральном квадранте правой и левой молочных желез определяются участки консолидации с более интенсивным накоплением контраста размерами до 10–13 мм. Уплотнение кожи на уровне молочных желез билатерально, симметрично. На уровне тела грудины, Т1–3 справа от остистых отростков, определяется уплотнение подкожной жировой клетчатки передней и задней грудной стенки. Увеличение размеров селезенки 104–154–140 мм, парааортально/кавально — множественные лимфатические узлы с нечеткими контурами до 8–12 мм. КТ-признаки бронхиолита/альвеолита. Выводы: очаговая патология легких неспецифического характера. Спленомегалия. Аденопатия лимфатических узлов забрюшинного пространства. Образования молочных желез. Узловой зоб. Магнитно-резонансная томография головного мозга от 18.10.2019: признаки мелкоочагового поражения головного мозга сосудистого генеза, умеренного расширения субарахноидальных пространств как начальных проявлений дисциркуляторной (церебральной микроангиопатии) энцефалопатии. Консультирована неврологом 19.10.2019: церебральная микроангиопатия неуточненная, цервикокраниалгия.
/47.jpg)
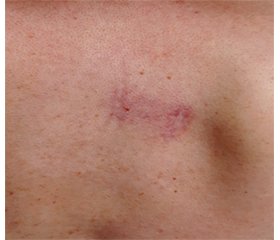
На консультации у ревматолога 25.10.2019 при объективном исследовании выявлено: при осмотре — плотный отек кожи лица, увеличение околоушных слюнных желез, плотные гиперемированные очаги до 3 см в диаметре в области обеих молочных желез, декольте и межлопаточной области, увеличение щитовидной железы 1-й степени (рис. 1, 2). Увеличение подчелюстных и шейных лимфатических желез до 1,5 см. При аускультации легких и сердца патологии не выявлено. Пальпация живота безболезненна, печень не увеличена, пальпируется нижний полюс селезенки, кишечник обычных пальпаторных свойств.
С учетом изменений на КТ ОГК, ОБП, лимфаденопатии, образований на коже был сделан вывод о том, что следует исключить саркоидоз с поражением кожи и легких, а также паранеопластическую патологию. Рекомендована консультация пульмонолога, фтизиатра, онколога с проведением биопсии образований кожи.
Патогистологическое исследование кожи от 11.11.2019: вся ткань дермы в состоянии отека, в слоях коллагеновых волокон ближе к эпидермису — значительные дегенеративно-дистрофические изменения с частичной деструкцией волокон. В более глубоких слоях дермы — загрубевшие коллагеновые волокна с дегенерацией, обеднение придатков кожи. Периваскулярная инфильтрация лимфоидными клетками по типу узелков, наличие коллагеновых и муциновых депозитов в дерме. Такие же инфильтраты — вокруг структуры волоса. Выводы: изменения кожи соответствуют варианту склередемы взрослых Бушке. Имеет место слизисто-кожно-лимфоидный синдром как проявление системного заболевания соединительной ткани.
Осмотрена пульмонологом: данных о саркоидозе, туберкулезе нет. Осмотрена онкогематологом: данных об онкопатологии нет. Выводы были сделаны на основании клинических, лабораторных и инструментальных данных.
Пациентка повторно обратилась к ревматологу 20.11.2019. Рекомендовано дообследование на антинуклеарные антитела и анти-SSa/Ro и анти-SSb/La, исследование функции щитовидной железы и антител к тиреопероксидазе (АТ к ТПО), консультация окулиста с проведением теста Ширмера, капилляроскопия.
Капилляроскопия от 24.11.2019: при анализе капиллярного кровотока отмечаются признаки спазма капиллярных петель мелкого диаметра, капилляры преимущественно короткие и средние по длине — до 70 %, регистрируются короткие по длине, незначительно извитые по типу спиралей, знаков параграфа капиллярные петли преимущественно мелкого и среднего калибра — 30 %. Регистрируются множественные аваскулярные поля в 1-м и 2-м эшелоне — на 2–5-м пальцах обеих кистей (преимущественно на левой кисти склеродермический паттерн). Удельный вес капилляров незначительно снижен на 2-м пальце левой кисти и на 5-х пальцах обеих кистей (4–5 капиллярных петель на 1 мм2), скорость капиллярного кровотока незначительно снижена. Индекс извитости капилляров — 30 %. Синдром Рейно 1–2-й степени. Спастический тип микроциркуляции. Признаки медленно прогрессирующего типа ССД.
Антинуклеарные антитела (ANA) от 21.11.2019 — 1 : 1200; обнаружены в высоком титре анти-SSa/Ro (50 МЕ/мд) и анти-SSb/La (46 МЕ/мл). Функция щитовидной железы не нарушена, повышен титр АТ к ТПО (150 МЕ/мл). Ревматоидный фактор — 12 МЕ/мл. Консультирована окулистом: синдром «сухого глаза», тест Ширмера 1 мм за 5 минут.
Исходя из полученных данных, при повторном осмотре 18.12.2019 был установлен диагноз: оверлап-синдром склередемы Бушке (плотный отек лица, очаговые уплотнения в области спины, декольте, молочных желез) и первичного синдрома Шегрена с поражением слюнных желез (сиалоаденит), легких (альвеолит), сосудов (синдром Рейно), ретикулоэндотелиальной системы (лимфаденопатия, спленомегалия), щитовидной железы (аутоиммунный тиреоидит, эутиреоз), сухим синдромом (ксерофтальмия), иммунологическим (ANA, anti-SSa/La, anti-SSb/Ro) и гематологическим (тромбоцитопения, лейкопения) синдромами.
Рекомендован прием метилпреднизолона 12 мг в сутки, метотрексата 10 мг 1 раз в неделю с повышением через 2 недели до 15 мг 1 раз в неделю, фолиевой кислоты 5 мг через 24 часа после приема метотрексата 1 раз в неделю, препаратов кальция (1200 мг) и витамина D (800 мг) 1 раз в сутки, местно на кожные очаги мази с мометазоном, местно капли искусственной слезы.
Выбор терапии метилпреднизолоном и метотрексатом был основан на приведенных клинических наблюдениях и сериях случаев в медицинской базе данных PubMED по ключевым словам «Sjogren’s syndrome and scleredema adultorum of Buschke» и рекомендациям EULAR 2019 по менеджменту пациента с СШ [9]. В табл. 1 представлена динамика лабораторных показателей пациентки.
На фоне приема метотрексата, метилпреднизолона в течение первых 2 месяцев отмечалось уменьшение отека кожи лица, отека слюнных желез, регресс кожных образований (рис. 3), нормализация СОЭ и уровня лейкоцитов. Учитывая значительное улучшение клинической картины, отсутствие жалоб, начали снижение метилпреднизолона по 2 мг в 2 недели с февраля 2020 года и с апреля по 2 мг в месяц до полной отмены в мае 2020 года. Терапия метотрексатом 15 мг в неделю продолжена.
Суммарные дозы метотрексата и метилпреднизолона, полученные пациенткой в течение 7 месяцев до появления признаков лимфомы в июле 2020 года, составили 420 и 1900 мг соответственно.
В процессе наблюдения за пациенткой в общем анализе крови с марта 2020 г. наблюдалась тенденция к нейтропении и лимфоцитозу. А в июле 2020 года пациентка отметила выбухание левого глаза (рис. 4). Никаких общих симптомов (лихорадка, общая слабость, повышенная потливость) не наблюдалось. Кожные высыпания — без динамики. 17.07.2020 проведена КТ орбиты, органов грудной клетки и брюшной полости: в левой орбите между латеральными и верхними прямыми мышцами, прилегая к верхнелатеральному отделу глазного яблока, определяется дополнительная мягкотканная масса размерами 6–16–14 мм, неотделимая от верхней слезной железы, аналогично которой накапливает контраст, дифференциация контуров указанных мышц на этом уровне снижена.
/48.jpg)
Определяются множественные лимфатические узлы шеи с двух сторон, максимальный из группы подбородочных — до 4 мм, подчелюстных — до 7 мм, верхних яремных — до 7 мм, нижних яремных — до 7 мм, дорсальных — до 5 мм, надключичных — до 5 мм. В средостении визуализируются периваскулярные, аортопульмональные, бронхопульмональные, бифуркационные лимфатические узлы до 9 мм. Со стороны легких отмечена положительная динамика: инфильтративные изменения не обнаруживаются. Положительная динамика со стороны аксиллярных областей билатерально вследствие уменьшения отека жировой ткани, уменьшения ее размеров, уменьшение толщины кожи передней грудной стенки. В верхнелатеральном квадранте правой молочной железы сохраняется узелковое утолщение 6–10 мм с положительной динамикой за счет уменьшения размеров и плотности. Сохраняются узелковые изменения щитовидной железы. Гепатоспленомегалия (длина правой доли печени 201 мм, селезенка 49–130–141 мм). Множественные лимфоузлы в гепатодуоденальной связке — до 10 мм, забрюшинные — до 7 мм, малого таза (общие и внешние подвздошные) — до 8 мм.
Проведено патогистологическое исследование опухоли орбиты. Гистологический пунктат новообразования левой орбиты (30.07.2020) — скопление полиморфных клеток с неоднородными гиперхромными ядрами, патогномоничными для лимфомы. Проведена пункция костного мозга и иммуногистохимический анализ клеток опухоли орбиты. В клетках опухоли определяется положительная мембранная реакция с CD20, CD23, bd2. В части клеток опухоли определяется положительная мембранная реакция с CD11c. Клетки опухоли негативны к CD123, DBA44, аннексину Ф1, CD10, CD30, SOX-11, циклинам D1, CD3, CD5. С учетом результатов гистологического и иммуногистохимического исследования имеет место поражение костного мозга В-клеточной лимфомой, фенотип которой характерен для нодальной лимфомы из клеток маргинальной зоны. Пациентка консультирована онкогематологом, установлен диагноз неходжкинской В-клеточной лимфомы маргинальной зоны орбиты и селезенки (NMZL), IVа стадия, с поражением костного мозга. Согласно рекомендациям онкогематолога, терапия метотрексатом была приостановлена, начата терапия ритуксимабом 1 г в 2 недели дважды. 1.08.2020 и 25.08.2020 проведено 2 введения, отмечается значительный регресс опухоли орбиты. Пациентка находится под наблюдением онкогематолога и ревматолога.
У пациентов с ПСШ может развиться большое количество системных проявлений как в виде клинических манифестаций, являющихся первыми признаками заболевания, так и появляющихся в процессе развития заболевания [10]. Системные проявления, приводящие к преждевременной и высокой смертности пациентов с ПСШ, — это криоглобулинемический васкулит, интерстициальное заболевание легких и лимфома [11]. Следует отметить, что пациенты с ПСШ имеют более высокий риск развития лимфомы, чем пациенты с другими аутоиммунными заболеваниями: в 7 и 4 раза выше, чем у пациентов с системной красной волчанкой и РА соответственно, и в 10 раз выше, чем у здоровых [12]. В недавних исследованиях, посвященных изучению роли прогностических маркеров в развитии ПСШ-ассоциированных лимфом, предлагается синергетическая модель риска, поскольку чем больше прогностических факторов у пациентов, тем выше риск развития лимфомы. S. Fragkioudaki и соавт. (2016) [13] предложили предиктивный показатель риска развития неходжкинской лимфомы (НХЛ), включающий семь прогностических маркеров: низкий уровень С4 и/или С3, увеличение околоушных слюнных желез, криоглобулинемия, спленомегалия, системная активность и лимфаденопатия. Было обнаружено, что у пациентов с не менее чем тремя факторами вероятность развития НХЛ составляет 40 % и 100 % у тех, кто имеет все семь прогностических факторов. W. Zhang и соавт. (2010) [14] сообщили, что риск возникновения злокачественных новообразований был увеличен примерно в 30 раз у пациентов с тремя или более факторами риска, в 3 раза — с одним фактором риска по сравнению с пациентами без таковых. У нашей пациентки имелось 4 из предложенных факторов риска — увеличение околоушных слюнных желез, спленомегалия, системная активность и лимфаденопатия.
Выводы
Таким образом, данный клинический случай описывает редкое сочетание СБ с аутоиммунным заболеванием — ПСШ. В литературе мы нашли только одно клиническое наблюдение ассоциации СБ со вторичным синдромом Шегрена (с сопутствующим РА) [4] и одно — с первичным СШ [5]. Это подчеркивает важность изучения других ассоциаций СБ, в частности с аутоиммунными заболеваниями, для обеспечения надлежащего ведения и лечения таких пациентов. Кроме того, риск развития лимфомы на фоне ПСШ достаточно высок, что подразумевает повышенную онконастороженность практикующих врачей в отношении вероятного развития и целенаправленного исключения лимфом у пациентов с ПСШ с проведением оценки факторов риска.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Источники финансирования — нет.
Вклад каждого автора: Егудина Е.Д., Триполка С.А. — концепция и дизайн исследования, анализ и интерпретация данных; Егудина Е.Д. — сбор данных, написание статьи; Тер-Вартаньян С.Х. — редактирование статьи.
/47.jpg)
/48.jpg)

/47_2.jpg)
/46.jpg)
/48_2.jpg)