Архив офтальмологии Украины Том 8, №3, 2020
Вернуться к номеру
Сучасні тенденції в офтальмології: огляд «Рефракційного пленеру’20»
Авторы: Т.В. Тлустова
Рубрики: Офтальмология
Разделы: Справочник специалиста
Версия для печати
15–17 жовтня 2020 року у Києві відбулась науково-практична конференція з міжнародною участю «Рефракційний пленер’20». У рамках конференції були розглянуті сучасні погляди на патогенез, діагностику, лікування й профілактику захворювань ока й сучасні підходи до корекції зору в різних клінічних випадках. Програма конференції була насиченою і включала доповіді як вітчизняних, так і закордонних спеціалістів у галузі офтальмології.
З доповіддю «Інфекція очної поверхні — як поєднати лагідність і силу?» виступила професор Христина Групчева (Christina Grupcheva), MD, PhD, DSc (м. Варна, Болгарія). Перш за все професор акцентувала увагу на мікроорганізмах, які можуть викликати бактеріальний кон’юнктивіт:
— у дорослих: епідермальний стафілокок, золотистий стафілокок, гемофільна паличка, пневмокок;
— у дітей: гемофільна паличка, пневмокок;
— у новонароджених: гемофільна паличка, гонокок, хламідія трахоматіс.
Яким же має бути «ідеальний» антибіотик для лікування бактеріальної інфекції очної поверхні? Він має бути: ефективним щодо грампозитивних і грамнегативних бактерій, із великою тривалістю дії (щоб не потребувати частого застосування), з коротким курсом лікування, повинен мати м’яку дію на поверхню ока. «Ідеальний» антибіотик має проникати в бактеріальні клітини й накопичуватися в них, при цьому не пошкоджуючи клітини ока. Такому механізму дії і критеріям відповідає азитроміцин в очних краплях.
Додатковими перевагами азитроміцину є:
— широкий спектр дії з впливом на грамнегативні, а також грампозитивні бактерії, внутрішньоклітинні мікроорганізми;
— він не має вікових обмежень і може бути застосований з першого дня життя, а також у вагітних і жінок під час лактації.
В Україні нарешті з’явився Азитер® (від компанії Thea) — це очні краплі 1,5% азитроміцину. Професор звернула увагу, що це перший антибіотик у вигляді крапель, курс лікування яким становить усього 3 дні, і він є ефективним як при гнійному бактеріальному кон’юнктивіті, так і при запаленні кон’юнктиви, викликаному Chlamidia trachomatis. Препарат має бактерицидну дію і не потребує додаткового призначення другого антибіотика.
Унікальні фармакологічні властивості препарату:
— швидкий розподіл у тканинах;
— внутрішньоклітинний механізм дії;
— стабільна концентрація і дуже тривалий період напіввиведення;
— проникнення, накопичення й транспортування у фагоцитах і лейкоцитах.
Дослідження препарату Азитер® довели, що азитроміцин 1,5% при застосуванні двічі на добу протягом трьох діб демонструє відмінну мікробіологічну активність протягом тривалого часу (понад тиждень). Окрім того, азитроміцин при місцевому застосуванні не виявлявся в плазмі клінічно здорових добровольців, а також у пацієнтів, які отримували препарат протягом трьох діб, що свідчить про відсутність системної дії і високу безпеку препарату.
У дослідженні третьої фази вивчалась ефективність препарату Азитер® при бактеріальному кон’юнктивіті — мультицентрове рандомізоване контрольоване масковане для дослідника дослідження у 8 країнах, у якому взяли участь 1043 пацієнти (893 дорослі, 150 дітей). Це дослідження довело, що препарат Азитер® не поступався за ефективністю очним краплям з тобраміцином при більш зручній кратності прийому — азитроміцин 1,5% (Азитер®) двічі на добу протягом трьох діб, тобраміцин 0,3% — мінімум чотири рази на добу протягом семи діб. При ретельному вивченні ефективності було встановлено, що на третій день лікування стостерігалась статистично значуща рання клінічна різниця між препаратами: регресія клінічних симптомів у пацієнтів, які отримували Азитер®, у 1,5 раза перевищувала регресію симптомів у пацієнтів, які отримували тобраміцин (29,8 і 18,6 %). Уже на третю добу на препараті Азитер® спостерігалось значне зменшення гіперемії бульбарної кон’юктиви, зменшення гнійних виділень з ока. Отже, загалом Азитер® у дозуванні 1 крапля 2 рази на день протягом трьох діб має таку саму ефективність, як і лікування тобраміцином протягом 7 діб, але клінічна ефективність препарату Азитер® на третю добу лікування значно вища, ніж тобраміцину. Азитер® забезпечує більш швидку регресію основних клінічних симптомів і є більш зручним у застосуванні завдяки короткому курсу лікування.
Професор Христина Групчева звернула увагу на дослідження ефективності препарату Азитер® у дітей. У дослідження було включено 150 дітей віком від 1 дня до 17 років (середній вік дітей становив 7 років) із 7 країн із діагнозом гнійного бактеріального кон’юнктивіту (основні симптоми — бульбарна гіперемія, гнійні виділення з ока).
Перевагами застосування препарату Азитер® у дітей були:
— більш короткий курс лікування — 3 дні, що сприяє дотриманню режиму лікування;
— менш частий прийом — двічі на день, що полегшує курс лікування й допомагає батькам дотримуватись режиму лікування;
— не потребує прийому в денний час, тобто немає необхідності залучати до лікування співробітників у школі або дитячому садку;
— швидше одужання.
Для розрізнення гіперемії, що виникає як реакція на застосування масляного розчину, і гіперемії як наслідку алергічної реакції на лікарський засіб було проведено дослідження 40 здорових добровольців: 28 жінок і 12 чоловіків, середній вік яких становив 33 роки (від 25 і 45 років) без ознак запалення ока або очних хвороб. Дослідниками був протестований масляний розчин азитроміцину 15 мг/г, який застосовували 2 рази на день. 50 % добровольців закапували розчин в одне око, друга половина — в обидва ока. Гіперемія оцінювалась за градуйованою шкалою Ефрона через 30 хвилин після застосування препарату. За допомогою конфокальної мікроскопії HRT-II із рогівковим модулем був проведений мікроструктурний аналіз in vivo. Набряк кон’юнктиви був оцінений за допомогою оптичного когерентного томографа. Гіперемія механічна після застосування масляного розчину азитроміцину розцінюється як 3-й ступінь або менше, триває до 5 годин, зазвичай проявляється на другий день і зникає самостійно. Загалом серед учасників дослідження гіперемія 1–3-го ступеня спостерігалась у 37,5 % добровольців (n = 15), але при дослідженні методом оптичної когерентної томографії набряку виявлено не було. Конфокальна мікроскопія in vivo виявила розширення судин у середньому на 30 %, переважно на другу добу. Проте при цьому показники кровотоку не змінились, інфільтрація запальних клітин виявлена не була. Мікроструктура була відновлена на третю добу, клінічні прояви гіперемії були відсутні.
Отже, можна дійти таких висновків:
— гіперемія часто проявляється після застосування будь-яких очних крапель;
— гіперемія взагалі може бути результатом алергії і/або запалення очей;
— гіперемія після застосування препарату Азитер® може спостерігатись унаслідок подразнюючої дії і не триває довго, найімовірніше, вона є результатом застосування масляного розчину (до складу крапель входять тригліцериди);
— отримані докази того, що гіперемія при використанні препарату Азитер® не пов’язана зі структурними змінами, такими як кон’юнктивальний набряк, запалення, інфільтрація або зміни кровотоку.
Отже, Азитер® є препаратом першої лінії для ефективного, швидкого й безпечного лікування гнійного бактеріального кон’юнктивіту. Зручна схема застосування забезпечує високу прихильність хворих до проходження повного курсу лікування, знижує ризик появи резистентних мікроорганізмів через неправильний прийом ліків. Препарат є зручним у застосуванні: в упаковці 6 контейнерів з діючою речовиною для однократного застосування, що забезпечує зручність і гігієнічність використання.
Про особливості й переваги використання нового антибіотика Азитер® доповів завідувач кафедри офтальмології Національної медичної академії післядипломної освіти імені П.Л. Шупика, заслужений лікар України, д.м.н., професор Сергій Олександрович Риков (м. Київ, Україна).
В Україні бактеріальний кон’юнктивіт частіше зустрічається в дітей, ніж у дорослих, і при тому 23 % випадків реєструється в дітей віком 0–2 роки, 28 % — у дітей віком 3–9 років і 13 % — у дітей віком 10–19 років. Дорослі з бактеріальним кон’юнктивітом становлять лише 36 %.
Фактори, що зумовлюють виникнення бактеріального кон’юнктивіту:
— травма ока;
— хірургічне втручання;
— зниження місцевого і/або загального імунітету;
— вірулентність мікроорганізму;
— кількість мікроорганізмів;
— інші фактори.
Макроліди мають широкий спектр дії (ефективні при різних видах Staphylococcus, Streptococcus, N.gonorrhoeae, N.meningitidis, Clostridium spp., H.influenzae, Mycoplasma pneumoniae, Corynebacterium diphtheriae, Listeria monocytogenes тощо). Препарат Азитер® — 1,5% розчин азитроміцину для місцевого застосування. Це перший у світі антибіотик для триденного лікування інфекцій поверхні ока, який ефективний при гнійному бактеріальному кон’юнктивіті й кон’юнктивіті, викликаному Chlamidia trachomatis. Професор С.О. Риков звернув особливу увагу на те, що Азитер® взагалі не має системної дії і може бути призначений новонародженим, дітям, дорослим, людям похилого віку, а також може застосовуватись при вагітності й лактації.
Доведено, що Азитер® демонструє швидкий розподіл і тривале накопичення у високих концентраціях у кон’юнктиві, рогівці й сльозі. Навіть через 24 години після закапування однієї краплі концентрація в сльозах, кон’юнктиві й рогівці є вищою від мінімальної інгібуючої концентрації (МІК). Триденне лікування Азитером® забезпечує понад 2 тижні підтримання ефективної концентрації в рогівці й кон’юнктиві (вище від МІК для більшості мікроорганізмів).
Для ефективного емпіричного призначення препарату широкого спектра, що охоплює підозрюваний збудник, необхідно надавати перевагу антибіотикам першої лінії. При цьому професор наголосив, що фторхінолони й комбінації антибіотиків — це терапія другої лінії або терапія гострого (надзвичайно тяжкого) бактеріального кон’юнктивіту.
Безумовними перевагами препарату Азитер® є ефективність, безпечність, обмежена місцева подразнююча дія, довге зберігання лікувальної концентрації в кон’юнктиві й рогівці, дуже зручний режим прийому й дозування, можливість використання для всіх пацієнтів (з першого дня життя, при вагітності, під час лактації, у похилому віці).
Із доповіддю «Офтальмологічні нутрицевтики, вітаміни і мінерали в період пандемії COVID-19» виступила д.м.н., професор, завідувач кафедри офтальмології Запорізького державного медичного університету Наталія Григорівна Завгородня (м. Запоріжжя, Україна).
Професорка коротко нагадала інформацію про нове коронавірусне захворювання COVID-19:
— коронавіруси — це вкриті оболонкою РНК-віруси, які викликають респіраторні захворювання різного ступеня тяжкості (від звичайної застуди до смертельно небезпечної пневмонії);
— SARS-CoV-2 — це новий коронавірус, який був ідентифікований як причина коронавірусної хвороби (COVID-19), що виникла в місті Ухань у Китаї у кінці 2019 року й поширилась у всьому світі;
— поряд з ураженням дихальної системи розвиваються й інші серйозні ускладнення: ураження серця (аритмії, кардіоміопатії, гостре ураження серця), коагуляційні порушення (включно з тромбоемболією, легеневою емболією, синдромом дисемінованого внутрішньосудинного згортання), крововиливи, синдром Гієна — Барре;
— основні групи ризику тяжкого перебігу й летальності при COVID-19: пацієнти з гіпертонічною хворобою та іншими захворюваннями серцево-судинної системи, захворюваннями обміну речовин (цукровий діабет, ожиріння), онкологічними захворюваннями, особи віком понад 60 років.
Ця хвороба є актуальною не тільки для інфекціоністів і пульмонологів. Наприклад, середній вік пацієнтів з катарактою, глаукомою, віковою макулярною дегенерацією — 67 років, що одразу відносить їх до групи ризику тяжкого перебігу COVID-19. Пацієнти цієї вікової групи зараз рідше приходять на планові профілактичні огляди, і, як наслідок, у них частіше діагностується ускладнений перебіг офтальмологічних захворювань. Тому було б доцільно розглянути можливість призначення таким пацієнтам офтальмологічних нутрицевтиків на тривалий термін з метою як збереження зорових функцій, так і підтримки імунітету.
COVID-19 порушує роботу імунної системи й спричиняє зниження імунореактивності організму на тривалий час. На сьогодні активно вивчається потенціальна ефективність 5 компонентів у профілактиці й комплексному лікуванні коронавірусної хвороби COVID-19 і її тяжкого перебігу: вітаміну С, вітаміну D3, цинку, дигідрокверцетину, мелатоніну.
Вітамін С має антиоксидантні й протизапальні властивості, сприяє нейтралізації вільних радикалів і захисту клітин легень від їх шкідливої дії. Вітамін С є визнаним імуностимулятором, він збільшує міграцію лейкоцитів у місцях скупчення вірусу й збільшує вироблення інтерферонів. Збалансований рівень вітаміну С сприяє здоровому функціонуванню імунної системи. Його рівень суттєво зменшується при розвитку гострих респіраторних вірусних захворювань унаслідок збільшення його витрат організмом.
Вітамін D3 зараз розглядається вченими як комплексний регулятор імунітету. Встановлена кореляція між рівнем вітаміну D3 в організмі та смертністю від COVID-19: чим вищий дефіцит цього вітаміну, тим більше смертність у цій групі хворих. Вітамін D3 посилює активність моноцитів, регулює вироблення цитокінів.
Цинк. На сьогодні широко вивчається властивість цинку блокувати активність ферменту РНК-полімерази коронавірусу, що заважає його розмноженню. Також передбачається, що цей мікроелемент може знижувати активність аденозинперетворюючого ферменту 2, за рахунок взаємодії з яким вірус проникає в клітини.
Кверцетин (дигідрокверцетин) — це біофлавоноїд модрини сибірської, унікальний природний біорегулятор із широким спектром дії. Він має антиоксидантні властивості, за рахунок яких перешкоджає руйнуванню клітинних мембран вільними радикалами й розвитку запалення. Кверцетин позитивно впливає на стан судинної стінки капілярів, зменшує в’язкість крові й перешкоджає тромбоутворенню.
Разом з вітаміном С, вітаміном D3 і цинком мелатонін може сприяти швидкому одужанню, він забезпечує захист від найбільш тяжкого ушкодження легень завдяки його здатності впливати на запалення, знижувати тяжкість перебігу COVID-19. А його протитривожні й антидепресивні якості допомагають легше перенести захворювання.
Нутрицевтики — це продукти, що містять біологічно активні компоненти, які забезпечують загальнозміцнюючий вплив на організм. До групи нутрицевтиків відносять антиоксиданти, жирні кислоти, а також інші компоненти рослинного походження, що можуть мати профілактичний і лікувальний ефект.
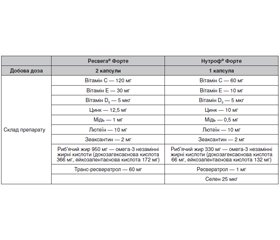
Розглянемо офтальмологічні нутрицевтики Ресвега® Форте і Нутроф® Форте (табл. 2), які містять важливі вітаміни й мікроелементи для профілактики порушень зору, з точки зору доцільності їх використання не тільки в офтальмології, але й для профілактики тяжкого перебігу COVID-19.
В офтальмології важливу роль відіграють нутрицевтики, що містять каротиноїди. Каротиноїди — це жиророзчинні фітонутрієнти, які поділяються на каротини (альфа-каротин, бета-каротин, лікопін) і ксантофіли (лютеїн, зеаксантин). Функції каротиноїдів — це А-провітамінна активність. Вони є незамінними для зору, росту, репродукції, захисту від грибкових, бактеріальних захворювань, нормального функціонування шкіри й слизових. Каротиноїди збільшують утворення антитіл та інтерферону, що беруть активну участь у гуморальному імунітеті.
Бета-каротин — помаранчевий пігмент, який надає забарвлення моркві, гарбузу, персикам. Він є попередником вітаміну А: кожна молекула бета-каротину може бути перетворена на 2 молекули вітаміну А. У процесі споживання абсорбується лише 14 %. Бета-каротин проникає глибоко в ліпіди клітинних мембран, зміцнює імунну систему, зменшує ризик пошкодження клітин сонячними променями. Бета-каротин присутній у судинній оболонці ока й внутрішніх шарах пігментного епітелію сітківки. Для захисту організму від вірусів і бактерій в осінньо-зимовий період імунологи рекомендують вживати продукти з високим вмістом бета-каротину. Але рекомендується не перевищувати добову потребу в цьому нутрієнті, тому що передозування вчені пов’язують з підвищенням ризику розвитку деяких видів онкологічних захворювань. Альфа-каротин міститься в плодах тих самих овочів і фруктів, що й бета-каротин. Він також перетворюється на вітамін А: одна молекула альфа-каротину перетворюється на одну молекулу вітаміну А.
Лютеїн не є провітаміном, не синтезується в організмі, але має виражені позитивні властивості: захищає шкіру від ультрафіолетового опромінення, допомагає шкірі зберігати пружність, сприяє підтримці на високому рівні когнітивних можливостей — пам’яті, мислення, здатності до навчання. Окрім того, лютеїн має виражені протективні властивості щодо зору: покращує гостроту зору, зміцнює захист від вільних радикалів, які утворюються під впливом світла, зменшує потік світла синьо-фіолетового кольору — найбільш агресивної частини видимого світла. Зеаксантин, як і лютеїн, міститься в зелених овочах — шпинаті, капусті тощо. Також діє як світлофільтр і поглинає вільні радикали. Однією з найбільш суттєвих якостей лютеїну й зеаксантину є антиоксидантний вплив на організм, що дозволяє зменшити руйнівну дію вільних радикалів і запобігти розвитку таких захворювань, як цукровий діабет, онкологічні захворювання, хвороба Альцгеймера, захворювання серця. Також ці нутрієнти сприяють зниженню рівня ліпопротеїдів низької щільності і тим самим гальмують розвиток атеросклерозу.
Однією з важливих функцій каротиноїдів у період пандемії COVID-19 є адаптація організму до гіпоксії. Передбачається, що каротиноїди, міоглобін та окиснювальні ферменти створюють специфічну систему окиснення, де каротиноїди функціонують як внутрішнє депо кисню, а окиснювальні ферменти створюють систему термінального окиснення, у якій кінцевою ланкою окиснення є або оксигенований каротиноїд, або кисень із внутрішніх депо. За рахунок цієї системи здійснюється енергозабезпечення клітини в умовах дефіциту кисню в тканинах, що край важливо при COVID-19.
Докозагексаєнова та ейкозапентаєнова кислоти є частиною фосфоліпідів клітинних мембран і належать до незамінних жирних кислот. Дефіцит цих кислот перешкоджає нормальному розвитку дітей та обумовлює деякі патологічні стани. Зовнішні сегменти фоторецепторів сітківки мають високий вміст докозагексаєнової кислоти в їх мембранах (50–70 % жирних кислот), що групуються навколо білка родопсину. Коли світловий сигнал приймається, родопсин піддається конформаційній зміні, якій сприяє фізична природа докозагексаєнової кислоти. Вплив докозагексаєнової та ейкозапентаєнової кислот на зниження ризику серцево-судинних захворювань можливий завдяки таким ефектам:
— антифібриляторна активність;
— зниження ризику серцевої тахікардії;
— антитромбогенна дія;
— зниження рівня тригліцеридів;
— протизапальна активність;
— гальмування збільшення атеросклеротичних бляшок;
— зниження експресії адгезивних молекул на поверхні ендотелію;
— зменшення продукції тромбоцитарного фактора росту.
Вітамін Е (альфа-токоферол) також є потужним антиоксидантом. Вітамін Е гальмує процеси старіння клітин, стимулює роботу імунної системи щодо захисту від бактеріальних і вірусних інфекцій, покращує регенерацію тканин, стимулює утворення капілярів і покращує тонус, проникність судин, захищає шкіру від впливу ультрафіолетових променів, бере участь у синтезі деяких гормонів, знижує утворення рубців на шкірі, бере участь у захисті від раку сечового міхура й простати, сприяє нормалізації глікемії.
Мідь є важливим антиоксидантом у складі ферментів, завдяки чому впливає на утворення колагену, меланіну, гістаміну. Мідь має протизапальні властивості, забезпечує роботу залоз, що беруть участь у травленні. Разом із залізом мідь бере участь у формуванні еритроцитів і гемоглобіну, сприяє нормальному всмоктуванню заліза в кишечнику. Також мідь бере участь у синтезі простагландинів, жіночих статевих гормонів. Разом з аскорбіновою кислотою мідь запобігає негативному впливу деяких інфекцій і деяких видів мікроорганізмів.
Селен — один з найважливіших мікроелементів у протипухлинному захисті (у першу чергу — від раку легень, простати, товстої кишки, прямої кишки, матки й шийки матки). Цей мікроелемент бере участь у противірусному захисті організму (грип, вірусні гепатити, герпесвірусна інфекція тощо). Відомо, що селен запобігає прогресуванню ВІЛ-інфекції, а також бере участь в елімінації з організму важких металів: ртуті, марганцю, свинцю, кадмію. Селен входить до складу ферменту глутатіонпероксидази, який бере участь в антиоксидантному захисті. Він може зменшувати кисневе голодування тканин і стимулювати ріст клітин підшлункової залози. Селен може зменшувати інсулінорезистентність за рахунок покращання споживання глюкози.
Ресвератрол — речовина рослинного походження, що має антиоксидантні, протизапальні властивості, сприяє підтриманню нормальної ваги, захищає шкіру від дії ультрафіолетових променів, забезпечує нейропротекцію при хворобі Альцгеймера шляхом обмеження індукованої смерті нейронів, інгібування утворення бета-амілоїдного пептиду, сприяє деградації бета-амілоїду. У дослідженні LANCON була доведена ефективність ресвератролу й комплексного препарату Ресвега® в профілактиці вологої форми вікової макулярної дегенерації за рахунок інгібування секреції трьох ключових цитокінів (ІЛ-6, ІЛ-8, VEGF-A) in vitro на клітинах пігментного епітелію людини. На сьогодні блокування секреції інтерлейкінів ресвератролом може бути використано в лікуванні пацієнтів з тяжкою формою коронавірусної хвороби COVID-19. Тому професор підкреслила важливість тривалого призначення комплексних препаратів Ресвега® і Нутроф® при офтальмологічній патології, особливо в умовах пандемії.
Показання для застосування препарату Ресвега® Форте в офтальмології:
— діабетична ретинопатія з проліферацією;
— діабетичний макулярний набряк;
— тромбоз центральної вени сітківки;
— вітреоретинальна хірургія;
— неоваскулярна глаукома;
— висока ускладнена міопія;
— волога форма вікової макулярної дегенерації.
Нутроф® Форте, у свою чергу, переважно рекомендують при сухій формі вікової макулярної дегенерації, вікових змінах зору, при катаракті, початковій діабетичній ретинопатії, при міопії легкого/середнього ступеня, значному зоровому навантаженні й профілактично — для підтримки зорових функцій.
Отже, аналіз відомостей про механізми дії складових різних офтальмологічних нутрицевтиків і відомі заходи щодо профілактики коронавірусної хвороби COVID-19 дозволяють вважати доцільним для підтримуючої терапії вікової макулярної дегенерації, діабетичної ретинопатії, глаукоми, судинної патології в умовах пандемії використовувати нутрицевтичні препарати, що містять вітаміни С, D3, Е, цинк та інші біологічно активні речовини, які блокують синтез інтерлейкінів. Таким критеріям відповідають відомі офтальмологам препарати Ресвега® Форте і Нутроф® Форте.
Д.м.н., професор, професор кафедри офтальмології Національної медичної академії післядипломної освіти імені П.Л. Шупика Ірина Василівна Шаргородська (м. Київ, Україна) доповіла про місце аналогів простагландинів у сучасних Guidelines for Glaucoma та загальні принципи, прихильність, compliance і наполегливість у лікуванні різних форм глаукоми.
Головні завдання терапії глаукоми: зниження внутрішньоочного тиску (ВОТ) до індивідуального цільового рівня, що запобігає подальшому пошкодженню зорового нерва, і нейропротекторна терапія, що збереже зорові функції і якість життя пацієнта.
Для визначення рівня цільового ВОТ і агресивності терапії необхідна оцінка ймовірного темпу прогресування глаукоми. Для підбору оптимальної стратегії терапії слід оцінювати темп прогресування глаукоми для кожного ока окремо. Темпи прогресування захворювання в різних пацієнтів можуть значною мірою відрізнятися залежно від типу глаукоми й стадії захворювання. Ключем до ефективного лікування є ретельне, регулярне динамічне спостереження пацієнта й нейропротекторна терапія.
Обстеження пацієнта з глаукомою повинно включати: визначення гостроти зору, біомікроскопію, гоніоскопію, тонометрію з оцінкою пахіметрії, огляд диска зорового нерва (OCT або HRT) і периметрію.
Для визначення темпу прогресування глаукоми Європейське глаукомне товариство (EGS) рекомендує:
1. Повторювати периметрію та огляд диска зорового нерва 3 рази на рік протягом двох років після встановлення діагнозу.
2. Систематичні курси топічної і загальної нейропротекторної терапії при всіх типах глаукоми.
Згідно із сучасними рекомендаціями щодо лікування глаукоми в більшості пацієнтів з первинною відкритокутовою глаукомою лікування починають з медикаментозної терапії. Провідним напрямком медикаментозної терапії є гіпотензивна терапія. При цьому дуже важливо починати лікування з ефективного препарату. Ризик прогресування глаукоми в пацієнта з ранньою стадією захворювання зменшується на 10 % при зниженні ВОТ на 1 мм рт.ст. У пацієнтів зі значними добовими коливаннями ВОТ ризик прогресування втрати полів зору збільшується в 7 разів.
При призначенні антиглаукоматозної гіпотензивної терапії необхідно враховувати вимоги до антиглаукомного препарату:
— ефективне зниження ВОТ;
— стабільний контроль ВОТ протягом 24 годин з мінімальними добовими коливаннями;
— відсутність ефекту «вислизання»;
— висока безпека;
— зручний і простий режим дозування.
Критерії вибору препарату:
— відповідність терапевтичного засобу етіології і патогенезу захворювання;
— зручність дозування й невелика кратність прийому протягом доби;
— вартість;
— безпека (для очей і організму в цілому);
— переносимість лікарського препарату (містить консерванти або є безконсервантною формою лікарського засобу);
— оригінальність лікарського засобу.
Сучасні стандарти терапії глаукоми (EGS):
1. Препарати першої лінії першого вибору: аналоги простагландинів (висока ефективність у зниженні ВОТ, добовий контроль ВОТ).
2. Препарати другої лінії першого вибору: бета-блокатори (ефективно знижують ВОТ), місцеві інгібітори карбоангідрази (ефективно знижують ВОТ, краще контролюють ВОТ уночі порівняно з бета-блокаторами), альфа-2-адреноміметики.
3. Препарати третьої лінії: пілокарпін.
Механізм дії антиглаукомних препаратів включає покращання відтоку водянистої вологи і/або зменшення утворення внутрішньоочної рідини шляхом впливу на різні тканини ока (фармакологічні мішені).
Аналоги простагландинів (АП) є гіпотензивними препаратами першої лінії першого вибору завдяки своїй ефективності й низькому ризику розвитку системних побічних ефектів. Це біогенні речовини, що впливають на різні процеси в організмі. До АП належать активні речовини, які в малих кількостях чинять регуляторні дії в клітинах і тканинах організму людини.
АП знижують ВОТ шляхом посилення увеосклерального відтоку внутрішньоочної рідини за рахунок зміни структури циліарного тіла й склери. Це може досягатись за рахунок взаємодії зі специфічними рецепторами, стимуляції матриксних металопротеїназ і колагеназ (переходу їх в активну форму), руйнування протеазаміноколагенових фібрил екстрацелюлярного матриксу, зменшення товщини циліарного м’яза й зниження опору відтоку вологи, а також за рахунок розслаблення пучків циліарного м’яза. АП знижують ВОТ на 30–36 % від вихідного рівня. При призначенні АП рекомендовано проводити місцеві інстиляції один раз на день щоденно.
Відомі декілька молекул, які належать до АП: латанопрост, біматопрост, травопрост, тафлупрост, уніпрост. Саме травопрост, біматопрост, латанопрост є препаратами першої лінії вибору, вони мають еквівалентну ефективність у зниженні ВОТ (8–10 мм рт.ст.) — на 30–36 % від вихідного рівня. Ці три препарати схвалені в Європі та США як препарати першої лінії завдяки високій ефективності в зниженні ВОТ, мінімальній кількості системних побічних ефектів, простому й зручному режиму дозування (1 раз на добу). Зазвичай АП переносяться добре. Найчастішими побічними ефектами є гіперемія кон’юнктиви й подразнення очей. Вони можуть викликати зміну кольору райдужки, пігментацію шкіри навколо ока, посилення росту пушкового волосся та вій.
Історично в різні періоди ставлення науковців до АП було неоднозначним: були етапи, коли вплив АП на екстрацелюлярний матрикс вважався несприятливим. Але на сьогодні встановлено, що в багатьох тканинах співвідношення матриксних металопротеїназ (ММР) і тканинних інгібіторів металопротеїназ (ТІМР) визначає швидкість обміну в позаклітинному матриксі. Латанопрост змінює експресію (продукцію) ММР у кератоцитах і кон’юнктиві, генів, які регулюють активність ММР-9, регулює рівні ММР-9 у циліарному тілі, гладкій мускулатурі, підвищує рівень ММР-1 у хоріоїдній оболонці й змінює співвідношення активності ММР і ТІМР у трабекулярній сітці. Концентрація латанопросту 0,005 % не токсична для тканин ока. А визначені й описані несприятливі токсичні ефекти препаратів латанопросту пов’язані з дією консервантів, що входять до складу гіпотензивних крапель (Meloni study, 2017).
Доведено, що прогресування глаукоми може бути спричинене побічними ефектами призначеного антиглаукомного лікування.
Встановлено, що навіть м’які консерванти дестабілізують структуру епітелію, підвищують проникність і призводять до запалення. Чим більш ефективний консервант, тим він більш токсичний. Консерванти індукують апоптоз, стимулюють вироблення супероксиду й збільшують продукцію прозапальних медіаторів, індукують субепітеліальний фіброз. Вони справляють токсичний вплив на келихоподібні клітини й муцин, епітеліальні клітини трабекули й кришталика, кон’юнктиву, рогівку, макулу, сітківку. Але найважливішим є те, що консерванти можуть негативно впливати на відтік внутрішньоочної рідини при тривалому застосуванні.
У дослідженні Brignole-Baudouin et al. (2012) було доведено, що накопичення консервантів з очних крапель у структурах ока може негативно впливати на ділянку зорового нерва й трабекулярну сітку. У декількох дослідженнях було встановлено, що при оперативному лікуванні глаукоми успіх відзначався в 97 % пацієнтів без попередньої гіпотензивної терапії і лише в 45 % хворих на глаукому, які довго отримували гіпотензивні очні краплі, особливо у випадках комбінованої терапії. Окрім того, 7-річне ретроспективне дослідження даних 12 454 пацієнтів (на базі Французької інформаційної системи медичного страхування) довело, що консерванти в протиглаукомних краплях у 8 разів підвищують ризик необхідності проведення хірургічного втручання порівняно з групою пацієнтів, які отримували безконсервантні антиглаукомні препарати (доповідь Dr Chloé Chamard, EVER, 2019, Nice, Франція).
Топічні антиглаукомні препарати, що містять консерванти, можуть викликати або загострювати сухість очей. Відомо, що 40–59 % хворих на глаукому страждають від хвороби сухого ока. Запалення очної поверхні можуть викликати: бета-блокатори, альфа-адренергічні агоністи, холінергічні агенти, АП, інгібітори карбоангідрази. Лікарські препарати повинні проникати крізь тканини ока (рогівку, кон’юнктиву й склеру) для досягнення терапевтичних цілей. При запаленні ці тканини стають бар’єром і зменшують швидкість та ефективність доставки лікарських засобів, що знижує їх біодоступність та ефективність.
Професор Ірина Шаргородська підкреслила, що терапія глаукоми повинна бути комплексною і має призначатись тільки після повної оцінки стану очної поверхні — стану рогівки, кон’юнктивальної оболонки, повік і придаткового апарату ока (наявність блефаритів тощо). Доведено, що запалення поверхні ока сприяє підвищенню ВОТ і прогресуванню глаукоми. Своєчасне лікування запалення поверхні ока покращує контроль ВОТ: призначення курсу протизапальної терапії повинно передувати призначенню протиглаукомних препаратів. При тяжкому й тривалому запаленні поверхні рекомендована терапія із циклоспорином.
Протизапальна терапія з циклоспорином впливає безпосередньо на імунозапальну патофізіологію хвороби сухого ока й покращує об’єктивні й суб’єктивні показники в пацієнтів із цією патологією. Форма випуску препаратів із циклоспорином А: місцеві очні краплі 0,05% або 0,1%. DEWS рекомендує використовувати циклоспорин при хворобі сухого ока ІІІ рівня тяжкості та вище. Рекомендована тривалість лікування становить 6 місяців, оскільки дія препарату розвивається повільно. Циклоспорин має сприятливий профіль безпеки. Побічним явищем, що зустрічається найчастіше, є тимчасова печія після закапування в очі, але печія і почервоніння не виключають продовження терапії і не призводять до відмови від препарату.
Професор Ірина Шаргородська підкреслила, що останні проведені широкомасштабні рандомізовані дослідження спричинили революцію в терапії глаукоми: препаратами першого вибору для лікування на сьогодні є безконсервантні форми лікарських засобів.
На фармацевтичному ринку України є відносно новий препарат латанопросту — Монопрост. За ефективністю зниження ВОТ він еквівалентний оригінальному латанопросту з консервантом з аналогічною ефективністю вже з 15-го дня, а за переносимістю перевищує його: менша частота місцевих симптомів при інстиляції, нижчий рівень кон’юнктивальної гіперемії.
Монопрост — формула латанопросту без консервантів у матриксі Протріаксін®. Протріаксін® — інноваційна запатентована формула, поєднує в собі кілька полімерів, що добре переносяться, розчиняють і стабілізують простагландин. Розчин має відмінну стабільність при температурі 25 °С, постійність концентрації в кожній краплі, високу ефективність і добру переносимість.
Результати метааналізу понад 20 досліджень (CUCHERAT, 2014) довели, що Монопрост настільки ж ефективний або перевершує всі інші АП, включно з новими формулами, і має найкращу переносимість серед АП і найменший ризик гіперемії. Потреба в сльозозамісній терапії зменшилася в кожного другого пацієнта при переході на Монопрост.
Слід пам’ятати, що важливу роль у терапії глаукоми відіграє нейропротекція.
Молекула латанопросту має додаткові нейропротекторні властивості:
— непряма нейропротекція (за рахунок ефективної гіпотензивної дії);
— пряма нейропротекція: інстиляції латанопросту підтримують життєздатність і запобігають апоптозу гангліонарних клітин сітківки за рахунок проникнення в склоподібне тіло й задній полюс ока; прямий антиапоптозний ефект латанопросту пов’язаний з гальмуванням каспази-3 (ферменту, який індукує процес апоптозу) шляхом активації протеїнкінази, а також за рахунок підвищення концентрації циклооксигенази-2, яка має доказову нейропротекторну дію;
— вторинна нейропротекція за рахунок впливу на кровотік у ділянці диска зорового нерва.
Критерії оцінки ефективності медикаментозного лікування первинної відкритокутової глаукоми:
1) значне й тривале зниження рівня ВОТ до цільового рівня (рекомендації залежно від стадії глаукоми, табл. 3);
2) стабілізація поля зору;
3) нейропротекторний ефект.
Дотримання режиму лікування (compliance) хворими на глаукому є важливим аспектом успіху при призначенні терапії глаукоми. Доповідач зазначила, що, за даними деяких досліджень, у середньому близько 112 діб на рік пацієнти пропускають призначене лікування. Тому слід надавати перевагу препаратам з більш вираженим гіпотензивним ефектом і мінімальним спектром побічних ефектів, що стане запорукою прихильності пацієнтів до призначеної терапії.
Професор навела огляд сучасної закордонної літератури стосовно відповідей на найбільш часті запитання, що виникають у лікарів під час призначення або аналізу проведеного лікування глаукоми.
Чи є необхідність у відміні препаратів із групи АП перед оперативним втручанням? Загальновідомо, що консерванти в складі очних крапель АП провокують запалення й процеси рубцювання в кон’юнктиві, і це порушує прогноз фільтруючих антиглаукомних операцій, тому АП з консервантом необхідно відміняти перед проведенням хірургічного втручання (як правило, за 3–4 дні). Якщо ж хворий отримує безконсервантну форму АП, то препарат не потребує відміни. Цей АП може бути використаний також у післяопераційному періоді для зменшення явищ офтальмогіпертензії, яка може бути наслідком ятрогенного оперативного впливу. Численні міжнародні організації повідомляють про переваги й рекомендують безконсервантну терапію глаукоми, прикладом такого препарату є Монопрост.
Як впливають АП на прогресування вікової дегенерації макули? Проведені численні дослідження не виявили зв’язку між місцевим використанням АП і розвитком неоваскуляризації в пацієнтів з віковою дегенерацією макули й глаукомою.
Чи доцільні АП при нормотензивній глаукомі? Безконсервантна форма АП показана при такій формі глаукоми як нейропротектор і препарат контролю досягнення рівня цільового ВОТ.
Чи показане використання АП при псевдоексфоліативному синдромі й офтальмогіпертензії? У даної категорії пацієнтів більш доцільним є використання інгібіторів карбоангідрази, альфа-2-адреноблокаторів і їх комбінації, а також раннє проведення факоемульсифікації катаракти.
Чи можливе застосування АП при хронічній нирковій недостатності (у тому числі в пацієнтів, які отримують гемодіаліз)? Доповідач акцентувала увагу на тому, що при проведенні аналізу літературних даних не було знайдено свідчень системних побічних ефектів і розвитку хронічної ниркової недостатності при місцевому застосуванні АП, але це питання потребує подальшого ретельного вивчення.
Чи можливе застосування АП у дітей? У літературних джерелах є лише дані про рекомендації та ефективність використання латанопросту в дітей від 1 року. Однак слід пам’ятати, що вроджена глаукома — це пряме показання для проведення хірургічного лікування, а гіпотензивна підтримка відіграє вторинну роль.
Наскільки зручно застосовувати монодози в пацієнтів похилого віку? Доповідач не спостерігала особливих проблем при використанні такої форми препарату в осіб похилого віку, але ці пацієнти потребують більше часу на обстеження, навчання й ретельних роз’яснень щодо процедури використання засобу.
Підсумовуючи, професор Ірина Шаргородська ще раз акцентувала увагу присутніх на тому, що сучасними завданнями терапії глаукоми є зниження ВОТ до індивідуального цільового рівня й нейропротекторна терапія, які досягаються шляхом таких кроків (EGS):
— вибір ефективної моно- або комбінованої терапії;
— оцінка ймовірного темпу прогресування глаукоми;
— підбір оптимальної стратегії терапії для кожного ока окремо залежно від типу глаукоми й стадії захворювання;
— регулярне динамічне спостереження за хворим;
— систематичні курси топічної і загальної нейропротекторної терапії при всіх типах глаукоми.
Отже, АП — ефективні препарати першої лінії першого вибору при глаукомі. Рекомендована безконсервантна форма АП, що підвищує безпечність і прихильність до призначеної терапії, знижує токсичний вплив і ризики розвитку хвороби сухого ока й прогресування глаукомного процесу.
Проблеми естетичної блефаропластики та шляхи їх вирішення були висвітлені в доповіді д.м.н., професора кафедри офтальмології Національної медичної академії післядипломної освіти імені П.Л. Шупика, президента Асоціації фахівців з офтальмопластики та очного протезування Оксани Василівни Петренко (м. Київ, Україна).
Блефаропластика — хірургічна операція, спрямована на видалення надлишку шкіри й гриж на верхніх і/або нижніх повіках. На жаль, деякі спеціалісти, які виконують її, не враховують особливості будови повік і періорбітальної ділянки. Звідси і виникає велика кількість негативних наслідків.
Ускладнення блефаропластики:
— ранні ускладнення з’являються ще до завершення втручання або в короткі терміни після нього (набряки, гематоми, приєднання інфекції, функціональні проблеми);
— пізні ускладнення виникають через декілька тижнів, а іноді й місяців (розходження швів, гіперпігментація, порушення нормального рубцювання, лагофтальм, блефароптоз, естетичні проблеми тощо).
Для зменшення ризиків виникнення ускладнень необхідно на етапі планування оперативного втручання врахувати:
— індивідуальні особливості пацієнта: алергічні реакції в анамнезі, розташування судин, специфіку формування рубців;
— можливість недотримання пацієнтом поведінкових рекомендацій як перед операцією, так і після неї;
— загальнохірургічні ризики (розрізи, висічення, підтягування шкіри і м’яких тканин — це травми, на які організм може відреагувати по-різному).
Набряк. Наявність набряку навколо очей декілька діб після операції — це варіант норми. Але якщо набряк не став зменшуватись через тиждень після операції (або почав збільшуватись), це свідчить про розвиток ускладнення. Системними причинами набряків навколо очей можуть бути захворювання серцево-судинної системи, сечовидільної системи тощо. Місцевими причинами стійких набряків після операції можуть бути приєднання інфекції або токсикоалергічний кон’юнктивіт (додатковими симптомами на його користь є сильний свербіж, гіперемія шкіри повік, кон’юнктивальна ін’єкція). Для лікування токсикоалергічного кон’юнктивіту призначаються протиалергічні препарати, місцеві та/або системні.
Гематома. Це ускладнення може виникнути як одразу після хірургічного втручання на повіках, так і через декілька діб. Це може бути проста підшкірна гематома, ретробульбарна гематома, напружена гематома.
Проста підшкірна гематома не загрожує життю, через деякий час розсмоктується сама. Вона не потребує активного втручання. Напружена гематома — це більш серйозний і небезпечний різновид підшкірної гематоми, вона виникає при пошкодженні великої судини, що не тромбується природним шляхом, унаслідок чого з неї постійно безконтрольно витікає кров і здавлює тканини навкруги. Радикальне лікування — це ушивання пошкодженої судини.
Ретробульбарна гематома — крововилив у глибині очниці. Кров з гематоми здавлює судини, які постачають кров до зорового нерва й сітківки. Унаслідок цього виникає гіпоксія, і на очному дні з’являються ішемічні зміни. Якщо тиск у гематомі продовжує збільшуватись, можлива сліпота внаслідок гострого порушення кровообігу в системі зорового нерва, а в тяжких випадках може розвинутись тромбоз артерій сітківки. Зазвичай ретробульбарна гематома з’являється протягом доби після операції, але може розвинутись і в кінці першого тижня після операції. Причини розвитку ретробульбарної гематоми: непомічена кровотеча протягом операції, різка зміна артеріального тиску в пацієнтів з артеріальною гіпертензією, різке м’язове напруження, кашель, нахили голови. Іноді до розвитку ретробульбарної гематоми призводить і неправильна техніка виконання операції. Для профілактики рекомендовано після операції 3–4 доби спати з піднятою головою, протягом тижня після операції не піднімати важкі предмети, уникати фізичних навантажень взагалі. Лікування ретробульбарної гематоми: проведення ревізії рани. На ранніх стадіях застосовують засоби, що знижують внутрішньоочний тиск. Додатково проводиться протинабрякова інфузійна терапія. Якщо з’явились ознаки зниження зору, необхідна повторна операція.
Інфекційні ускладнення проявляються набряком, гіперемією, болем, локальним або системним підвищенням температури тіла. Лікування проводиться із застосуванням антибактеріальних препаратів, як місцевих, так і системних. Профілактика цього ускладнення полягає в ретельному дотриманні правил асептики й антисептики, зборі анамнезу перед операцією, проведенні санації кон’юнктивальної порожнини й повік у передопераційний період. Для гігієни повік рекомендовані стерильні серветки Блефаклін®. Їх використання рекомендоване як за наявності інфекції поверхні очей, так і перед будь-якою офтальмологічною/пластичною операцією на очах або інтравітреальною ін’єкцією. Обробка Блефакліном® проводиться 2 рази на день. Це дозволяє значно знизити бактеріальне обсіменіння повік і кон’юнктиви, забезпечити якісну й безпечну гігієну періорбітальної зони.
Порушення нормального рубцювання — це грубі шрами, кісти, гранульоми, які виникають унаслідок індивідуальної схильності до келоїдних рубців або неправильного і/або багаторазового накладення швів. При появі перших ознак рубцювання рекомендовано застосування мазі з вмістом кортикостероїдних гормонів. Можливе проведення апаратних процедур, якщо рубцям понад 6 місяців (лазерне шліфування, лазерний пілінг).
Для мінімізації рубцевих змін у післяопераційному періоді застосовуються комплексні препарати для гігієни й нормалізації стану повік і тканин періорбітальної зони: препарати Блефаклін® і Теагель®. Ці препарати при комплексному застосуванні сприяють регенерації епідермісу, мають протизапальну й зволожуючу дію, зменшують фіброзування й рубцювання, модифікують роботу сальних і мейбомієвих залоз, зменшують бактеріальне обсіменіння.
Розходження післяопераційних швів найчастіше зустрічається в пацієнтів з активною мімікою або в тих, хто не може втриматись від тертя очей. Причинами може бути повільне загоєння рани, механічна травма прооперованої ділянки, виражений натяг країв рани, у тому числі внаслідок набряку, передчасне видалення шовних ниток, інфікування рани. При виникненні цього ускладнення необхідне повторне ушивання рани, але слід пам’ятати, що ця маніпуляція збільшує ризик появи грубих рубців.
Птоз може бути тимчасовим (унаслідок набряку або гематоми) або постійним (при травматизації м’язових волокон або зв’язок — ушкодженні леватора). При тимчасовому птозі лікування не проводиться. При постійному птозі необхідна повторна операція для корекції травматичної деформації повік (реконструктивна пластика повік).
Лагофтальм — неспроможність ока повністю заплющуватись. Лагофтальм може бути тимчасовим при порушенні іннервації після застосування місцевих анестетиків. При цьому рекомендоване застосування зволожуючих крапель з кератопротективною дією. Саме таким є Теалоз® Дуо — комбінований препарат без консервантів і фосфатів, до складу якого входять трегалоза й гіалуронова кислота. Трегалоза забезпечує біо- і осмопротекцію, регенерацію і захист очної поверхні, тривале зволоження. Гіалуронова кислота додатково зволожує і зменшує вираженість симптомів. Розчин Теалоз® Дуо є гіпоосмолярним, що дозволяє проводити профілактику гіперосмолярності сльози й зменшувати пошкодження очної поверхні при сухості очей.
Постійний лагофтальм виникає при видаленні занадто великої ділянки шкіри. При цьому порушується зволоження кон’юнктиви й рогівки, що може привести до кератокон’юнктивіту, втрати прозорості рогівки, зниження гостроти зору. При постійному лагофтальмі виконується пересадка шкіри.
Інші функціональні проблеми, що виникають після блефаропластики:
— сухий кератокон’юктивіт — рекомендовано використання сльозозамінників;
— хемоз — рекомендоване застосування місцевих засобів із вмістом кортикостероїдних гормонів;
— диплопія внаслідок токсичної дії місцевого анестетика (самостійно минає через 6–8 тижнів), сильного набряку або гематоми, травми рухового нерва або одного з м’язів (необхідна повторна реконструктивна хірургія);
— сльозотеча може виникнути внаслідок рубцювання (необхідне хірургічне втручання) або стиснення слізних канальців унаслідок набряку (минає самостійно).
Більшість естетичних ускладнень після блефаропластики коригуються тільки хірургічним шляхом (гіпокорекція, гіперкорекція, надлишкове видалення жиру на верхній повіці, «риб’яче око», асиметрія очей). При виникненні гіперпігментації курсом застосовуються креми з гідрохіноном, іноді в комбінації з гідрокортизоном.
Отже, більшості ускладнень при блефаропластиці можна запобігти, дотримуючись правил передопераційної підготовки, техніки проведення оперативного втручання, ретельного спостереження за перебігом післяопераційного періоду й навчання пацієнтів догляду за очима.

/24.jpg)
/26.jpg)
/30.jpg)
/33.jpg)
/34.jpg)
/35.jpg)
/36.jpg)