Журнал «Боль. Суставы. Позвоночник» Том 11, №1, 2021
Вернуться к номеру
Клінічне значення ентезитів при спондилоартритах: від патофізіології до лікування (огляд літератури)
Авторы: Головач І.Ю.
Клінічна лікарня «Феофанія» Державного управління справами, м. Київ, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
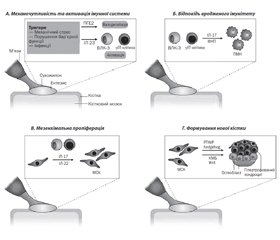
У статті наведені новітні погляди стосовно анатомії та патогенезу ентезитів, клінічних особливостей, можливостей діагностики та лікування. Ураження ентезисів вважається відмітною патолого-клінічною ознакою групи спондилоартритів; цей симптом включений до класифікаційних критеріїв Міжнародної групи з вивчення спондилоартритів (ASAS) для периферичних й аксіальних форм. Типовими локалізаціями ентезитів при спондилоартритах є: місце прикріплення ахіллового сухожилля і підошовного апоневрозу до п’яткової кістки, латеральний виросток плечової кістки, медіальний виросток стегнової кістки, верхній край надколінка, верхній край клубових кісток, вертлюги стегнових кісток, остисті відростки хребців. Структури, зосереджені в ділянці ентезису, мають анатомічний, функціональний і фізіологічний взаємозв’язок і формують єдиний синовіально-ентезіальний комплекс. На відміну від ревматоїдного артриту, при якому основний патологічний процес відбувається в синовіальній оболонці, при спондилоартритах основою морфологічних змін є ентезити, а артрит (синовіт), що розвивається, є вторинним щодо ентезитів. Ентезит виявляється в 30–50 % пацієнтів зі спондилоартритами та асоціюється з більш високою активністю, вищими показниками болю та гіршою якістю життя. Наявність ентезиту у хворих на псоріатичний артрит асоціюється з ураженням осьових та периферичних суглобів, високою ймовірністю анкілозування, загальною вищою активністю захворювання, більш вираженим болем, погіршенням якості життя та функціонального стану, порушенням сну. Крім того, ентезит розглядається як провісник негативного прогнозу захворювання й може пророкувати меншу ймовірність досягнення ремісії та низької активності. Ентезіальне запалення виникає внаслідок механічного та/або інфекційного стресу, призводячи до активації простагландину E2 та інтерлейкіну-23 із подальшою вазодилатацією й активацією Т-клітин та вроджених лімфоїдних клітин типу 3. Подальше запалення внаслідок активації вродженого імунітету характеризується вивільненням фактора некрозу пухлин та інтерлейкіну-17, що призводить до припливу імунних клітин, таких як поліморфноядерні нейтрофіли. Проліферація мезенхіми, спричинена впливом інтерлейкіну-17 та -22, характеризується активацією та проліферацією резидентних мезенхімальних стовбурових клітин окістя. Лікувальні стратегії залишаються невизначеними при ентезитах. Найчастіше використовують нестероїдні протизапальні препарати, локальні ін’єкції глюкокортикоїдів, апреміласт, а також таргетні препарати — інгібітори фактора некрозу пухлини та інтерлейкінів-17 та -23.
В статье представлены новейшие взгляды относительно анатомии и патогенеза энтезитов, клинических особенностей, возможностей диагностики и лечения. Поражение энтезисов считается отличительным патолого-клиническим признаком группы спондилоартритов; этот симптом включен в классификационные критерии Международной группы по изучению спондилоартритов (ASAS) для периферических и аксиальных форм. Типичными локализациями энтезитов при спондилоартрите являются: место прикрепления ахиллового сухожилия и подошвенного апоневроза к пяточной кости, латеральный мыщелок плечевой кости, медиальный мыщелок бедренной кости, верхний край надколенника, верхний край подвздошных костей, вертелы бедренных костей, остистые отростки позвонков. Структуры, сосредоточенные в области энтезисов, имеют анатомическую, функциональную и физиологическую взаимосвязь и формируют единый синовиально-энтезиальный комплекс. В отличие от ревматоидного артрита, при котором основной патологический процесс проходит в синовиальной оболочке, при спондилоартритах основой морфологических изменений являются энтезиты, а развивающийся артрит (синовит) является вторичным по отношению к энтезитам. Энтезит выявляется у 30–50 % пациентов со спондилоартритами и ассоциируется с более высокой активностью, высокими показателями боли и худшим качеством жизни. Наличие энтезитов у больных псориатическим артритом ассоциируется с поражением осевых и периферических суставов, высокой вероятностью анкилозирования, высокой активностью заболевания, выраженными болями, ухудшением качества жизни и функционального состояния, нарушением сна. Кроме того, энтезит рассматривается как предвестник негативного прогноза заболевания и может предсказывать меньшую вероятность достижения ремиссии и низкой активности. Энтезиальное воспаление возникает в результате механического и/или инфекционного стресса, приводя к активации простагландина E2 и интерлейкина-23 с последующей вазодилатацией и активацией Т-клеток и врожденных лимфоидных клеток типа 3. Дальнейшее воспаление в результате активации врожденного иммунитета характеризуется высвобождением фактора некроза опухолей и интерлейкина-17, что приводит к притоку иммунных клеток, таких как полиморфноядерные нейтрофилы. Пролиферация мезенхимы под влиянием интерлейкина-17 и -22 характеризуется активацией и пролиферацией резидентных мезенхимальных стволовых клеток надкостницы. Лечебные стратегии остаются неопределенными при энтезитах. Чаще всего используют нестероидные противовоспалительные препараты, локальные инъекции глюкокортикоидов, апремиласт, а также таргетные препараты — ингибиторы фактора некроза опухоли и интерлейкинов-17 и -23.
The article presents the latest views on enthesites’ anatomy and pathogenesis, clinical features, diagnostic and therapeutic options. The enthesis lesions are considered an outstanding pathologic and clinical manifestation of spondyloarthritis group; this symptom is included into the classification criteria by the Assessment of SpondyloArthritis International Society for the peripheral and axial forms. The typical spondyloarthritis-attended enthesites’ localizations are: the site of Achilles tendon and plantar aponeurosis’ attachment to the calcaneus, the lateral condyle of the humerus, the medial condyle of the femur, the upper edge of the patella, the upper edge of the iliac bones, trochanters of the femoral bones, spinous processes of the vertebrae. The structures focused in the entheses’ sites have anatomical, functional and physiological interactions and constitute a single synovial-entheseal complex. Unlike the rheumatoid arthritis with a key pathological process occurring in the synovial lining, the spondyloarthritis is mainly provoking the morphological modifications, namely enthesites, while the developing arthritis (synovitis) appears secondary to enthesites. The enthesitis is detected in 30–50 % of spondyloarthritis patients and associated with a higher activity, higher pain indices and a compromised life quality. The presence of enthesites in the psoriatic arthritis patients is associated with axial and peripheral joint lesions, a high chance of ankylosation, a high disease activity, pronounced pains, a compromised life quality and functional state, sleeping disorders. Furthermore, the enthesitis is considered a precursor of the negative disease outcome, and may forecast a lower probability of remission and a low activity. The entheseal inflammation occurs as a result of mechanical and/or infection-originating stress, resulting in the prostaglandin E2 and interleukin-23 activation with a further vasodilatation, and T-cell and Group 3 innate lymphoid cell (ILC3) activation. The innate immunity-generated inflammation is characterized by a release of tumor necrosis factor and interleukin-17, resulting in the immune cell influx, namely the polymorphonuclear neutrophils. Under the influence of interleukin-17 and interleukin-22, the mesenchymal proliferation is characterized by an activation and proliferation of resident mesenchymal stem cells in the periosteum. The enthesitis treatment strategies remain undefined; however, the ones most commonly used are the nonsteroidal anti-inflammatory drugs (NSAIDs), localized glucocorticoid injections, Apremilast, as well as targeted medications, namely the tumor necrosis factor, interleukin-17 and interleukin-23 inhibitors.
ентезит; спондилоартрит; псоріатичний артрит; синовіально-ентезіальний комплекс; простагландин Е2; запалення; патогенез; лікування; огляд
энтезит; спондилоартрит; псориатический артрит; синовиально-энтезиальный комплекс; простагландин Е2; воспаление; патогенез; лечение; обзор
enthesitis; spondyloarthritis; psoriatic arthritis; synovial-enthesial complex; prostaglandin E2; inflammation; pathogenesis; treatment
- Benjamin M., Moriggl B., Brenner E. et al. The “Enthesis Organ” Concept. Why Enthesopathies May Not Present as Focal Insertional Disorders. Arthritis Rheum. 2004. 50(10). 3306-3313. doi: 10.1002/art.20566.
- Rudwaleit M., van der Heijde D., Landewe R. et al. The Assessment of SpondyloArthritis International Society classification criteria for peripheral spondyloarthritis and for spondyloarthritis in general. Ann. Rheum. Dis. 2011. 70(1). 25-31. doi: 10.1136/ard.2010.133645.
- Taylor W., Gladman D., Helliwell P. et al; CASPAR Study Group. Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum. 2006. 54(8). 2665-2673. doi: 10.1002 %2Fart.21972.
- Sieper J., Rudwaleit M., Baraliakos X. et al. The Assessment of SpondyloArthritis international Society (ASAS) handbook: a guide to assess spondyloarthritis. Ann. Rheum. Dis. 2009. 68, Suppl 2. 1-44. doi: 10.1136/ard.2008.104018.
- Healy P.J., Helliwell P.S. Measuring clinical enthesitis in psoriatic arthritis: assessment of existing measures and development of an instrument specific to psoriatic arthritis. Arthritis Rheum. 2008. 59(5). 686-691. doi: 10.1002/art.23568.
- Schett G., Lories R.J, D’Agostino M.-A. et al. Enthesitis: from pathophysiology to treatment. Nat. Rev. Rheumatol. 2017. 13. 731-741. doi: 10.1038/nrrheum.2017.188.
- Sherlock J.P., Joyce-Shaikh B., Turner S.P. et al. IL-23 induces spondyloarthropathy by acting on ROR-gammat+ CD3+ -CD4 -CD8-entheseal resident T cells. Nat. Med. 2012. 18. 1069-1076.
- Polachek A., Li S., Chandran V., Gladman D.D. Clinical enthesitis in a prospective longitudinal psoriatic arthritis cohort: incidence, prevalence, characteristics, and outcome. Arthritis Care Res. 2017. 69. 1685-1691.
- Mease P.J., Liu M., Rebello S. et al. Characterization of Patients With Axial Spondyloarthritis by Enthesitis Presence: Data from the Corrona Psoriatic Arthritis/Spondyloarthritis Registry. ACR Open Rheum. 2020. 2(7). 449-456. doi: 10.1002/acr2.11154.
- Arslan Alhussain F., Kasapoglu Gunal E., Kurum E. et al. Greater magnitude of entheseal microdamage and repair in psoriatic arthritis compared with ankylosing spondylitis on ultrasound. Rheumatology (Oxford). 2019. 58. 299-303.
- Solmaz D., Bakirci S., Jibri Z. et al. Psoriasis is an independent risk factor for entheseal damage in axial spondyloarthritis. Semin. Arthritis Rheum. 2019. 50. 42-47.
- Lubrano E., Perrotta F.M., Manara M. et al. The sex infuence on response to tumor necrosis factor-α inhibitors and remission in axial spondyloarthritis. J. Rheumatol. 2018. 45. 195-201.
- Mease P.J., Karki C., Palmer J.B. et al. Clinical characteristics, disease activity, and patient-reported outcomes in psoriatic arthritis patients with dactylitis or enthesitis: results from the Corrona Psoriatic Arthritis/Spondyloarthritis Registry. Arthritis Care Res. (Hoboken). 2017. 69. 1692-1699.
- Polachek A., Li S., Chandran V., Gladman D.D. Clinical enthesitis in a prospective longitudinal psoriatic arthritis cohort: incidence, prevalence, characteristics, and outcome. Arthritis Care Res. (Hoboken). 2017. 69. 1685-1691.
- Kaeley G.S., Eder L., Aydin S.Z., Gutierrez M., Bakewell C. Enthesitis: a hallmark of psoriatic arthritis. Semin. Arthritis Rheum. 2018. 48. 35-43.
- Benjamin M., McGonagle D. The anatomical basis for disease localisation in seronegative spondyloarthropathy at entheses and related sites. J. Anat. 2001. 199. 503-526. doi: 10.1046/j.1469-7580.2001.19950503.x.
- Reveille J.D. Genetics of spondyloarthritis – beyond the MHC. Nat. Rev. Rheumatol. 2012. 8. 296-304. doi: 10.1038/nrrheum.2012.41.
- Xavier R.J., Podolsky D.K. Unravelling the pathogenesis of inflammatory bowel disease. Nature. 2007. 448. 427-434. doi: 10.1038/nature06005.
- Jacques P., Lambrecht S., Verheugen E. et al. Proof of concept: enthesitis and new bone formation in spondyloarthritis are driven by mechanical strain and stromal cells. Ann. Rheum. Dis. 2014. 73(2). 437-445. doi: 10.1136/annrheumdis-2013-203643.
- Paulissen S.M., van Hamburg J.P., Davelaar N. et al. Synovial fibroblasts directly induce Th17 pathogenicity via the cyclooxygenase/prostaglandin E2 pathway, independent of IL-23. J. Immunol. 2013. 191(3). 1364-1372. doi: 10.4049/jimmunol.1300274.
- Sherlock J.P., Joyce-Shaikh B., Turner S.P. et al. IL-23 induces spondyloarthropathy by acting on ROR-γt+ CD3+CD4-CD8- entheseal resident T cells. Nat. Med. 2012. 18(7). 1069-1076. doi: 10.1038/nm.2817.
- Hamada S., Umemura M., Shiono T. et al. IL-17A produced by gammadelta T cells plays a critical role in innate immunity against listeria monocytogenes infection in the liver. J. Immunol. 2008. 181(5). 3456-3463. doi: 10.4049/jimmunol.181.5.3456.
- Cuthbert R.J., Fragkakis E.M., Dunsmuir R. et al. Brief Report: Group 3 Innate Lymphoid Cells in Human Enthesis. Arthritis Rheumatol. 2017. 69(9). 1816-1822. doi: 10.1002/art.40150.
- Karbach S., Croxford A.L., Oelze M. et al. Interleukin 17 drives vascular inflammation, endothelial dysfunction, and arterial hypertension in psoriasis-like skin disease. Arterioscler Thromb. Vasc. Biol. 2014 Dec. 34(12). 2658-2668. doi: 10.1161/ATVBAHA.114.304108.
- McGonagle D., Marzo-Ortega H., O’Connor P. et al. Histological assessment of the early enthesitis lesion in spondyloarthropathy. Ann. Rheum. Dis. 2002. 61(6). 534-5347. doi: 10.1136/ard.61.6.534.
- Simon D., Faustini F., Kleyer A. et al. Analysis of periarticular bone changes in patients with cutaneous psoriasis without associated psoriatic arthritis. Ann. Rheum. Dis. 2016. 75(4). 660-666. doi: 10.1136/annrheumdis-2014-206347.
- Finzel S., Englbrecht M., Engelke K. et al. A comparative study of periarticular bone lesions in rheumatoid arthritis and psoriatic arthritis. Ann. Rheum. Dis. 2011. 70(1). 122-127. doi: 10.1136/ard.2010.132423.
- Loi F., Córdova L.A., Pajarinen J. et al. Inflammation, fracture and bone repair. Bone. 2016. 86. 119-130. doi: 10.1016/j.bone.2016.02.020.
- van Hamburg J.P., Tas S.W. Molecular mechanisms underpinning T helper 17 cell heterogeneity and functions in rheumatoid arthritis. J. Autoimmun. 2018. 87. 69-81. doi: 10.1016/j.jaut.2017.12.006.
- El-Zayadi A.A., Jones E.A., Churchman S.M. et al. Interleukin-22 drives the proliferation, migration and osteogenic differentiation of mesenchymal stem cells: a novel cytokine that could contribute to new bone formation in spondyloarthropathies. Rheumatology (Oxford). 2017. 56(3). 488-493. doi: 10.1093/rheumatology/kew384.
- Hakeda Y., Nakatani Y., Kurihara N. et al. Prostaglandin E2 stimulates collagen and non-collagen protein synthesis and prolyl hydroxylase activity in osteoblastic clone MC3T3-E1 cells. Biochem. Biophys. Res. Commun. 1985. 126(1). 340-345. doi: 10.1016/0006-291x(85)90611-4.
- Heiland G.R., Zwerina K., Baum W. et al. Neutralisation of Dkk-1 protects from systemic bone loss during inflammation and reduces sclerostin expression. Ann. Rheum. Dis. 2010. 69(12). 2152-2159. doi: 10.1136/ard.2010.132852.
- Ruiz-Heiland G., Horn A., Zerr P. et al. Blockade of the hedgehog pathway inhibits osteophyte formation in arthritis. Ann. Rheum. Dis. 2012. 71(3). 400-407. doi: 10.1136/ard.2010.148262.
- Razzak M. Osteoarthritis: The hedgehog and the bony spur. Nat. Rev. Rheumatol. 2012. 8(3). 123. doi: 10.1038/nrrheum.2012.5.
- Chen X., Macica C., Nasiri A., Judex S., Broadus A.E. Mechanical regulation of PTHrP expression in entheses. Bone. 2007 Nov. 41(5). 752-759. doi: 10.1016/j.bone.2007.07.020.
- Queiro R., Gonzalez S., Alperi M. et al. HLA-DR17 is associated with enthesitis in psoriatic arthritis. Joint Bone Spine. 2011. 78. 428-429. doi: 10.1016/j.jbspin.2011.03.006..
- McGonagle D. Enthesitis: an autoinflammatory lesion linking nail and joint involvement in psoriatic disease. J. Eur. Acad. Dermatol. Venereol. 2009 Sep. 23, Suppl 1. 9-13. doi: 10.1111/j.1468-3083.2009.03363.x.
- Sherlock J.P., Joyce-Shaikh B., Turner S.P. et al. IL-23 induces spondyloarthropathy by acting on ROR-γt+ CD3+CD4-CD8- entheseal resident T cells. Nat. Med. 2012, Jul 1. 18(7). 1069-1076. doi: 10.1038/nm.2817.
- Lytkina K.A., Zjangirov R.R. Primenenie ustekinumaba v terapii jentezitov u pacientov s psoriaticheskim artritom (analiz literaturnyh dannyh). RMZh. Medicinskoe obozrenie. 2017. 1. 32-34. (in Russian).
- Polachek A., Li S., Chandran V., Gladman D.D. Clinical Enthesitis in a Prospective Longitudinal Psoriatic Arthritis Cohort: Incidence, Prevalence, Characteristics, and Outcome. Arthritis Care Res. (Hoboken). 2017. 69(11). 1685-1691. doi: 10.1002/acr.23174.
- Langenbruch A., Radtke M.A., Krensel M., Jacobi A., Reich K., Augustin M. Nail involvement as a predictor of concomitant psoriatic arthritis in patients with psoriasis. Br. J. Dermatol. 2014 Nov. 171(5). 1123-1128. doi: 10.1111/bjd.13272.
- Tan A.L., Benjamin M., Toumi H. et al. The relationship between the extensor tendon enthesis and the nail in distal interphalangeal joint disease in psoriatic arthritis — a high-resolution MRI and histological study. Rheumatology (Oxford). 2007 Feb. 46(2). 253-256. doi: 10.1093/rheumatology/kel214.
- Sidorchik T.G., Linev V.A., Radzynja M.A., Rubins A.J., Rubins S.A. Jentezit i psoriaticheskaja onihopatija kak predraspolagajushhie faktory psoriaticheskogo artrita u pacientov, bol’nyh psoriazom. Vestnik dermatologii i venerologii. 2018. 1. 38-50. doi: 10.25208/0042-4609-2018-94-1-38-50. (in Russian).
- Østergaard M, Poggenborg R.P. Magnetic resonance imaging in psoriatic arthritis — update on current status and future perspectives: a report from the GRAPPA 2010 annual meeting. J. Rheumatol. 2012. 39(2). 408-412. doi: 10.3899/jrheum.111235.
- Kavanaugh A., van der Heijde D., McInnes I.B. et al. Golimumab in psoriatic arthritis: one-year clinical efficacy, radiographic, and safety results from a phase III, randomized, placebo-controlled trial. Arthritis Rheum. 2012. 64(8). 2504-2517. doi: 10.1002/art.34436.
- Maksymowych W.P., Mallon C., Morrow S. et al. Development and validation of the Spondyloarthritis Research Consortium of Canada (SPARCC) Enthesitis Index. Ann. Rheum. Dis. 2009. 68(6). 948-953. doi: 10.1136/ard.2007.084244.
- Healy P.J., Helliwell P.S. Measuring clinical enthesitis in psoriatic arthritis: assessment of existing measures and development of an instrument specific to psoriatic arthritis. Arthritis Rheum. 2008. 59(5). 686-691. doi: 10.1002/art.23568.
- Gutierrez M., Filippucci E., De Angelis R. et al. Subclinical entheseal involvement in patients with psoriasis: an ultrasound study. Semin. Arthritis Rheum. 2011. 40(5). 407-412. doi: 10.1016/j.semarthrit.2010.05.009.
- van der Heijde D., Ramiro S., Landewe R. et al. 2016 update of the ASASEULAR management recommendations for axial spondyloarthritis. Ann. Rheum. Dis. 2017 Jun. 76(6). 978-991. doi: 10.1136/annrheumdis-2016-210770.
- Singh J.A., Guyatt G., Ogdie A. et al. Special Article: 2018 American College of Rheumatology/National Psoriasis Foundation Guideline for the Treatment of Psoriatic Arthritis. Arthritis Rheumatol. 2019. 71(1). 5-32. doi: 10.1002/art.40726.
- Song I.H., Hermann K., Haibel H. et al. Effects of etanercept versus sulfasalazine in early axial spondyloarthritis on active inflammatory lesions as detected by whole-body MRI (ESTHER): a 48-week randomised controlled trial. Ann. Rheum. Dis. 2011. 70. 590-596. doi: 10.1136/ard.2010.139667.
- Coates L.C., Helliwell P.S. Methotrexate efficacy in the tight control in Psoriatic Arthritis Study. J. Rheumatol. 2016. 43. 356-361. doi: 10.3899/jrheum.150614.
- Mease P.J., Gladman D.D., Collier D.H. et al. Etanercept and methotrexate as monotherapy or in combination for psoriatic arthritis: primary results from a randomized, controlled phase III trial. Arthritis Rheumatol. 2019. 71. 1112-1124. doi: 10.1002/art.40851.
- Аriga M., Neitzert B., Nakae S., Mottin G., Bertrand C. et al. Nonredundant function of phosphodiesterases 4D and 4B in neutrophil recruitment to the site of inflammation. J. Immunol. 2004. 173(12). 7531-7538. doi: 10.4049/jimmunol.173.12.7531.
- Kavanaugh A., Gladman D.D., Edwards C.J. et al. Long-term experience with apremilast in patients with psoriatic arthritis: 5-year results from a PALACE 1- 3 pooled analysis. Arthritis Res. Ther. 2019. 21. 118-125. doi: 10.1186/s13075-019-1901-3.
- Marzo-Ortega H., McGonagle D., Jarrett S. et al. Infliximab in combination with methotrexate in active ankylosing spondylitis: a clinical and imaging study. Ann. Rheum. Dis. 2005. 64. 1568-1575. doi: 10.1136/ard.2004.022582.
- Dougados M., Braun J., Szanto S. et al. Continuous efficacy of etanercept in severe and advanced ankylosing spondylitis: results from a 12-week open-label extension of the SPINE study. Rheumatology (Oxford). 2012. 51(9). 1687-1696. doi: 10.1093/rheumatology/kes125.
- Dougados M., Combe B., Braun J. et al. A randomised, multicentre, double-blind, placebo-controlled trial of etanercept in adults with refractory heel enthesitis in spondyloarthritis: the HEEL trial. Ann. Rheum. Dis. 2010. 69(8). 1430-1435. doi: 10.1136/ard.2009.121533.
- Antoni C., Krueger G.G., de Vlam K. et al. Infliximab improves signs and symptoms of psoriatic arthritis: results of the IMPACT 2 trial. Ann. Rheum. Dis. 2005. 64. 1150-1157. doi: 10.1136/ard.2004.032268.
- Mease P., Sieper J., Van den Bosch F. et al. Randomized controlled trial of adalimumab in patients with nonpsoriatic peripheral spondyloarthritis. Arthritis Rheumatol. 2015. 67(4). 914-923. doi: 10.1002/art.39008.
- Kavanaugh A., Puig L., Gottlieb A.B. et al. Efficacy and safety of ustekinumab in psoriatic arthritis patients with peripheral arthritis and physician-reported spondylitis: posthoc analyses from two phase III, multicentre, double-blind, placebo-controlled studies (PSUMMIT-1/PSUMMIT-2). Ann. Rheum. Dis. 2016. 75. 1984-1988. doi: 10.1136/annrheumdis-2015-209068.
- McInnes I.B., Chakravarty S.D., Apaolaza I. et al. Efficacy of ustekinumab in biologic-naive patients with psoriatic arthritis by prior treatment exposure and disease duration: data from PSUMMIT 1 and PSUMMIT 2. RMD Open 2019. 5. e000990. doi: 10.1136/rmdopen-2019-000990.
- Mease P.J., Rahman P., Gottlieb A.B. et al. Guselkumab in biologic-naive patients with active psoriatic arthritis (DISCOVER-2): a double-blind, randomized, placebo-controlled phase 3 trial. Lancet. 2020. 395(10230). 1126-1136. doi: 10.1016/S0140-6736(20)30263-4.
- McInnes I.B., Mease P.J., Kirkham B. et al.; FUTURE 2 Study Group. Secukinumab, a human anti-interleukin-17A monoclonal antibody, in patients with psoriatic arthritis (FUTURE 2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2015. 386(9999). 1137-1146. doi: 10.1016/S0140-6736(15)61134-5.
- Mease P.J., van der Heijde D., Ritchlin C.T. et al.; SPIRIT-P1 Study Group. Ixekizumab, an interleukin-17A specific monoclonal antibody, for the treatment of biologic-naive patients with active psoriatic arthritis: results from the 24-week randomized, double-blind, placebo-controlled and active (adalimumab)-controlled period of the phase III trial SPIRIT-P1. Ann. Rheum. Dis. 2017. 76(1). 79-87. doi: 10.1136/annrheumdis-2016-209709.

/23.jpg)
/24.jpg)
/26.jpg)