Журнал «Почки» Том 10, №1, 2021
Вернуться к номеру
Роль метаболічної терапії в лікуванні гіпоксії паренхіми нирок у дітей з пієлонефритом, асоційованим із недиференційованою дисплазією сполучної тканини
Авторы: Лук’яненко Н.С.(1, 2), Кенс К.А.(2), Добрик О.О.(2)
(1) — Державна установа «Інститут спадкової патології НАМН України», м. Львів, Україна
(2) — Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Нефрология
Разделы: Клинические исследования
Версия для печати
Мета: обґрунтувати вибір та оцінити ефективність застосування метаболічного лікувального комплексу, направленого на зменшення гіпоксії та покращення метаболічних процесів у паренхімі нирок в терапії гострого пієлонефриту на фоні міхурово-сечовідного рефлюксу як вісцерального прояву недиференційованої дисплазії сполучної тканини у дітей раннього віку. Матеріали та методи. Обстежено 67 дітей віком від 3 місяців до 3 років із пієлонефритом і міхурово-сечовідним рефлюксом, асоційованим з недиференційованою дисплазією сполучної тканини (НДСТ). Контрольну групу становили 65 дітей раннього віку з гострим пієлонефритом, в яких після обстеження не було виявлено ознак НДСТ. Друга група контролю — 40 соматично здорових дітей цього ж віку. З метою діагностики наявності недиференційованої дисплазії сполучної тканини всім дітям у періоді ремісії запального процесу проводився тест на вміст оксипроліну в сечі. Визначались маркери недиференційованої тканинної гіпоксії паренхіми нирок: тест на антикристалутворюючу здатність сечі та добова екскреція солей у сечі за методикою Ю.Є. Вельтищева та Е.О. Юр’євої. Досліджувались маркери морфофункціонального стану цитомембран ниркового епітелію: проба на кальцифікацію — наявність полярних ліпідів у сечі та тест на наявність продуктів перекисного окислення ліпідів у сечі. Дітям раннього віку з пієлонефритом та НДСТ, у сечі яких була встановлена висока екскреція оксипроліну, на додаток до протокольного лікування в періоді ремісії запального процесу був рекомендований прийом протягом місяця комплексу вітаміну Е та L-карнітину у вікових дозах, здатного покращувати метаболічні процеси в паренхімі нирок. Результати. Після метаболічної терапії з антигіпоксантною та мембранопротекторною дією в обстежених дітей спостерігалась значна позитивна динаміка маркерів тканинної гіпоксії та мембранодеструкції паренхіми нирок. Висновки. Доведено позитивний вплив метаболічного комплексу (вітамін Е и L-карнітин), який виявився у зменшенні ступеня тканинної гіпоксії та мембранодеструкції в паренхімі нирок у періоді ремісії запального процесу нирок, що підтверджує можливість зменшення тканинної гіпоксії у дітей з пієлонефритом та міхурово-сечовідним рефлюксом, асоційованим з недиференційованою дисплазією сполучної тканини, при застосуванні вітаміну Е та L-карнітину у вікових дозах протягом місяця, та дозволяє рекомендувати цим дітям проведення метаболічної терапії.
Цель: обосновать выбор и оценить эффективность применения метаболического лечебного комплекса (витамин Е и L-карнитин), направленного на уменьшение тканевой гипоксии и улучшение метаболических процессов в паренхиме почек в терапии острого пиелонефрита на фоне пузырно-мочеточникового рефлюкса как висцерального проявления недифференцированной дисплазии соединительной ткани у детей раннего возраста. Материалы и методы. Обследованы 67 детей с пиелонефритом и пузырно-мочеточниковым рефлюксом (ПМР), ассоциированным с недифференцированной дисплазией соединительной ткани (НДСТ), в возрасте от 3 месяцев до 3 лет. В контрольную группу вошли 65 детей раннего возраста с острым пиелонефритом, у которых после обследования не было выявлено ПМР и признаков НДСТ. Вторую группу контроля составили 40 соматически здоровых детей этого же возраста. С целью диагностики наличия недифференцированной дисплазии соединительной ткани всем детям в периоде ремиссии воспалительного процесса проводился тест на содержание оксипролина в моче. Определялись маркеры недифференцированной тканевой гипоксии паренхимы почек: тест на антикристаллобразующую функцию мочи и суточную экскрецию солей в моче по методике Ю.Е. Вельтищева и Э.А. Юрьевой. Исследовались маркеры морфофункционального состояния цитомембран почечного эпителия: проба на кальцификацию — наличие полярных липидов в моче и тест на наличие продуктов перекисного окисления липидов в моче. Детям раннего возраста с пиелонефритом, ПМР и НДСТ, в моче которых была установлена высокая экскреция оксипролина, в дополнение к протокольному лечению в периоде ремиссии воспалительного процесса был рекомендован прием в течение месяца комплекса витамина Е и L-карнитина в возрастных дозах, способного улучшать метаболические процессы в паренхиме почек. Результаты. После метаболической терапии с антигипоксантным и мембранопротекторным действием у обследованных детей наблюдалась значительная положительная динамика изучаемых маркеров тканевой гипоксии и мембранодеструкции паренхимы почек. Выводы. Выявлено положительное влияние метаболического комплекса (витамин Е и L-карнитин) в периоде ремиссии воспалительного процесса почек, который выразился в уменьшении степени тканевой гипоксии и мембранодеструкции, что подтверждает возможность уменьшения тканевой гипоксии у детей с пиелонефритом и пузырно-мочеточниковым рефлюксом, ассоциированным с недифференцированной дисплазией соединительной ткани, при применении витамина Е и L-карнитина в возрастных дозах в течение месяца и позволяет рекомендовать этим детям проведение метаболической терапии.
Purpose of the work: to substantiate the choice and evaluate the effectiveness of the use of a metabolic therapeutic complex (vitamin E and L-carnitine) aimed at reducing tissue hypoxia and improving metabolic processes in the renal parenchyma during the treatment of acute pyelonephritis against the background of vesicoureteral reflux (VUR) as visceral manifestation of undifferentiated connective tissue dysplasia (UCTD) in young children. Materials and methods. Sixty-seven children aged 3 months to 3 years with pyelonephritis and VUR associated with UCTD were examined. The control group consisted of 65 young children with acute pyelonephritis, who after examination did not reveal VUR and signs of UCTD. The second control group included 40 somatically healthy children of the same age. In order to diagnose the presence of undifferentiated connective tissue dysplasia, all children with remission of the inflammatory process underwent a hydroxyproline urine test. Markers of renal parenchymal hypoxia were determined using a test for anticrystallization function of urine and daily urinary salt excretion according to the method of Yu.Ye. Veltyshchev and Ye.O. Yurieva. The markers of the morphofunctional state of the renal epithelial cytomembranes were studied by means of a test for calcification — the presence of polar lipids in urine, and a test for the presence of lipid peroxidation products (LPР) in urine. For young children with pyelonephritis, VUR and UCTD in whose urine a high excretion of hydroxyproline was detected, in addition to protocol treatment in the period of remission of the inflammatory process, it was recommended to take for a month medications that have antihypoxant properties and are able to improve metabolic processes in the renal parenchyma — vitamin E and L-carnitine in age-related doses. Results. The high frequency of detection of phenotypic signs of undifferentiated connective tissue dysplasia and significant urinary excretion of hydroxyproline (86.6 %) in children with pyelonephritis against the background of vesicoureteral reflux reliably indicate the presence of undifferentiated connective tissue dysplasia as a result of fibrillogenesis disorders. In young children with pyelonephritis against the background of vesicoureteral reflux, the presence of renal parenchymal hypoxia and nephrothelial membrane destruction was revealed, as indicated by a decrease in the anticrystallization function of urine, daily excretion of phosphates and a high excretion of lipid peroxidation products from urine and polar lipids. In children in whom the association of the pathological process with UCTD was detected, these changes were more significant. This is indicated by a more pronounce decrease, compared to children in whom no association with UCTD was found, in the anticrystallization function of urine, an increase in the oxalate excretion and a decrease in the daily urinary excretion of phosphates and urates, which was accompanied by a significant intensification of lipid peroxidation processes and the appearance of polar lipids in daily urine. After metabolic therapy with antihypoxant and membrane-protective action, the examined children showed a significant positive dynamics of the studied markers of tissue hypoxia and membrane destruction of the renal parenchyma. Conclusions. A positive effect of a metabolic complex (vitamin E and L-carnitine) during remission of the inflammatory process in the kidneys was revealed, which was expressed in a decrease in the degree of tissue hypoxia and membrane destruction, which confirms the possibility of reducing tissue hypoxia in children with pyelonephritis and vesicoureteral reflux associated with undifferentiated dysplasia connective tissue using vitamin E and L-carnitine in age-related doses for a month and allows you to recommend metabolite therapy to these children.
діти раннього віку; міхурово-сечовідний рефлюкс; метаболічна терапія недиференційованої дисплазії сполучної тканини
дети раннего возраста; пузырно-мочеточниковый рефлюкс; метаболическая терапия; недифференцированная дисплазия соединительной ткани
young children; vesicoureteral reflux; metabolic therapy; undifferentiated connective tissue dysplasia
Вступ
Матеріали та методи
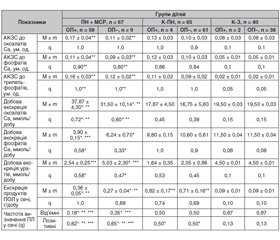
Результати та обговорення
Висновки
- Крыганова Т.А., Длин В.В. Частота аномалий органов мочевой системы и функциональное состояние почек в зависимости от степени выраженности дисплазии соединительной ткани у детей. Российский вестник перинатологии и педиатрии. 2016. № 3. С. 81-86.
- Rodriguez M.M. Congenital anomalies of the kidney and the urinary tract CAKUT. Fetal. Pediatr. Pathol. 2014. 33. 293-320.
- Sanna-Cherchi S., Westland R., Ghiggeri G.M. et al. Genetic basis of human congenital anomalies of the kidney and urinary tract. J. Clin. Invest. 2018. 128. 4-15.
- Nicolaou N., Renkema K.Y., Bongers E.M. et al. Genetic, environmental, and epigenetic factors involved in CAKUT. Nat. Rev. Nephrol. 2015. 11. 720-731.
- Повшедна Т.Ю., Шевчук Д.В., Корнійчук Н.М. Роль своєчасного лікування вроджених вад розвитку сечовидільної системи в попередженні хронічної ниркової недостатності у дітей. Біологічні дослідження. 2015. Збірник наукових праць. Житомир: ПП «Рута», 2015. С. 423-429.
- Крыганова Т.А., Аксенова М.Е., Длин В.В. Пузырно-мочеточниковый рефлюкс и его осложнения у детей в зависимости от степени выраженности дисплазии соединительной ткани. Российский вестник перинатологии и педиатрии. 2016. № 4. С. 93-97.
- Lee K.H., Gee H.Y., Shin J.I. Genetics of vesicoureteral reflux and congenital anomalies of the kidney and urinary tract. Investig. Clin. Urol. 2017. 58. S4-S13.
- Национальные рекомендации Российского научного медицинского общества терапевтов по диагностике, лечению и реабилитации пациентов с дисплазиями соединительной ткани. А.И. Мартынов, Г.И. Нечаева, Е.В. Акатова и др. Медицинский вестник Северного Кавказа. 2016. № 1. С. 2-76.
- Сем’янчук В.Б. Поширеність проявів недиференційованої дисплазії сполучної тканини у дітей Прикарпаття, хворих на бронхіальну астму. Актуальні проблеми сучасної медицини. Вісник української медичної стоматологічної академії. 2015. № 2(50). С. 145-149.
- Лук’яненко Н.С., Іськів М.Ю., Кенс К.А., Макух Г.В. Маркери порушення фібрилогенезу у дітей з різними варіантами перебігу пієлонефриту. Почки. 2018. 7(2). 100-106. doi: 10.22141/2307-1257.7.2.2018.127395.
- Лукина Т.С. Оценка маркера оксипролина и его значение у женщин с недифференцированной дисплазией соединительной ткани. Современная медицина: актуальные вопросы: сб. ст. по мат-лам XLIV–XLV Междунар. науч.-практ. конф. № 6–7(41). Новосибирск: СибАК, 2015.
- Adi D., Xie X., Xiang Y. et al. Polymorphisms of COL4A1 gene are associated with arterial pulse wave velocity in healthy Han Chinese and Uygur subjects. Int. J. Clin. Exp. Med. 2015. 8(2). 2693-2701. PMID: 25932222
- Майданник В.Г., Бурлака Є.А. Стан метаболічно-гіпоксичних порушень при діабетичній нефропатії у дітей. Експериментальна та клінічна фізіологія і біохімія: наук.-практ. журн. Львівський нац. мед. ун-т ім. Данила Галицького. Львів: Світ, 2015. № 4. С. 47-55.
- Волошин А.Н., Чумак О.Ю. Недифференцированная дисплазия соединительной ткани и респираторные заболевания у детей и подростков (обзор литературы). Здоровье ребенка. 2017. № 12. С. 720-727. doi: 10.22141/2224-0551.12.6.2017.112842.
- Аверьянова Н.И., Балуева Л.Г. Оксалатная кристаллурия у детей. Международный журнал прикладных и фундаментальных исследований. 2012. № 5. С. 25-27.
- Кенс К.А. Неінвазивні маркери порушення функції нирок у дітей раннього віку з міхурово-сечовідним рефлюксом в динаміці хірургічного та метаболічного лікування: автореф. дис. ... канд. мед. наук: спец. 14.01.06; Державна установа «Інститут урології НАМН України». Київ, 2012. 23 с.
- Лукьянова Л.Д. Сигнальная роль митохондрий при адаптации к гипоксии. Фізіологічний журнал. 2013. Т. 59. № 6. С. 141-154.
- Топчий И.И., Кириенко А.Н., Бондарь Т.Н., Лесовая А.В., Щенявская Е.Н. Перекисное окисление липидов и метаболизм оксида азота у больных хронической болезнью почек в динамике лечения. Український журнал нефрології та діалізу. 2012. № 1. С. 3-8.
- Tain Y.L., Luh H., Lin C.Y. et al. Incidence and risks of congenital anomalies of kidney and urinary tract in newborns: A population-based case-control study in Taiwan. Medicine (Baltimore). 2016. 95. e2659.
- Губергриц Н.Б., Голубова О.А., Лукашевич Г.М. L-карнитин: от биохимических свойств к клиническому применению. Сучасна гастроентерологія. 2012. № 2. С. 114-121.
- Неврологические аспекты дисплазии соединительной ткани: диагностика, лечение, реабилитация: уч.-метод. пособие. Е.Г. Бутолин, Т.Е. Чернышова, И.Л. Иванова и др.; под ред. проф. Т.Е. Чернышовой. Ижевск, 2012. 68 с.
- Chesnaye N., Bonthuis M., Schaefer F. et al. Demographics of paediatric renal replacement therapy in Europe: A report of the ESPN/ERA-EDTA registry. Pediatr. Nephrol. 2014. 29. 2403-2410.
- Патент № 95526U, МПК G 01 N 33/48. Спосіб діагностики дисплазій сполучної тканини. Добрик О.О., Няньковський С.Л., Іськів М.Ю.; заявник і патентовласник Львівський національний медичний університет імені Данила Галицького. № u 2014 07921; заявл. 14.07.2014; опубл. 25.12.2014; Бюл. № 24.
- Алгоритм діагностики та медико-генетичного консультування екологічно детермінованої патології у дітей, що постійно проживають в умовах підвищених концентрацій солей важких металів та фтору: методичні рекомендації. Лук’яненко Н.С., Гнатейко О.З., Кеч Н.Р. та ін. МОЗ України, Нац. акад. мед. наук України, Укр. центр наук. мед. інформації і патентно-ліцензійної роботи. К., 2012. 34 с.
- Наказ МОЗ України № 627 від 03.11.2008 р. «Про затвердження протоколу лікування дітей з інфекціями сечової системи і тубулоінтерстиціальним нефритом».
- Лук’яненко Н.С., Кенс К.А., Петріца Н.А., Короляк О.Я. Природжені вади розвитку сечовидільної системи в дітей раннього віку та синдром недиференційованої дисплазії сполучної тканини. Почки. 2015. № 1. С. 12-17.
- Топчий И.И., Кириенко А.Н., Щенявская Е.Н. и др. Процессы перекисного окисления липидов у больных хронической болезнью почек в динамике лечения ингибиторами АПФ и блокаторами АРА. Научные ведомости Белгородского государственного университета. 2012. № 10(129). С. 24-28.

/19.jpg)
/20.jpg)
/21.jpg)