Вступ
На сьогодні відомо, що у більшості пацієнтів COVID-19 має безсимптомний перебіг, але у деяких хворих може розвинутись тяжка та вкрай тяжка форма COVID-19, за якої може розвинутися системна запальна реакція, що здатна призвести до ураження легень і дисфункції органів з розвитком пневмонії, гострого респіраторного дистрес-синдрому (ГРДС), септичного шоку та навіть до летального наслідку.
За даними Mohamed Rafiullah та Khalid Siddiqui (2020), ризик розвитку тяжкого перебігу та смертності від COVID-19 коливався від 12,6 до 23,5 % та від 2 до 4,4 % відповідно [1].
У осіб з тяжким перебігом COVID-19 може швидко прогресувати до гострої дихальної недостатності, набряку легень та гострого респіраторного дистрес-синдрому зі значним вивільненням запальних цитокінів на ранній стадії [2]. ГРДС є найпоширенішим ускладненням при тяжкому перебігу COVID-19. Частота його розвитку коливається від 15,6 до 31 %. Це ускладнення є одним із провідних причин смерті пацієнтів з COVID-19, тому лікування ГРДС є вирішальним для одужання при COVID-19. У випадку розвитку при COVID-19 тяжкого перебігу ГРДС на сьогодні немає засобів для лікування [1].
З метою впливу на системну запальну реакцію з урахуваням потужного протизапального ефекту багатьма дослідниками запропоновані кортикостероїди. Протизапальний ефект дексаметазону полягає у пригніченні прозапального гена, що кодує хемокіни, цитокіни, молекули клітинної адгезії та гостру запальну реакцію. Протизапальна дія дексаметазону обумовлена впливом на хемотаксис і вазодилатацію, на регуляцію генів AhR та IDO1 [3].
Завдяки швидкому протизапальному та імунодепресивному ефекту кортикостероїдів препарати широко використовуються для лікування різних гіперзапальних захворювань. Зокрема, системні й інгаляційні кортикостероїди використовуються для лікування бронхіальної астми, хронічної легеневої обструктивної хвороби та пневмоніту, а також при попередніх захворюваннях, викликаних коронавірусами (MERS, SARS) [1, 3].
Хоча лікування кортикостероїдами при вірусних інфекціях є суперечливим, вони широко використовуються як допоміжна терапія при епідемічній вірусній пневмонії при грипі, тяжкому гострому респіраторному синдромі коронавірусу (SARS-CoV) та близькосхідному респіраторному синдромі коронавірусу (MERS-CoV). Під час епідемії SARS кортикостероїди широко використовувались у пацієнтів з прогресуючою дихальною недостатністю. В різних звітах зв’язок лікування кортикостероїдами та летального результату був неоднозначним.
Дослідження групи Chen’s показало, що правильне використання кортикостероїдів у підтверджених критичних хворих на SARS в Гуанчжоу призвело до зниження смертності та скорочення терміну госпіталізації, було несуттєво пов’язане з розвитком вторинної інфекції нижніх дихальних шляхів та інших ускладнень. Автори відзначають, що, за даними інших досліджень, хороший ефект був отриманий при застосуванні високих або імпульсних доз кортикостероїдів (менша кількість хворих потребували кисню, були кращими результати рентгенографії). Водночас, з посиланням на Auyeung та співавт., автори відзначають, що хворі з SARS, які отримували кортикостероїди, частіше надходили до відділення реанімації та мали вищий ризик розвитку летального наслідку. Також в іншому ретроспективному дослідженні у Гонконгу з аналізом 1287 випадків із SARS відзначалось, що смертність була вищою в групі хворих, які отримували кортикостероїди (28,3 проти 17 %). Lee et al. показали, що раннє застосування кортикостероїдів при SARS було пов’язане з більшим навантаженням вірусу у плазмі крові, з затримкою кліренсу SARS-CoV. Також повідомлялося про інвазивну грибкову інфекцію та остеонекроз після терапії кортикостероїдами в осіб із SARS [2]. Mohamed Rafiullah та Khalid Siddiqui (2020) із посиланням на деякі дослідження відзначають, що вживання кортикостероїдів призводило до уповільненого кліренсу вірусів і несприятливих наслідків [1].
За результатами іншого аналізу 1043 статей, які містили дані 4498 пацієнтів, встановлено, що найбільш часто використовувались такі кортикостероїди: метилпреднізолон, преднізолон, гідрокортизон і дексаметазон (в еквівалентій дозі метилпреднізолону від 40 до 2000 мг на день, спосіб уведення був внутрішньовенним, курс лікування — від 1 до 21 дня; одноденне введення було пов’язане із пульс-терапією). Із аналізу встановлено, що кортикостероїди не знижували смертність від COVID-19 та SARS-CoV, не скорочували час кліренсу вірусу, тривалість госпіталізації та тривалість симптомів [4].
Тобто на основі опублікованих досліджень результати терапії кортикостероїдами при SARS були різними.
Також і ВООЗ у проміжних рекомендаціях щодо клінічного лікування COVID-19, опублікованих 27 травня 2020 року, рекомендувала не застосовувати кортикостероїди у випадках COVID-19, якщо це не показано з інших причин.
Нещодавно було показано, що дексаметазон знижує смертність у пацієнтів з COVID-19, які знаходились на апаратах штучної вентиляції легень (ШВЛ) або на кисні. На сьогодні це єдине лікування для зниження смертності від інфікованого COVID-19 ARDS. Згодом багато країн прийняли застосування дексаметазону у тяжких хворих [1].
На сьогодні відомо, що ГРДС — це запальний стан, частково спричинений імунною реакцією. У хворих з COVID-19 може розвинутись масивна неконтрольована реплікація вірусу та пошкодження тканин у деяких органах. При цьому виникає величезна кількість запальних цитокінів, розвивається цитокінова буря з розвитком сильного запалення з ураженням легень. Кортикостероїди можуть суттєво впливати на таку бурю, тому дані препарати є корисними при ГРДС незалежно від етіології. Нещодавні метааналізи показали, що у хворих із ГРДС кортикостероїди знижували рівень смертності, випадків переведення хворих на штучну вентиляцію легень. Встановлено, що раннє застосування кортикостероїдів у низьких дозах було ефективним у зниженні смертності. Високі дози, короткочасне та пізнє введення препарату і профілактичне застосування кортикостероїдів не знижували рівень смертності [1].
Тобто на сьогодні існують різні думки щодо ефективності кортикостероїдної терапії при COVID-19.
J.-W. Yang, L. Yang, R.-G. Luo, J.-F. Xu (2020) провели дослідження щодо ефективності кортикостероїдів при COVID-19 в період від початку до 30 квітня 2020 року. Кортикостероїди застосовували у 22,4 % (670/2995) хворих. Рівень летальності у хворих, які отримували кортикостероїди, був вищим, ніж у тих, які їх не отримували (15,6 % (69/443) проти 4,3 % (56/1310)). Використання кортикостероїдів було значно вищим серед хворих з тяжкою формою захворювання, ніж в осіб з більш легкими формами (52,6 % (201/382) проти 15,3 % (301/1310)) [2].
Застосування кортикостероїдів у пацієнтів з SARS-CoV-2, SARS-CoV та MERS-CoV затримувало елімінацію вірусу та непереконливо покращувало виживання, зменшувало тривалість ліжко-дня, кількість госпіталізацій, застосовування ШВЛ [5].
Ще один систематичний огляд публікацій до 15 березня 2020 року не повністю підтримує звичайне застосування кортикостероїдів при COVID-19. Із чотирьох досліджень, включених до аналізу, два повідомили про можливу шкоду від використання кортикостероїдів (підвищений ризик госпіталізації до відділення інтенсивної терапії (72,2 проти 35,3 %) та затримка вірусного кліренсу (15 днів проти 8)). Водночас в іншому дослідженні показано, що метилпреднізолон суттєво — на 62 % — знизив рівень смертності у пацієнтів з тяжкою пневмонією [1].
Також були проведені дослідження щодо використання кортикостероїдів для лікування гіперзапальних станів, обумовлених іншими вірусними інфекціями (респіраторно-синцитіальним вірусом (RSV), грипом та ін.). Встановлено, що низькі дози дексаметазону (0,4 мг/кг/добу, що вводяться чотирма дозами протягом 48 год) мали позитивний вплив при ураженні легень вірусом RSV. Дексаметазон (0,6 мг/кг/добу) також показав позитивний ефект при бронхіоліті на фоні RSV. Zhong et al. припустили, що високі дози кортикостероїдів можна застосовувати хворим із SARS протягом 3 днів та/або більше, якщо є дані про прогресуюче ураження легень, оскільки це зменшить ризик легеневого фіброзу. Ці автори пропонують низьку та середню дози кортикостероїдів при тяжких випадках SARS. Препарати сприяли зниженню смертності та терміну перебування в лікарні. Ними зроблений висновок, що з низькими дозами метилпреднізолону (від 1 до 2 мг/кг на день) протягом тривалого часу можуть бути пов’язані значне поліпшення стану легень, зменшення кількості днів перебування на ШВЛ. Подальший пошук був проведений у базі даних дослідницьких статей щодо COVID-19 Всесвітньої організації охорони здоров’я. В результатах останніх досліджень обговорювались активність кортикостероїдів in vitro та in vivo проти COVID-19 та іншої коронавірусної пневмонії. Низькі дози кортикостероїдів (дексаметазон) можуть зменшити смертність у пацієнтів з тяжкою формою COVID-19, однак вони не впливали на рівень смертності пацієнтів із легкою формою захворювання. Більше того, ліберальне використання кортикостероїдів не пропагувалось, оскільки високі дози препарату можуть завдати більше шкоди, ніж користі.
Під час проведення метааналізу ефекту кортикостероїдів при лікуванні 6458 хворих із грипом встановлено, що з ними асоціюється вищий рівень смертності, розвиток імунодефіциту. Дексаметазон у дозі 0,4 мг/кг/добу протягом 5 днів вводили для лікування гострого респіраторного дистрес-синдрому, індукованого H5N1, в пацієнтів у В’єтнамі також отримані негативні результати. Водночас Steinberg et al. встановили, що кортикостероїди при ГРДС сприяють покращенню насичення киснем, впливають на запальні маркери, тривалість перебування в реанімації. Дослідження, проведене в Іспанії у період з березня 2013 року по грудень 2018 року, показало, що раннє введення дексаметазону сприяло скороченню терміну перебування на ШВЛ та загальної смертності в пацієнтів із ГРДС середньої тяжкості.
Hazbun et al. застосовували метилпреднізолон (125 мг кожні 6 годин протягом 24 годин, потім 60 мг кожні 12 годин протягом 10 днів) у хворих із ГРДС на фоні SARS-CoV-2. Через 48 годин після початку лікування метилпреднізолоном відбулося зменшення альвеолярно-артеріального (Аа) градієнту O2 з 455 до 228 мм рт.ст., при цьому відбулося поліпшення передачі кисню в легенях. Встановлено, що 95 % осіб були зняті з ШВЛ через 8 днів лікування. В іншому дослідженні був показаний позивний вплив метилпреднізолону у хворих із пневмонією на фоні коронавірусу на зниження ризику смерті.
Дослідження у Китаї встановили, що використання кортикостероїдів (метилпреднізолону або інших) у тяжкохворих із COVID-19 було корисним. Фахівці рекомендували лише короткі курси (менше 7 днів) кортикостероїдів (0,5–1 мг на кг/добу) у критичних пацієнтів із пневмонією COVID-19. Також інші дослідження в централізованій клінічній мікробіологічній лабораторії Генрі Форда продемонстрували, що ранній короткий курс прийому метилпреднізолону (від 0,5 до 1 мг/кг на добу у двох розділених дозах протягом 3 днів) у пацієнтів із середньотяжкою і тяжкою формами COVID-19 зменшував потребу в невідкладних методах медичної допомоги та покращував клінічні результати [3].
Дослідження, проведене у Великобританії, показало, що застосування 6 мг дексаметазону один раз на день протягом 10 діб у 2104 пацієнтів знижувало на 35 % 28-денну смертність у хворих, які отримували інвазивну механічну вентиляцію легень, і на 20 % у пацієнтів, які отримували додатковий кисень. Дексаметазон застосовували лише у низькій та середній дозі протягом 10 днів, побічні ефекти не зафіксовані. Переваги препарату були чіткішими в пацієнтів, які отримували лікування після 7 днів з появи перших симптомів [3].
В рандомізованому багатоцентровому відкритому дослідженні RECOVERY у госпіталізованих пацієнтів з COVID-19 встановлено, що смертність була нижчою серед пацієнтів, які отримували дексаметазон, ніж серед тих, які отримували стандартну терапію [6].
Також, за даними останніх висновків ВООЗ, дексаметазон при лікуванні хворих з COVID-19 покращує наслідки хвороби [3].
За результатами метааналізу 10 досліджень (4282 пацієнти), застосування комбінації рибавірину та кортикостероїдів помітно знижувало смертність [7].
Нещодавно було показано, що дексаметазон знижує смертність від коронавірусної хвороби 2019 р. (COVID-19). Раніше застосування кортикостероїдів було шкідливим для інших коронавірусних інфекцій. ВООЗ рекомендувала відмовитись від рутинного застосування кортикостероїдів при COVID-19. З огляду на це ми вивчили дані про використання кортикостероїдів при індукованому вірусом гострому респіраторному дистрес-синдромі. Кортикостероїди корисні при ГРДС незалежно від етіології. Однак вони збільшили рівень смертності при ГРДС, асоційованому з грипом. При ГРВІ та респіраторному синдромі Близького Сходу кортикостероїди збільшували смертність, затримували кліренс вірусів і збільшували тривалість перебування в лікарні. У випадку з COVID-19 наявні докази ретроспективних і спостережних досліджень не дозволяють визначити використання кортикостероїдів. Низькодозова терапія виявляється ефективною. Докази рандомізованого контрольного дослідження показали, що дексаметазон ефективний для зменшення смертності у тяжких випадках COVID-19. Потрібні додаткові дослідження, щоб підтвердити користь кортикостероїдів при COVID-19.
У багатоцентровому квазіекспериментальному дослідженні ранній короткий курс прийому метилпреднізолону (0,5–1 мг/кг/день, розділений на дві внутрішньовенні дози протягом 3 днів) знизив смертність, дихальну недостатність, що вимагає штучної вентиляції легень, і ризик надходження до відділення реанімації та інтенсивної терапії (ВРІТ), значно сприяв скороченню середньої тривалості перебування в лікарні.
У ретроспективному спостережному дослідженні пацієнтів з COVID-19 віком до 50 років встановлено, що лікування кортикостероїдами покращувало симптоми.
В іншому ретроспективному аналізі показано, що низькі дози метилпреднізолону не затримували вірусний кліренс як у тяжких, так і в більш легких формах. Також у хворих з COVID-19 короткий курс дексаметазону мав суттєвий вплив на рівень С-реативного білка (СРБ) та жоден із пацієнтів не мав ескалації до ШВЛ [1].
За даними Villar та ін., раннє введення дексаметазону скоротило тривалість ШВЛ і загальну смертність у пацієнтів із середньотяжким ГРДС [2].
Li та ін. (2020) встановили, що лише високі дози кортикостероїдів (метилпреднізолон 80 мг/добу) затримували вірусний кліренс у пацієнтів з COVІD-19, тоді як низькі дози — ні.
Mohamed Rafiullah та Khalid Siddiqui (2020) з посиланням на дослідження RECOVERY, в якому визначався ефект дексаметазону 6 мг/день протягом 10 днів та було рандомізовано 2104 пацієнти для отримання дексаметазону із 176 лікарень у Великобританії, відзначають, що загалом 21,6 % пацієнтів, яким був призначений дексаметазон, і 24,6 % пацієнтів, яким була призначена стандартна терапія, померли протягом 28 днів. Дексаметазон зменшив кількість смертей у пацієнтів, які отримували інвазивну ШВЛ (29,0 проти 40,7 %), або у тих, які отримували кисень (21,5 проти 25,0 %), але не зменшував смертність у хворих, які не отримували респіраторну підтримку. Було доведено, що дексаметазон є єдиним препаратом, що знижує рівень смертності тільки у тяжких хворих з COVID-19. Автори відзначають, що кортикостероїди корисні при ГРДС незалежно від етіології. При ранньому призначенні низьких доз кортикостероїдів вони ефективно знижують смертність і допомагають при ШВЛ при ГРДС будь-якої етіології. Високі дози, короткочасне та пізнє введення препарату та профілактичне застосування кортикостероїдів не покращили рівень смертності при ГРДС будь-якої етіології. Кортикостероїди принесли користь пацієнтам, які страждають на позалікарняну пневмонію. Раннє призначення гідрокортизону (< 7 днів хвороби) призвело до більш високого вірусного навантаження на другому та третьому тижнях хвороби у хворих на SARS [1].
Також J.-W. Yang, L. Yang, R.-G. Luo, J.-F. Xu (2020) відзначають, що бази даних PubMed, EMBASE, Web of Science та SCOPUS проводили пошук до липня 2019 року. Було виявлено 19 досліджень за участю 6637 осіб, і 15 досліджень (6427 пацієнтів) були включені в метааналіз смертності. 18 досліджень були обсерваційними, а одне — рандомізованим контрольованим випробуванням (RCT). Результати метааналізу показали, що терапія кортикостероїдами асоціювалась зі значно вищою смертністю (OR 1,53, 95% ДІ 1,16–2,01) та частотою виникнення внутрішньолікарняних інфекцій (OR 3,15, 95% ДІ 1,54–6,45). Аналіз підгруп показав, що серед пацієнтів з нескоригованими оцінками шанси смертності були вищими в осіб, які отримували кортикостероїди (OR 1,98, 95% ДІ 1,23–3,17), однак серед пацієнтів із скоригованими оцінками результат не показав статистично значущої різниці між групою кортикостероїдів і контрольною групою (OR 1,31, 95% ДІ 0,95–1,80). Сучасні дані не підтверджують звичайне застосування кортикостероїдів у пацієнтів з тяжкою пневмонією грипу або ГРДС. РКІ необхідні для надання більш вагомих доказів. Сучасні дані не підтверджують звичайне застосування кортикостероїдів у пацієнтів з тяжкою пневмонією грипу або ГРДС.
У клінічній практиці терапія кортикостероїдами асоціювалась із кращими клінічними результатами при тяжкому перебігу COVID-19. Zhou та ін. та Wang та ін. повідомили, що терапія кортикостероїдами покращила клінічні симптоми і показники оксигенації у хворих із COVID-19. Wang та ін. також виявили, що при тяжкому перебігу COVID-19 терапія кортикостероїдами скоротила тривалість госпіталізації та перебування в реанімації. Wu та ін. повідомили, що лікування метилпреднізолоном знижує ризик смерті у хворих із COVID-19 та ГРДС. Автори зробили висновок із посиланням також на консенсус китайських експертів, що короткі курси, які тривають приблизно 1 тиждень, і дози від низької до помірної (метилпреднізолон ≤ 0,5–1 мг/кг/добу) можуть бути обґрунтованими при лікуванні хворих із COVID-19 [2].
Наданий матеріал демонструє різні дані щодо ефективності глюкокортикостероїдів при COVID-19. На сьогодні є багато різноманітних опублікованих досліджень, але питання щодо критеріїв призначення глюкокортикоїдів, динаміка лабораторних показників крові недостатньо відображені. Тому для визначення характеру перебігу захворювання, розвитку наслідків на підставі лабораторних аналізів метою нашого дослідження було встановлення динаміки змін у лабораторних показниках крові в COVID-19-позитивних хворих із тяжким перебігом, які одужали та померли на фоні прийому 8 мг дексаметазону, згідно з наказом Міністерства охорони здоров’я України від 02 квітня 2020 року № 762 (у редакції наказу Міністерства охорони здоров’я України від 17 вересня 2020 року № 2116) [8].
Матеріали та методи
Проведений аналіз даних медичних карт стаціонарного хворого осіб, які лікувались з приводу нової коронавірусної хвороби COVID-19 у відділеннях реанімації та інтенсивної терапії у Центральному госпіталі МВС і Національному військово-медичному клінічному центрі «Головний військовий клінічний госпіталь» та отримували серед інших лікарських препаратів дексаметазон 8 мг. Статистична обробка матеріалів дослідження проводилась за допомогою персонального комп’ютера з використанням програми Statistica. З огляду на те, що більшість показників мали тип розподілу, відмінний від параметричного, кількісні ознаки були подані у вигляді медіани та міжквартильного розмаху (25 %, 75 %).
Результати та обговорення
Приводимо результати попередніх досліджень щодо тяжкохворих з приводу нової коронавірусної хвороби COVID-19, які отримували 8 мг дексаметазону згідно з рекомендаціями.
Середній вік хворих, які отримували 8 мг дексаметазону та одужали, становив: Me = 59 (Q25 = 48, Q75 = 63), min = 40, max = 73 роки, а у тих, які отримували також 8 мг дексаметазону та померли, — Me = 66 (Q25 = 62, Q75 = 81), min = 49, max = 94 роки.
Серед 34 хворих, які лікувались у відділенні реанімації та інтенсивної терапії й отримували при лікуванні 8 мг дексаметазону, чоловіків було 18 (81,8 %), жінок — 4 (18,2 %). Серед цих хворих та тих, які одужали, чоловіків було 8 (80 %), жінок — 2 (20 %), а серед померлих чоловіків було 10 (83,3 %), жінок — 2 (16,7 %).
Вік усіх хворих, які перебували на лікуванні у відділенні реанімації та інтенсивної терапії, становив: Me = 62 (Q25 = 50, Q75 = 68), min = 40, max = 94 роки; у тих, які одужали: Me = 55 (Q25 = 48, Q75 = 63), min = 40, max = 73 роки; у тих, які померли: Me = 65,5 (Q25 = 62, Q75 = 80,5), min = 49, max = 94 роки.
Середній ліжко-день у всіх категорій хворих, які перебували у ВРІТ та отримували 8 мг дексаметазону, становив: Me = 9,5 (Q25 = 7, Q75 = 17), min = 4, max = 29 днів; у тих, які одужали: Me =15 (Q25 = 9, Q75 = 21), min = 7, max = 29 днів; у тих, які померли: Me = 7,5 (Q25 = 5, Q75 = 12,5), min = 4, max = 28 днів.
Середній день, на який були госпіталізовані хворі, які перебували у ВРІТ та отримували 8 мг дексаметазону: Me = 7 (Q25 = 5, Q75 = 8), min = 2, max = 12 днів; у тих, які одужали: Me = 7,5 (Q25 = 6, Q75 = 9), min = 3, max = 12 днів; у тих, які померли: Me = 6 (Q25 = 4,5, Q75 = 7), min = 2, max = 10 днів.
Тривалість лихоманки до госпіталізації у всіх категорій хворих становила: Me = 5 (Q25 = 2, Q75 = 7), min = 1, max = 10 днів; у тих, які одужали: Me = 6 (Q25 = 5, Q75 = 7), min = 2, max = 8 днів; у тих, які померли: Me = 2 (Q25 = 2, Q75 = 7), min = 1, max = 10 днів.
Характер температури до госпіталізації у всіх категорій хворих (дані отримані при зборі анамнезу захворювання): нормальна — у 1 (4,5 %), субфебрильна — у 7 (31,8 %), фебрильна — у 11 (50 %), піретична — у 3 (13,6 %); у тих, які одужали: нормальна — 0 (0 %), субфебрильна — у 2 (20 %), фебрильна — у 7 (70 %), піретична — у 1 (10 %); у тих, які померли: нормальна — у 1 (8,3 %), субфебрильна — у 5 (41,7 %), фебрильна — у 4 (33,3 %), піретична — у 2 (16,7 %).
Температура при госпіталізації у всіх категорій хворих становила: Me = 37,35 (Q25 = 36,9, Q75 = 38,2), min = 36, max = 39,5 оС; у тих, які одужали: Me = 37,25 (Q25 = 36,9, Q75 = 39), min = 36,5, max = 39,5 оС; у тих, які померли: Me = 37,45 (Q25 = 36,85, Q75 = 38), min = 36, max = 39,5 оС.
Тривалість гарячки в стаціонарі у всіх категорій хворих становила: Me = 4,5 (Q25 = 3, Q75 = 8), min = 1, max = 15 діб; у тих, які одужали: Me = 3,5 (Q25 = 3, Q75 = 7), min = 1, max = 9 діб; у тих, які померли: Me = 5,5 (Q25 = 3,5, Q75 = 9), min = 1, max = 15 діб. Тривалість субфебрильної температури у стаціонарі в усіх категорій хворих становила: Me = 4 (Q25 = 2, Q75 = 5), min = 0, max = 9 діб; у тих, які одужали: Me = 3 (Q25 = 1, Q75 = 4), min = 0, max = 6 діб; у тих, які померли: Me = 4,5 (Q25 = 2,5, Q75 = 5,5), min = 0, max = 9 діб. Тривалість фебрильної температури в стаціонарі у всіх категорій хворих становила: Me = 2 (Q25 = 0, Q75 = 3), min = 0, max = 8 діб; у тих, які одужали: Me = 2 (Q25 = 1, Q75 = 3), min = 0, max = 5діб; у тих, які померли: Me = 2 (Q25 = 0, Q75 = 3), min = 0, max = 8 діб. Тривалість піретичної температури в стаціонарі у всіх категорій хворих становила: Me = 0 (Q25 = 0, Q75 = 0), min = 0, max = 1 доба; у тих, які одужали: Me = 0 (Q25 = 0, Q75 = 0), min = 0, max = 1 доба; у тих, які померли: Me = 0 (Q25 = 0, Q75 = 0), min = 0, max = 0 діб.
Частота дихання при госпіталізації у всіх категорій хворих становила: Me = 19 (Q25 = 18, Q75 = 24), min = 16, max = 30/хв; у тих, які одужали: Me = 19,5 (Q25 = 18, Q75 = 24), min = 17, max = 28/хв; у тих, які померли: Me = 18,5 (Q25 = 18, Q75 = 22), min = 16, max = 30/хв. У всіх категорій хворих частота дихання до 20 відзначалась у 12 (54,5 %), від 20 до 24 — у 8 (36,4 %), від 25 до 30 — у 1 (4,5 %), 30 і більше — в 1 (4,5 %) хворого; серед тих, які одужали, частота дихання до 20/хв була у 5 (50 % хворих), від 20 до 24 — у 4 (40 %), від 25 до 30 — в 1 (10 %); серед тих, які померли, частота дихання до 20/хв була у 7 (58,3 % хворих), від 20 до 24 — у 4 (33,3 %), від 25 до 30 — в 1 (8,3 %), 30 і більше — у 0 (0 %) хворих.
Частота пульсу при госпіталізації у всіх категорій хворих становила: Me = 79,5 (Q25 = 75, Q75 = 88), min = 48, max = 116/хв; у тих, які одужали: Me = 78 (Q25 = 72, Q75 = 80), min = 48, max = 116/хв; у тих, які померли: Me = 80 (Q25 = 75,5, Q75 = 95), min = 60, max = 116/хв. У тих, які одужали, при госпіталізації брадикардія була у 10 % хворих, норма — у 70 %, тахікардія — у 20 % хворих (до 100/хв — у 50 %, більше 100/хв — у 50 %); у тих, які померли, брадикардії не було, норма відзначалась у 58,3 % хворих, тахікардія — у 41,7 % хворих (до 100/хв — у 60 %, більше 100/хв — у 40 %).
Сатурація при госпіталізації у всіх категорій хворих: Me = 91,5 % (Q25 = 82,5, Q75 = 95,5), min = 45, max = 98 %; у хворих, які одужали: Me = 95 % (Q25 = 90, Q75 = 96), min = 87, max = 97 % (більше 93 % — у 55,6 % хворих, 90–93 % — у 33,3 % хворих, 80–89 % — у 11,1 % хворих); водночас у хворих, які в подальшому померли: Me = 88 % (Q25 = 80 %, Q75 = 94 %), min = 62 %, max = 97 % (більше 93 % — у 36,4 % хворих, 90–93 % — у 9,09 % хворих, 80–89 % — у 36,4 % хворих, менше 80 % — у 18,2 % хворих). Тобто у хворих, які в подальшому померли, вже при надходженні на лікування частіше реєструвався нижчий рівень сатурації.
За даними табл. 1, в перші 3 дні після госпіталізації серед хворих, які отримували 8 мг дексаметазону та одужали, дещо частіше реєструвались лейкоцитоз і кількість осіб із агранулоцитозом, збільшена кількість паличкоядерних нейтрофілів і число осіб із нею, а серед хворих, які померли, частіше реєструвались лейкопенія, більш виражена лімфопенія та кількість осіб із нею, більш виражена тромбоцитопенія (але кількість хворих із нею не відрізнялась від показників тих, які одужали), вища швидкість осідання еритроцитів (ШОЕ).
Доба призначення дексаметазону: у всіх категорій хворих — Me = 8-ма доба (Q25 = 6, Q75 = 10), min = 4-та, max = 12-та доба; у тих, які одужали, — Me = 10,5 доба (Q25 = 7, Q75 = 12), min = 6-та, max = 12-та доба; у тих, які померли, — Me = 7-ма доба (Q25 = 4,5, Q75 = 8,5), min = 4-та , max = 10-та доба.
Тривалість призначення дексаметазону: у всіх категорій хворих — Me = 4,5 доби (Q25 = 3, Q75 = 7), min = 2, max = 18 діб; у хворих, які одужали, — Me = 4,5 (Q25 = 3, Q75 = 6), min = 2, max = 10 діб; у хворих, які померли, — Me = 4,5 (Q25 = 3,5, Q75 = 7), min = 2, max = 18 діб.
Динаміка рівня лейкоцитів у хворих, які одужали та померли на фоні отримання 8 мг дексаметазону, наведена на рис. 1, 2. Ми бачимо, що у хворих, які померли на фоні застосування дексаметазону, спостерігалось поступове зростання кількості лейкоцитів, а у тих, які одужали, спочатку було їх зростання із поступовим зниженням.
Динаміка рівня лімфоцитів у хворих, які одужали та померли на фоні отримання 8 мг дексаметазону, наведена на рис. 3, 4. Видно, що у хворих, які померли на фоні застосування дексаметазону, спостерігалось поступове зменшення кількості лімфоцитів, а у тих, які одужали, — їх поступове зростання.
Динаміка рівня паличкоядерних нейтрофілів у хворих, які одужали та померли на фоні отримання 8 мг дексаметазону, наведена на рис. 5, 6. Ми бачимо, що у всіх категорій хворих в динаміці спостерігалось поступове зменшення кількості паличкоядерних нейтрофілів.
Динаміка рівня тромбоцитів у хворих, які одужали та померли на фоні отримання 8 мг дексаметазону, наведена на рис. 7, 8. Видно, що у всіх категорій хворих із часом спостерігалось поступове їх зростання, але у тих, хто одужав, їх рівень був дещо вищим.
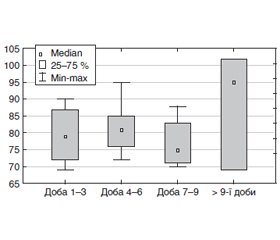
Динаміка рівня креатинінфосфокінази (КФК) у хворих, які одужали та померли на фоні отримання 8 мг дексаметазону, наведена на рис. 9, 10. Видно, що у хворих, які одужали, з часом спостерігалось зменшення рівня креатинфосфокінази, але у тих, які померли, їх рівень з 7–9-ї доби перебування у стаціонарі, навпаки, збільшувався.
Динаміка рівня лактатдегідрогенази (ЛДГ) у хворих, які одужали та померли на фоні отримання 8 мг дексаметазону, наведена на рис. 11, 12. Видно, що у хворих, які одужали, з часом спостерігалось їх зниження, але у тих, які померли, їх рівень на 4–6-ту добу значно збільшувався з подальшим їх зниженням до рівня, що був більшим, ніж у тих, які одужали.
Динаміка рівня сечовини у хворих, які одужали та померли на фоні отримання 8 мг дексаметазону, наведена на рис. 13, 14. Ми бачимо, що у хворих в обох групах із часом спостерігалось зростання рівня сечовини, але у тих, які померли, її рівень з 7-ї доби та пізніше був значно вищим, ніж у тих, які одужали.
Динаміка рівня креатиніну у хворих, які одужали та померли на фоні отримання 8 мг дексаметазону, наведена на рис. 15, 16. Видно, що у хворих в обох групах з часом спостерігалось зростання рівня креатиніну, але у тих, які померли, його рівень з 7-ї доби та пізніше був значно вищим, ніж у тих, які одужали.
Динаміка рівня С-реактивного білка у хворих, які одужали та померли на фоні отримання 8 мг дексаметазону, наведена на рис. 17, 18. Видно, що у хворих в обох групах із часом спостерігалось зменшення рівня СРБ, але у тих, які померли, вже з початку перебування у стаціонарі та протягом усіх періодів спостереження його рівень був вищим порівняно з тими, які одужали.
Динаміка рівня протромбінового індексу (ПТІ) у хворих, які одужали та померли на фоні отримання 8 мг дексаметазону, наведена на рис. 19, 20. Видно, що у хворих в обох групах протягом усіх періодів спостереження рівень ПТІ був знижений.
Динаміка рівня тромбінового часу (ТЧ) у хворих, які одужали та померли на фоні отримання 8 мг дексаметазону, наведена на рис. 21, 22. Видно, що у хворих, які в подальшому померли, протягом усіх періодів спостереження підвищений рівень ТЧ реєструвався дещо частіше, ніж у групі порівняння.
Висновки
Привертає увагу, що хворі з тяжким перебігом (які як одужали, так і померли) можуть мати при надходженні на лікування різні клініко-лабораторні прояви, що здатні вводити в оману лікаря у зв’язку з невідповідністю проявів стану хвороби.
Висновок щодо перебігу хвороби, часу необхідності проведення корекції лікування слід робити з урахуванням декількох показників (клінічних, інструментальних, лабораторних).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Отримано/Received 16.01.2021
Рецензовано/Revised 02.02.2021
Прийнято до друку/Accepted 12.02.2021

/56.jpg)
/57.jpg)
/58.jpg)
/59_2.jpg)
/60_2.jpg)