Резюме
Актуальність. Виникнення та рецидивування птеригіуму після хірургічного лікування до сих пір становить актуальну проблему сучасної офтальмології. Мета дослідження — визначення нових факторів, що ведуть до виникнення та рецидивування птеригіуму після хірургічного лікування. Матеріали та методи. Під нашим спостереженням знаходились 203 пацієнти (232 ока) з птеригіумом. Чоловіків було 108, жінок — 95. Вік пацієнтів становив від 35 до 65 років. Давність захворювання 2,5–2,7 року. Пацієнтам було виконане хірургічне лікування птеригіуму за методом Мак-Рейнольдса з його подальшим заворотом у кон’юнктивальний карман та за методом Арльта з його висіченням, а також за методами Мак-Рейнольдса і Арльта із використанням 0,02% розчину мітоміцину С. Огляд через 3 місяці, 6 місяців та 1 рік після оперативного втручання. Статистичний аналіз результатів клінічних досліджень проводили за допомогою пакета програм SPSS 11.0, MedStat (Лях Ю.Є., Гур’янов В.Г., 2004–2012), MedCalc (MedCalc Software bvba, 1993–2013). Результати. Встановлено, що частота виникнення рецидивів птеригіуму після хірургічного лікування за традиційним методом Мак-Рейнольдса, за методом Мак-Рейнольдса із застосуванням 0,02% розчину мітоміцину С, за традиційним методом Арльта, за методом Арльта із застосуванням 0,02% розчину мітоміцину С становила через 3 місяці 20, 17, 15, 8,7 %; через 6 місяців — 29,5; 27, 27, 26 %; через 1 рік — 26,5; 34,2; 30,6; 37 % відповідно. Частота рецидивів у віддалені терміни спостереження суттєво не відрізнялася (p < 0,05). Аналізувалися дані щодо ролі герпесвірусів та вірусу папіломи людини (ВПЛ) у виникненні птеригіуму. Встановлено, що у тканині птеригіуму вірусна інфекція виявлена у 50,9 % випадків, у тому числі герпесвіруси — у 33,6 % та ВПЛ — у 34,0 % випадків. Серед герпесвірусів вірус простого герпесу (ВПГ) був виявлений у 15,1 %, цитомегаловірус (ЦМВ) — у 7,3 % і вірус Епштейна — Барр (ВЕБ) — у 11,2 %. Регресійний аналіз показав зв’язок ВПГ з ІІ і ІІІ стадією птеригіуму (p < 0,05). Для ЦМВ та ВЕБ таких залежностей виявлено не було. Встановлено зв’язок ВПЛ з І–ІІІ стадіями птеригіуму (p < 0,01). Серед ВПЛ були виявлені 6 (34,2 %), 11 (24,1 %), 16 (21,5 %) та 18-й (20,2 %) типи. Типи 6 і 11 переважно виявлялися при перших стадіях і не виявлялися при IV стадії, типи 16 і 18 не виявлялися при І стадії (р `= 7,9е-04). Серед інших типів тільки ВПЛ-6 мав зв’язок із І та ІІІ стадіями птеригіуму (p < 0,05). У 32,1 % хворих була виявлена мікст-інфекція. Найчастішим було поєднання ВПГ та ВПЛ (30,6 % від усіх випадків мікст-інфекції), три віруси — у 2,5 % (ВПГ + ЦМВ + ВПЛ та ВПГ + ВЕБ + ВПЛ). Досліджено роль мутації V600E гена BRAF у виникненні птеригіуму. Уперше встановлено, що мутація V600E гена BRAF була виявлена у 35,3 % випадків птеригіуму. Вірогідної різниці частоти мутації залежно від статі та віку хворих виявлено не було. Частота мутації за стадіями збільшувалася з 21,3 % при І стадії до 57,7 % при IV стадії (р = 0,0003). Регресійний аналіз показав сильний прогресуючий зв’язок наявності мутації V600E гена BRAF зі стадією птеригіуму і, відповідно, з його прогресуванням. Отже, було доведено, що наявність у тканині птеригіуму ВПГ, ВПЛ та мутації V600E гена BRAF вірогідно впливала на прогресування птеригіуму за стадіями патологічного процесу: на I і II стадії впливали наявність ВПЛ і BRAF+, на III — ВПГ, ВПЛ і BRAF+, на IV — тільки BRAF. Висновки. Отримані нами дані свідчать про прямий зв’язок між виникненням і рецидивуванням птеригіуму після хірургічного лікування та наявністю у хворих BRAF+ мутації та вірусів групи герпесвірусів і вірусу папіломи людини.
Background. Occurrence and recurrence of pterygium after surgical treatment are still urgent problems of modern ophthalmology. The purpose was to determine the main factors leading to the occurrence and recurrence of pterygium after surgical treatment. Materials and methods. We observed 203 patients (232 eyes) with pterygium. There were 108 men and 95 women. The age of patients ranged from 35 to 65 years. The duration of the disease is 2.5–2.7 years. Patients underwent surgical treatment for pterygium by the McReynolds’ method forming a cul-de-sac, by the Artl method with its incision, and the McReynolds and Artl methods using 0.02% solution of mitomycin C. The patients were examined in 3, 6 months, and one year after surgery. The statistical analysis of the results of clinical trials was performed using the software package SPSS 11.0, MedStat (Lyakh Y.E., Guryanov V.G., 2004–2012), MedCalc (MedCalc Software bvba, 1993–2013). Results. The results of clinical studies have found that the frequency of pterygium recurrence after traditional surgical interventions by the McReynolds method, the McReynolds method using 0.02% solution of mitomycin C, by the traditional Arlt method, the Arlt method using 0.02% solution of mitomycin C in 3 months was 20, 17, 15, and 8.7 %, respectively; in 6 months — 29.5, 27, 27, and 26 %, respectively; after 1 year — 26.5, 26.5, 30.6, and 37 %, respectively. Long-term recurrence of pterygium did not differ significantly (p < 0.05). Viral infection was found in pterygium tissue in 50.9 % of cases, including herpesviruses (33.6 %) and human papillomavirus (HPV, 34.0 %). Among herpesviruses, herpes simplex virus (HSV) was found in 15.1 % of cases, cytomegalovirus (CMV) in 7.3 %, and Epstein-Barr virus (EBV) in 11.2 % of cases. The regression analysis showed an association of HSV with stage II and stage III pterygium (p < 0.05). No such dependencies were found for CMV and EBV. There was a relationship of HPV with the I–III stages of pterygium (p < 0.01). There were types 6 (34.2 %), 11 (24.1 %), 16 (21.5 %), and 18 (20.2 %) among HPV. Types 6 and 11 were mainly detected at the first stages and were not detected in stage IV; types 16 and 18 were not detected in stage I (p = 7.9e-04). Among other types, only HPV6 was associated with the I and III stages of pterygium (p < 0.05). Double mixed infection was detected in 32.1 % of patients. The most common was the combination of HSV and HPV (30.6 % of all cases of mixed infection), three viruses — in 2.5 % of cases in the combination of HSV + CMV + HPV and HSV + EBV + HPV. It was first established that the V600E mutation of the BRAF gene was detected in 35.3 % of cases of pterygium. No significant difference in mutation frequency depending on the sex and age of patients was found. The frequency of mutation by stages increased from 21.3 % at stage I to 57.7 % at stage IV (p = 0.0003). The regression analysis showed a strong progressive association with the presence of the BRAF gene V600E mutation with the pterygium stage and, therefore, its progression. Conclusions. Thus, it was proved that the presence of HSV, HPV, and mutation V600E of the BRAF gene significantly influenced the occurrence and progression of pterygium after surgical treatment.
Вступ
Захворювання поверхні ока становлять 32 % від загальної кількості очних хвороб в Європі На сьогодні лікування птеригіуму залишається однією із невирішених проблем сучасної офтальмології, так само як і його рецидивування після хірургічного лікування [7, 8, 17]. Основним способом лікування птеригіуму залишається хірургічний, а основним післяопераційним ускладненням — рецидив, відсоток якого залишається досить високим, незалежно від вибору метода хірургічного лікування. Установлені етіологічні фактори його виникнення (ультрафіолет, географічні райони ендемічного поширення) давно відомі, але останнім часом науковці почали вивчати проблему виникнення та рецидивування птеригіуму більш детально [1, 3, 5, 6, 11, 16]. Ученим відомо про дослідження взаємозв’язку птеригіуму з генними мутаціями, зокрема BRAF. Крім того, велике значення у виникненні птеригіуму мають герпесвіруси та віруси папіломи людини (ВПЛ). Однак їх роль до кінця не з’ясована, дані щодо їх поширеності у різних етнічних популяціях хворих відрізняються [2, 9, 21].
У роботі проаналізовано залежність виникнення рецидивів птеригіуму після хірургічного лікування від наявності герпесвірусів, вірусу папіломи людини та мутації V600E гена BRAF. Виявлення цих вірусів і мутації в операційному матеріалі пацієнтів досліджуваної групи переконливо вказувало на їх важливу роль в етіології виникнення та рецидивування птеригіуму.
Мета дослідження — визначення нових факторів, що ведуть до виникнення та рецидивування птеригіуму після хірургічного лікування.
Матеріали та методи
Під нашим спостереженням знаходилось 203 пацієнти (232 ока) з птеригіумом. Чоловіків було 108, жінок — 95. Вік пацієнтів становив від 35 до 65 років. Давність захворювання 2,5–2,7 року. Стадію птеригіуму перед операцією визначали згідно з класифікацією A.L. Anduze. Відповідно до цієї класифікації I стадія була діагностована на 32 очах (13,79 %), IІ стадія — на 88 очах (37,93 %), IІІ стадія — на 91 оці (39,22 %), IV стадія — на 21 оці (9,05 %) та жодного випадку V стадії.
Пацієнтам проводили загальноклінічні, офтальмологічні (візометрія, кератометрія, кератотопографія (її виконували на ORBSCAN IIz Bausch&Lomb для визначення стадії захворювання відносно нововиявленого астигматизму), рефрактометрія, біомікроскопія, офтальмоскопія), молекулярно-генетичні (наявність і рівень герпесвірусів, вірусу папіломи людини в тканинах хворих на птеригіум, мутації V600E гена BRAF) дослідження. Виявлення в матеріалі ДНК вірусів проводили з використанням наборів реактивів виробництва ТОВ «ДНК-технологія», які призначені для ПЛР-ампліфікації ДНК і флуоресцентної детекції у форматі real time. Ампліфікацію пробірок з реакційною сумішшю проводили в апараті «ДТ-lite» (ТОВ «ДНК-технологія») з використанням програм ампліфікації, рекомендованих виробником комплекту реагентів. Методи статистичного аналізу: за допомогою пакета програм SPSS 11.0, MedStat (Лях Ю.Є., Гур’янов В.Г., 2004–2012), MedCalc (MedCalc Software bvba, 1993–2013).
Оперативне лікування було проведено під місцевою анестезією, однією бригадою хірургів. Передопераційна підготовка відбувалася відповідно до протоколів лікування птеригіуму, затверджених МОЗ України.
Критерії виключення хворих із дослідження: з цукровим діабетом 1-го та 2-го типів; хронічними інфекційними захворюваннями; запальними захворюваннями очей в анамнезі; із системними хворобами; захворюваннями ротоглотки, вуха та носової порожнини; наявністю в анамнезі травм ока та його придатків; із оперативними втручаннями на очному яблуці в анамнезі; наявністю в анамнезі офтальмогерпесу.
Пацієнтам було виконане хірургічне лікування птеригіуму за традиційним методом Мак-Рейнольдса, за методом Мак-Рейнольдса із застосуванням 0,02% розчину мітоміцину С, за традиційним методом Арльта, за методом Арльта із застосуванням 0,02% розчину мітоміцину С. Післяопераційне спостереження за хворими відбувалося відповідно до протоколу МОЗ України. Усі хворі оглядалися на наступний день після операції. Проводили перевірку зорових функцій. Потім проводили зовнішній огляд та огляд за допомогою щілинної лампи. Усім пацієнтам закапували очні краплі з антибіотиком широкого спектра групи фторхінолонів та кортикостероїди по два рази на день. Такої схеми закапувань дотримувались протягом п’яти днів після хірургічного лікування.
Статистичний аналіз результатів клінічних досліджень проводили за допомогою пакета програм SPSS 11.0, MedStat (Лях Ю.Є., Гур’янов В.Г., 2004–2012), MedCalc (MedCalc Software bvba, 1993–2013). Для уявлення про чисельні показники розраховували середнє арифметичне значення (М) і помилку середнього (m) або середньоквадратичне відхилення (s). Для оцінки якісних ознак розраховувалася частота їх появи (%) і стандартна помилка (m%). Статистична обробка кількісних даних включала розрахунок середнього значення та стандартної похибки середнього (± m). Для якісних ознак розраховували показник частоти виникнення, який виражався в абсолютному значенні і у відсотках, та стандартну похибку частоти (± m%). При порівнянні кількісних ознак у двох групах використовували параметричні критерії (у разі нормального закону розподілу) або непараметричний критерій Манна — Уїтні (у разі відмінності закону розподілу від нормального). При порівнянні частоти для якісних ознак у двох групах використовували точний критерій Фішера. При порівнянні середніх значень кількісних показників у трьох і більше групах використовували параметричні та непараметричні методи множинних порівнянь. Для аналізу динаміки показників використовували методи дисперсійного аналізу для пов’язаних груп або їх непараметричний аналог — критерій Фрідмана. Кількісна оцінка величини ефекту для якісних ознак проводилася за показником відношення шансів (ВШ), для узагальнення отриманих результатів розраховувався також 95% довірчий інтервал (95% ДІ). Для оцінки ступеня зв’язку між ознаками були використані методи кореляційного аналізу.
Для аналізу факторів, пов’язаних із ризиками розвитку патологічних процесів, залучали методи побудови математичних моделей: моделей множинної регресії, однофакторних та багатофакторних моделей логістичної регресії. Визначення факторних ознак, пов’язаних з прогнозованим ризиком, проводили із використанням методу покрокового відкидання (Backward). Для оцінки адекватності моделей використовували метод аналізу кривих операційних характеристик (ROC — Receiver Operating Characteristic curve analysis), при цьому розраховували площу під ROC-кривою (AUC — Area under the ROC curve). Модель вважали адекватною при статистично значущій відмінності величини AUC від 0,5. Для оцінки ступеня і направленості впливу факторних ознак на результуючу в рамках побудованої логістичної моделі розраховували показник ВШ та відповідний 95% ДІ. Аналіз проводили з використанням пакета MedStat (Лях Ю.Є., Гур’янов В.Г., 2004–2011) і статистичного пакета MedCalc v.15.1 (MedCalc Software bvba). У всіх випадках проведення аналізу критичний рівень значущості був прийнятий рівним 0,05 [4, 10, 18, 22].
Результати та обговорення
Проведені нами клінічні дослідження встановили, що частота рецидиву птеригіуму після застосування традиційного методу хірургічного лікування Мак-Рейнольдса становила через 3 місяці 20 %, через 6 місяців — 29,5 % та через 1 рік — 26 %, методу Мак-Рейнольдса із застосуванням 0,02% розчину мітоміцину С: через 3 місяці — 17 %, через 6 місяців — 27 % та через 1 рік — 32 %; після традиційного методу Арльта: через 3 місяці — 15 %, через 6 місяців — 27 % та через 1 рік — 30,6 %, методу Арльта із застосуванням 0,02% розчину мітоміцину С: через 3 місяці — 8,7 %, через 6 місяців — 26 % та через 1 рік — 37 % (табл. 1).
Як видно з табл. 1, частота рецидивів птеригіуму після різних методів хірургічного лікування у віддалені терміни спостереження не відрізнялася. Привертає увагу менша частота рецидивів при терміні спостереження 3 місяці після застосування традиційного методу Арльта та методу Арльта з мітоміцином С.
З 232 очей вірусна інфекція у тканині птеригіуму виявлена загалом у 118 випадках (50,9 %), у тому числі герпесвіруси — у 78 (33,6 %) та вірус папіломи людини (ВПЛ) — у 79 (34,0 %) випадках. Серед герпесвірусів вірус простого герпесу (ВПГ) був виявлений у 35 випадках (15,1 %), цитомегаловірус (ЦМВ) — у 17 (7,3 %) і вірус Епштейна — Барр (ВЕБ) — у 26 (11,2 %). Це відображено на рис. 1.
Аналіз структури поширеності вірусів у тканині за стадіями птеригіуму показав, що їх частота загалом мала тенденцію до збільшення згідно зі стадіями патологічного процесу — від І до ІІІ стадії. Статистичний аналіз показав, що ці зсуви мали статистичну значущість (р < 0,0001).
При статистичному порівнянні розподілу кількості віруспозитивних випадків при різних стадіях птеригіуму за критерієм χ2 Пірсона вірогідних відмінностей не було показано тільки для І і IV стадій (р = 0,685) (табл. 2).
При аналізі змін частоти кожного з герпесвірусів за стадіями хвороби (табл. 3) було з’ясовано, що статистичну значущість мали зміни частоти тільки ВПГ (р = 0,020). Це наводило на думку про можливу значущість ВПГ для прогресування птеригіуму за стадіями патологічного процесу.
Для перевірки цього припущення було проведено регресійний аналіз з побудовою мультиномінальної однофакторної логістичної регресії з використанням пакета GLZ (StatSoft, Inc., США). Як предиктор використовували індикаторні значення, прийняті для визначення наявності (+) або відсутності (–) вірусу у тканині птеригіуму. Як залежна змінна для розробки моделі була визначена стадія птеригіуму (табл. 4).
Регресійний аналіз підтвердив зв’язок наявності ВПГ у тканині з ІІ і ІІІ стадією розвитку птеригіуму (p < 0,05), що вказувало на можливу роль цього вірусу у прогресуванні захворювання. Для ЦМВ та ВЕБ таких залежностей виявлено не було.
Ретроспективний аналіз, наведений в літературі [12], показав, що при дослідженні пацієнтів із Греції ВПГ був виявлений у 22–45 % випадків, а ЦМВ — у 40 % пацієнтів з птеригіумом. B. Otlu зі співавт. (2009) на підставі обстеження турецьких хворих дійшли висновку, що ВЕБ може брати участь в етіопатогенезі птеригіуму [19]. Велику частоту виявлення у тканині птеригіуму ВПЛ спостерігали й інші автори [12, 19]. У нашому дослідженні ВПЛ був виявлений у 34,0 % випадків при максимальній частоті у хворих з ІІ і ІІІ стадіями: 43,3 та 45,5 % відповідно.
Етіологічну роль папіломавірусів, які виконують роль тригера у запуску механізмів надмірної клітинної проліферації, відмічали й інші автори [13, 20]. M. Gallagher зі співавт. ще у 2001 році виявили наявність вірусу папіломи людини у 90 % зразків пацієнтів з папіломами кон’юнктиви та у 50 % хворих на птеригіум [13]. Є дані, що інфекція ВПЛ-16/18 була виявлена у 24 % випадків у тканині птеригіуму (31/129), але не у нормальній кон’юнктиві, а онкопротеїн HPV16/18 E6 був визначений у 48,3 % ДНК-позитивних випадків (15/31) [23].
У нашому дослідженні при птеригіумі були виявлені 6, 11, 16 та 18-й типи ВПЛ, частота яких становила відповідно 34,2 % (27 хворих), 24,1 % (19 хворих), 21,5 % (17 хворих) і 20,2 % (16 хворих). Отже, найчастіше виявлявся 6-й тип, решта типів мали приблизно рівний розподіл.
Статистичний аналіз типів ВПЛ за стадіями наведений у табл. 5. Типи 6 і 11 переважно виявлялися при І–ІІІ стадіях і не виявлялися при IV стадії, тоді як типи 16 і 18, навпаки, не виявлялися при І стадії, але виявлялися при IV стадії (по 5,8 %). Статистична значущість таких зсувів (р < 0,05) давала змогу висловити припущення, що типи ВПЛ були асоційовані зі стадіями птеригіуму.
При статистичному порівнянні розподілу ВПЛ-позитивних випадків при різних стадіях птеригіуму за критерієм χ2 Пірсона були показані вірогідні відмінності (рис. 2).
Мала місце вірогідна різниця розподілу ВПЛ-позитивних випадків при порівнянні IV стадії з І (р = 0,045), ІІ (р = 4,0е-04) і ІІІ (p = 2,0е-04). Як і для герпесвірусів, була перевірена гіпотеза про асоціацію типів ВПЛ з прогресуванням птеригіуму.
Для цього було здійснено регресійний аналіз із побудовою мультиномінальної однофакторної логістичної регресії з використанням пакета GLZ (StatSoft, Inc., США). Як предиктори використовували індикаторні значення, прийняті для визначення наявності (+) або відсутності (–) типів ВПЛ у тканині птеригіуму. Залежною змінною для розробки моделі була визначена стадія птеригіуму (табл. 6).
Проведення такого аналізу не виявило зв’язку типів ВПЛ зі стадією птеригіуму, за винятком ВПЛ-6, який мав зв’язок з розвитком І та ІІІ стадії (p < 0,05).
Розгляд розподілу пар ВПЛ-позитивних випадків для різних типів ВПЛ показав вірогідну різницю розподілу між типами 6/16, 6/18 і 11/16, 11/18 (р < 0,05). При цьому розподіл не відрізнявся для пар 6/11 (р = 0,781) і 16/18 (р = 0,999). Це, на наш погляд, підтверджувало правильність об’єднання типів за онкогенним ризиком: типи 6/11 відносяться до низького ризику, типи 16/18 — до високого [13]. З іншого боку, це обґрунтовувало принципову можливість їх об’єднання по парах (6/11 і 16/18) для подальших порівнянь.
Типи вірусу папіломи різняться за їх потенційними властивостями ініціації неопластичних процесів: високий онкогенний ризик мають типи 16, 18, 31, 45, 56, менший ризик — 6, 11, 42, 43, 44. ВПЛ високого онкогенного ризику був виявлений у 56 % випадків, а низького онкогенного ризику — у 37,5 % [20]. Отже, зважаючи на мультифакторіальну природу птеригіуму, можна вважати, що ВПЛ має суттєве значення як фактор ризику розвитку захворювання. Наші дослідження цілком підтвердили таку думку. Більше того, нами показана можлива асоціація ВПЛ високого онкогенного ризику з прогресуванням птеригіуму.
В огляді N. Di Girolamo (2012) за даними пошукової системи PubMed знайдено 34 дослідження, присвячені ВПЛ і птеригіуму [14]. Загалом показник поширеності вірусу становив 18,6 % (136/731). Найчастіше були представлені типи 6, 11, 16 і 18. Ці дані також цілком узгоджуються з отриманими нами результатами.
За даними гістологічних досліджень, птеригіум характеризується не тільки проліферативними, але й дегенеративними змінами [14]. У 2000 році E.T. Detorakis зі співавт. запропонували теорію подвійного удару в етіології птеригіуму: перший удар — мутагенна дія ультрафіолетового випромінювання, другого удару завдає вірусна інфекція вже постраждалим від зовнішнього фактора клітинам [12].
Білок р53 необхідний для зупинки клітинного циклу, репарації ДНК та запуску процесу апоптозу, результати дослідження даного білка при розвитку птеригіуму суперечливі [12, 23]. Відомо, що ВПЛ-16, який має високий онкогенний ризик, через убіквітин-протеоліз викликає деградацію білка р53, тож даний механізм може пояснювати проліферативну активність клітин лімба внаслідок дії цього вірусу. Крім того, проонкогенний потенціал ВПЛ зумовлений впливом його білків Е6 та Е7. Так, саме Е6, зв’язуючись із р53, викликає його деградацію, а крім того — стимулює експресію гена TERT (каталітична субодиниця теломерази), який зумовлює іммортальність клітин епітелію. Е7 блокує дію регуляторного білка клітинного циклу RB, що призводить до вивільнення стимулятора клітинної проліферації E2F і проходження клітини через контрольну точку G1/S, зумовлюючи початок клітинного циклу. Також Е7 інактивує інгібітори CDK р21 і р27 та активує цикліни Е і А. Інтеграція ДНК вірусу у геном призводить до надмірної експресії онкопротеїнів Е6 та Е7 [15].
У зв’язку з тим, що ключовим компонентом розвитку птеригіуму є надмірна проліферація клітин, нашу увагу привернув ген BRAF, роль якого широко досліджується при різних новоутвореннях. Але, незважаючи на численні публікації стосовно ролі мутацій цього гена (у базі даних PubMed на кінець І кварталу 2019 року — 13 032 публікації), нам не вдалося знайти жодної публікації з дослідження гена BRAF при птеригіумі.
Отже, можна стверджувати, що таке дослідження при птеригіумі нами виконано вперше.
З 232 випадків захворювання на птеригіум у тканині птеригіуму мутація була виявлена на 82 очах (35,3 %, рис. 3). Вірогідної різниці частоти мутації залежно від статі та віку хворих виявлено не було (р = 0,102 та р = 0,211 відповідно).
Поширеність мутації V600E гена BRAF у тканині птеригіуму згідно зі стадіями (по групах хворих) наведена у табл. 7.
У цілому була відмічена тенденція до збільшення частоти виявлення мутації V600E гена BRAF за стадіями розвитку птеригіуму (рис. 4), що мало статистичну значущість (χ2 = 18,53; р = 0,0003). Мінімальною вона була у хворих, що мали І стадію (21,3 %), максимальною — при IV стадії (57,7 %). Частота мутації при ІІІ стадії перевищувала таку при І і ІІ стадіях у 1,6 раза (37,9 проти 23,7 %; р = 0,0003).
Частота мутації при IV стадії перевищувала таку при І і ІІ стадіях у 2,4 раза (57,7 проти 23,7 %; р = 2,0е-5) і у 2,0 раза (57,7 проти 28,9 %; р = 1,0е-4) порівняно зі всіма іншими хворими (стадії І + ІІ + ІІІ).
Збільшення частоти виявлення мутації V600E гена BRAF продиктувало необхідність аналізу її асоціації з прогресуванням захворювання (табл. 8).
Результати регресійного аналізу показали сильний зв’язок наявності мутації V600E гена BRAF зі стадією птеригіуму і, відповідно, його прогресуванням. Поступове збільшення значень β-коефіцієнтів і їх статистичної значущості вказувало на прогресивний характер такого впливу.
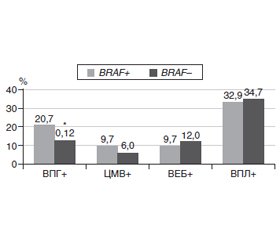
Надалі була проаналізована можливість зв’язку наявності вірусів і мутації V600E гена BRAF, що могло мати значення для посилення асоціації з прогресуванням захворювання. Дані (табл. 9) свідчать, що частота віруспозитивних та віруснегативних випадків при різному статусі мутації V600E гена BRAF (BRAF+/BRAF–) загалом не відрізнялася (p > 0,05), за винятком ВПГ. Для нього частота ВПГ-позитивних випадків за наявності мутації (BRAF+) була вірогідно вищою, ніж за її відсутності (BRAF–): 20,7 проти 12,0 % відповідно (p = 0,046).
Оскільки частота ВПЛ була проаналізована не тільки загалом, а й за типами, була проаналізована можливість зв’язку наявності типів ВПЛ і мутації V600E гена BRAF (табл. 10).
Частота ВПЛ-позитивних та ВПЛ-негативних випадків при різному статусі мутації V600E гена BRAF (BRAF+/BRAF–) загалом не відрізнялася (p > 0,05), за винятком ВПЛ-11. Частота ВПЛ-11-позитивних випадків за наявності мутації (BRAF+) була вірогідно вищою, ніж за її відсутності (BRAF–): 13,4 проти 5,3 % відповідно (p = 0,032).
Цю тенденцію ілюструє рис. 5. Значення частоти віруспозитивних випадків вірогідно відрізнялися тільки для ВПГ.
/72.jpg)
Мутація V600E гена BRAF була виявлена у 35,3 % випадків птеригіуму. Вірогідної різниці частоти мутації залежно від статі та віку хворих виявлено не було. Частота мутації за стадіями збільшувалася з 21,3 % при І стадії до 57,7 % при IV (р = 0,0003). Регресійний аналіз показав сильний прогресуючий зв’язок наявності мутації V600E гена BRAF зі стадією птеригіуму і, відповідно, його прогресуванням. Поступове збільшення значень β-коефіцієнтів і їх статистичної значущості вказувало на прогресивний характер такого впливу (p < 0,05). Частота ВПГ-позитивних випадків за наявності мутації (BRAF+) була вірогідно вищою, ніж за її відсутності (BRAF–): 20,7 проти 12,0 % відповідно (p = 0,046). Серед інших типів ВПЛ тільки частота ВПЛ-11-позитивних випадків за наявності мутації (BRAF+) була вірогідно вищою, ніж за її відсутності (BRAF–): 13,4 проти 5,3 % відповідно (p = 0,032). Дискримінантний аналіз показав високий ступінь впливу наявності ВПЛ (F = 6,46; p < 0,001) та мутації V600E гена BRAF (F = 6,87; p < 0,001), менший — ВПГ (F = 2,88; p = 0,037). ЦМВ і ВЕБ такого впливу не мали. Таким чином, доведено, що наявність у тканині птеригіуму ВПГ, ВПЛ та мутації V600E гена BRAF вірогідно впливала на прогресування птеригіуму за стадіями патологічного процесу: на I і II стадії впливали наявність ВПЛ і BRAF+, на III — ВПГ, ВПЛ і BRAF+, на IV — тільки BRAF+. Побудована модель багатофакторної логістичної регресії, що відображала суцільний вплив ВПГ, ВПЛ та мутації V600E гена BRAF на виникнення птеригіуму з правильністю 70,1 %. Значимість відібраних чинників у прогнозуванні захворювання в ряду від максимального до мінімального була така (за величиною β-коефіцієнтів): ВПЛ+ |3,006| > BRAF+ |2,304| > ВПГ+ |1,648|. У порядку зменшення ймовірності можливі варіанти збігу патогенетичних чинників співвідносилися так: ВПГ+/ВПЛ+/BRAF+ > ВПЛ+/BRAF+ > ВПГ+/ВПЛ+ > ВПГ+/BRAF+ > ВПЛ+.
Таким чином, можна відмітити патогенетичну роль поєднання цих вірусних чинників у розвитку птеригіуму: значення мали наявність або тільки ВПЛ, або ВПЛ разом з ВПГ. Наявність мутації V600E гена BRAF завжди збільшувала ймовірність птеригіуму. У цьому можна бачити розвиток та розширення теорії подвійного удару в етіології птеригіуму E.T. Detorakis зі співавт. (2000), згідно з якою перший удар — мутагенна дія ультрафіолетового випромінювання, другого удару завдає вірусна інфекція вже постраждалим від зовнішнього фактора клітинам [12]. Можна думати, що ультрафіолетове випромінювання, що є потужним фізичним фактором пухлинної трансформації, призводить до появи соматичної мутації (V600E гена BRAF) у стовбуровій клітині лімба, яка стає родоначальницею клона пухлинних клітин. При цьому пряма мутагенна дія ультрафіолету (прямий мутагенез) поєднується з епігеномним механізмом вірусного онкогенезу.
Висновки
1. У тканині птеригіуму вірусна інфекція виявлена у 50,9 % очей. З них герпесвіруси — 33,6 % (ВПГ — 15,1 %, ЦМВ — 7,3 % і ВЕБ — 11,2 %), віруси папіломи людини — 34,0 % (тип 6 — 34,2 %, тип 11 — 24,1 %, тип 16 — 21,5 %, тип 18 — 20,2 %), подвійна мікст-інфекція — 32,1 % (ВПГ + ВПЛ — 30,6 %) та потрійна мікст-інфекція — 2,5 % (ВПГ + ЦМВ + ВПЛ та ВПГ + ВЕБ + ВПЛ). За регресійним аналізом: відмічено зв’язок ВПГ з ІІ і ІІІ стадією птеригіуму (p < 0,05) і зв’язок ВПЛ з І–ІІІ стадіями птеригіуму (p < 0,01).
2. У тканині птеригіуму мутація V600E гена BRAF була виявлена у 35,3 % випадків. Регресійний аналіз показав сильний прогресуючий зв’язок наявності мутації V600E гена BRAF зі стадією птеригіуму (p < 0,05). При І стадії частота мутації — 21,3 %, при IV стадії — 57,7 % (р = 0,0003).
3. Виявлена залежність розвитку рецидиву птеригіуму від наявності мутації V600E гена BRAF: на прооперованих очах протягом року за наявності мутації кількість рецидивів становила 73,3–81,2 %, а без мутації — 4,2–10,7 % (p < 0,001). Наявність мутації V600E гена BRAF підвищувала ризик розвитку рецидиву протягом року після операції у 35,7 раза (ВШ = 35,72; 95% ДІ 15,71–81,24). Математична модель багатофакторної логістичної регресії для розрахунку ймовірності виникнення рецидиву після хірургічного лікування птеригіуму показала залежність від наявності мутації V600E гена BRAF і ВЕБ з правильністю 85,3 %.
4. Наявність у тканині птеригіуму ВПГ, ВПЛ та мутації V600E гена BRAF вірогідно впливала на прогресування птеригіуму за стадіями патологічного процесу: на I і II стадії впливали наявність ВПЛ і BRAF+, на III — ВПГ, ВПЛ і BRAF+, на IV — тільки BRAF+. Побудована модель багатофакторної логістичної регресії, що відображала спільний вплив ВПГ, ВПЛ та мутації V600E гена BRAF на виникнення птеригіуму з правильністю 70,1 %. У порядку зменшення ймовірності можливі варіанти збігу патогенетичних чинників співвідносилися так: ВПГ + ВПЛ + BRAF+ > ВПЛ + BRAF+ > ВПГ + ВПЛ > ВПГ + BRAF+ > ВПЛ.
Отримано/Received 16.04.2021
Рецензовано/Revised 03.05.2021
Прийнято до друку/Accepted 10.05.2021
/68.jpg)
/70.jpg)
/71.jpg)

/68_2.jpg)
/69.jpg)
/70_2.jpg)
/71_2.jpg)
/72_2.jpg)
/72.jpg)