Газета «Новости медицины и фармации» №13 (770), 2021
Вернуться к номеру
Епідеміологія автоімунного тиреоїдиту
Авторы: Кравченко В.І. (1), Товкай О.А. (2), Раков О.В. (1), Тронько М.Д. (1)
(1) — ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
(2) — Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Хронічний автоімунний тиреоїдит (АІТ) — хронічне запалення щитоподібної залози (ЩЗ) автоімунного генезу, обумовлене порушеннями вродженого й адаптивного імунітету, одна з найпоширеніших патологій у структурі ендокринних захворювань і найчастіша причина гіпотиреозу. До сьогодні немає чітких установлених рекомендацій щодо діагностики та лікування цього захворювання та відокремлення його певних проявів від явного захворювання. Особливої соціальної значимості набуває проблема лікування і профілактики АІТ у зв’язку з екологічним забрудненням навколишнього середовища, незбалансованою йодною профілактикою, застосуванням деяких лікарських препаратів, які виступають як фактори ушкодження імунної системи, і реалізацією ефекту на рівні органів-мішеней, зокрема ЩЗ. Потреба діагностики, лікування та профілактики АІТ обумовлена також необхідністю запобігання супутнім захворюванням, включаючи порушення в серцево-судинній системі, гіперхолестеринемію, фібриляцію передсердь, депресію й енцефалопатії [1–5].
З урахуванням актуальності проблеми, вивчення етіології, патогенезу, діагностики та епідеміології АІТ набуває важливого значення. Поширеність та захворюваність на АІТ оцінити повністю складно у зв’язку з наявністю еутиреоїдної та субклінічної фаз захворювання, тому існують різні досить відмінні значення для цих показників. На початку ХХ століття Х. Хашимото вперше описав АІТ за ознаками лімфоцитарного ураження залози [6]. За його критеріями, АІТ виникає приблизно в 0,3–1,5/1000 суб’єктів на рік, причому в жінок — у 4–10 разів частіше, ніж у чоловіків. Цей діагноз може бути встановлений випадково при обстеженні хворих з екстратиреоїдними автоімунними порушеннями або деякими хромосомними аномаліями. У виникненні АІТ задіяні вроджений та адаптивний імунітет із клітинними та гуморальним його чинниками [7]. Повногеномні асоціативні дослідження близнюків та сімей з автоімунними захворюваннями ЩЗ (АЗЩЗ) показали високу їх спадковість та важливе значення генетичних факторів у виникненні захворювань [8].
На важливе значення генетичних факторів у виникненні АІТ вказує висока його частота одночасно з іншими автоімунними захворюваннями та генетичними пошкодженнями [9, 10]. Було ідентифіковано 103 гени, які мають відношення до АІТ [11]. Деякі гени беруть участь в імунному розпізнаванні, інші — у загальній відповіді, а деякі є спільними для АІТ та хвороби Грейвса або тільки до хвороби Грейвса [12, 13].
На сьогодні встановлені імуномодулюючі гени: HLA-DR, CTLA-4, CD40 і PTPN22, ген цитотоксичного фактора 4, асоційованого з Т-лімфоцитами (CTLA-4), шо є основним негативним регулятором Т-клітин при АІТ [14].
Окрім генетичних, імунних механізмів, втрата імунної толерантності до автоантигенів ЩЗ тиреоїдної пероксидази (ТПО), утворення антитіл до TПO, тиреоглобуліну (TГ), рецептора тиреотропного гормона (рТТГ), а також, меншою мірою, симпортера йодиду натрію і пендрину є основою розвитку АЗЩЗ [15, 16]. АІТ має перебіг переважно за Th1-типом імунної відповіді з переважанням продукції цитокінів Th1-профілю, які опосередковують цитотоксичний вплив імунокомпетентних клітин (CD8+ і МФ) на тиреоцити, і поєднується з ураженням тиреоїдних клітин при первинному гіпотиреозі, якщо автоантигеном слугують ТПО, TГ та інші компоненти тиреоїдної тканини [17].
За своїм етіологічним походженням на сьогодні виділяють шість форм первинного АІТ, для яких не виявлено причини: класична, родинна, ювенільна форми, хашитоксикоз, безболісна, що виникає у вагітних та в післяпологовому періоді. Вторинні форми АІТ, в яких можна ідентифікувати етіологічний фактор, пов’язують із застосуванням імуномодулюючих препаратів, впливом інфекції, деяких лікарських препаратів та екологічних факторів. Загалом АІТ є багатофакторним захворюванням, що в основі має генетичні, екологічні, гормональні фактори.
Зовсім неочікуваним виявився факт захисної дії куріння від підвищення рівня автоантитіл до антигенів ЩЗ та гальмування розвитку захворювання у хворих на АІТ під впливом куріння [23–26].
Унаслідок імунних змін у ЩЗ хворих на тиреоїдит Хашимото (ТХ) виникають запальні клітини, до яких належать переважно В- та Т-клітини. Лімфоцити вступають у тісний контакт із тиреоцитами, частково проникають у цитоплазму та викликають їх руйнування. Інколи тиреоцити збільшуються в розмірі, мають гіперхромне ядро, цитоплазма переповнена мітохондріями та набуває інтенсивно рожевого кольору при забарвленні еозином. Ці клітини іменуються клітинами Хюртля та мають важливе діагностичне значення [27–29].
Втрата імунної толерантності до автоантигенів ЩЗ TПO, ТГ та рТТГ є основою розвитку АЗЩЗ. Оксидативний стрес, опосередкований активними формами оксигену — ROS, є важливим чинником патогенезу автоімунного запалення, у тому числі при АЗЩЗ. У малих кількостях, що вважаються фізіологічними, ROS задіяні в таких процесах, як індукція стресових білків і ферментів, синтез і розпад цитокінів, ріст, поділ і диференціювання клітин, антимікробний, противірусний, протипухлинний ефекти, старіння і загибель клітин, руйнування пошкоджених молекул, міжклітинної речовини, регуляція репаративних процесів тощо. При запальних захворюваннях поліморфні ядерні нейтрофіли (PMN) мають велику здатність пошкоджувати клітини тканин шляхом їх неадекватної активації («респіраторного вибуху») та вивільнення токсичних продуктів — реактивних форм кисню (ROS), протеаз та інших молекул, а також за участю нейтрофільних позаклітинних пасток (neutrophil extracellular traps — NET), які зазвичай служать для знешкодження мікроорганізмів. Під час утворення NET відбувається дегрануляція продуктів гранул PMN (мієлопероксидаза, протеаза, дефензини тощо), які прикріплені до сітки ядерної чи мітохондріальної ДНК, що вивільняється, та здійснення цитотоксичної дії PMN. Крім того, активовані PMN можуть секретувати широкий спектр цитокінів і хемокінів, які можуть регулювати практично кожен елемент імунної системи. При автоімунному запаленні (зокрема, васкулітах) через вивільнення з PMN ферментів гранул і ROS, зміну властивостей компонентів їх плазматичної мембрани в результаті активації або апоптозу, а також через вивільнення NET можуть виникати неоепітопи (антигенні детермінанти) PMN. Ці неоепітопи мають потенціал для порушення імунної толерантності і генерації антинейтрофільних цитоплазматичних антитіл (ANCA), спрямованих проти протеїнази-3 або мієлопероксидази, які є автоантигенами PMN [30].
Однією з характерних особливостей АІТ є суттєве підвищення рівня антитіл до ТПО. За цим показником 2 % населення та 10–15 % жінок похилого віку мають згадане захворювання [31]. Поточні дослідження демонструють досить різні показники захворюваності на АІТ, ніж зазначені Х. Хашимото. Одна з клінічних проблем пов’язана з відсутністю специфічних симптомів захворювання, суттєва кількість осіб мають патологічні зміни в імунній системі, навіть цього не підозрюючи. Велика частина досліджень була спрямована на визначення поширеності антитіл до ЩЗ до того, як виникне явне захворювання.
Поширеність латентного АІТ у різних країнах наведена в огляді Rodríguez et al. [32]. Важливість цих досліджень може бути позначена в плані виявлення предикторів захворювання АІТ. Це також актуально для виявлення факторів ризику інших споріднених автоімунних захворювань, зокрема цукрового діабету (ЦД) 1-го типу [33, 34].
Наявність антитіл до ЩЗ в еутиреоїдних осіб задокументована в багатьох публікаціях. Звіти про ці дослідження вказують на поширеність антитіл до ТПО та ТГ відповідно 11,3 та 10,4 %. Наведені в статті дані свідчать про значну поширеність прихованого або латентного АІТ серед населення різних країн. З огляду на розглянуті публікації ми навели дані в табл. 1. Існує суттєва розбіжність у наявності антитіл до ЩЗ у різних країнах, причому у всіх країнах у жінок підвищений рівень антитіл спостерігається значно частіше, ніж у чоловіків. Найбільш важливим підтвердженням ураження ЩЗ автоімунним процесом є наявність інфільтрації її лімфоцитами, що є проявом клітинного імунітету. Спеціальні цитопатологічні дослідження препаратів біопсії від 761 хворого на патологію ЩЗ показали високу її ураженість (13,4 %) запальним процесом та поширеність ТХ > 10 % у хворих на вузловий зоб [35].
Помірне підвищення антитіл до ТПО може відбуватися при ендемічному зобі і часто не супроводжується ніякими клінічними порушеннями, тому при розрахунку частоти АІТ необхідно враховувати наявність всіх симптомів даного захворювання. Поточні епідеміологічні дослідження, зроблені за останні 5 років, аналізують значення різних факторів у виникненні АІТ та діагностичні підходи у виявленні цього захворювання. Найбільш прийнятним підходом для діагностики АІТ є виявлення підвищеного рівня сироваткових автоантитіл до ТПО, ТГ, ТТГ, неоднорідної ехоструктури паренхіми ЩЗ із гіпоехогенністю при ультразвуковому дослідженні (УЗД) [36]. Захворюваність на АІТ була проаналізована у великому дослідженні в Швеції, результати якого були опубліковані у 2020 році [37]. Для дослідження поширеності АІТ та впливу на цей показник різних факторів була проаналізована база даних Шведського реєстру хворих на СНІД (за 48 років — із 1964 по 2012 рік). Реєстр включав дані 769 991 хворого. Загальна популяція першої родинної лінії включала 519 180 обстежених. Діагностика хвороби Хашимото здійснювалася за прийнятими критеріями: типова картина УЗД ЩЗ та наявність антитиреоїдних антитіл. Було діагностовано 25 607 випадків АІТ. Ризик захворювання на АІТ у нащадків при захворюванні в батьків становив 3,51, у братів та сестер — 5,52, у батьків та братів і сестер — 22,06. Конкордантна родинна асоціація ТХ (4,75) перевищувала відповідну для хвороби Грейвса (3,85). Ризики між братами та сестрами були вищими, ніж ризики між дітьми та батьками, що вказує на значення рецесивних генетичних ефектів та ефектів навколишнього середовища для виникнення захворювання. Дуже високий ризик виникнення АІТ (22,06) спостерігався в родинах, де перенесли інфекційні хвороби батьки та діти (брати і сестри), що також вказує на дуже важливу роль генів у виникненні захворювання. У даному дослідженні були проаналізовані також ризики виникнення АІТ залежно від широкого кола захворювань (здебільшого ці ризики були менше 2,0). На жаль, безпосередні показники поширеності та захворюваності на АІТ у цьому дослідженні не наведені.
В іншому сучасному огляді, присвяченому епідеміології, патогенезу та лікуванню АІТ, F. Ragusa et al. [38], оцінюючи епідеміологічні показники, посилаються на публікацію D.S. McLeod, D.S. Cooper [39], в якій найбільш детально розглянуті наявні дослідження захворюваності на АІТ у різних країнах світу. Наводимо ці дані на рис. 1.
Згідно з дослідженнями авторів, захворюваність на АІТ залежить від раси та збільшується з віком обстежених, вона вища у йодозабезпечених регіонах, ніж у дефіцитних на цей елемент територіях. Спеціальні дослідження, проведені в Китаї в трьох округах із різним йодним забезпеченням, показали різний рівень АІТ [40]. В окрузі з помірним йодним дефіцитом позитивний статус антитіл до ЩЗ із підвищеним сироватковим рівнем ТТГ становив 0,5 %, в іншому — із більше ніж достатнім йодним забезпеченням — 1,8 %, у регіоні з надлишковим споживанням йоду — 2,8 %. Сукупна захворюваність на АІТ становила відповідно 40 випадків, 200 і 260 випадків на 100 000 населення за рік [41]. Подібні результати спостережень наведені і в інших публікаціях [42]. Надлишкове споживання йоду може мати декілька наслідків. Один із них полягає в підвищенні імуногенності ТГ, інший — у підвищенні адгезії йоду на самому тиреоциті [43], що призводить до виникнення АІТ. Тому необхідний контроль за запровадженням йодної профілактики.
Для виникнення АІТ дуже важливі генетичні й екологічні фактори. У цьому аспекті чітко спостерігається сімейний фактор, захворюваність жінок у декілька разів перевищувала таку в чоловіків. Дослідження останнім часом показують, що причиною більшої захворюваності на АІТ у жінок є особливості епігенетики в осіб різної статі. Естрогензадіяне метилювання сайтів CpG у промоторній ділянці FIRE може руйнувати тонкий баланс між автореактивними Т-клітинами та Тreg-клітинами і за наявності тригерів викликати автоімунне захворювання, що, можливо, відбувається в більшості випадків захворювань жінок на АІТ [44, 45].
Характерною особливістю АІЩЗ є те, що одночасно відбувається ураження імунними процесами інших органів. У cучасному дослідженні Bliddal et al. [46] зазначають, що серед автоімунних захворювань найбільш поширеним є АІТ, який є найбільшим ризиком для виникнення інших автоімунних захворювань. На підтвердження цього наводять епідеміологічні дослідження, в які включені дані на більше ніж 5 млн мешканців Данії [46, 47]. У цьому дослідженні вивчали поширеність 31 автоімунного захворювання відповідно до МКХ-10. При АЗЩЗ часто спостерігалися захворювання надниркових залоз (відношення шансів (ОR) становило 12,9), вогнищева алопеція (OR 11,4), вітиліго (OR 7,9), злоякісна анемія (OR 5,6). Серед хворих на АІТ спостерігалася велика кількість пацієнтів із ЦД 1-го типу, ревматоїдним артритом, розсіяним склерозом. Характерним моментом було те, що ризик появи іншого автоімунного захворювання разом з ураженням ЩЗ у чоловіків був вищим, ніж у жінок. Цей факт може бути важливим при лікуванні автоімунних уражень ЩЗ.
Тісний зв’язок АІТ із генетичними порушеннями обумовлює появу ознак захворювання вже в дитячому віці. У віці до трьох років хвороба виникає дуже рідко. У період раннього та середнього статевого дозрівання частота АІТ суттєво зростає, причому в цьому віці спостерігається значне переважання захворюваності в дітей жіночої статі [48, 49].
За даними аналізу публікацій щодо поширеності захворюваності на АІТ дітей, частота захворювання становить від 0,3 до 9,6 % (у середньому — близько 3 %) [50].
Подібні результати поширеності АІТ серед дітей спостерігали в Росії. Серед дітей віком 7–8 років частота АІТ становила 0,5 %, а в підлітків — 2,2 %, на стадії субклінічного гіпотиреозу — відповідно 0,35 та 0,9 % [51].
АІТ у дітей часто перебігає безсимптомно та може бути виявлений при обстеженні дітей із підвищеним ризиком АЗЩЗ, осіб з екстратиреоїдними автоімунними порушеннями або хромосомними аномаліями [52]. Діагноз установлюють шляхом виявлення антитіл до ТПО, ТГ та гіпоехогенності ЩЗ при УЗД. У цих дослідженнях 52,1 % пацієнтів були еутиреоїдними, 19,2 % мали субклінічний, 22,2 % — маніфестний гіпотиреоз, 6,5 % — субклінічний (3,25 %) та маніфестний гіпертиреоз (3,25 %) [50]. Спостереження за пацієнтами протягом п’яти років показало погіршення функції ЩЗ (підвищення рівня ТТГ, зниження рівня тиреоїдних гормонів) та збільшення обсягу залози [53]. Серед еутиреоїдних пацієнтів у 30,6 % розвинувся субклінічний гіпотиреоз, у 12,3 % — маніфестний, спонтанне відновлення функції спостерігалося в 40,6 % випадків.
На особливу увагу заслуговує розгляд питання про АІТ у вагітних. Під час вагітності відбуваються суттєві зміни функції ЩЗ. Збільшення рівня естрогенів викликає підвищення рівня тироксинзв’язуючого глобуліну, збільшується кількість зв’язаних тиреоїдних гормонів, хоріонічного гормона людини, що має властивості ТТГ, який дещо збільшує рівень вільного Т4, що за принципом зворотного зв’язку гальмує синтез ТТГ [54]. Виникає ситуація гіпертироксинемії або гестаційного транзиторного тиреотоксикозу. Підвищення швидкості клубочкової фільтрації та трансплацентарного проходження Т4 також збільшує синтез ТГ [55–57].
У другій половині вагітності із зменшенням продукції хоріонічного гормона людини прояви гіперфункції ЩЗ та наявні симптоми стихають. Фізіологічні процеси, що відбуваються при вагітності, включають імунотолерантні зміни, зниження активності антитіл в організмі, створюють сприятливі умови для розвитку плода [58, 59]. Захворювання ЩЗ при вагітності є поширеним явищем. Близько 2–3 % жінок мають дисфункцію ЩЗ, і близько 10 % страждають від АЗЩЗ, включаючи еутиреоїдний стан [60]. Подібні результати отримані при дослідженні антитіл до ТПО у прибережних районах Китаю. Серед 1169 вагітних у І триместрі 118 жінок мали антитіла до ТПО у 10,1 % випадків. У другому триместрі частота випадків антитіл до ТПО становила 9,21 %. Було встановлено, що поширеність гіпотиреозу серед АТ-ТПО-позитивних жінок була значно вищою, ніж у жінок із відсутністю АТ-ТПО (9,3 проти 3,8 %, χ2 = 7,73, p = 0,014). Логістичний множинний регресійний аналіз даних жінок із АТ-TПO показав, шо історія хвороби ЩЗ (OR = 17,13, p = 0,001) і позитивний тест АТ-TПO (OR = 2,34, p = 0,020) були факторами ризику гіпотиреозу під час вагітності [61].
У дослідженні з Південного Іраку серед 628 вагітних 106 (16,9 %) мали антитіла до ТПО. Із них 10,4 % — субклінічний гіпотиреоз, ізольовану гіпотироксинемію — 8,5 %, ізольовану гіпертироксинемію — 5,7 %, клінічний гіпотиреоз — 7,5 %, субклінічний та клінічний гіпертиреоз — 4,7 та 2,8 % відповідно. Серед іншої когорти обстежених із відсутністю антитіл до ТПО усі ці показники були удвічі меншими. Це вказує на важливе значення імунних змін у ЩЗ у виникненні її захворювань [62].
Одним із найчастіших проявів АІТ є післяпологовий автоімунний тиреоїдит (ППТ). У літературі існують дуже різні дані відносно поширеності цього захворювання. Так, є дані, що рівень поширеності через три місяці після пологів становив 4,0 і 5,9 %, а через 9 місяців — 11,4 % [63]. У Таїланді рівень поширеності ППТ становив 1 %, в Уельсі — 22 %, причому цей показник був вище в жінок із раніше існуючим автоімунним захворюванням, особливо з ЦД 1-го типу [64]. Дослідження 1372 жінок у післяпологовому періоді в Торонто виявило 78 (5,7 %) випадків ППТ і 3 випадки (0,22 %) хвороби Грейвса [65]. У дослідженні Fung et al. через 12 місяців після пологів була виявлена поширеність захворювання 16,7 % [66]. ППТ може проявлятися клінічно, як і при класичному варіанті хронічного АІТ. Здебільшого ППТ продовжується близько 4–6 місяців. Однак протягом першого року після пологів захворювання може переходити в стійкий маніфестний АІТ [67].
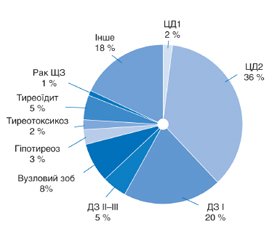
Епідеміологічні дослідження захворюваності на АІТ в Україні не проводилися, однак є офіційні відомості МОЗ України відповідно до звітів обласних ендокринологів. Згідно з останнім довідником основних показників діяльності ендокринологічної служби України [68], частота тиреоїдиту в Україні серед всієї ендокринної патології становила 5 %. Після ЦД та зоба тиреоїдит посідав третю позицію (рис. 2). Поширеність даного захворювання становила 421,2 на 100 000 населення. Захворюваність на тиреоїдит тоді ж дорівнювала 43,1 випадку на 100 000 населення. Загалом цей результат узгоджується з вищенаведеними європейськими показниками.
У дітей і підлітків включно до 14 років поширеність АІТ становила 47,7 на 100 000, захворюваність — 13,4 на 100 000 дитячого населення. Ці дані були суттєво нижчими за наведені раніше іншими авторами, можливо, внаслідок того, що враховувалися випадки тільки з маніфестним гіпотиреозом, субклінічний та латентний АІТ не діагностувалися.
Характерною особливістю соціально-медичної ситуації в Україні є невирішеність проблеми профілактики йодозалежних захворювань [68, 69]. Як результат цього серед патологій ендокринних залоз в Україні за поширеністю та частотою захворюваності перше місце посідають дифузний та вузловий зоб, а далі — тиреоїдит. У багатьох дослідженнях вказується на значення йоду та селену у виникненні АІТ [17, 18, 69, 71]. Наші дослідження також констатують недостатню забезпеченість цими елементами населення України [68], зокрема і хворих на АІТ [72]. У науковій літературі достатньо повідомлень про зростання захворюваності на АІТ після підвищеного надходження йоду в організм [73]. Дослідження інших елементів у крові при АІТ поодинокі. Зокрема, є публікації відносно вмісту заліза, цинку, міді в сироватці крові хворих на АІТ [74, 75]. Нами встановлено зниження вмісту макро- та мікроелементів у сироватці крові хворих на АІТ (табл. 2).
Дослідження вмісту елементів у сироватці крові проводилося методом атомно-емісійної спектрометрії з індуктивно-зв’язаною плазмою (АЕС-ІЗП) (джерело 2003 р.) на приладі Optima 2100 DV фірми PerkinElmer (США) за рекомендованою методикою в лабораторії аналітичної хімії та моніторингу токсичних сполук ДУ «Інститут медицини праці НАМН України» [72]. Звертає на себе увагу знижений рівень кальцію, магнію, цинку та міді в сироватці крові хворих на АІТ. У той же час ми не знайшли відмінностей у вмісті селену у хворих на АІТ порівняно з контрольною групою. Хоча, враховуючи нормальні показники цього елемента в сироватці крові населення з достатнім забезпеченням селеном, які становлять 80–120 мкг/л, можна констатувати, що як хворі на АІТ, так і пацієнти контрольної групи зазнавали дефіциту селену.
У цих дослідженнях установлено, що відносний ризик розвитку АІТ при низькому вмісті магнію (Р < 0,001) становив RR = 5,4 (95% ДІ 2,7–8,8), при низькому вмісті кальцію — 2,9 (95% ДІ 1,8–3,6) (Р < 0,001) та при низькому вмісті цинку — 2,3 (95% ДІ 1,6–2,6) (Р < 0,01). Це вказує на важливу роль цих елементів у виникненні АІТ [72]. Участь цих елементів у виникненні АІТ підтверджується дослідженнями, які показують, що кальцій, магній та цинк тісно пов’язані з імунною системою, йони цих елементів є важливими вторинними месенджерами в імунній активації Т- і В-лімфоцитів. Більше того, магній зв’язаний з окиснювальним стресом та запальними реакціями [76, 77]. Установлено вплив різних екологічних факторів, інфекцій, забруднювачів навколишнього середовища та лікарських засобів на утворення антитіл проти ЩЗ.
Однак їх вплив на важливі епідеміологічні показники, захворюваність і поширеність АІТ потребує подальших спеціальних досліджень. Вивчення епідеміології АІТ важливо для України у зв’язку з розробкою закону про профілактику йодозалежних захворювань і запровадження масової йодної профілактики, що зроблено в більшості країн світу. Необхідний контроль не тільки за охопленням населення цим заходом, але й за рівнем захворювань ЩЗ. Необхідно мати на увазі, що в разі надлишкового надходження йоду можна очікувати підвищення частки захворювань на АІТ, що диктує необхідність враховувати досвід інших країн та контролювати запровадження масової йодної профілактики йодозалежних захворювань.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
Список літератури знаходиться в редакції

/10_m.jpg)
/11_m.jpg)
/11_m2.jpg)