Вступ
Синдром Арнольда — Кіарі, також відомий як мальформація Кіарі (МК), — це група деформацій структур заднього мозку (мозочок, міст і довгастий мозок). Проблеми варіюють від грижі вмісту задньої ямки позачерепної порожнини до відсутності мозочка, можливі супутні внутрішньочерепні або екстракраніальні дефекти, такі як гідроцефалія, сиринкс або дизрафізм хребта.
Історична довідка та патогенез
Синдром уперше описали патолог Г. Кіарі (Австрія) в 1891 році та професор патології Ю. Арнольд (Німеччина) в 1894 році. Частота цього захворювання становить від 3,3 до 8,2 випадку на 100 тис. населення. Патогенез захворювання остаточно не встановлено. Серед патогенетичних факторів розглядають спадково зумовлені вроджені остеонейропатії, травматичні пошкодження клиноподібно-решітчастої і клиноподібно-потиличної частини схилу внаслідок родової травми, гідродинамічний удар ліквору в стінки центрального каналу спинного мозку. Але більшість науковців вважають, що захворювання має генетичну основу.
Етіологія
Запропоновано кілька теорій, включно з молекулярною, гідродинамічною і механічною. Цілком імовірно, що різні механізми можуть призвести до формування однакової вади Кіарі.
Розрізняють 4 основні типи мальформації (аномалії) Арнольда — Кіарі:
— тип 1 — зсув мигдаликів мозочка в хребтовий канал нижче від рівня великого потиличного отвору з відсутністю спинномозкової грижі; у 15–20 % пацієнтів цей тип поєднується з гідроцефалією, а в 50 % хворих — із сирингомієлією;
— тип 2 — каудальна дислокація нижніх відділів черв’яка мозочка, довгастого мозку й IV шлуночка; характерною ознакою цього типу є поєднання з менінгомієлоцеле в поперековому відділі, відзначається прогресуюча гідроцефалія, часто — стеноз водопроводу мозку;
— тип 3 — зміщення стовбура мозку в хребтовий канал з високим цервікальним або субокципітальним енцефаломенінгоцеле, значним лікворно-гіпертензивним синдромом;
— тип 4 — гіпоплазія мозочка без зміщення його вниз з ектопією довгастого мозку.
Найпоширенішими є перший і другий типи мальформації, а третій і четвертий типи зазвичай несумісні із життям. Другий тип аномалії Арнольда — Кіарі пов’язаний із розщепленням хребта, і, за даними автопсії, серед дітей з менінгомієлоцеле мальформацію Арнольда — Кіарі типу 2 виявляють з частотою до 90 % випадків. У 1991 році було запропоновано перший варіант синдрому Арнольда — Кіарі поділити на тип А (із сирингомієлією) і тип В (без сирингомієлії).
Клініка
Клінічно синдром Арнольда — Кіарі проявляється такими ознаками:
1) лікворно-гіпертензійним синдромом (біль у потилиці й ділянці шиї, що підсилюється під час чхання, кашлю, напруження тонусу м’язів шиї), можливе блювання, що не залежить від прийому їжі та її характеру;
2) мозочково-бульбарним синдромом (зниження гостроти зору, диплопія, розлад ковтання), зниженням слуху за типом кохлеарного невриту, системним запамороченням з ілюзією обертання навколишніх предметів, вушним шумом, синдромом сонного апное, повторюваною короткочасною втратою свідомості, орто-
статичним синдром, порушенням мовлення (дизартрія), ністагмом, атаксією, осиплістю голосу й утрудненням дихання. Можливий тетрапарез з більшим зниженням м’язової сили у верхніх кінцівках, ніж у нижніх;
3) сирингомієлітичним синдромом (порушення чутливості за дисоційованим типом, оніміння, м’язові гіпотрофії, порушення функції органів таза, нейроартропатії, зникнення черевних рефлексів).
У новонароджених синдром Арнольда — Кіарі супроводжується гучним диханням (вроджений стридор), періодами короткочасної зупинки дихання, двостороннім нейропатичним парезом гортані, порушенням ковтання з потраплянням рідкої їжі в ніс, ністагмом, підвищенням м’язового тонусу у верхніх кінцівках, ціанозом шкірних покривів, що виникають під час годування. Рухові розлади можуть проявлятися різною мірою і прогресувати до тетраплегії.
Симптоми
У багатьох людей з мальформацією Кіарі типу 1 симптоми відсутні. Однак будь-який з наступних симптомів може проявлятися окремо або в поєднанні з іншими. Деякі симптоми пов’язані з розвитком сиринксу (порожнина, заповнена рідиною в спинному мозку):
— сильний біль у голові й шиї;
— потиличний головний біль, що відчувається біля основи черепа, він посилюється при кашлі, чханні або напруженні;
— втрата больової і температурної чутливості у верхній частині тулуба й руках (унаслідок сирингомієлії);
— втрата м’язової сили в руках і руках (унаслідок сирингомієлії);
— падіння на землю через слабкість м’язів;
— спастичність;
— запаморочення;
— проблеми з балансом;
— диплопія або розмитий зір;
— підвищена чутливість до яскравого світла;
— апное сну;
— у дітей і немовлят симптоми можуть бути неспецифічними: гіпотонія, значна затримка моторики, труднощі при ковтанні, напади задишки, опістотонус.
Симптоми, пов’язані з мальформацією Кіарі типу 2, також можуть бути викликані проблемами, пов’язаними з мієломенінгоцеле й гідроцефалією. До таких симптомів належать:
— зміна структури дихання, включно з періодами апное (короткі періоди припинення дихання);
— пригнічений кашльовий рефлекс;
— мимовільні швидкі рухи очей вниз;
— втрата сили руки.
Мальформація Кіарі типу 3 включає форму дизрафізму з частиною мозочка і/або стовбура мозку, що виштовхується через дефект задньої частини голови або шиї. Ці вади розвитку дуже рідкісні й пов’язані з високим рівнем ранньої смертності або вираженим неврологічним дефіцитом у пацієнтів, які виживають. Якщо проводити лікування, то необхідно раннє оперативне закриття дефекту. Гідроцефалію, яка зазвичай присутня, також слід лікувати шляхом шунтування.
Часто зустрічаються додаткові тяжкі вроджені вади, які можуть потребувати широкого лікування. У немовлят з вадами розвитку Кіарі типу 3 можуть виникнути небезпечні для життя ускладнення.
Мальформація Кіарі типу 4 є найбільш тяжкою і найрідкіснішою формою. Мозочок не розвивається нормально. Можуть бути й інші супутні вади розвитку мозку. Більшість дітей, народжених із цією вадою, не переживають малюковий вік.
Сирингомієлія/гідромієлія
Коли ЧСФ утворює порожнину або кісту всередині спинного мозку, говорять про сирингомієлію або гідромієлію. Це хронічні порушення, що залучають спинний мозок і можуть із часом розширюватися. При розширенні порожнини рідини вона може зміщувати або травмувати нервові волокна всередині спинного мозку. Залежно від розміру й розташування сиринксу може виникати найрізноманітніша симптоматика.
Ліквородинамічні порушення внаслідок мальформації Кіарі є однією з найпоширеніших причин виникнення сирингомієлії.
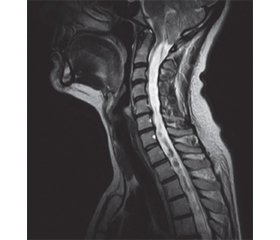
Згідно з даними досліджень Milhorat, сирингомієлія розвивається в 60–90 % пацієнтів з мальформацією Кіарі типу 1 [1–3]. Опущення структур задньої черепної ямки більше ніж на 5 мм (мальформація Кіарі типу 1 (рис. 1)) є патологічним для дорослих [4].
МК типу 1 може бути вродженою — порушення мезодерми, що проявляється недостатніми розмірами задньої черепної ямки [5, 6], і набутою — унаслідок тривалого функціонування люмбоперитонеальних шунтів [7], пухлин задньої черепної ямки [8], родової травми [9]. Мальформація Кіарі типу 1.5 визначається як ектопія мигдаликів мозочка з додатковим каудальним опущенням стовбура головного мозку через великий потиличний отвір [10] (рис. 2).
Захворювання може перебігати безсимптомно при значному опущені мигдаликів, і навпаки, пацієнти можуть мати виражені симптоми при мінімальній дислокації мозкових структур. Домінуючими симптомом у більшості пацієнтів є потиличний головний біль, що посилюється при фізичних навантаженнях [3], біль у шиї, порушення координації, запаморочення [11]. За даними літератури, порушення дихання, центральні апное, синкопи, кашльові синкопи мають місце в 4–20 % пацієнтів із МК [15].
Сирингомієлія, як правило, є причиною таких симптомів, як порушення чутливості й зниження м’язової сили в кінцівках, дисфагія, загальна слабкість. Дані симптоми при прогресуванні захворювання й відсутності лікування можуть значно вплинути на якість життя [3, 12, 13].
Існують декілька теорій, що пояснюють виникнення сирингомієлії при МК типу 1. Згідно з даними досліджень Williams, центральний канал розширюється через різницю тисків всередині спинного мозку й навколо нього, в субарахноїдальному просторі [24, 25]. Gardner пояснює появу сирингомієлітичної кісти гідродинамічною гіпотезою: прогресуюча кістозна дилатація спинного мозку є наслідком артеріальної пульсації ліквору, що у випадку перешкоджання току ліквору з ІV шлуночка у велику потиличну цистерну створює тиск на стінки центрального каналу спинного мозку [24, 26]. У нормі коли кожен гідродинамічний удар лікворної хвилі нівелюється у великій потиличній цистерні, центральний канал облітерується ще в дитинстві. Однак Milhorat і співавт., вивчаючи гістологічні препарати спинного мозку із сирингомієлітичними кістами, виявили, що більшість кіст, пов’язаних із МК, не були безпосередньо сполучені з ІV шлуночком — центральний канал був стенозований, мала місце ізольована кіста в спинному мозку. Детальніше вивчення показало, що існує незначний зв’язок між субарахноїдальним простором навколо спинного мозку і центральним каналом, через який відбувається доцентровий рух рідини внаслідок пульсації артерій, що призводить до появи сирингомієлітичних порожнин у спинному мозку.
Магнітно-резонансну томографію (МРТ) для діагностики МК уперше було використано Aboulezz у 1985 році. У 1992 році Mikulis на основі результатів МРТ-досліджень клінічно здорових людей різних вікових груп (від 5 місяців до 89 років) виявив, що положення мигдаликів у нормі істотно варіює залежно від віку. Для діагностики дистопії невральних структур задньої черепної ямки використовують такі краніометричні показники, як лінія Чемберлена, лінія Мак-Рея (пряма, що з’єднує basion и opisthion) (рис. 3). Встановлено, що ізольоване зміщення мигдаликів мозочка при МК 1-го типу не визначає прогноз, має значення тільки вираженість ліквородинамічних порушень, до яких призводить їх дистопія в поєднанні з іншими клінічними і МРТ-ознаками. У 1985 році Bergstand і співавтори вперше дослідили діагностику ліквородинамічних порушень методом МРТ з кардіосинхронізацією. Надалі нормальна ліквородинаміка вивчалась за допомогою фазово-контрастної МРТ.
/35.jpg)
Дослідження ліквородинаміки в пацієнтів з МК типу 1 за допомогою МРТ у режимі cine-mode було запропоновано в 1991 році Tominaga і співавт. Cine-mode — режим МРТ, який дозволяє оцінити рух рідини в будь-який момент серцевого циклу. Низка зображень зв’язуються і створюють коротке відео, що дає змогу оцінити ліквородинаміку. Oldfield у 1994 році за допомогою даної методики обстежив пацієнтів з МК типу 1 із супутньою сирингомієлією.
Для пацієнтів без симптомів захворювання або із симптомами, що не прогресують, виправдані очікувальна тактика й консервативне лікування. Консервативне лікування направлене на зняття суб’єктивних симптомів: біль голови й головокружіння за відсутності прогресування об’єктивної симптоматики. Неврологи нашого університету активно використовують у симптоматичному лікуванні препарат L-лізину есцинат. Згідно з даними клінічних досліджень, у пацієнтів із травматичним набряком мозку L-лізину есцинат ліквідує або значно зменшує явища набряку й набрякання головного мозку й мозкових оболонок, усуває стискання і зсув структур мозку, прискорює розсмоктування вогнищ контузії мозку, включно з їх геморагічним компонентом, ліквідує внутрішньочерепну гіпертензію. Препарат не тільки усуває всі ці явища, але й запобігає їх розвитку. Через виражену протинабрякову й венотонізуючу дію L-лізину есцинат дає можливість уникнути травматичного оперативного втручання, провести консервативне лікування й запобігти можливому розвитку різних ускладнень. Є дані, що підтверджують ефективність застосування L-лізину есцинату при лікуванні набряку мозку в пацієнтів з ішемічними порушеннями й пухлинним ураженням мозку. Препарат проявляє також аналгетичну дію при больовому синдромі травматичного генезу, включно з головними болями, сприяє швидкій резорбції травматичного набряку м’яких тканин голови, обличчя, кінцівок, тулуба. При лікуванні L-лізину есцинатом у посттравматичному періоді не було відмічено розвитку ускладнень запального характеру. Це дуже вигідно відрізняє препарат від кортикостероїдів. Для запобігання набряку спинного мозку або його зменшенню рекомендується застосовувати розчин L-лізину есцинату в пацієнтів з ускладненою травмою хребта в ранньому післяопераційному періоді. Досвід використання L-лізину есцинату свідчить про те, що препарат має високу ефективність у купіруванні проявів набряково-больового синдрому у хворих після операцій з приводу травм і захворювань опорно-рухового апарату, а також у пацієнтів з нейродистрофічним синдромом. Поряд із цим препарату властива добра переносимість, він не впливає на загальногомеостатичні функції організму. Рекомендується призначення L-лізину есцинату по 2 ампули на добу протягом 6–10 днів залежно від тяжкості захворювання й ефективності терапії. У цілому препарат значно розширює арсенал медикаментозного впливу на вираженість набряково-больового синдрому. Розчин L-лізину есцинату рекомендується вводити по 5–10 мл на добу строго внутрішньовенно (внутрішньоартеріальне введення не допускається). Максимальна добова доза — 25 мл. Курс лікування триває до досягнення стійкого клінічного ефекту, зазвичай він становить 6–10 діб. Наші спостереження показали його добрий ефект у пацієнтів із симптоматичною мальформацією Арнольда — Кіарі, але без сирингомієлії. Хірургічне лікування для них показане у випадку появи симптомів [14]. За наявності сирингомієлії і прогресування клінічної симптоматики основним методом лікування є оперативне втручання [22].
Особлива роль у становленні хірургії мальформації Кіарі типу 1 належить Gardner. В основі операції, запропонованої ним, лежить краніовертебральна декомпресія з відновленням шляху відтоку спинномозкової рідини з четвертого шлуночка. Серія наступних досліджень етіології, патогенезу й хірургічного лікування мальформації Кіарі типу 1 і «поєднаної сирингомієлії» проведена англійським нейрохірургом Bernard Williams. Основу його теоретичних поглядів становили роботи з вивчення циркуляції спинномозкової рідини на рівні цервікомедулярного переходу, які дозволили констатувати, що при МК типу 1 має місце клапанний механізм порушень ліквородинаміки, що обумовлює «виштовхування» флоконодулярного комплексу в шийно-потиличну воронку [23].
Декомпресія задньої черепної ямки (субокципітальна краніектомія) є найбільш поширеною операцією при МК типу 1. Для запобігання післяопераційній дислокації мозочка й довгастого мозку Batzdorf запропонував обмежити резекцію луски потиличної кістки до 3 × 3 см [16]. Розтин твердої мозкової оболонки виконується У- або Т-подібним розрізом [17, 18], однак з метою профілактики пролапсу мозку в кістково-дуральний дефект найбільш доцільним є виконання вертикального розрізу по середній лінії [19]. Виконують пластику твердої мозкової оболонки окістям або фрагментом широкої фасції [14]. Субокципітальну краніектомію зазвичай комбінують із пластикою твердої мозкової оболонки і ламінектомією на рівні С1, С1-С2 хребців [14]. При використанні методик, що обмежуються кістковою декомпресією, доцільно проводити поетапну оцінку ефективності виконуваної операції за допомогою інтраопераційного ультразвукового моніторингу [35]. За наявності в пацієнтів із МК сирингомієлії в низці випадків виконується дренування сирингомієлітичних кіст [20].
Матеріали та методи
Ретроспективно досліджені 24 пацієнти з мальформацією Кіарі типів 1 і 1.5, яким проведено оперативне лікування в умовах Обласного клінічного центру ней-рохірургії і неврології (ОКЦНН) м. Ужгорода у період з грудня 2006 року до грудня 2017 року. Пацієнти з МК типу 1.5 становили 54 %. Середній вік прояву захворювання — 36 років (8–65 років). Переважали особи жіночої статі — 62,5 %. Найбільш поширеною скаргою серед пацієнтів був потиличний головний біль, який зустрічався в 60 % випадків, головокружіння — в 40 %. Відмічалися скарги на нічні апное, порушення температурної і больової чутливості, порушення рівноваги, утруднене ковтання, слабкість у кінцівках (рис. 4).
Середня тривалість клінічних проявів становила 3,2 року (від 1 міс. до 10 років). За даними МРТ розміри ектопії мозкових структур сягали від 5,2 до 19 мм нижче від рівня великого потиличного отвору.
Оперативне втручання включало виконання декомпресійної краніектомії, у деяких випадках виконувалась ламінектомія на рівні С1 або С1-С2 хребців, пластика твердої мозкової оболонки (табл. 1).
За допомогою МРТ-обстеження шийного й грудного відділів спинного мозку в 10 з 24 хворих були виявлені супутні сирингомієлітичні кісти, що локалізувалися в шийному (40 %), шийно-грудному (40 %) й грудному (20 %) відділах спинного мозку (рис. 5).
Під час дослідження всіх хворих із МК було розподілено на 2 групи залежно від тривалості симптомів захворювання. І групу становили пацієнти з наявністю симптомів понад 3 роки. До цієї групи було віднесено 14 хворих, серед яких сирингомієлітичні кісти зустрічалися у 8 осіб (57 %). Тривалість симптомів у пацієнтів ІІ групи не перевищувала трьох років. ІІ групу становили 10 хворих, серед яких лише у 3 осіб (30 %) були виявлені сирингомієлітичні кісти.
Проаналізувавши скарги хворих із супутньою сирингомієлією в післяопераційному періоді із середнім терміном спостереження 5 років, встановили, що в усіх хворих відзначалося повне зникнення попередніх симптомів, пов’язаних із сирингомієлітичною кістою, або значне зниження їх інтенсивності. Така клінічна картина зумовлена регресом сирингомієлітичних кіст, що підтверджується даними післяопераційних МРТ-обстежень (рис. 6).
Пункційна евакуація вмісту сирингомієлітичної кісти додатково була виконана в 50 % пацієнтів. У всіх інших випадках регрес сирингомієлітичної кісти обумовлений адекватним хірургічним лікуванням мальформації Кіарі за рахунок усунення причини порушення ліквороциркуляції на рівні вертебромедулярного переходу.
Під час дослідження стан пацієнтів у післяопераційному періоді було оцінено за допомогою Chicago Chiari Outcome Scale (CCOS) (табл. 2), яка була розроблена й запропонована групою вчених Чиказького університету для стандартної оцінки результатів хірургічного лікування пацієнтів з мальформацією Кіарі у віддаленому періоді [36]. CCOS дозволяє оцінити 4 категорії (біль, небольові симптоми, функціональність і післяопераційні ускладнення). Для кожної категорії максимальний бал — 4, що свідчить про повний регрес болю й відсутність неврологічного дефіциту. Найвищий можливий сумарний бал — 16. За сумою отриманих результатів кожен пацієнт зараховується до групи improved (з покращенням), unchanged (без змін) або worse (з погіршенням) (I/U/W). Пацієнти, які досягли показників 13–16, належать до групи «І». Якщо сумарний показник пацієнтів варіює від 9 до 12, їх слід віднести до групи «U», при показниках CCOS від 4 до 8 — до групи «W».
Пацієнти були розподілені на чотири групи (А, В, С, D) за віком. Група А — пацієнти віком до 18 років, група В — від 19 до 30 років, група C — 31–50 років, група D — старші від 50 років. Пацієнти були протестовані у віддаленому післяопераційному періоді за допомогою CCOS (табл. 3). Середній термін спостереження становив 5 років.
Результати
Оцінивши групи A, B, C, D за CCOS, виявили, що пацієнти, які отримали оперативне лікування у віці до 18 років (група А), мають найвищий сумарний показник, що свідчить про значно кращі хірургічні результати пацієнтів молодого віку порівняно з іншими групами.
Прогностично при МК велике значення має не ізольоване зміщення мигдаликів, а вираженість ліквородинамічних порушень, до яких призводить дистопія невральних структур. Встановлено, що в пацієнтів із тривалістю симптомів захворювання понад 3 роки ризик утворення супутніх сирингомієлітичних кіст значно зростає і становить 57 %. У досліджених випадках останні були наявні в 10 пацієнтів.
При оперативних втручаннях у 50 % випадків пункція кісти не проводилась. Клінічно і за допомогою магнітно-резонансної томографії встановлено, що в післяопераційному періоді регрес сирингомієлітичних кіст спостерігався в усіх пацієнтів.
Важливе значення має доопераційне ведення пацієнта й встановлення правильного часу оперативного лікування до настання морфологічного дефекту головного мозку. В доопераційному періоді ми використовували L-лізину есцинат для зняття набряку та інколи — больового синдрому. Відповідно до схеми перед-, інтра- і післяопераційної терапії набряку мозку L-лізину есцинат застосовують по 10 мл за дві доби до операції, у день операції 10 мл — до видалення пухлини й 10 мл — після закінчення операції і початку самостійного дихання у хворого. Необхідно відзначити, що неврологічний дефіцит у пацієнтів, що перебувають у середньотяжкому стані, має тенденцію до регресу вже перед оперативним втручанням. Застосування L-лізину есцинату в цих хворих у передопераційному періоді та під час операції створює сприятливі умови для роботи ней-рохірургів. Інтраопераційно набряк мозку не розвивається, що дозволяє уникнути введення осмотичних і петльових діуретиків, кортикостероїдів, не застосовувати режим гіпервентиляції. У ранньому післяопераційному періоді протягом 2 діб хворим вводять 20 мл препарату, на 3-тю добу — 10 мл. Згідно з даними клінічних та інструментальних досліджень, проведених протягом 2 років, застосування L-лізину есцинату привело до зниження загальної летальності в пацієнтів з пухлинами головного мозку на 2,4 %, а післяопераційної летальності — на 3,9 %. L-лізину есцинат не тільки зменшує виражені явища набряку й набрякання головного мозку (за площею і ступенем), але й запобігає розвитку пасивного набряку мозку, збільшенню вогнища забитого місця, виникненню компресії, зсуву цистерн, шлуночкової системи і структур мозку, виникненню внутрішньочерепної гіпертензії [40].
/38_2.jpg)
Обговорення
Незважаючи на те, що проблема мальформації Кіарі є предметом вивчення й обговорення вже тривалий час, єдиного алгоритму діагностики, визначення показань, вибору методів і обсягу хірургічного лікування, оцінки його результатів не існує і до цього дня [35].
Клінічна значимість ліквородинамічних порушень при МК типу 1 обговорювалась у великій кількості робіт. На їх підставі було зроблено висновок, що вираженість клінічних проявів більшою мірою корелює зі ступенем порушення ліквородинаміки, ніж безпосередньо з дистопією мигдаликів мозочка. При цьому порушення ліквородинаміки може варіювати при однаковому ступені дистопії мигдаликів мозочка.
Отже, основним завданням при лікуванні МК і пов’язаної з ним сирингомієлії є відновлення нормальної ліквороциркуляції на рівні краніовертебрального переходу [21]. У дослідженнях Ventureyra та співавт. було встановлено, що всі хворі з мальформацією Кіарі з порушенням ліквородинаміки на рівні краніовертебрального переходу, засвідченим за допомогою МРТ у режимі сine-mode, мають кращі післяопераційні результати при виконанні субокципітальної декомпресії і дуропластики. Пацієнти, у яких ліквородинамічні порушення були відсутні, відчували значне покращення після декомпресії задньої черепної ямки [39]. Реконструкція анатомічної співмірності між кістковими й невральними структурами краніоцервікального зчленування й відновлення циркуляції спинномозкової рідини крізь отвори IV шлуночка в 90 % випадків дають позитивні результати лікування.
Під час нашого дослідження було виявлено, що в пацієнтів, яким не проводилось хірургічне втручання протягом трьох років і пізніше від початку проявів клінічної симптоматики, імовірність розвитку сирингомієлітичних кіст зростає. Проаналізувавши отримані дані, ми вважаємо, що раннє оперативне лікування є виправданим.
Шкала CCOS — сучасна шкала, яка створена з метою зниження суб’єктивності оцінки післяопераційних результатів пацієнтів із МК. Оцінка стану пацієнтів за даною шкалою у віддаленому післяопераційному періоді дала змогу встановити, що відновлення пацієнтів молодого віку є більш швидким.
Висновки
1. У пацієнтів з МК типів 1 і 1.5 і тривалістю захворювання понад 3 роки значно зростає імовірність розвитку лікворних порожнин у спинному мозку.
2. Оперативне лікування є ефективним методом корекції ліквородинамічних порушень, пункційна евакуація сирингомієлітичної кісти не є обов’язковою при хірургічних втручаннях.
3. Динаміка післяопераційного регресу ліквородинамічних порушень має вікову залежність і є більш сприятливою в осіб молодого віку.
Конфлікт інтересів. Не заявлений.
Отримано/Received 12.10.2021
Рецензовано/Revised 28.10.2021
Прийнято до друку/Accepted 03.11.2021
Список литературы
1. Klekamp J., Batzdorf U., Samii M., Bothe H.W. The surgical treatment of Chiari I malformation. Acta Neurochir. (Wien). 1996. 138. 788-801.
2. Menezes A.H. Chiari I malformations and hydromyelia: Complications. Pediatr. Neurosurg. 1991. 17. 146-154.
3. Milhorat T.H., Chou M.W., Trinidad E.M., Kula R.W., Mandell M., Wolpert C., Speer M.C. Chiari I malformation redefined: Clinical and radiographic findings for 364 symptomatic patients. Neurosurgery. 1999. 44. 1005-1017.
4. Castillo M., Wilson J.D. Spontaneous resolution of a Chiari I malformation: MR demonstration. Am. J. Neuroradiol. 1995 May. 16(5). 1158-60.
5. Badie B., Mendoza D., Batzdorf U. Posterior fossa volume and response to suboccipital decompression in patients with Chiari I malformation. Neurosurgery. 1995. 37. 214-218.
6. Marin-Padilla M., Marin-Padilla T.M. Morphogenesis of experimentally induced Arnold-Chiari malformation. J. Neurol. Sci. 1981. 50. 29-55.
7. Chumas P.D., Armstrong D.C., Drake J.M., Kulkarni A.V., Hoffman H.J., Humphreys R.P., Rutka J.T., Hendrick E.B. Tonsillar herniation: The rule rather than the exception after lumboperitoneal shunting in the pediatric population. J. Neurosurg. 1993. 78. 568-573.
8. Klekamp J., Samii M., Tatagiba M., Sepehrnia A. Syringomyelia in association with tumours of the posterior fossa: Pathophysiological considerations, based on observations on three related cases. Acta Neurochir. (Wien). 1995. 137. 38-43.
9. Williams B. Difficult labour as a cause of communicating syringomyelia. Lancet. 1977. 2. 51-53.
10. Kim I.-K., Wang K.-C., Kim I.-O., Cho B.-K. Chiari 1.5 Malformation: An Advanced Form of Chiari I Malformation. J. Corean Neurosurg. Soc. 2010 Oct. 48(4). 375-9.
11. Schanker B.D., Walcott B.P., Nahed B.V., Kahle K.R.T., Li Y.M., Coumans A.-V.C.E. Familial Chiari malformation: case series. Neurosurg. Focus. 2011. 31(3). E1.
12. Nohria V., Oakes W.J. Chiari I malformation: a review of 43 patients. Pediatr. Neurosurg. 1990. 16 (4–5). 222-227.
13. Strayer A. Chiari I malformation: clinical presentation and management. J. Neurosci Nurs. 2001. 33(2). 90-96, 104.
14. Гринберг М.С. Нейрохирургия. 5-е изд. Москва, 2010. С. 165-166.
15. Vadivelu S., Bolognese P., Milhorat T., Mogilne А. Occipital neuromodulation for refractory headache in the Chiari malformation population. Prog. Neurol. Surg. 2011. Vol. 24. P. 118-25.
16. Holly L.T., Batzdorf U. Management of cerebellar ptosis following craniovertebral decompression for Chiari I malformation. J. Neurosurg. 2001. Vol. 94. P. 21-26.
17. Batzdorf U., McArthur D.L., Bentson J.R Surgical treatment of Chiari malformation with and without syringomyielia: experience with 177 adult patients. J. Neurosurg. 2013. Vol. 118. P. 232-242.
18. Williams B. Pahogenesis of syringomyelia. Batzdorf (ed.) Syrinomyelia. Current concepts in diagnosis and treatment. Baltimore: Williams & Wilkins, 1991. P. 59-90.
19. Blagodatsky M.D., Larionov S.N., Alexandrov Y.A., Velm A.I. Surgical treatment of Chiari Malformation with or without syringomyelia. Acta Neurochir. (Wien). 1999. Vol. 141. P. Р. 963-968.
20. Кузбеков А.Р., Магжанов Р.В., Сафин Ш.М. Современные представления о мальформации Киари. Медицинский вестник Башкортостана. 2011. № 6 С. 118-125.
21. Sahuquillo J., Rubio E., Poca M.-A., Rovira A. Rodriguez-Baeza A., Cervera C. Posterior Fossa Reconstruction: A Surgical Technique for the Treatment of Chiari I Malformationand Chiari I/Syringomyelia Complex — Preliminary Results and Magnetic Resonance Imaging Quantitative Assessment of Hindbrain Migration. Clinical Study. Neurosurgery. Nov 1994. Vol. 35. № 5874.
22. Каххаров Р.А., Флегонтов А.Н., Мохов Н.В. Опыт использования различных вариантов пластики твердой мозговой оболочки в лечении больных с аномалией (мальформацией) Киари I типа. Вестник РГМУ. 2016. № 4.
23. Ларионов С.Н., Сороковиков В.А., Потапов В.Э. Мальформация Киари и современные аспекты диагностики и лечения. Бюллетень ВСНЦ СО РАМН. 2013. № 5(93).
24. Caban L., Bentson J. Considerations in the diagnosis and treatment of syringomyelia and the Chiari malformation. J. Neurosurg. 1982. Vol. 57. P. 24-31.
25. Levy W.J., Mason L., Hahn J. Chiari malformation presen-ting in adults: a surgical experience of 127 cases. J. Neurosurg. 1983. V. 12(2). P. 377-390.
26. Sakamoto H., Nishikawa M., Nakanishi N. et al. Surgical treatment of syringomyelia associated with Chiari malformation. Spinal Surg. (Jpn) 1994. Vol. 8. P. 1-6.
27. Макаров А.Ю., Холин А.В., Крицкая Л.А. Метод магнитно-резонансной томографии в диагностике сирингомиелии. Вопр. нейрохирургии. 1991. № 6. С. 18-21.
28. Парамонов Л.В. Кистография спинного мозга в определении тактики хирургического лечения сирингомиелий. Вопр. нейрохирургии. 1983. № 5. С. 8-12.
29. Благодатский М.Д., Ларионов С.Н., Шантуров В.А. Результаты лечения прогрессирующих форм сирингомиелии. Вопр. нейрохир. 1993. № 2. С. 8-10.
30. Благодатский М.Д., Суфианов А.А., Ларионов С.Н. и др. Трансплантация эмбриональной нервной ткани при сирингомиелии: первый клинический опыт. Вопр. нейрохир. 1994. № 3. С. 27-29.
31. Dyste G.N., Menezes A.H., VanGilder J.C. Symptomatic Chiari malformations. J. Neurosurg. 1989. Vol. 71. P. 159-168.
32. Klekamp J. Neurological deterioration after foramen magnum decompression for Chiari malformation Type I: old or new pathology? J. Neurosurg. Pediatrics. 2012. Vol. 10. P. 538-547.
33. Menezes A.H. Primary craniovertebral anomalies and the hindbrain herniation syndrome (Chiari I): data base analysis. Pediatr. Neurosurg. 1995. Vol. 23. P. 260-269.
34. Sgouros S., Kountouri M., Natarajan K. Posterior fossa volume in children with Chiari malformation type I. J. Neurosurg. (2 Suppl. Pediatrics). 2006. Vol. 105. P. 101-106.
35. Реутов А.А. Принципы диагностики и тактика хирургического лечения больных с мальформацией Киари I типа: дис… канд. мед. наук. Москва, 2012.
36. Yarbrough C.K., Greenberg J.K., Smyth M.D., Leonard J.R., Tae S.P., Limbrick D.D. External Validation of the Chicago Chiari Outcome Scale. J. Neurosurg. Pediatr. 2014 June. 13(6). 679-684. doi:10.3171/2014.3.
37. Иванов А.А. Клиника, диагностика и оперативное лечение мальформации Киари I типа в разных возрастных группах: дис… канд. мед. наук. СПб., 2016.
38. Gilmer H.S., Xi М., Young S.H. Surgical Decompression for Chiari Malformation Type I: An Age-Based Outcomes Study Based on the Chicago Chiari Outcome Scale. World Neosurg. 2017 Nov. 107. 285-290.
39. Ventureyra E.C., Aziz H.A., Vassilyadi M. The role of cine flow MRI in children with Chiari I malformation. Childs Nerv. Syst. 2003 Feb. 19(2). 109-13. Epub 2003 Jan 30. DOI: 10.1007/s00381-002-0701-1.
40. Сапон М.А., Спасіченко П.В. Застосування препарату L-лізину есцинат у нейрохірургії, неврології, травматології і ортопедії. Здоров’я України. 2015. № 3. С. 23-27.
/35.jpg)
/36.jpg)
/36_3.jpg)

/34.jpg)
/36_2.jpg)
/37.jpg)
/38.jpg)
/38_2.jpg)