Вступ
Інсульт залишається однією з найважливіших причин смерті й втрати працездатності в усьому світі, що призводить до тяжкого неврологічного дефіциту, такого як порушення функції ходьби, спричиняє потребу в постійній сторонній допомозі (приблизно у чверті тих, хто вижив після інсульту) та викликає інші функціональні та чутливі порушення, які заважають повсякденній діяльності, навіть у легких випадках інсульту [1–3]. Незважаючи на той факт, що рання нейрореабілітація досягла значного прогресу у відновленні моторних функцій і навичок у пацієнтів, які перенесли інсульт, особливо при використанні концепцій рухового навчання й компенсації, існує все ще дуже мало стратегій для покращання моторних порушень у підгострій фазі інсульту. Питання про те, наскільки фармакологічне втручання може вплинути на нейровідновлення після інсульту, залишається без остаточної відповіді. У галузі нейрореабілітації часто все ще бракує даних доказової медицини. Отже, потрібні рекомендації, засновані на доказах, для використання в клінічній практиці, щоб забезпечити розуміння питань, що стосуються прийняття клінічних рішень медичними працівниками, які працюють із хворими на інсульт. Незважаючи на те, що ранню нейрореабілітацію слід починати з гострішої фази інсульту, ці рекомендації базуються на ініціюванні фармакологічної підтримки у гострій фазі (перші 7 днів після інсульту) відповідно до нових стандартів у дослідженні відновлення після інсульту, проведеному Bernhardt і його колегами в 2017 році [1].
Метою цих рекомендацій щодо фармакологічної підтримки ранньої моторної реабілітації після гострого ішемічного інсульту було виявлення, узагальнення й оцінка наявної інформації з даної теми з використанням градацій оцінки, розробки й оцінювання рекомендацій (Grading of Recommendations Assessment, Development and Evaluation, GRADE) [4]. Ці рекомендації, засновані на доказах, розроблені спільно представниками Європейської академії неврології (EAN) і Європейської федерації нейрореабілітаційних товариств (EFNR).
Методи
Систематичний огляд був проведений з використанням рекомендацій з пріоритетних елементів звітування для систематичних оглядів і метааналізів (PRISMA) і кокранівського посібника для систематичних оглядів втручань. Рекомендації були розроблені з використанням системи GRADE. В аналіз були включені лише втручання, що відповідають вибраним питанням дослідження (табл. 1). Припущеннями, що визначали вибір критеріїв включення й виключення для розглянутих досліджень, були такі: (1) фармакологічне втручання в комплексі ранньої моторної реабілітації після гострого ішемічного інсульту повинно завжди проводитися лише як доповнення (а не конкурентний захід) до програми нейрореабілітації, і (2) з метою посилення ендогенної пластичності розпочинати лікування слід протягом перших 7 днів після розвитку інсульту згідно з останніми визначеннями й спільним баченням нових стандартів у дослідженнях відновлення після інсульту [1]. В аналіз були включені лише рандомізовані клінічні дослідження й порівняльні спостережні дослідження. Виключення втручань, які не відповідають цим критеріям, пояснюється лише відсутністю або неповною інформацією, що необхідна для обробки даних відповідно до вищезазначених наукових інтересів.
/64.jpg)
Систематичний пошук літератури
У PubMed, Cochrane Library та Embase проводили пошук статей, у яких наведені результати проспективних досліджень, включно з рандомізованими клінічними дослідженнями, контрольованими дослідженнями й спостережними дослідженнями. Пошук проводився з початку наявності відповідних досліджень у базі даних до 30 червня 2018 року й включав статті, що мали назву й резюме англійською мовою. Пошук у базі Embase фільтрували за результатами PubMed. Параметри пошуку були узгоджені між базами даних. Що стосується нових досліджень, що з’явилися після застосування пошукових обмежень, був проведений пізній аналіз чутливості досліджень за період з 1 липня 2018 року по 29 лютого 2020 року.
Оновлення рекомендацій
Ці рекомендації планується оновлювати за консенсусним рішенням групи, до складу якої входять голови робочої групи, голова наукової групи з нейрореабілітації EAN і представник наукового комітету EFNR. За умов появи нових доказів, що принципово змінять ці рекомендації, буде сформовано нову виробничу робочу групу, яка може включати членів початкової групи, і рекомендації буде оновлено відповідно до рекомендацій EAN [5]. Науковий комітет EAN регулярно перевірятиме дійсність опублікованих рекомендацій. Зазвичай комітет просить переглядати рекомендації кожні 5 років або в менший термін, якщо вважає це необхідним [6].
Вибір, вилучення й синтез доказів
До двоступеневого процесу скринінгу були залучені троє дослідників. У першому раунді двоє дослідників самостійно переглянули заголовки й тези, визначені в результаті пошуку літератури, і відкинули записи, що не відповідають критеріям включення. Якщо було неясно, чи відповідає дослідження критеріям включення, оцінювався повний текст відповідної статті. Будь-які розбіжності на цьому етапі вирішувалися консенсусом. У другому раунді повноцінний огляд вибраних досліджень щодо відповідності клінічному питанню й дотримання критеріїв включення був проведений незалежно двома дослідниками. Були включені лише дослідження, у яких подвійне втручання (реабілітаційне й фармакологічне) розпочато в гострій фазі інсульту (перші 7 днів включно [1]), виключалися будь-які випадки втручання в підгострому або в більш пізньому періоді. Реабілітація після інсульту була визначена відповідно до Міжнародної класифікації функціонування, інвалідності та здоров’я як будь-яка процедура, офіційно включена в дослідження, що аналізувалося, спрямована на сприяння оптимальному функціонуванню осіб, які перенесли інсульт, у їх взаємодії з навколишнім середовищем. Будь-які розбіжності на цьому етапі вирішувалися консенсусом. Якщо двоє дослідників не досягали консенсусу, залучали третього дослідника. Для вилучення даних була використана спеціальна електронна таблиця. Дані оцінювались на предмет придатності для проведення метааналізу. Усі виявлені втручання в роботах були асоційовані із системою анатомічно-терапевтично-хімічної класифікації (ATCC), включно з кодами класів лікарських засобів ATCC. Поодинокий випадок, що включав втручання, яке не можна класифікувати за цим методом, було позначено терапевтичним доменом.
Альтернативні шкали оцінки, що описують ті самі результати, були інтегровані з використанням стандартизованих середніх різниць (SMD), надаючи дані, доступні для об’єднання з різних шкал оцінок у заздалегідь визначеному домені.
Відповідно до підходу GRADE, коли для кожного клінічного питання можливі декілька результатів, було зроблено чітку оцінку важливості кожного результату для надання рекомендації, що супроводжується ранжируванням результатів за їх відносною важливістю. Ранні показники моторної функції через 1 і 3 місяці визначались як первинні й вторинні критичні результати відповідно при формулюванні рекомендацій щодо фармакологічної підтримки в ранній моторній реабілітації. Висновки щодо неврологічних функцій, загального функціонального результату через 1 і 3 місяці після інсульту та результатів щодо безпеки також повідомляються й враховуються в процесі створення рекомендацій. Для порівняння між усіма пацієнтами/популяцією, втручанням, порівнянням і результатами (ПВПР) та ідентифікованими дослідженнями шкали результатів групували на основі субдоменів клінічного питання ефективності (ранні моторні показники, неврологічна функція, загальний функціональний результат). Розподіл досліджень і класифікація шкал оцінки щодо усіх ПВПР проводили за допомогою форми Excel, де вся інформація, необхідна для аналізу даних, була вилучена й задокументована з першоджерел. Також були відібрані шкали з урахуванням їх важливості в рамках ПВПР на основі консультацій робочої групи перед систематичною статистичною оцінкою результатів.
Після цього етапу дослідження були підтверджені за допомогою перехресного підрахунку й перерахунку результатів разом з іншими стандартами й тестами. Важливою проблемою перевірки було те, що розміри ефектів, відносні ризики чи коефіцієнти шансів, про які повідомляється в роботах, у деяких випадках не можна було відтворити. У цих випадках результати реконструювали з використанням наявних додаткових даних. Якщо вирішення проблеми було неможливим, дослідження було виключено з цього етапу протоколу. Далі проводили процедуру синтезу відповідно до затвердженого протоколу. Будь-які розбіжності щодо включення окремих статей вирішувались консенсусом; якщо не було досягнуто згоди щодо включення дослідження, повнотекстове дослідження було надіслане третьому незалежному досліднику для винесення рішення. Перебіг процесу відбору даних стосовно кожного питання й причини виключення був повністю задокументований для максимальної прозорості. Дані з кожної включеної статті були вилучені двома членами робочої групи (дослідниками), які працювали самостійно й використовували форму вилучення, що була розроблена для дослідження. Кожне включене дослідження (крім якісних звітів про дослідження) оцінювалось на предмет відбору, результативності, виявлення, похибки й упередженості звітності та інших упереджень, які могли бути виявлені в процесі огляду [7]. Розбіжності щодо вилучених елементів, класифікації доказів або оцінки величини ефекту були вирішені консенсусом; якщо консенсус не був досягнутий, був залучений інший член робочої групи. Для кожного дослідницького питання основна група складала профілі доказів, що включали деталі оцінки якості, а також зведені (об’єднані) або не об’єднані дані результатів, абсолютний показник ефекту втручання, коли це доцільно, і короткий зміст якості доказів для кожного результату. Профілі доказів були розглянуті й затверджені всіма членами робочої групи.
Підсумки якості доказів для кожного результату
Цільова група оцінювала загальну якість доказів окремо, враховуючи кожен результат під час досліджень [4, 5]. Відповідні докази були зібрані в підсумковій таблиці висновків, що включала кожний відповідний результат, з використанням програмного забезпечення Revman (версія 5.3, Cochrane Collaboration) для детальних описів і програмного забезпечення GRADEpro (версія 3.6, робоча група GRADE) для зведеного огляду.
Формулювання рекомендацій
Останнім кроком був перехід від доказів до рекомендацій. Визначення спрямованості й сили рекомендацій базувалося на інтерпретації наявних доказів робочою групою: баланс між бажаними й небажаними критичними результатами визначав напрямок рекомендації.
Було застосовано підхід у два раунди [5]. У першому раунді було розглянуто напрямок кожної рекомендації (метою було досягти найбільшої користі при найменшій шкоді), що передбачає судження про баланс між бажаними й небажаними ефектами. У другому раунді була визначена сила кожної рекомендації (тобто ступінь впевненості, що бажані ефекти переважають небажані, беручи до уваги чотири детермінанти: якість доказів, баланс між бажаними й небажаними ефектами, цінності й уподобання пацієнта). Консенсус щодо кожної рекомендації був досягнутий за допомогою методу Дельфі з метою мінімізації упереджень, які можуть бути обумовлені груповою динамікою або домінуючими особистостями [8]. Метод Дельфі передбачає анонімне голосування, обговорення, групові відгуки й статистичний аналіз відповідей. Для забезпечення повної анонімності протягом усього процесу голосування була розроблена комп’ютеризована система з кодованим завантаженням сервера, що запобігає будь-якому окремому розголошенню інформації під час виробничого процесу. На кожному раунді члени робочої групи самостійно завантажували анонімно заповнену анкету. Форма реєстру інтересів EAN, що фіксує відповідну фінансову діяльність, і додатково запроваджена форма реєстру участі в навчанні, яка фіксує потенційні інтелектуальні конфлікти, визначали право голосу за кожне втручання. За конкретні втручання голосували лише члени, які не мали конфлікту інтересів. На кожному раунді помічник надавав анонімне резюме висновків робочої групи з попереднього раунду, і були визначені ділянки розбіжностей. Членам, що брали участь у голосуванні, було запропоновано анонімно переглянути свої попередні відповіді у світлі відповідей інших членів робочої групи. Після досягнення консенсусу в припущеннях і обґрунтуваннях усі рішення були чітко обговорені. Якщо розбіжності все ще існували, їх характер і ступінь враховувались і пояснювались у рекомендаціях.
Результати
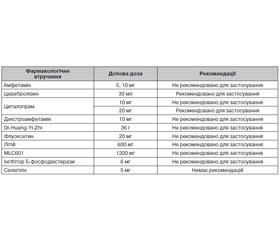
Наш систематичний пошук дав 57 001 результат у всіх базах даних, з яких 17 969 унікальних записів було вручну перевірено щодо критеріїв включення. Для метааналізу були відібрані дослідження, у яких використовувалися: амфетамін (5, 10 мг/добу перорально), Церебролізин (30 мл/добу внутрішньовенно, мінімум 10 днів), циталопрам (10, 20 мг/добу перорально), декстроамфетамін (10 мг/добу перорально), Di-Huang-Yi-Zhi (2 × 18 г/добу перорально), флуоксетин (20 мг/добу перорально), літій (2 × 300 мг/добу перорально), MLC601 (3 × 400 мг/добу перорально), інгібітор 5-фосфодіестерази PF-03049423 (6 мг/добу перорально), селегілін (5 мг/добу перорально). Результати наведені в табл. 2.
Амфетамін
Рання моторна активність (1-й місяць, 3-й місяць)
В одному дослідженні (N = 33) порівнювали амфетамін зі стандартним/звичайним лікуванням за допомогою шкали Фугля-Меєра (ФМ) для оцінки функції верхніх кінцівок через 1 місяць після інсульту [9]. Дані низького ступеня доказовості, отримані в рандомізованому дослідженні, свідчать про незначну різницю між групами. Показник функції верхніх кінцівок за шкалою ФМ у групі прийому амфетаміну був на 2,4 вищим (95% довірчий інтервал [ДІ] 16,27–21,07), SMD 0,09 (95% ДІ від –0,60 до 0,77). У двох рандомізованих дослідженнях [9, 10] (N = 69) через 3 місяці після інсульту порівнювали показники рухової активності, використовуючи різні шкали ФМ у пацієнтів, які приймали амфетамін, і в пацієнтів, у яких застосовували тільки стандартний/звичайний комплекс лікування; не встановлено будь-якої різниці між групами (доказові дані низької якості з метааналізу; SMD –0,01; 95% ДІ від –0,49 до 0,46).
Неврологічні функції (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 33) порівнювали амфетамін зі стандартним/звичайним лікуванням за допомогою Скандинавської шкали інсульту (СШІ) через 1 місяць після інсульту [9]. Дані низького ступеня доказовості свідчать про незначну різницю між групами, показники за СШІ в групі амфетаміну були на 1,1 нижчими (95% ДІ від –10,25 до 8,05), SMD –0,08 (95% ДІ від –0,76 до 0,60). Через 3 місяці після інсульту показник за СШІ у тому ж дослідженні був на 1,8 вищий (95% ДІ від –6,99 до 10,59; докази низької якості), SMD 0,14 (95% ДІ від –0,55 до 0,82).
Глобальний функціональний результат (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 33) порівнювали амфетамін зі стандартним/звичайним лікуванням за допомогою індексу Бартел через 1 місяць після інсульту [9]. Дані низького ступеня доказовості свідчать про незначну різницю між групами; індекс Бартел у групі амфетаміну був на 1,0 вище (95% ДІ від –3,52 до 5,52), SMD 0,15 (95% ДІ від –0,54 до 0,83). У двох дослідженнях через 3 місяці після інсульту (N = 69) порівнювали групу амфетаміну з групою, у якій використовували стандартне/звичайне лікування, за допомогою індексу Бартел. Докази низького ступеня доказовості в метааналізі свідчать про незначну різницю в групах; індекс Бартел був вищим на 0,58 (95% ДІ від –4,22 до 5,37), SMD –0,08 (95% ДІ від –0,55 до 0,40).
Серйозні побічні ефекти (СПЕ)
Дані низького ступеня доказовості у двох рандомізованих дослідженнях [9, 10] (N = 69) не вказують на різницю між групами щодо кількості пацієнтів із СПЕ (контрольна група — 4/35; група прийому амфетаміну — 3/34; співвідношення шансів [OR] 0,65; 95% ДІ 0,13–3,38).
Клінічна рекомендація
Мінімальні ефекти. Наявні докази свідчать про відсутність проблем з безпекою. Додаткова інформація, отримана на основі доказів, які не були предметом цієї рекомендації, свідчить про необхідність обережного використання амфетаміну [11] через слабкі або неодно-значні профілі безпеки й переносимості.
На основі доказів низької якості й спостережуваної неповноцінності щодо вторинного критичного результату надається рекомендація слабкого рівня доказовості щодо застосування амфетаміну в пацієнтів на етапі ранньої моторної нейрореабілітації. З огляду на низький загальний обсяг вибірки (N = 69) майбутні дослідження можуть змінити цю рекомендацію.
Церебролізин
Рання моторна активність (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 203) порівнювали Церебролізин зі стандартним/звичайним лікуванням через 1 місяць після інсульту, використовуючи тест оцінки функції верхньої кінцівки (Action Research Arm Test, ARAT) [12]. Середній вихідний показник за ARAT у контрольній групі становив 10,7 (16,5). Дані високого ступеня доказовості, отримані в цьому дослідженні, вказували на сприятливі (статистично вірогідні) ефекти Церебролізину щодо покращання показника за ARAT — на 0,5 SD більше (SMD 0,5; 95% ДІ 0,20–0,80), OR 2,35 (95% ДІ 1,43–4,04). Дані низького ступеня доказовості в метааналізі двох досліджень через 3 місяці після інсульту (N = 442) продемонстрували сприятливі (статистично невірогідні) ефекти щодо покращання показника за ARAT — на 0,44 SD більше (SMD 0,44; 95% ДІ від –0,22 до 1,11), OR 2,12 (95% ДІ 0,68–6,59) [13].
Неврологічні функції (1-й місяць, 3-й місяць)
У чотирьох рандомізованих дослідженнях (N = 542) порівнювали Церебролізин зі стандартним/звичайним лікуванням через 1 місяць після інсульту за допомогою шкали інсультів Національного інституту здоров’я (NIHSS) [12–15]. Середнє базове значення за NIHSS у контрольних групах становило 9,6 (SD 3,6). Метааналіз чотирьох досліджень з високим рівнем доказовості показав сприятливі (статистично вірогідні) ефекти з покращанням (зменшенням) показника за NIHSS — у групі Церебролізину покращання було на 0,40 SD більшим, ніж у контрольній групі (SMD –0,40; 95% ДІ від –0,62 до –0,18), OR 1,94 (95% ДІ 1,35–2,77). Дані високого рівня доказовості в метааналізі двох рандомізованих досліджень через 3 місяці після інсульту (N = 248, середнє значення NIHSS 10,0; SD 3,2) продемонстрували сприятливі (статистично вірогідні) ефекти з покращанням NIHSS на 0,77 SD більше в групі Церебролізину порівняно з контрольною групою (SMD –0,77; 95% ДІ від –1,15 до –0,38), OR 3,67 (95% ДІ 1,89–7,13) [12, 14].
Глобальний функціональний результат (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 59) порівнювали Церебролізин зі стандартним/звичайним лікуванням через 1 місяць після інсульту, використовуючи модифіковану шкалу Ренкіна (mRS) [15]. Дані середнього ступеня доказовості вказували на сприятливий (статистично вірогідний) вплив на глобальний функціональний результат. Покращання (зменшення) показника mRS у групі пацієнтів, що отримували Церебролізин, було в середньому на 0,88 SD більшим (SMD –0,88; 95% ДІ від –1,46 до –0,31), ніж у конт-рольній групі; OR становив 4,52 (95% ДІ 1,88–14,93). Докази високої якості, отримані в дослідженні через 3 місяці після інсульту (N = 205), показали сприятливі (статистично вірогідні) ефекти щодо покращання mRS на 0,88 SD більше в групі Церебролізину порівняно з контрольною групою (SMD –0,88; 95% ДІ від –1,20 до 0,57), OR 4,52 (95% ДІ 2,72–8,23) [12].
Серйозні побічні ефекти
Докази середньої якості, отримані в чотирьох рандомізованих дослідженнях [12, 13, 15, 16] (N = 578), не продемонстрували різницю між групами щодо кількості пацієнтів із СПЕ (контрольна група — 13/289; група Церебролізину — 12/289; OR 0,92, 95% ДІ 0,41–2,05).
Пізній аналіз чутливості
Рost hoc аналіз чутливості з виключенням одного рандомізованого дослідження [13] внаслідок виявлення відсутньої первинної публікації (дослідження було опубліковане лише як частина метааналізу) змінив рівень доказовості щодо ПВПР 1a (рання моторна активність через 3 місяці після інсульту) від низького до високого. Через 3 місяці якісні докази, отримані в одному дослідженні (N = 205), показали сприятливі (статистично вірогідні) ефекти щодо покращання показника за ARAT — на 0,79 SD більше (SMD 0,79; 95% ДІ 0,45–1,13), OR 3,85 (95% ДІ 2,23–7,28). Виключення цього дослідження не змінило рівень доказовості для інших ПВПР.
Клінічна рекомендація
Докази, визначені в цій рекомендації, вказують на відсутність проблем з безпекою використання препарату. Додаткова інформація, отримана на основі доказів, які не були предметом цієї рекомендації, свідчить про посилення ефекту Церебролізину в середньотяжких випадках інсульту [17]. З огляду на спосіб введення препарату додавання Церебролізину в комплекс терапії має бути пріоритетним у випадках інсульту середнього й тяжкого ступеня (NIHSS > 8).
На основі доказів низької і високої якості щодо первинних і вторинних критичних результатів надається слабка рекомендація щодо призначення Церебролізину (30 мл внутрішньовенно, мінімум 10 днів) для ранньої моторної нейрореабілітації після інсульту середнього й тяжкого ступеня.
Циталопрам 10 мг
Рання моторна активність (1-й місяць, 3-й місяць)
В одному невеликому рандомізованому дослідженні (N = 20) порівнювали використання циталопраму в дозі 10 мг із стандартним/звичайним лікуванням через 1 місяць після інсульту за допомогою шкали Ліндмарка (ШЛ) [18]. Середній вихідний показник за ШЛ у конт-рольній групі становив 54. Докази низької якості, отримані в одному дослідженні, вказують на сприятливий (але не статистично вірогідний) ефект. Показник за ШЛ у групі застосування циталопраму в дозі 10 мг був на 4,0 вищим (95% ДІ від –4,77 до 12,77), SMD 0,38 (95% ДІ від –0,50 до 1,27). Оцінок результатів через 3 місяці після інсульту не наведено.
Неврологічні функції (1-й місяць, 3-й місяць)
В одному невеликому рандомізованому дослідженні (N = 20) порівнювали використання циталопраму в дозі 10 мг зі стандартним/звичайним лікуванням через 1 місяць після інсульту за допомогою NIHSS [18]. Середнє базове значення за NIHSS у контрольній групі становило 5,3 [18]. Докази низької якості, отримані в дослідженні, свідчать про сприятливий (але не статистично вірогідний) ефект (NIHSS у групі використання циталопраму в дозі 10 мг був на 1,2 нижчим [95% ДІ від –2,68 до 0,28], SMD –0,68 [95% ДІ від –1,59 до 0,23]). Оцінок результатів через 3 місяці після інсульту не наведено.
Глобальний функціональний результат (1-й місяць, 3-й місяць)
В одному невеликому рандомізованому дослідженні (N = 20) порівнювали ефекти циталопраму в дозі 10 мг зі стандартним/звичайним лікуванням через 3 місяці після інсульту за допомогою індексу Бартел [18]. Середнє значення базового рівня індексу Бартел у контрольній групі становило 60. Докази низької якості, отримані в дослідженні, вказують на несприятливий (не статистично вірогідний) ефект (індекс Бартел у групі циталопраму в дозі 10 мг був на 7,0 вищим [95% ДІ від –16,27 до 30,27], SMD 0,25 [95% ДІ від –0,63 до 1,13]). Оцінок результатів через 1 місяць після інсульту не наведено.
Серйозні побічні ефекти
Не проводилося жодної оцінки щодо пацієнтів із СПЕ. У жодній групі не доповідалося про будь-які серйозні, виражені побічні події (одне невелике дослідження з N = 20).
Клінічна рекомендація
Ефект від мінімального до більше ніж слабкого. Докази вказують на відсутність проблем з безпекою застосування препарату.
На підставі низької якості доказів і відсутніх оцінок щодо пацієнтів із СПЕ дається слабка рекомендація щодо застосування циталопраму в дозі 10 мг для ранньої моторної нейрореабілітації після гострого ішемічного інсульту. З огляду на низький загальний обсяг вибірки і лише одне дослідження (N = 20) майбутні дослідження можуть змінити цю рекомендацію.
Циталопрам 20 мг
Рання моторна активність (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 123) порівнювали циталопрам у дозі 20 мг із стандартним/звичайним лікуванням, використовуючи субшкалу NIHSS для оцінки моторної функції верхньої кінцівки через 1 місяць після інсульту [19]. Середній базовий показник за субкшкалою NIHSS у контрольній групі становив 2,21. Докази середньої якості, отримані в дослідженні, вказують на більше ніж невелику різницю між групами щодо показника за субшкалою оцінки моторної функції верхньої кінцівки в групі прийому циталопраму в дозі 20 мг, що на 0,37 нижче порівняно з контрольною групою (95% ДІ від –0,71 до –0,03), SMD –0,38 (95% ДІ від –0,74 до –0,03). Через 3 місяці різниця між групами в тому ж дослідженні становила –0,57 (95% ДІ від –0,86 до –0,28) із SMD –0,69 (95% ДІ від 1,06 до –0,33). Результати (статистично вірогідні), отримані через 1 місяць і через 3 місяці після інсульту, слід інтерпретувати з належною обережністю через неточність субшкали NIHSS для оцінки рухової функції верхньої кінцівки, існуючі базові відмінності, що сприяють втручанню, і нечітку обробку результатів тих, хто вибув (15 %).
Неврологічні функції (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 123) порівнювали циталопрам у дозі 20 мг зі стандартним звичайним лікуванням через 3 місяці після інсульту, використовуючи показники пацієнтів, у яких спостерігалося принаймні 50% покращання за NIHSS [19]. Докази середньої якості, отримані в цьому дослідженні, вказували на позитивний ефект у вигляді 79 % сприятливих результатів у групі прийому циталопраму в дозі 20 мг порівняно з 54 % сприятливих результатів у контрольній групі (різниця ризику [RD] 0,25; 95% ДI 0,10–0,40; відносний ризик [RR] 1,46; 95% ДІ 1,15–1,86).
Глобальний функціональний результат (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 123) порівнювали циталопрам у дозі 20 мг зі стандартним/звичайним лікуванням через 1 місяць після інсульту, використовуючи показники, отримані в пацієнтів з покращеним балом за шкалою mRS (0–2) [19]. Докази середньої якості, отримані в дослідженні, вказували на позитивний ефект у вигляді 58 % сприятливих результатів у групі прийому циталопраму в дозі 20 мг порівняно з 32 % у конт-рольній групі (РD 0,26; 95% ДІ 0,08–0,43; РР 1,80; 95% ДІ 1,15–2,81). Через 3 місяці різниця між групами становила 22,93 (95% ДІ 11,13–34,73) із SMD 0,97 (95% ДІ 0,43–1,51).
Серйозні побічні ефекти
Не проводилося жодної оцінки щодо СПЕ (немає інформації про СПЕ у двох дослідженнях із загальним N = 786).
Пізній аналіз чутливості
Рання моторна активність (3-й місяць)
В одному рандомізованому дослідженні (N = 60) порівнювали циталопрам у дозі 20 мг зі стандартним/звичайним лікуванням через 3 місяці після інсульту за допомогою рухової шкали ФМ [20]. Отримані дані свідчили про сприятливі ефекти (статистично вірогідні), коли показник за руховою шкалою ФМ був на 22,93 вищим (95% ДІ 11,13–34,73) із SMD 0,97 (95% ДІ 0,43–1,51). Докази середньої якості, отримані за результатами post hoc метааналізу двох доступних досліджень [19, 20] щодо моторних показників за 3 місяці, включно з пізнім включенням досліджень, показали відповідні (статистично вірогідні) розбіжності між групами із SMD 0,78 (95% ДІ 0,48–1,08). Рівень доказовості був знижений на 1 бал через неточність моторної підшкали, існуючі базові відмінності й нечітку обробку результатів осіб, які вибули (15 %), в одному з двох досліджень.
Глобальний функціональний результат (1-й місяць)
В одному з пізніх рандомізованих досліджень у пацієнтів з легким інсультом (N = 642) порівнювали ефекти циталопраму в дозі 20 мг зі стандартним/звичайним лікуванням через 1 місяць після інсульту, використовуючи показник пацієнтів зі сприятливим балом mRS (0–2) [20]. Отримані дані не свідчили про перевагу препарату — у групі прийому циталопраму в дозі 20 мг зареєстровано 67 % сприятливих результатів, у контрольній групі — 78 % (RD –0,11; 95% ДІ від –0,18 до –0,04; RR 0,86; 95% ДІ 0,78–0,95). Дані низької якості, отримані після метааналізу двох досліджень [19, 20] щодо сприятливого показника mRS (0–2), включно з пізнім дослідженням, вказували на незначні групові відмінності з RD –0,06; 95% ДІ від –0,12 до 0,01; RR 0,92; 95% ДІ 0,84–1,02. Існувала виражена гетерогенність двох досліджень з I2 = 93 %. Рівень доказовості був знижений на 2 бали через неточність і виражену гетерогенність (I2 = 93 %).
Клінічна рекомендація
Немає вірогідної інформації про СПE. Загальний профіль безпеки свідчить про добру переносимість.
На основі доказів середньої якості щодо сприятливого впливу на критичні результати дається слабка рекомендація щодо застосування циталопраму в дозі 20 мг для ранньої моторної нейрореабілітації після гострого ішемічного інсульту.
Декстроамфетамін
Рання моторна активність (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 67) порівнювали декстроамфетамін зі стандартним/звичайним лікуванням через 1 місяць після інсульту за допомогою шкали ФМ [21]. Середній базовий бал за шкалою ФМ у контрольній групі становив 30,0. Докази низької якості, отримані в дослідженні, вказують на граничну різницю між групами при тому, що в групі декстроамфетаміну показник за шкалою ФМ на 1,0 вищий (95% ДІ від –6,43 до 8,43) із SMD 0,06 (95% ДІ від –0,42 до 0,44). Через 3 місяці в цьому ж дослідженні не було виявлено різниці між групами, показник за шкалою ФМ був на 0,4 нижчим у групі декстроамфетаміну (95% ДІ від –8,35 до 7,55) із SMD –0,02 (95% ДІ від –0,50 до 0,46).
Неврологічні функції (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 67) порівнювали декстроамфетамін зі стандартним/звичайним лікуванням через 1 місяць після інсульту за допомогою шкали активності верхніх кінцівок і кистей Chedoke (CAHAI) [21]. Докази низької якості в цьому дослідженні не свідчать про сприятливий ефект, при цьому показник за CAHAI у групі декстроамфетаміну на 6,2 нижчим (95% ДІ від –18,84 до 6,44), SMD –0,23 (95% ДІ від –0,71 до 0,25). Через 3 місяці показник балансу за шкалою ФМ у тому ж дослідженні вказував на незначну різницю між групами з показником, на 0,2 вищим у групі декстроамфетаміну (95% ДІ від –1,05 до 1,45) із SMD 0,08 (95% ДІ від –0,40 до 40,56).
Глобальний функціональний результат (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 67) порівнювали декстроамфетамін зі стандартним/звичайним лікуванням через 1 місяць після інсульту за допомогою шкали функціональної незалежності (ШФН) [21]. Середнє базове значення за ШФН становило 67,3. Докази низької якості в одному дослідженні вказують на незначну різницю між групами з показником за ШФН, на 3,7 нижчим у групі декстроамфетаміну (95% ДІ від –11,78 до 4,38), із SMD –0,22 (95% ДІ від –0,70 до 0,26). Через 3 місяці оцінка за ШФН у тому ж дослідженні продемонструвала незначну різницю між групами з показником балансу за ШФН, на 1,3 нижчим у групі декстроамфетаміну (95% ДІ від –8,87 до 6,27), із SMD –0,08 (95% ДІ від –0,56 до 0,40).
Серйозні побічні ефекти
Не проводилося жодної оцінки СПЕ. Повідомлялося, що досліджуваний препарат добре переноситься.
Клінічна рекомендація
Мінімальні ефекти, включно зі шкодою. Додаткова інформація, отримана на основі доказів, які не були предметом цієї рекомендації, свідчить про обережне використання декстроамфетаміну через слабкі або неоднозначні профілі безпеки й переносимості [22].
На основі низької якості доказів і відсутності впливу на критичні результати дається слабка рекомендація не використовувати декстроамфетамін для ранньої моторної нейрореабілітації після гострого ішемічного інсульту.
Di-Huang-Yi-Zhi (DHYZ)
Рання моторна активність (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 87) порівнювали DHYZ зі стандартним/звичайним лікуванням через 1 місяць після інсульту за допомогою шкали ФМ [23]. Середній базовий бал за ФМ у контрольній групі становив 51,0. Докази низької якості в даному дослідженні вказували на незначну різницю між групами, показники за шкалою ФМ у групі DHYZ були на 1,2 нижчими (95% ДІ від –6,42 до 4,02), SMD –0,10 (95% ДІ від –0,52 до 0,32). Через 3 місяці докази середньої якості в тому самому дослідженні вказували на сприятливі ефекти з показниками за шкалою ФМ, на 6,50 вищими у групі DHYZ (95% ДІ 0,73–12,27), SMD 0,47 (95% ДІ 0,04–0,90).
Неврологічні функції (1-й місяць, 3-й місяць)
Немає даних про оцінку неврологічної функції DHYZ у пацієнтів з гострим ішемічним інсультом.
Глобальний функціональний результат (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 87) порівнювали DHYZ із стандартним/звичайним лікуванням через 1 місяць після інсульту з використанням індексу Бартел [23]. Середнє значення індексу Бартел на базовому рівні в контрольній групі становило 51,0. Докази низької якості свідчать про зниження індексу Бартел у групі DHYZ порівняно з контрольною групою (індекс Бартел у групі DHYZ був на 3,7 нижчим [95% ДІ від –8,38 до 0,98] при SMD –0,33 [95% ДІ від –0,75 до 0,10]). Докази середньої якості (статистично вірогідні) через 3 місяці вказували на сприятливі ефекти — індекс Бартел був на 4,5 вищий у групі DHYZ порівняно з контрольною групою (95% ДІ 0,24–8,76), SMD 0,44 (95% ДІ 0,01–0,87).
Серйозні побічні ефекти
Дані низької якості, отримані в одному рандомізованому дослідженні [23] (N = 100), свідчать про відсутність різниці між групами — 0/50 подій у контрольній групі й 0/50 подій у групі DHYZ (коефіцієнт шансів не можна оцінити).
Клінічна рекомендація
Мінімальні й помірні ефекти, включно зі шкодою. Докази вказують на відсутність проблем з безпекою.
На основі доказів низької якості щодо негативного впливу на первинний критичний результат і докази помірної якості щодо сприятливого впливу на вторинний критичний результат дається слабка рекомендація не використовувати DHYZ для ранньої рухової нейрореабілітації після гострого ішемічного інсульту. З огляду на низький загальний обсяг вибірки (N = 87) подальші дослідження в майбутньому можуть змінити цю рекомендацію.
Флуоксетин
Рання моторна активність (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 113) порівнювали флуоксетин зі стандартним/звичайним лікуванням через 3 місяці після інсульту за допомогою шкали FM [24]. Середній базовий бал за шкалою FM у контрольній групі становив 13,4. Докази високої якості, отримані в дослідженні, вказували на сприятливий (статистично вірогідний) вплив на моторні показники, у групі флуоксетину бал за шкалою ФМ був на 9,7 вищим від вихідного рівня (95% ДІ 3,68–15,72) при SMD 0,59 (95% ДІ 0,21–0,97).
Неврологічні функції (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 113) порівнювали флуоксетин зі стандартним/звичайним лікуванням через 3 місяці після інсульту з використанням NIHSS (середнє базове значення NIHSS у контрольній групі становило 13,1) [24]. Докази низької якості вказували на сприятливий (але не статистично вірогідний) вплив на неврологічну функцію, причому показник за NIHSS у групі флуоксетину був на 1,1 нижчим (95% ДІ від –2,61 до 0,41), ніж у контрольній групі, SMD –0,27 (95% ДІ від –0,64 до 0,10).
Глобальний функціональний результат (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 113) порівнювали флуоксетин зі стандартним/звичайним лікуванням через 3 місяці після інсульту за допомогою mRS [24]. Докази низької якості свідчили про сприятливий (але не статистично вірогідний) вплив на глобальний функціональний результат. Показник mRS у групі флуоксетину в середньому був на 0,21 SD нижчим (–0,56; 0,14), ніж у контрольній групі; OR 1,43 (95% ДІ 0,79–2,66).
Серйозні побічні ефекти
Незважаючи на те, що було повідомлено про два СПE при використанні флуоксетину, кількість пацієнтів з СПЕ не була надана.
Пізній аналіз чутливості
Рання моторна активність (3-й місяць)
В одному рандомізованому дослідженні (N = 60) [25] порівнювали ефекти флуоксетину в дозі 20 мг зі стандартним/звичайним лікуванням через 3 місяці після інсульту за допомогою моторної оцінки за шкалою ФМ. Були вказівки на сприятливі ефекти (статистично вірогідні), при цьому показник за шкалою ФМ був вищим на 24,46 (95% ДІ 12,93–35,99), SMD 1,06 (95% ДІ 0,52–1,60). Докази високої якості post hoc метааналізу двох доступних рандомізованих досліджень [26, 27] щодо моторних показників за 3 місяці, включно з пізнім дослідженням, показали відповідні (статистично вірогідні) розбіжності в групах, причому показник за шкалою ФМ був на 20,89 вищий (95% ДІ 13,68–28,10), SMD 0,84 (95% ДІ 0,53–1,16).
Клінічна рекомендація
Результати нашого систематичного пошуку продемонстрували докази високої якості щодо сприятливого впливу флуоксетину на моторну активність і докази низької якості щодо неврологічної функції і загальних функціональних результатів. Немає вірогідних даних про СПE. Інформація, отримана на основі доказів, які не були предметом цієї рекомендації, свідчить про обережне використання флуоксетину [26–28] через слабкі або неоднозначні профілі безпеки й переносимості, включно з потенційно підвищеним ризиком переломів кісток, гіпонатріємії та епілептичних нападів.
Сукупні докази, отримані в результаті нашого систематичного пошуку (сприятливий вплив на моторну функцію через 1 і 3 місяці), та критичні результати досліджень поза заздалегідь визначеними ПВПР (загальний функціональний результат через 6 місяців, що вказує на відсутність ефекту флуоксетину при нейрореабілітації після гострого ішемічного інсульту, а також питання безпеки [26–28]) визначили слабку рекомендацію проти використання флуоксетину для ранньої моторної нейрореабілітації після гострого ішемічного інсульту.
Літій
Рання моторна активність (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 66) порівнювали літій зі стандартним/звичайним доглядом через 1 місяць після інсульту, використовуючи моторну підшкалу для оцінки функції верхньої кінцівки шкали ФМ (hFM) [29]. Середнє значення показника за hFM на вихідному рівні в контрольній групі становило 0,76. Докази низької якості свідчили про більше ніж невеликий корисний (але не статистично вірогідний) ефект. Показник за hFM у групі літію був на 0,84 вищим (95% ДІ від –0,17 до 1,85), SMD 0,40 (95% ДІ від –0,09 до 0,89). Щодо ефектів через 3 місяці після інсульту результати оцінки не наведені.
Неврологічні функції (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 66) порівнювали літій зі стандартним/звичайним лікуванням через 1 місяць після інсульту, використовуючи модифіковану шкалу NIHSS (mNIHSS) [29]. Середнє значення за mNIHSS на базовому рівні в контрольній групі становило 6,82. Докази низької якості свідчили про більше ніж невеликий корисний (але не статистично вірогідний) ефект при зниженні показника за mNIHSS у групі літію на 0,7 більше (95% ДІ від –1,55 до 0,15), SMD –0,40 (95% ДІ 0,89– 0,09). Результати через 3 місяці після інсульту не наведені.
Глобальний функціональний результат (1-й місяць, 3-й місяць)
Не було доступних оцінок загальних функціональних результатів.
Серйозні побічні ефекти
Дані низької якості, отримані в рандомізованому дослідженні [29] (N = 66), свідчать про відсутність різниці між групами — 0/34 подій у контрольній групі й 0/32 подій в групі літію (коефіцієнт шансів не можна оцінити).
Клінічна рекомендація
Через 1 місяць після інсульту наявні більше ніж незначні ефекти літію щодо ранньої моторної активності й неврологічної функції. Немає оцінок ефекту через 3 місяці після інсульту. Додаткова інформація, отримана на основі доказів, які не були предметом цієї рекомендації, свідчить про обережне використання літію [30] через слабкий або неоднозначний профіль безпеки й переносимості.
На основі доказів низької якості щодо сприятливих ефектів дається слабка рекомендація проти використання літію для ранньої моторної нейрореабілітації.
MLC601
Рання моторна активність (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 1061) порівнювали MLC601 зі стандартним/звичайним лікуванням через 3 місяці після інсульту за допомогою моторної шкали NIHSS [31]. Докази низької якості свідчили про незначну різницю між групами. Середня зміна показників за моторною шкалою NIHSS у групі MLC601 була на 0,17 більшою (95% ДІ від –0,55 до 0,21).
Неврологічні функції (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 1061) порівнювали MLC601 зі стандартним/звичайним лікуванням через 3 місяці після інсульту за допомогою NIHSS [31]. Середнє базове значення NIHSS у конт-рольній групі становило 8,6. Докази низької якості свідчили про незначну різницю між групами. Середнє зниження показника за NIHSS у групі MLC601 було в середньому на 0,46 більшим (95% ДІ від –1,26 до 0,34).
Глобальний функціональний результат (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 1061) порівнювали MLC601 зі стандартним/звичайним лікуванням через 3 місяці після інсульту за допомогою mRS [31]. Докази низької якості вказують про відсутність сприятливого впливу на глобальний функціональний результат. Показник за mRS у групі MLC601 був в середньому на 0,04 SD нижчим (95% ДІ від –1,74 до 1,02), ніж у контрольній групі; OR 1,06 (0,87–1,38).
Серйозні побічні ефекти
Докази середньої якості, отримані в рандомізованому дослідженні [31] (N = 1087), не свідчать про різницю між групами — 74/545 подій у контрольній групі й 60/542 подій у групі MLC601 (OR 0,79; 95% ДІ 0,55–1,14).
Клінічна рекомендація
Мінімальні ефекти. Докази вказують на відсутність проблем з безпекою.
На основі доказів низької якості, незначного ефекту препарату й відсутності доказів щодо первинного критичного результату дається слабка рекомендація проти використання MLC601 для ранньої моторної нейрореабілітації в пацієнтів з гострим ішемічним інсультом.
Інгібітор 5-фосфодіестерази PF-03049423
Рання моторна активність (1-й місяць, 3-й місяць)
Оцінка ранньої моторної активності не проводилася.
Неврологічні функції (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 137) порівнювали PF-03049432 зі стандартним/звичайним лікуванням через 3 місяці після інсульту, використовуючи показники пацієнтів, які мали 0 або 1 бал за NIHSS [32]. Докази низької якості не вказували на різницю між групами (RD –0,01; 95% ДІ від –0,16 до 0,14; RR 0,96; 95% ДІ 0,54–1,71).
Глобальний функціональний результат (1-й місяць, 3-й місяць)
В одному рандомізованому дослідженні (N = 1061) порівнювали PF-03049432 зі стандартним/звичайним лікуванням через 3 місяці після інсульту за допомогою mRS [32]. Докази низької якості свідчили про незначний корисний (не статистично вірогідний) вплив на глобальний функціональний результат. Показник mRS у групі PF-03049432 був у середньому на 0,11 SD нижчим (–0,45; 0,23), ніж у контрольній групі, з OR 1,20 (95% ДІ 0,67–2,17).
Серйозні побічні ефекти
Докази середньої якості, отримані в одному рандомізованому дослідженні [32] (N = 137), свідчать про відсутність різниці між групами — 18/67 подій у конт-рольній групі й 15/70 подій у групі PF-03049432 (OR 0,74; 95% ДІ 0,34–1,62).
Клінічна рекомендація
Не було ефекту або був лише незначний корисний ефект. Докази вказують на відсутність проблем з безпекою.
На основі доказів низької якості дається слабка рекомендація проти використання PF-03049432 для ранньої моторної нейрореабілітації. З огляду на низький загальний обсяг вибірки (N = 137) подальші дослідження в майбутньому можуть змінити цю рекомендацію.
Селегілін
Рання моторна активність (1-й місяць, 3-й місяць)
В одному невеликому рандомізованому дослідженні (N = 19) порівнювали селегілін зі стандартним/звичайним лікуванням через 1 місяць після інсульту за допомогою шкали ФМ [33]. Середнє базове значення в контрольній групі становило 55,3. Докази низької якості свідчать про відсутність сприятливого ефекту. Моторна активність за шкалою ФМ у групі селегіліну була на 12,8 нижчою (95% ДІ від –37,26 до 11,66) при SMD –0,46 (95% ДІ від –1,38 до 0,45). Через 3 місяці спостерігалася лише незначна різниця між групами (дані низької якості свідчили про підвищення показника за шкалою ФМ на 2,0 [95% ДІ від –17,21 до 21,21], SMD 0,10 [95% ДІ від –0,92 до 1,11]).
Неврологічні функції (1-й місяць, 3-й місяць)
В одному невеликому рандомізованому дослідженні (N = 19) порівнювали селегілін зі стандартним/звичайним лікуванням через 1 місяць після інсульту за допомогою СШІ [33]. Середнє вихідне значення в контрольній групі становило 38,9. Докази низької якості свідчать про відсутність сприятливого ефекту. Показник за СШІ у групі селегіліну був на 3,3 нижчим (95% ДІ від –10,94 до 4,34), SMD –0,38 (95% ДІ від –1,29 до 0,53). Через 3 місяці спостерігався більше ніж невеликий корисний (не статистично значущий) ефект (докази низької якості) — показник за СШІ був на 2,6 вищим (95% ДІ від –1,8 до 7,0), SMD 0,55 (95% ДІ від –0,49 до 1,59).
Глобальний функціональний результат (1-й місяць, 3-й місяць)
В одному невеликому рандомізованому дослідженні (N = 19) порівнювали селегілін зі стандартним/звичайним лікуванням через 1 місяць після інсульту за допомогою індексу Бартел [33]. Середнє вихідне значення в контрольній групі становило 43,5. Докази низької якості свідчать про відсутність сприятливого ефекту. Індекс Бартел у групі селегіліну був на 3,3 нижчим (95% ДІ від –33,0 до 26,4) при SMD –0,10 (95% ДІ від –1,00 до 0,81). Через 3 місяці спостерігався невеликий сприятливий (але не статистично вірогідний) ефект (докази низької якості) — індекс Бартел був вищим на 5,4 (95% ДІ від –16,82 до 27,62), SMD 0,23 (95% ДІ від –0,79 до 1,25).
Серйозні побічні ефекти
Хоча було повідомлено про п’ять СПЕ при використанні селегіліну і 10 СПЕ при використанні плацебо, кількість пацієнтів із СПЕ у двох групах лікування не повідомлялася.
Клінічна рекомендація
Нечіткі ефекти (середня перевага над середньою неповноцінністю) обумовлені доказами низької якості. Немає вірогідних даних щодо СПE.
На підставі низької впевненості щодо оцінок ефекту та інших непереконливих результатів не надаються рекомендації за або проти використання селегіліну для нейрореабілітації після гострого ішемічного інсульту, оскільки це було б спекулятивним з огляду на існуючі дані.
Обговорення
Нейровідновлення — це динамічний і багатофакторний процес, що є найбільш помітним у перші 30 днів після початку інсульту [2, 34].
Нейропластичність — це біологічна підтримка відновлення головного мозку, що залучає всі механізми реорганізації нейронів, включаючи синаптогенез, ріст дендритів, проростання аксонів, залучання нових анатомічних шляхів з функціями, подібними до пошкоджених, активацію функціональних, але «мовчазних» синапсів і генезу клітин [35]. Ці метаболічні, запальні й генетичні процеси відбуваються в певній послідовності залежно від часу, що минув з моменту початку інсульту. Поглиблене знання такої послідовності й взаємозв’язків між цими процесами є життєво важливим, оскільки різні фармакологічні й нефармакологічні методи лікування можуть зменшити інвалідність лише за умови їх застосування в потрібний час. Фармакологічне втручання може подолати інгібуючі механізми й стимулювати нейропластичність різними способами, починаючи від поведінки й закінчуючи експресією генів [24, 36]. Нейропластичність є центральним ядром функціонального відновлення після інсульту, і важливо розробити сильні стратегії, здатні полегшити ці процеси, щоб запропонувати найкраще лікування хворих на інсульт.
Недавні клінічні дослідження продемонстрували, що фармакологічне втручання здатне стимулювати ендогенну нейропластичність і в поєднанні з ранньою руховою реабілітацією може значно зменшити інвалідність після інсульту. Селективні інгібітори зворотного захвату серотоніну (СІЗЗС), нейротрофічні фактори, моноклональні антитіла, леводопа, метилфенідат та амфетамін — це лише деякі препарати, що вивчались на ранніх етапах реабілітації після інсульту. Було порушено багато питань щодо імплементації результатів цих досліджень у клінічну практику (тобто пов’язаних з вибором лікарських засобів, дозуванням, тривалістю, термінами початку лікування). Незважаючи на виявлення й обробку понад 57 000 записів у базі даних, суворий підхід GRADE, який застосовується під час роботи над цими рекомендаціями, гарантує виключення статей, які не відповідають всім критеріям включення, навіть якщо вони в цілому відповідають темі дослідження. Роботу над аналізом доцільності використання деяких препаратів (наприклад, леводопи) не завершено через відсутність інформації у звітах, про які повідомляється.
У цих рекомендаціях знайдено достатньо доказів, щоб рекомендувати Церебролізин у випадках інсульту середньої тяжкості як допоміжну терапію до стандартної реабілітації в перші 7 днів після розвитку гострого ішемічного інсульту. Слабка рекомендація щодо використання циталопраму в дозі 20 мг була дана завдяки одному з включених негативних досліджень, що було перерване на пізньому етапі [20], у якому аналізувалися лише дуже легкі випадки; отже, застосування даного препарату може бути розглянуте для пацієнтів з інсультом середнього й тяжкого ступеня.
Церебролізин — це фармакологічний засіб, що містить активні фрагменти різних нейротрофічних факторів, отриманих з використанням стандартизованого біологічного методу контрольованого розщеплення високоочищених безліпідних білків мозку [37]. Активні фрагменти нейротрофічного фактора (пептиди) й амінокислоти швидко проходять гематоенцефалічний бар’єр і зв’язуються зі специфічними рецепторами на різних мембранах нервової системи. Кожен фрагмент спеціально ініціює внутрішньоклітинний сигнальний шлях за допомогою фосфорилювання залучених протеїнкіназ, що в результаті призводить до активації факторів транскрипції і продукції білків, які беруть участь у процесах підтримки клітинної нейротрофічності, нейропротекції, нейропластичності й нейрогенезу. Церебролізин має фармакологічно мультимодальний механізм дії, впливаючи на ендогенну захисну активність мозку в пошкодженій ділянці мозку за допомогою плейотропних терапевтичних ефектів, одночасно модулюючи кілька компонентів патологічного каскаду при інсульті, черепно-мозковій травмі й нейродегенеративних захворюваннях [38–40].
У кількох дослідженнях, проведених у хворих на інсульт, вивчали, чи можуть антидепресанти, такі як флуоксетин і циталопрам, відігравати певну роль у нейрореабілітації. Зокрема, визначено, що СІЗЗС викликають нейропротекторний ефект завдяки своїй протизапальній дії. Підвищуючи кількість серотоніну, цінного церебрального моноаміну, ці препарати можуть спричиняти як короткочасні, так і тривалі процеси покращання моторної і когнітивної реабілітації [41]. Систематичний огляд і метааналіз, проведені McCann та співавт. у 2014 р., припускають, що СІЗЗС зменшують об’єм інфаркту й покращують нейроповедінкові результати на моделях ішемічного інсульту у тварин [42].
У дослідженнях на тваринах були виявлені різні корисні механізми, за допомогою яких СІЗЗС можуть покращати структурно-функціональне відновлення після ішемічного ураження мозку, включно з посиленням нейропластичності, опосередкованою протизапальним процесом нейропротекцією (гальмування пізніх стадій постішемічного запалення), покращанням авторегуляції мозкового кровотоку й модуляцією адренергічної нейрогормональної системи [43]. Підкреслюється, що будь-яке клінічне рішення, яке ґрунтується на даних, отриманих з досліджень, які є близькими, але не відповідають критеріям включення й обсягу цієї рекомендації (наприклад, дослідження FOCUS [26], у якому вивчалися ефекти флуоксетину в дозі 20 мг, яке було розпочате в період між 2-м і 15-м днем з моменту розвитку ішемічного інсульту і в якому визначали показник за mRS через 6 місяців, було виключено із цих рекомендацій через відсутність програми нейрореабілітації і недоступність результатів через 1 і 3 місяці після інсульту, так само як і кокранівський огляд щодо ефектів Церебролізину було виключено через різні критерії включення в дослідження, наприклад, початок терапії в перші 48 годин після інсульту, порівняння з плацебо або відсутністю лікування, відсутність згадок про нейрореабілітацію) [44], слід оцінювати з обережністю в поєднанні з основними питаннями й результатами дослідження, щоб визначити найкращі варіанти лікування. Також зазначається, що після першого подання цієї статті було опубліковано два дослідження флуоксетину (EFFECTS та AFFINITY) з негативними результатами щодо первинного результату (mRS) після 6-місячного спостереження. Флуоксетин знизив частоту депресії, але одночасно збільшив ризик переломів кісток і гіпонатріємії [27, 28].
На основі висновків, узагальнених у цих рекомендаціях, можна сказати, що необхідна подальша робота для надання більш точних рекомендацій і розуміння практичних аспектів, які слід враховувати при призначенні допоміжних методів терапії для ранньої моторної реабілітації після ішемічного інсульту. Дослідники повинні вирішити деякі епістемологічні невизначеності, такі як консенсус щодо узгоджених типів протоколів реабілітації, які слід вивчити. На рівні наших дослідницьких питань рекомендується поєднувати фармакологічне втручання з моторною реабілітацією. Однак через не-однорідність підходів та обмежену інформацію про протоколи реабілітації на більш конкретні запитання щодо частоти, типу або налаштувань такого фармакологічного втручання відповісти неможливо. Облік цих терапевтичних нюансів є важливим для формулювання висновків про додатковий ефект фармакологічного втручання після інсульту. По-друге, майбутні зусилля з оцінки можуть враховувати більш широкий спектр термінів і результатів втручання, про що свідчить наше систематичне картографування доказів, яке виявило тенденцію до розширення терапевтичного вікна й більш тривалого спостереження за пацієнтами. Схильність до перехідних результатів, орієнтованих на пацієнта, також має бути методологічно врахована при порівнянні широкого діапазону результатів дослідження. Нарешті, ще одна складова, яку треба брати до уваги у всіх майбутніх дослідженнях, — це економічна оцінка. У контексті тиску на системи охорони здоров’я через триваючі тенденції пандемії і захворюваності аналіз економічної ефективності інформує політиків про те, як забезпечити найвищий рівень доступу до цільових груп населення. Вторинною перевагою звітування про економічну складову є те, що виділяється інформація про якість життя пацієнтів, яка доповнює дані про ефекти й ефективність клінічних випробувань. З огляду на ці аспекти зацікавленим сторонам надається багатовимірний огляд терапевтичних стратегій, найчастіше необхідних для прийняття клінічних і політичних рішень, особливо при захворюванні з великим навантаженням на систему охорони здоров’я, такому як інсульт.
Перспективні досягнення науки також відкривають нові можливості для вивчення фармакологічного вдосконалення нейрореабілітації після інсульту [45]. З появою нових досліджень метою цих рекомендацій є інформування лікарів про існуючу фармакологічну підтримку нейровідновлення після гострого ішемічного інсульту. Оновлення цього матеріалу потенційно дасть відповіді на наявні питання, покращить поточні рекомендації і, сподіваємось, розширить терапевтичні можливості для пацієнтів, які вижили після інсульту.
Отримано/Received 05.07.2021
Рецензовано/Revised 17.07.2021
Прийнято до друку/Accepted 24.07.2021
Список литературы
1. Bernhardt J., Hayward K.S., Kwakkel G. et al. Agreed definitions and a shared vision for new standards in stroke recovery research: the Stroke Recovery and Rehabilitation Roundtable Taskforce. Int. J. Stroke. 2017. 12(5). 444-450. https://doi.org/10.1177/1747493017711816.
2. Dobkin B.H. Clinical practice. Rehabilitation after stroke. N. Engl. J. Med. 2005. 352(16). 1677-1684. https://doi.org/10.1056/NEJMcp043511.
3. Gorelick P.B. The global burden of stroke: persistent and disabling. Lancet Neurol. 2019. 18(5). 417-418. https://doi.org/10.1016/S1474-4422(19)30030-4.
4. Guyatt G.H., Oxman A.D., Vist G.E. et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 2008. 336(7650). 924-926. https://doi.org/10.1136/bmj.39489.470347.AD.
5. Leone M.A., Brainin M., Boon P. et al. Guidance for the preparation of neurological management guidelines by EFNS scientific task forces-revised recommendations 2012. Eur. J. Neurol. 2013. 20(3). 410-419. https://doi.org/10.1111/ene.12043.
6. Leone M.A., Keindl M., Schapira A.H., Deuschl G., Federico A. Practical recommendations for the process of proposing, planning and writing a neurological management guideline by EAN task forces. Eur. J. Neurol. 2015. 22(12). 1505-1510. https://doi.org/10.1111/ene.12818.
7. Higgins H., van Limbeek J., Geurts A., Zwarts M. Chapter 8: Assessing risk of bias in included studies. In: Higgins J.P.T., Tho-mas J., Chandler J., Cumpston M., Li T., Page M.J., Welch V.A. (eds.). Cochrane Handbook for Systematic Reviews of Interventions. 6.2. The Cochrane Collaboration. 2011.
8. Hsu C.-C., Sandford B. The Delphi technique: making sense of consensus. Pract. Assess. Res. Eval. 2019. 12(1). 1-5. https://doi.org/10.7275/pdz9-th90.
9. Sprigg N., Willmot M.R., Gray L.J. et al. Amphetamine increases blood pressure and heart rate but has no effect on motor recovery or cerebral haemodynamics in ischaemic stroke: a randomized controlled trial (ISRCTN 36285333). J. Hum. Hypertens. 2007. 21(8). 616-624. https://doi.org/10.1038/sj.jhh.1002205.
10. Sonde L., Nordstrom M., Nilsson C.G., Lokk J., Viitanen M. A doubleblind placebo-controlled study of the effects of amphetamine and physiotherapy after stroke. Cerebrovasc. Dis. 2001. 12(3). 253-257. https://doi.org/10.1159/000047712.
11. Heal D.J., Smith S.L., Gosden J., Nutt D.J. Amphetamine, past and present — a pharmacological and clinical perspective. J. Psychopharmacol. (Oxford). 2013. 27(6). 479-496. https://doi.org/10.1177/0269881113482532.
12. Muresanu D.F., Heiss W.-D., Hoemberg V. et al. Cerebrolysin and Recovery After Stroke (CARS): a randomized, placebo-controlled, double-blind, multicenter trial. Stroke. 2016. 47(1). 151-159. https://doi.org/10.1161/STROKEAHA.115.009416.
13. Guekht A., Vester J., Heiss W.-D. et al. Safety and efficacy of cerebrolysin in motor function recovery after stroke: a meta-analysis of the CARS trials. Neurol. Sci. 2017. 38(10). 1761-1769. https://doi.org/10.1007/sl0072-017-3037-z.
14. Amiri-Nikpour M.R., Nazarbaghi S., Ahmadi-Salmasi B., Mokari T., Tahamtan U., Rezaei Y. Cerebrolysin effects on neurological outcomes and cerebral blood flow in acute ischemic stroke. Neuropsychiatr. Dis. Treat. 2014. 10. 2299-2306. https://doi.org/10.2147/NDT.S75304.
15. Stan A., Birle C., Blesneag A., Iancu M. Cerebrolysin and early neurorehabilitation in patients with acute ischemic stroke: a prospective, randomized, placebo-controlled clinical study. J. Med. Life. 2017. 10(4). 216-222.
16. Chang W.H., Park C., Kim D.Y. et al. Cerebrolysin combined with rehabilitation promotes motor recovery in patients with severe motor impairment after stroke. BMC Neurology. 2016. 16(1). 31. https://doi.org/10.1186/sl2883-016-0553-z.
17. Bornstein N.M., Guekht A., Vester J. et al. Safety and efficacy of cerebrolysin in early post-stroke recovery: a meta-analysis of nine randomized clinical trials. Neurol. Sci. 2018. 39(4). 629-640. https://doi.org/10.1007/sl0072-017-3214-C.
18. Acler M., Robol E., Fiaschi A., Manganotti P. A double blind placebo RCT to investigate the effects of serotonergic modulation on brain excitability and motor recovery in stroke patients. J. Neurol. 2009. 256(7). 1152-1158. https://doi.org/10.1007/s00415-009-5093-7.
19. Savadi Oskouie D., Sharifipour E., Sadeghi Bazargani H. et al. Efficacy of citalopram on acute ischemic stroke outcome: a randomized clinical trial. Neurorehabil. Neural. Repair. 2017. 31(7). 638-647. https://doi.org/10.1177/1545968317704902.
20. Kraglund K.L., Mortensen J.K., Damsbo A.G. et al. Neuroregeneration and vascular protection by citalopram in acute ische-mic stroke (TALOS). Stroke. 2018. 49(11). 2568-2576. https://doi.org/10.1161/STROKEAHA.117.020067.
21. Gladstone D.J., Danells C.J., Armesto A. et al. Physiotherapy coupled with dextroamphetamine for rehabilitation after hemiparetic stroke: a randomized, double-blind, placebo-controlled trial. Stroke. 2006. 37(1). 179-185. https://doi.org/10.1161/01.STR.0000195169.42447.78.
22. Louise M., Gunnar W.N. Safety of dexamphetamine in acute ischemic stroke. Stroke. 2003. 34(2). 475-481. https://doi.org/10.1161/01.STR.0000050161.38263.AE.
23. Yu M., Sun Z.-J., Li L.-T., Ge H.-Y., Song C.-Q., Wang A.-J. The beneficial effects of the herbal medicine Di-Huang-Yin-Zi (DHYZ) on patients with ischemic stroke: a randomized, placebo controlled clinical study. Complement. Ther. Med. 2015. 23(4). 591-597. https://doi.org/10.1016/j.ctim.2015.06.003.
24. Chollet F., Cramer S.C., Stinear C. et al. Pharmacological therapies in post stroke recovery: recommendations for future clinical trials. J. Neurol. 2014. 261(8). 1461-1468. https://doi.org/10.1007/s00415-013-7172-z.
25. Asadollahi M., Ramezani M., Khanmoradi Z., Karimialavijeh E. The efficacy comparison of citalopram, fluoxetine, and placebo on motor recovery after ischemic stroke: a double-blind placebo-controlled randomized controlled trial. Clin. Rehabil. 2018. 32(8). 1069-1075. https://doi.org/10.1177/0269215518777791.
26. Dennis M., Mead G., Forbes J. et al. Effects of fluoxetine on functional outcomes after acute stroke (FOCUS): a pragmatic, double-blind, randomised, controlled trial. Lancet. 2019. 393(10168). 265-274. https://doi.org/10.1016/S0140-6736(18)32823-X.
27. Lundstrom E., Isaksson E., Nasman P. et al. Safety and efficacy of fluoxetine on functional recovery after acute stroke (EFFECTS): a randomised, double-blind, placebo-controlled trial. Lancet Neurol. 2020. 19(8). 661-669. https://doi.org/10.1016/S1474-4422(20)30219-2.
28. AFFINITY Trial Collaboration. Safety and efficacy of fluoxetine on functional outcome after acute stroke (AFFINITY): a randomised, double-blind, placebo-controlled trial. Lancet Neurol. 2020. 19(8). 651-660. https://doi.org/10.1016/S1474-4422(20)30207-6.
29. Mohammadianinejad S.E., Majdinasab N., Sajedi S.A., Abdollahi F., Moqaddam M.M., Sadr F. The effect of lithium in post-stroke motor recovery: a double-blind, placebo-controlled, randomized clinical trial. Clin. Neuropharmacol. 2014. 37(3). 73-78. https://doi.org/10.1097/WNF.0000000000000028.
30. Albert U., De Cori D., Blengino G., Bogetto F., Maina G. Lithium treatment and potential long-term side effects: a systematic review of the literature. Riv. Psichiatr. 2014. 49(1). 12-21. https://doi.org/10.1708/1407.15620.
31. Chen C.L.H., Young S.H.Y., Gan H.H. et al. Chinese medicine neuroaid efficacy on stroke recovery: a double-blind, placebo-controlled, randomized study. Stroke. 2013. 44(8). 2093-2100. https://doi.org/10.1161/STROKEAHA.113.002055.
32. Di Cesare F., Mancuso J., Woodward P., Bednar M.M., Loudon P.T., A9541004 Stroke Study Group. Phosphodiesterase-5 inhibitor PF-03049423 effect on stroke recovery: a double-blind, placebo-controlled randomized clinical trial. J. Stroke Cerebrovasc. Dis. 2016. 25(3). 642-649. https://doi.org/10.1016/j.jstrokecerebrovasdis.2015.11.026.
33. Sivenius J., Sarasoja T., Aaltonen H., Heinonen E., Kilkku O., Reinikainen K. Selegiline treatment facilitates recovery after stroke. Neurorehabil. Neural. Repair. 2001. 15(3). 183-190. https://doi.org/10.1177/154596830101500305.
34. Wieloch T., Nikolich K. Mechanisms of neural plasticity following brain injury. Curr. Opin. Neurobiol. 2006. 16(3). 258-264. https://doi.org/10.1016/j.conb.2006.05.011.
35. Muresanu D.F., Buzoianu A., Florian S.I., von Wild T., Muresanu D. Towards a roadmap in brain protection and recovery. J. Cell. Mol. Med. 2012. 16(12). 2861-2871. https://doi.org/10.1111/j.1582-4934.2012.01605.x.
36. Sahota P., Savitz S.I. Investigational therapies for ischemic stroke: neuroprotection and neurorecovery. Neurotherapeutics. 2011. 8(3). 434-451. https://doi.org/10.1007/s13311-011-0040-6.
37. Muresanu D.F., Florian S., Homberg V. et al. Efficacy and safety of cerebrolysin in neurorecovery after moderate-severe trauma-tic brain injury: results from the CAPTAIN II trial. NeurolSci. 2020. 41(5). 1171-1181. https://doi.org/10.1007/s10072-019-04181-y.
38. Muresanu D.F., Buzoianu A., Florian S.I., von Wild T. Towards a roadmap in brain protection and recovery. J. Cell. Mol. Med. 2012. 16(12). 2861-2871. https://doi.org/10.1111/j.1582-4934.2012.01605.x.
39. Riley C., Hutter-Paier B., Windisch M., Doppler E., Moessler H., Wronski R. A peptide preparation protects cells in organotypic brain slices against cell death after glutamate intoxication. J. Neural. Transm. 2006. 113(1). 103-110. https://doi.org/10.1007/s00702-005-0302-8.
40. Wronski R., Tompa P., Hutter-Paier B., Crailsheim K., Friedrich P., Windisch M. Inhibitory effect of a brain derived peptide preparation on the Ca++-dependent protease, calpain. J. Neural. Transm. (Vienna). 2000. 107(2). 145-157. https://doi.org/10.1007/s007020050013.
41. Siepmann T., Penzlin A.I., Kepplinger J. et al. Selective serotonin reuptake inhibitors to improve outcome in acute ischemic stroke: possible mechanisms and clinical evidence. Brain Behav. 2015. 5(10). e00373. https://doi.org/10.1002/brb3.373.
42. McCann S.K., Cadi I., Mead G.E. et al. Efficacy of antidepressants in animal models of ischemic stroke. Stroke. 2014. 45(10). 3055-3063. https://doi.org/10.1161/STROKEAHA.114.006304
43. Mead G.E., Hsieh C.-F., Lee R. et al. Selective serotonin reuptake in hibitors (SSRIs) for stroke recovery. Cochrane Database Syst Rev. 2012. 11. CD009286. https://doi.org/10.1002/14651858.CD009286.pub2.
44. Ziganshina L.E., Abakumova T., Vernay L. Cerebrolysin for acute ischaemic stroke. Cochrane Database Syst Rev. 2016. 12. CD007026. https://doi.org/10.1002/14651858.CD007026.pub4.
45. Hiroki A., Susumu J., Takuya T. Pharmacological enhancement of stroke rehabilitation. Stroke. 2019. 50(11). 3323-3329. https://doi.org/10.1161/STROKEAHA.119.023720.
/64.jpg)

/66.jpg)