Результати та обговорення (завершення)
Незважаючи на безліч аналізів, із якими приходили до нас у клініку на прийом пацієнти зі словами: «Я зробив (зробила) всі аналізи, які тільки можливі», незважаючи на товстенні папки з безкінечними багаторічними результатами попередніх аналізів, зроблених у пошуках причини підвищеної температури, які, проте, нічого не змогли додати до розуміння походження страждань і поневірянь пацієнта, майже ні в кого не було найпростішого. Не було жодного результату бактеріологічного обстеження сечі. Обстеження, що відповідало на два найголовніших запитання: що відбувається? Як лікувати?
У зв’язку з непоодинокими випадками негативних результатів однократних бакпосівів холодної сечі у хворих без ознак запального процесу у нирках (тобто без розвитку пієлонефриту) для підвищення вірогідності виділення бактерій, а також для виключення контамінації матеріалу зазвичай проводили бактеріологічне обстеження ранкової теплої сечі тричі (три дні поспіль). За рахунок використання діагностичних тест-систем для експрес-аналізу сечі Diaslide® DS-101 та DS-105 (Novamed, Ізраїль) з нанесеними на них живильними середовищами агару CLED, агару Мак-Конкі та хромогенного агару UriSelect це можна було здійснювати навіть у домашніх умовах. Це було також зручно, бо не потребувало щоденного звернення пацієнта до лабораторії.
При бактеріологічному обстеженні сечі 3999 хворих із порушеннями температурного режиму (дітей — 1952, або 48,8 %, дорослих — 2047, або 51,2 %) у 2205/3999 (55,1 %) випадках було виділено по 1 культурі бактерій, тобто 2205 штамів, бо штами одного виду тієї самої бактерії, виділені при бакпосівах теплої сечі три дні поспіль в одного хворого двічі чи тричі, рахували, щоб не заплутатися, як один штам. Ще у 1608/3999 (40,2 %) хворих було виділено одночасно по 2 культури різних бактерій, тобто ще 3216 штамів, а по 3 культури з однієї порції сечі виділяли дуже рідко — усього у 186/3999 (4,7 %) випадках (558 штамів). Більше 3 штамів з одного бакпосіву майже не виділяли взагалі. Таким чином, було взагалі виділено 5979 штамів різних бактерій, що розглядали як діагностичне підтвердження наявності вогнища хронічної бактеріальної інфекції у нирках у всіх цих 3999 пацієнтів із затяжним субфебрилітетом, ЛНГ або із фебрильними атаками.
При цьому більше ніж у 2/3 випадків (у 2780/3999, або 69,5 % хворих) був установлений діагноз локального безсимптомного нефродисбактеріозу без клінічних, загальнолабораторних (майже нормальний загальний аналіз сечі) та інструментальних ознак запального процесу в нирках. Ще у 960/3999 (24,0 %) випадках було встановлено уповільнене латентне формування клінічно безсимптомного хронічного пієлонефріту з уперше виявленими протеїнурією, лейкоцитурією та циліндрурією, про що самі пацієнти чи батьки дітей навіть не здогадувалися. У 259/3999 (6,5 %) хворих були виявлені етіологічні збудники хронічного пієлонефриту у стадії маловираженого клінічного загострення. Наявність вогнища хронічної бактеріальної інфекції у нирках призводила до розвитку СХБІ [9] із домінуючим порушенням температурного режиму організму токсичного характеру з розвитком затяжного субфебрилітету, або ЛНГ, або фебрильних атак. У 2024/2784 (72,7 %) випадках у дітей та дорослих із затяжним субфебрилітетом були присутні в різному поєднанні такі типові клінічні прояви СХБІ, як підвищена втомлюваність, слабкість, пітливість, зниження працездатності, апетиту, поганий сон, відчуття жару або ознобу, тахікардія, інколи — головний біль, періодичний біль у суглобах, поганий настрій тощо [4]. У 760/2784 (27,3 %) випадках субфебрильна температура мала моносимптомний характер: окрім підвищеної температури інших скарг та клінічних симптомів у пацієнтів не було.
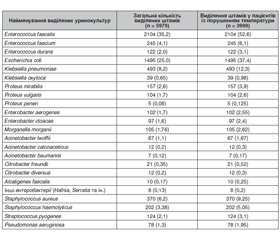
У табл. 1 наведені результати бактеріологічного обстеження теплої сечі 3999 хворих на СХБІ із клінічно домінуючим порушенням температури.
/45.jpg)
Як видно із табл. 1, головним фактором виникнення порушень температурного режиму на тлі СХБІ виявилися ентерококи, рівень виділення яких із сечі порівняно з іншими бактеріями значно переважав і становив 41,3 %, або 2471 серед 5979 взагалі ізольованих штамів. Найчастіше ізолювали Enterococcus faecalis — 2104 штами, або 35,2 % від взагалі виділених штамів та 85,1 % серед усіх виділених ентерококів, значно рідше — Enterococcus faecium — 245 штамів (4,1 і 9,9 % відповідно) та Enterococcus durans — 122 штами (2,0 та 4,9 %). Але з огляду на подвійне і навіть інколи потрійне одночасне виділення різних бактерій у одного хворого стає зрозумілим, що ентерококи як головний етіологічний збудник СХБІ із підвищенням температури були виділені більше ніж у половині випадків (2471/3999, або у 61,8 % від загальної кількості хворих). Другу за ентерококами сходинку зайняла кишкова паличка (Escherichia coli) — 25,0 %, або 1495 штамів (виділена у 37,4 % хворих). Таким чином, саме ці дві бактерії — ентерококи та кишкова паличка були головними домінуючими етіологічними чинниками виникнення затяжного субфебрилітету, ЛНГ та ФА на тлі СХБІ і становили 2/3, або 66,3 %, від усіх ізольованих штамів уринокультур та були виділенні в цілому в 99,2 % хворих з цими діагнозами.
Наступну велику групу виділених із сечі бактерій у хворих із температурними аномаліями становили стафілококи та стрептококи: сумарно 11,7 %, або 696/5979 штамів, ізольованих від 17,4 % хворих. А саме стафілококи (572/5979, або 9,6 %): Staphylococcus aureus — 370/5979, або 6,2 %, та Staphylococcus haemolyticus — 202/5979, або 3,38 % штамів, та стрептококи: Streptococcus pyogenes — 2,1 %, або 124/5979 штами (від 3,1 % хворих). І хоча стафілококи та стрептококи за частотою виявлення поступилися лише ентерококам та кишковій паличці, треба зауважити наступне. Територія слизових оболонок сечостатевих органів взагалі та нирок зокрема для стафілококів та стрептококів не є звичною та буденною. Враховуючи їх переважно повітряно-крапельний шлях передачі, перше і головне вогнище цих бактерій спочатку формується в носоглотці, мигдаликах та придаткових пазухах носа. Вже звідти вони різними шляхами потрапляють у сечостатеві органи, де певний час можуть навіть домінувати в етіологічній структурі вогнища хронічної бактеріальної інфекції в нирках (нефродисбактеріоз) із розвитком СХБІ з порушеннями температурного режиму організму (частіше в дітей).
Наступну за стафілококами та стрептококами клінічно суттєву етіологічну сходинку при СХБІ займали клебсієли — 8,85 %, або 532/5979 штами, виділені в 13,28 % хворих (значно частіше — Klebsiella pneumoniaе). Достатньо часто виділяли також протеї — 4,38 %, або 266/5979 штамів, виділених у 6,63 % хворих (значно частіше — Proteus mirabilis та Proteus vulgaris, лише в по–одиноких випадках — Proteus peneri). Уже значно рідше виділяли ентеробактери — 3,3 %, або 199/5979 штамів від 4,97 % хворих (майже порівну Enterobacter aerogenes і Enterobacter cloacae) та морганели (Morganella morganii) — 1,76 %, або 105/5979 штамів від 2,62 % хворих.
Як видно із табл. 1, іншу незначну групу ентеробактерій становили уринокультури ацинетобактерів (86/5979 штамів, або 1,4 %, виділених у 2,15 % хворих, частіше — Acinetobacter lwoffii), цитробактерів — 33/5979, або 0,55 %, що були виділені у 0,82 % хворих (частіше — Citrobacter freundii), а також 10/5979 штамів, або 0,17 %, Alcaligenes faecalis, виділених у 0,25 % хворих. Ще було виділено 8/5979 штамів (0,13 %) від 0,2 % хворих таких дуже рідкісних ізолятів, як гафнії, серації, і деяких зовсім поодиноких. Ще 1,3 %, або 78/5979, виділених штамів (ізольованих від 1,95 % хворих) становили бактерії синьогнійної палички (Pseudomonas aeruginosa) як етіологічно внутрішньолікарняна інфекція у хворих після хірургічного втручання, багаторазових інвазійних урологічних та гінекологічних процедур, гінекологічних оглядів, стоматологічних маніпуляцій тощо.
При проведенні токсикологічного обстеження крові за діагностичною системою «Токсикон» було встановлено таке. У 818 хворих на СХБІ дітей та дорослих, у тому числі зазвичай із порушеннями температурного режиму, загалом усі без винятку показники цитолітичної активності токсичних протеомів, що були перевірені, суттєво перевищували норму [6]. Різниця була статистично високозначима для всіх перевірених протеомів (p < 0,001). При цьому цитолітична активність деяких токсичних протеомів, а саме токсичних протеомів плазми крові, глобулін-асоційованих токсичних протеомів, альбумін-асоційованих токсичних протеомів з частинками розміром 10–200 нм та вільноциркулюючих токсичних протеомів з частинками розміром < 10 нм у дітей (n = 96) була статистично вірогідно вища (p < 0,05), ніж у дорослих (n = 722). Автоімунна активність деяких протеомів у дітей із СХБІ також була статистично вірогідно вища порівняно з дорослими (p < 0,05). Це стосувалося таких п’ятьох протеомів, як глобулін-асоційовані токсичні протеоми, вільноциркулюючі токсичні протеоми, глобулін-асоційовані токсичні протеоми з частинками розміром 10–200 нм, альбумін-асоційовані токсичні протеоми з частинками розміром 10–200 нм та вільноциркулюючі токсичні протеоми з частинками розміром 10–200 нм.
У переважної більшості хворих (у 664/818, або 81,2 %) була виявлена токсемія тяжкого ступеня, у 140/818 (17,1 %) — середньої тяжкості, тільки у 14 (1,7 %) — легка токсемія. При цьому статистично вірогідної різниці в ступені інтоксикації між дітьми та дорослими не встановлено. Форма інтоксикації була переважно компенсованою — у 740/818 (90,46 %) хворих, ще в 77/818 (9,41 %) — у стадії генералізації, і тільки в 1/818 (0,12 %) випадку у дорослого — декомпенсованою. Токсинонесучі фракції найбільш активних токсичних протеомів у кров’яному руслі в дітей та дорослих були переважно вільноциркулюючими (286/818, або 34,96 %) та глобулін-асоційованими (247/818, або 30,20 %). Серед токсичних протеомів переважали молекули із розміром частинок > 200 нм, які були виявлені у 612/818 (74,82 %) хворих, та розміром 10–200 нм — у 191/818 (23,35 %); ще у 15/818 випадках (1,83 %) розміри протеомів становили ˂ 10 нм. Тільки у половині випадків (412/818, або 50,37 %) був встановлений міцний зв’язок протеомів із несучою фракцією, в інших випадках зв’язок був нетривкий (120/818, або 14,67 %) або взагалі відсутній (286/818, або 34,96 %).
Фізіологічна елімінація токсичних протеомів в організмі хворих незалежно від віку здійснювалася переважно через макрофагальну систему клітин мезенхімального походження — у 614/818, або 75,06 %, випадках, значно рідше — через печінку (189/818, або 23,11 %), лише в окремих випадках (15/818, або 1,83 %) — через нирки. У переважної більшості хворих на СХБІ (738/818, або 90,22 %, у дітей — 93/96, або 96,88 %, у дорослих — 645/722, або 89,34 %, р > 0,05) установлений гіперергічний тип реактогенності системної відповіді на токсичні протеоми.
А зараз зауважимо щодо лікування хворих на затяжний субфебрилітет та фебрильні стани. Як вже зазначали в попередніх повідомленнях [4], був установлений чіткий зв’язок між виникненням нефродисбактеріозу і СХБІ із порушеннями температурного режиму та попереднім прийомом антибіотиків. З анамнезу 3759/3999 (94 %) пацієнтів із затяжними субфебрилітетом, ЛНГ або ФА було з’ясовано, що їм призначали і вони зазвичай неодноразово приймали раніше антибіотики різних груп. При цьому майже у двох третин дорослих перші перенавантаження організму антибіотиками відбувалися ще в дитинстві, частіше у зв’язку з частими простудними захворюваннями та їх гнійно-запальними ускладненнями. Майже у третині випадків виникнення або повернення субфебрилітету, фебрильної лихоманки або фебрильної атаки також відбувалося після прийому напередодні (від декількох тижнів до 1–2 місяців) саме антибіотиків. Більше того, антибіотики на попередніх етапах обстеження та лікування у зв’язку із порушенням температурного режиму призначали з метою нормалізації температури 3540/3999 (88,5 %) дітям та дорослим, у тому числі із затяжним субфебрилітетом у 87 % випадків (2422/2784), із фебрильними атаками — у 91,3 % (1023/1120) та всім 95/95 (100 %) пацієнтам із фебрильними лихоманками.
Якщо теза відносно того, що хворого на цукровий діабет неможливо вилікувати, призначаючи йому по столовій ложці цукру тричі на день, не викликає непорозуміння або протесту, стає зрозумілим таке. Хворих на хронічні бактеріальні захворювання, такі як нефродисбактеріоз або дисбактеріоз будь-якої іншої локалізації (кишечника, піхви, сечового міхура, простати, носоглотки, бронхолегеневої системи тощо), неможливо вилікувати антибіотиками. Це хибний шлях, яким людство йде вже не один десяток років. Дуже часто ці невеселі мандри закінчуються глухим кутом, із якого ані пацієнт, ані його лікар не можуть знайти вихід.
Необхідна нова, принципово інша парадигма такого лікування, яку ми сформулювали та обрали ще 10 років тому [10]. Неможливо вилікувати антибіотиками дисбактеріоз будь-якої локалізації, тобто ті захворювання, які є головними наслідками побічної дії антибіотиків. Поняття «дисбактеріоз» і «антибіотики» так само несумісні, як однакові полюси магніту, як порох та сірники, як мавпа і граната. А що ми маємо на сьогодні? Усі національні та міжнародні протоколи доказової медицини із лікування усіх хронічних запальних захворювань неспецифічної бактеріальної етіології (циститу, простатиту, пієлонефриту, кольпіту, гаймориту, бронхіту та багатьох подібних) передбачають регулярне та багаторазове застосування... саме антибіотиків. Стає зрозумілим, чому пацієнти, що за рекомендаціями своїх лікарів стали на стежку війни із бактеріями, з якими можливо жити у злагоді, після такого «лікування» вже майже ніколи не можуть вибратися з цієї глибокої ями, пожиттєво даючи прибуток фармацевтичним компаніям, що випускають антибіотики.
Треба змінити саму концепцію лікування хронічних неспецифічних бактеріальних інфекцій та захворювань, що вони викликають. Слід визнати, що лікування з позиції «вбивства» усіх бактерій та вірусів, що потрапили в організм людини, тактика «випаленої землі», що залишають після себе антибіотики, є хибними та ведуть до повного мікробного апокаліпсису. Треба навчитися перемагати хронічні бактеріальні інфекції за рахунок внутрішніх резервів самого організму людини шляхом підвищення загального специфічного імунітету та відновлення місцевого імунітету на слизових оболонках, на яких загарбницьки оселились ці бактерії.
І тут не обійтися без бактеріальних вакцин, які вже сьогодні де-факто можуть замінити антибіотики. Уже більше 20 років у нашій клінічний практиці бактеріальні автовакцини, виготовлені з автоштамів бактерій, виділених із локальних вогнищ хронічної інфекції, стали повною альтернативою антибіотикам при хронічних неспецифічних бактеріальних захворюваннях.
Усі 3999 хворих із затяжним субфебрилітетом, ЛНГ та ФА були проліковані бактеріальними автовакцинами. Певна частина хворих (68/1952, або 3,5 %, дітей та 147/2947, або 7,2 %, дорослих) після першого циклу лікування більше не зверталась у клініку на повторне контрольне обстеження та зникала з поля зору. Цих 215/3999, або 5,4 %, пацієнтів не включали до групи статистичної обробки результатів лікування. Ще до групи пролікованих автовакцинами хворих не була включена 61/3999, або 1,5 %, особа (дітей — 25/1952, або 1,3 %, дорослих — 36/2047, або 1,8 %), яким під час імунізації бактеріальними вакцинами за різних обставин були одночасно призначені антибіотики. Загалом 276/3999, або 6,9 %, хворих (дітей — 93/1952, або 4,8 %, дорослих — 183/2047, або 8,9 %) не були зараховані при статистичній обробці отриманих результатів. Тобто такими, які пройшли лікування, наслідки якого можна було рахувати за встановлені та які не були пов’язані із супутнім прийомом антибактеріальних препаратів, вважали 3723/3999 (93,1 %) пацієнтів, у тому числі 1859/1952, або 95,2 %, дітей та 1864/2047, або 91,1 %, дорослих.
Лікування пацієнтів із нефродисбактеріозом та СХБІ із порушеннями температурного режиму автовакцинами здійснювали відповідно до Локальних протоколів, затверджених у клініці «Вітацелл» та Клініці Маркова та зареєстрованих Державною службою інтелектуальної власності України [11]. Виготовлення термічно інактивованих бактеріальних вакцин із виділених культуральним методом автоштамів бактерій проводили у бактеріологічному відділі лабораторії Клініки Маркова за вдосконаленою стандартною методикою, викладеною у Наказі МОЗ України № 317 від 29.12.1994 р. «Про застосування аутовакцин» та відповідно до першого отриманого патенту на спосіб виготовлення та лікування стафілококовою вакциною Стафіло-Примавак® [12]. Для контролю стерильності зразки вакцини висівали на живильний бульйон та інкубували в термостаті при температурі 37 °С протягом 24–48 годин. Бактеріальні автовакцини не мали у складі антибіотиків та консервантів. Строк зберігання автовакцин при температурі 6–8 °С встановлювали на рівні до 6 місяців.
Схеми лікування завжди були індивідуальними, але мали й загальні риси. Один цикл складався із 2–3 курсів імунізації бактеріальними вакцинами. Один курс імунізації включав 10 або 12 підшкірних ін’єкцій у наростаючому дозуванні упродовж 19–21 дня. Між курсами витримували інтервал від 3 до 4 тижнів. Цикл лікування загалом тривав від 70 до 110 днів залежно від кількості курсів. Інтервали між циклами лікування зазвичай витримували упродовж 3 місяців. З урахуванням виділених із сечі автоштамів бактерій загалом дотримувалися такої послідовності їх призначення: спочатку моновалентна вакцина з одного виду бактерій, потім — двовалентна, за нею — полівалентна із додаванням накопичених під час попереднього та моніторингових обстежень та збережених автоштамів бактерій. Кількість циклів імунізації залежала від результатів попередньо проведеного лікування, а саме наявності/відсутності клінічних (насамперед підвищеної температури), мікроскопічних та бактеріологічних проявів СХБІ, за якими лікування саме і було призначено.
Ефективність проведеного лікування не залежала від строків захворювання, а також від віку пацієнтів, про що свідчать дані, наведені в табл. 2.
Як видно з табл. 2, загальний успіх після завершення імунізації бактеріальними автовакцинами серед хворих на СХБІ із порушеннями температурного режиму, які пройшли таке лікування та залишилися під катамнестичним спостереженням, був досягнутий у 1850/1859, або 99,5 %, дітей та у 1843/1864 (98,9 %) дорослих, загалом у 3693/3723 (99,2 %) пацієнтів. При цьому вже після перших 2–3 курсів першого циклу вакцинації температура повністю нормалізувалася більше ніж у 2/3 хворих — 2649/3723, або 71,2 %, пацієнтів. Ще у 807/3723 (21,6 %) хворих температура перетнула межу норми після додаткового другого циклу вакцинації, а у 237/3723 (6,4 %) — після третього. У деяких непоодиноких випадках нормалізацію температури реєстрували вже після перших ін’єкцій першої вакцини. Нерідко після певного часу нормальної температури вона знову підвищувалася до субфебрильних значень, що було пов’язано зі зміною домінуючого штаму збудника та потребувало додаткових курсів імунізації вакцинами іншого складу. Саме поліетіологічною структурою збудників СХБІ із порушеннями температурного режиму (табл. 2), скоріше за все, було обумовлено збереження, а частіше повернення температури у 30/3723 (0,8 %) пацієнтів із затяжним субфебрилітетом через 2–5 років після завершення лікування та клінічного одужання із повторним виділенням нових штамів уринокультур бактерій, що потребувало додаткового курсу/циклу імунізації бактеріальними автовакцинами. Майже у всіх хворих на фебрильну лихоманку нормалізація температури відбувалася вже під час перших курсів першого циклу вакцинації, як у наступному випадку (клінічний приклад 1), і більше температура не підвищувалася.
/48.jpg)
Клінічний приклад 1
Як дуже часто вже бувало, первинна консультація пацієнтки О., 58 років, відбулася заочно. До клініки 16.11.2012 р. зі сльозами на очах звернувся її чоловік і сказав, що дружина в дуже тяжкому стані, майже непритомна і вже 2 місяці знаходиться на лікуванні у стаціонарі приватної клініки, де лікарі не виключають найгіршого, бо немає підтвердженого діагнозу, а лікування не допомагає. Із розповіді чоловіка з’ясували таке. Майже 9 місяців назад раптово підвищилася температура до 40 °С, і після того кожного дня вона сягає 39–40 °С та навіть більше. Знесилена жінка майже постійно засинає, інколи заговорюється та не розуміє, що відбувається, періодично відчуває озноб, профузно пітніє, скаржиться на постійний біль у суглобах, на те, що «не слухаються ноги», зовсім відмовляється від їжі, виникають напади нестримного блювання, майже не підводиться з ліжка. За перші 5 місяців схудла на 20 кг (із 67 до 47 кг), погіршилися зір, слух. Після госпіталізації спочатку підозрювали онкологічне захворювання, провели операцію, видалили кісту яєчника. Упродовж усього терміну госпіталізації, тобто 2 місяці поспіль, щоденно отримує 2–3 антибіотики, у тому числі постійно внутрішньовенно, але температура навіть «не здригнулася». Зі слів чоловіка, ШОЕ становила 62 мм/год, С-реактивний білок — 85 мг/л (норма — до 5 мг/л). Висновок останнього консиліуму: у хворої або захворювання крові, або автоімунно-системне захворювання, або сепсис невстановленого походження. Але окрім найближчого, у хворої був ще і віддалений анамнез, до того ж дуже повчальний. Ще в дитинстві багато років поспіль трималася субфебрильна температура, у зв’язку з частим болем у суглобах підозрювали ревматизм і тривалий час (декілька років) регулярно кололи дитині антибіотик біцилін. Неодноразово виникали епізоди різкого короткочасного підвищення температури (фебрильні атаки. — Прим. авт.), причина появи яких залишалася не встановленою. Із підліткового віку страждає на періодично рецидивуючий псоріаз. Уже у зрілому віці упродовж більше 10 років знаходилася під наглядом та проходила лікування від синдрому хронічної втоми. На підставі такого вираженого анамнезу при зверненні чоловіка у клініку його дружині заочно був встановлений попередній діагноз нефродисбактеріозу та СХБІ з домінуючою фебрильною лихоманкою. Із теплої сечі (бакпосіви робили 3 дні поспіль), незважаючи на постійне застосування антибіотиків, були виділені 3 ідентичні антибіотикорезистентні штами Enterococcus faecalis, не чутливі до усіх перевірених антибіотиків, що підтверджувало діагноз нефродисбактеріозу/СХБІ. При цьому загальний аналіз сечі залишався майже у межах норми.
При токсикологічному обстеженні крові за діагностичною системою «Токсикон» були визначені параметри головної ланки токсемії та виявлені токсичні протеоми з цитолітичною активністю та розміром молекул від 10 до 200 нм, які мають найбільший рівень пошкоджуючої активності. До виникнення та розвитку тяжкої токсемії та токсикозу призвело накопичення у кров’яному руслі токсичних протеомів. Було встановлено, що головним патогенетичним механізмом синтезу токсикопротеомів, що переважно накопичилися у крові, є інфекційний. При цьому були виявлені токсичні протеоми не тільки ендотоксичного, а й екзотоксичного походження. У кров’яному руслі ці токсикопротеоми переважно були дислоковані на альбумінових білках, але цей зв’язок виявився неміцним. Параметри індексу реактогенності вказували на переважання гіперергічного фенотипу системної відповіді. При цьому рівень реактогенності системної відповіді ідентифікований як низький. Рівні відповідних реакцій адаптаційних антитоксичних систем організму у цілому знаходилися у зоні стресу. Антитоксичні системи цільної плазми щодо накопичених токсикопротеомів проявляли реакції декомпенсації. Автоімунна активність цільної плазми відповідала тяжкому ступеню. Основним патогенетичним механізмом синтезу імунотропних токсикопротеомів, накопичення у кров’яному руслі був резорбтивний. При цьому розміри молекул синтезованих токсикопротеомів, що мали найбільший рівень автоімунної активності, становили більше ніж 200 нм. Зв’язок імунотропних токсинів із токсиннесучою фракцією (альбумінові білки), був міцним. Основною системною тропністю токсичних протеомів визначена дерматологія, а основним органом — біологічною мішенню — тканини дерми. Фоновою системною тропністю токсичних протеомів визначена неврологія-психіатрія, а основним органом — біологічною мішенню — тканини ЦНС та периферичної нервової системи. Прогнозований ризик розвитку летального кінця становив 10,7 %. Таким чином, діагноз СХБІ був підтверджений не тільки бактеріологічно, але також і виявленням ендотоксикозу в генералізованій формі із токсемією тяжкого ступеня інфекційного генезу та накопиченням у кров’яному руслі токсинів із молекулами розміром 10–200 нм, що справляли пряму ушкоджуючу дію на біологічні мішені організму хворої.
Було рекомендовано негайно припинити прийом антибіотиків, які могли підсилювати ендотоксикоз, що виник на тлі СХБІ, зовнішнім екзотоксикозом, про що свідчили результати токсикологічного обстеження, та пройти курс лікування бактеріальною автовакциною із 10 ін’єкцій підшкірно через день. Вже після 3-ї ін’єкції першої вакцини температура почала знижуватися, а після 6–7-ї нормалізувалася. За наступні 3–4 місяці стан пацієнтки повністю відновився. Упродовж наступних 6 років (період спостереження) жила звичайним життям, присвячуючи себе онукам та чоловіку. У зв’язку зі збереженням бактеріурії та періодичним виділенням із сечі інших штамів Enterococcus faecalis було рекомендовано пройти наступні курси імунізації бактеріальними автовакцинами, від яких пацієнтка постійно відмовлялась. Таке небажання додаткового спілкування з лікарями, на жаль, із найбільшою ймовірністю свідчило про лікарський нігілізм зневіреної у можливостях сучасної медицини людини, яка все життя хворіла, завжди відповідально виконувала всі лікарські призначення та врешті-решт несподівано опинилася в такому складному, майже критичному стані.
Не менше ніж у 2/3 хворих на СХБІ з порушеннями температурного режиму на попередніх етапах лікування можна було констатувати синдром поліпрагмазії із призначенням їм більше 5, а зазвичай більше 10, препаратів одночасно. Але все було марно — стан пацієнтів не поліпшувався. Поступово вони втрачали віру в лікарів та лікування, що їм призначали. Це розчарування на межі своєрідного лікарського нігілізму інколи було дуже складно здолати, доводилося пояснювати пацієнту справжню причину виникнення у нього такого болісного стану та/або призначати лікування бактеріальними автовакцинами. Поєднання порушення психіки інтоксикаційного характеру на тлі СХБІ із діагностичною невизначеністю та постлікувальною зневірою, викликаною відсутністю будь-якої помітної позитивної відповіді на неодноразово проведене лікування, ставало гримучою сумішшю. Нерідко хворі з СХБІ на попередніх етапах лікування, перебуваючи у такому нестабільному психічному стані, проявляли нездоланну тягу до найбільш неординарних та радикальних кроків — проведення непотрібного хірургічного втручання: видалення мигдаликів, лімфатичних вузлів, зубів, проведення біопсій, пункцій кісткового мозку тощо, як у наступному випадку (клінічний приклад 2).
Клінічний приклад 2
Хвора Г., 62 років, звернулася до клініки у березні 2020 р. зі скаргами на довготривалу субфебрильну температуру упродовж близько 5 останніх років, походження якої залишалося не встановленим, підвищену втомлюваність, слабкість, поганий настрій та дратівливість, депресивний стан, періодичний біль у суглобах та м’язах. Хвору також турбувало посилення постійних рясних виділень слизу гнійного характеру з носа та по задній стінці глотки, а також майже відсутнє носове дихання. Ці симптоми періодично виникали вже більше 10 років, а упродовж останніх 2–3 років були присутніми майже постійно. У зв’язку з рецидивуючим хронічним риносинуситом регулярно (по 3–5 разів на рік) отримувала лікування антибіотиками з короткочасним позитивним ефектом та наступним все більш швидким рецидивом. Після появи близько 5 років тому субфебрильної температури та за відсутності чіткого розуміння її походження виникли та поступово стали посилюватися фобічні відчуття. У хворої на СХБІ та хронічний риносинусит був додатково виявлений синдром поліпрагмазії. Крім регулярного загального використання антибіотиків, двічі (у травні та червні 2019 р.) робили курси підшкірних ін’єкцій лінкоміцину в ділянку перенісся та носогубного трикутника, неодноразово майже одночасно призначали курси лікування противірусними, імуностимулюючими та симптоматичними препаратами. Зважаючи на відсутність позитивного клінічного ефекту та збереження субфебрилітету, за ініціативою лікаря та за наполяганнями самої хворої спочатку були видалені мигдалики, потім 2 зуби, а потім проведена тотальна депульпація усіх зубів верхньої щелепи. Але дарма — температура не зникала. При бактеріологічному обстеженні у клініці із носа, глотки та слизу з носа були виділені St. аureus та Klebsiella pneumoniaе, із теплої сечі — три ідентичних штами Escherichia coli. Клітинна ланка загального імунітету перебувала в активованому стані. Вже після першого курсу лікування моновалентною стафілококовою автовакциною відбулися помітні позитивні зміни в перебігу хронічного риносинуситу: відчутно зменшилася кількість виділень слизу з носа та майже відновилося носове дихання. Через 3 тижні був проведений упродовж 19 днів другий курс лікування двовалентною вакциною, і тільки після нього температура почала знижуватися періодично до нормальної. Вже після третього курсу імунізації полівалентною вакциною з усіх виділених автоштамів бактерій відчутно поліпшився загальний стан, стійко нормалізувалася температура, майже зникли фобії. Пацієнтка нарешті погодилася, що наробила дурниць із зайвими хірургічними втручаннями. Продовжує спостереження у клініці, із 18.10.2020 р. був проведений другий цикл лікування бактеріальними автовакцинами іншого складу. Рецидивів субфебрилітету та СХБІ більше не було.
Призначення та використання бактеріальних автовакцин майже не мали протипоказань. При встановленні супутніх до нефродисбактеріозу та СХБІ діагнозів вакцини неодноразово застосовували у пацієнтів, які перебували в періоді реабілітації після оперативного, хіміотерапевтичного та променевого лікування онкологічних захворювань, при автоімунно-системних хворобах та імунодефіцитних станах, у тому числі при ВІЛ/СНІДі. Вакцини призначали пацієнтам з обтяженим алергологічним анамнезом: при їх використанні був відсутній розвиток побічних алергічних реакцій. Більше того, введення бактеріальних вакцин зазвичай призводило до вираженого гіпоалергенного ефекту з поступовим істотним зниженням підвищених до початку лікування рівнів загального та специфічних імуноглобулінів Е (IgE). Це розглядали як додаткове підтвердження мікробноасоційованого характеру більшості випадків алергії у хворих із хронічними захворюваннями бактеріального походження.
Треба зазначити, що перші, такі довгоочікувані позитивні результати лікування деякі, мабуть, особливо вразливі пацієнти відчували вже за декілька днів після перших ін’єкцій бактеріальної вакцини. Після поліпшення стану майже обов’язково виникав полегшений рецидив, наставав своєрідний відкат трохи назад, самопочуття ставало гіршим. У цей момент найголовніше було не занепадати духом. Потім, із початком наступного курсу імунізації, стан знову поліпшувався, потім знову гіршав… Такі своєрідні гойдалки: ліпше — гірше, ліпше — гірше, ліпше, рух яких поступово сповільнювався. Зазвичай такий рух характеризує типовий перебіг як самого захворювання на СХБІ, у тому числі із порушеннями температурного режиму, так і клінічної відповіді на лікування бактеріальними вакцинами. Але з кожним наступним курсом самопочуття стає ліпшим та ліпшим, наближаючись до відмітки «100% одужання», уже майже ніколи не повертається під час погіршення на той болісний нуль, із якого лікування починалося.
Висновки
1. Походження таких патологічних станів, як затяжний субфебрилітет та фебрильна лихоманка неясного генезу, залишається в діагностичному плані одним із найбільш складних питань клінічної медицини. У всіх 3999 (100 %) пацієнтів із лихоманкою невстановленого походження, які знаходилися під наглядом, було виявлено вогнище хронічної бактеріальної інфекції в нирках. При цьому більше ніж у 2/3 випадків (у 2780/3999, або 69,5 % хворих) був установлений діагноз локального безсимптомного нефродисбактеріозу без клінічних, загальнолабораторних (майже нормальний загальний аналіз сечі) та інструментальних ознак запального процесу у нирках. Ще у 960/3999 (24,0 %) випадках було вперше встановлено латентне формування уповільненого, клінічно безсимптомного хронічного пієлонефріту. У 259/3999 (6,5 %) хворих був установлений діагноз хронічного пієлонефриту у стадії клінічного загострення.
2. Як наслідок формування вогнища хронічної бактеріальної інфекції в нирках у всіх хворих розвивався моносимптомний (тільки із підвищенням температури) або повносимптомний синдром хронічної бактеріальної інтоксикації. У 2024/2784 (72,7 %) дітей та дорослих із затяжним субфебрилітетом в різному поєднанні були типові клінічні прояви СХБІ, але у 760/2784 (27,3 %) випадках субфебрильна температура мала моносимптомний характер, без інших скарг та клінічних симптомів.
3. Таке незвичайне для існуючих на даний час загальних уявлень про генезис підвищеної температури тлумачення причин виникнення затяжного субфебрилітету, ЛНГ та ФА підтверджували бактеріологічним обстеженням сечі та токсикологічним обстеженням крові. При бактеріологічному обстеженні теплої сечі (тричі, 3 дні поспіль) 3999 хворих із порушеннями температурного режиму у всіх 3999 (100 %) випадках із сечі були виділені уринокультури різних бактерій. При цьому у 2205/3999 (55,1 %) випадках було виділено по 1 культурі бактерій, у 1608/3999 (40,2 %) — одночасно по 2 культури різних бактерій, тобто ще 3216 штамів, у 186/3999 (4,7 %) — по 3 культури (558 штамів). Таким чином, у цілому було виділено 5979 штамів різних бактерій, що розглядали як діагностичне підтвердження наявності у всіх 3999 пацієнтів із затяжним субфебрилітетом, ЛНГ або із фебрильними атаками вогнища хронічної бактеріальної інфекції в нирках.
4. Головним чинником виникнення порушень температурного режиму на тлі СХБІ виявилися ентерококи, рівень виділення яких із сечі порівняно з іншими бактеріями значно переважав і становив 41,3 %, або 2471 серед 5979 взагалі ізольованих штамів та 61,8 % (2471/3999) від загальної кількості хворих. Найчастіше ізолювали Enterococcus faecalis — 2104/5979 штами, або 35,2 % від взагалі виділених штамів та 85,1 % серед усіх виділених ентерококів.
5. Другу за ентерококами сходинку зайняла кишкова паличка (Escherichia coli) — 25,0 %, або 1495 штамів (виділена у 37,4 % хворих). Таким чином, саме ці дві бактерії — ентерококи та кишкова паличка — були головними домінуючими етіологічними чинниками виникнення затяжного субфебрилітету, ЛНГ та ФА на тлі СХБІ, вони становили 2/3, або 66,3 %, від усіх ізольованих штамів уринокультур та були виділені у 99,2 % хворих із цими діагнозами.
6. Наступну велику групу виділених із сечі бактерій у хворих із температурними аномаліями становили стафілококи та стрептококи: сумарно 11,7 %, або 696/5979 штамів, ізольованих від 17,4 % хворих, а саме стафілококи (572/5979, або 9,6 %): Staphylococcus aureus — 370/5979, або 6,2 %, та Staphylococcus haemolyticus — 202/5979, або 3,38 % штамів; стрептококи: Streptococcus pyogenes — 2,1 %, або 124/5979 штамів (від 3,1 % хворих). Стафілококи та стрептококи взагалі за частотою виявлення поступилися лише ентерококам та кишковій паличці.
7. Наступну за стафілококами та стрептококами клінічно суттєву етіологічну сходинку при СХБІ із порушеннями температурного режиму займали клебсієли — 8,85 %, або 532/5979 штамів, виділених у 13,28 % хворих (значно частіше — Klebsiella pneumoniaе) та протеї — 4,38 %, або 266/5979 штамів, виділених у 6,63 % хворих (значно частіше — Proteus mirabilis та Proteus vulgaris, лише в поодиноких випадках — Proteus peneri). Уже значно рідше виділяли ентеробактери — 3,3 %, або 199/5979 штамів від 4,97 % хворих (майже порівну Enterobacter aerogenes і Enterobacter cloacae) та морганели (Morganella morganii) — 1,76 %, або 105/5979 штамів від 2,62 % хворих. Іншу, зовсім незначну, групу ентеробактерій становили уринокультури ацинетобактерів (86/5979 штамів, або 1,4 %, виділених у 2,15 % хворих, частіше — Acinetobacter lwoffii), цитробактерів — 33/5979, або 0,55 %, що були виділені в 0,82 % хворих (частіше — Citrobacter freundii), а також 10/5979 штамів, або 0,17 %, Alcaligenes faecalis, виділених у 0,25 % хворих. Ще 1,3 %, або 78/5979 виділених штамів (від 1,95 % хворих), становили бактерії синьогнійної палички (Pseudomonas aeruginosa).
8. У 818 хворих на СХБІ дітей та дорослих, у тому числі переважно із порушеннями температурного режиму, при проведенні токсикологічного обстеження крові було встановлено таке. Загалом усі без винятку показники цитолітичної активності токсичних протеомів, що були перевірені, суттєво перевищували норму (p < 0,001). При цьому цитолітична активність деяких токсичних протеомів, а саме токсичних протеомів плазми крові, глобулін-асоційованих токсичних протеомів, альбумін-асоційованих токсичних протеомів з частинками розміром 10–200 нм та вільноциркулюючих токсичних протеомів з частинками розміром < 10 нм у дітей (n = 96), була статистично вірогідно вища (p < 0,05), ніж у дорослих (n = 722). Автоімунна активність деяких протеомів (глобулін-асоційовані токсичні протеоми, вільноциркулюючі токсичні протеоми, глобулін-асоційовані токсичні протеоми з частинками розміром 10–200 нм, альбумін-асоційовані токсичні протеоми з частинками розміром 10–200 нм та вільноциркулюючі токсичні протеоми з частинками розміром 10–200 нм) у дітей з СХБІ також була статистично вірогідно вища порівняно з дорослими (p < 0,05).
9. У переважної більшості хворих (у 664/818, або 81,17 %) була виявлена токсемія тяжкого ступеня, у 140/818 (17,11 %) — середньої тяжкості, тільки у 14 (1,71 %) — легка. При цьому статистично вірогідної різниці у ступені інтоксикації між дітьми та дорослими не встановлено. Форма інтоксикації була переважно компенсованою — у 740/818 (90,46 %) хворих, ще у 77/818 (9,41 %) — у стадії генералізації, і тільки у 1/818 (0,12 %) випадку у дорослого — декомпенсованою. У половині випадків (412/818, або 50,37 %) був встановлений міцний зв’язок протеомів із несучою фракцією, в інших випадках зв’язок був слабкий (120/818, або 14,67 %) або взагалі відсутній (286/818, або 34,96 %).
10. Фізіологічна елімінація токсичних протеомів в організмі хворих незалежно від віку здійснювалася переважно через макрофагальну систему клітин мезенхімального походження: у 614/818, або 75,06 %, випадках, значно рідше — через печінку (189/818, або 23,11 %), лише в окремих випадках (15/818, або 1,83 %) — через нирки. У переважної більшості хворих на СХБІ (738/818, або 90,22 %, у тому числі у дітей — 93/96, або 96,88 %, у дорослих — 645/722, або 89,34 %, р > 0,05) встановлений гіперергічний тип реактогенності системної відповіді на токсичні протеоми.
11. Усі 3999 хворих із затяжним субфебрилітетом, ЛНГ та ФА були проліковані бактеріальними автовакцинами. Загалом 276/3999, або 6,9 %, хворих (дітей — 93/1952, або 4,8 %, дорослих — 183/2047, або 8,9 %) не були зараховані при статистичній обробці отриманих результатів у зв’язку із відсутністю катамнестичного спостереження або через супутній прийом антибіотиків. Тобто такими, що пройшли лікування, наслідки якого можна було рахувати за встановлені та які не були пов’язані із супутнім прийомом антибактеріальних препаратів, вважали 3723/3999 (93,1 %) пацієнтів, у тому числі 1859/1952, або 95,2 %, дітей та 1864/2047, або 91,1 %, дорослих.
12. Загальний успіх із нормалізацією температури після завершення імунізації бактеріальними автовакцинами серед хворих на СХБІ із порушеннями температурного режиму був досягнутий у 1850/1859, або 99,5 %, дітей та у 1843/1864 (98,9 %) дорослих, загалом у 3693/3723 (99,2 %) пацієнтів. При цьому вже після перших 2–3 курсів першого циклу вакцинації температура повністю нормалізувалася більше ніж у 2/3 хворих — 2649/3723, або 71,2 %. Ще у 807/3723 (21,6 %) випадках температура перетнула межу норми після додаткового другого циклу вакцинації, а у 237/3723 (6,4 %) — після третього. Поліетіологічною структурою збудників СХБІ із порушеннями температурного режиму, скоріше за все, було обумовлено збереження, а частіше повернення температури у 30/3723 (0,8 %) хворих із затяжним субфебрилітетом через 2–5 років після завершення лікування та клінічного одужання із повторним виділенням нових штамів уринокультур, що потребувало додаткових курсів/циклів імунізації бактеріальними автовакцинами.
Лікування затяжного субфебрилітету, фебрильних лихоманок та фебрильних атак, що виникли на тлі СХБІ, бактеріальними автовакцинами з ефективністю 71,2 % після першого циклу лікування, 92,8 % — після другого та з кінцевим рівнем ефективності 99,2 % після третього з повним відновленням втрачених під час хвороби працездатності та емоційного рівня особистого життя можна вважати вельми обнадійливим як для самих хворих, так і для їх лікарів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 15.09.2021
Рецензовано/Revised 30.09.2021
Прийнято до друку/Accepted 10.10.2021

/45.jpg)
/48.jpg)