Архив офтальмологии Украины Том 10, №2, 2022
Вернуться к номеру
Зв’язок поліморфізмів rs2010963 та rs699947 гена VEGFA з розвитком та прогресуванням діабетичної ретинопатії в пацієнтів із цукровим діабетом 2-го типу: заключні результати
Авторы: Гудзь А.С. (1), Захаревич Г.Є. (1), Панченко Ю.О. (2), Могилевський С.Ю. (2), Бушуєва О.В. (1), Петренко О.В. (2)
(1) — Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
(2) — Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
Серед ускладнень цукрового діабету діабетична ретинопатія (ДР) — одне з найбільш несприятливих, оскільки призводить до сліпоти та інвалідизації пацієнтів. Мета: вивчити зв’язок поліморфізмів rs2010963 та rs699947 гена VEGFA з розвитком та прогресуванням діабетичної ретинопатії в пацієнтів із цукровим діабетом 2-го типу (ЦД2Т). Під наглядом перебували 302 пацієнти. Із них у 98 не були виявлені ні ЦД2Т, ні ДР. Вони були включені до контрольної групи. У 204 пацієнтів було встановлено ЦД2Т із різною стадією ДР (група дослідження). Усім пацієнтам виконували загальноприйняті офтальмологічні дослідження. Проводили дослідження поліморфних ДНК-локусів гена VEGFA rs2010963 та rs699947 методом полімеразної ланцюгової реакції в реальному часі з використанням уніфікованих тест-систем TaqMan Mutation Detection Assays Thermo Fisher Scientific (США). Поліморфізм rs2010963 пов’язаний із ДР; гетерозигота G/C збільшувала в 1,6 раза шанси розвитку ДР, мінорна гомозигота — в 1,9 раза; предкова гомозигота G/G зменшувала шанси розвитку ДР в 1,8 раза. Стратифікація за стадіями ДР показала, що розподіл генотипів та алелей rs2010963 мав статистичне значення тільки для пацієнтів із проліферативною ДР (ПДР). Поліморфізм rs699947 пов’язаний із ДР; предкова гомозигота С/С збільшувала у 2,2 раза шанси розвитку ДР, тоді як гетерозигота та мінорна гомозигота такі шанси зменшували відповідно в 1,5 та 5,6 раза. Стратифікація за стадіями ДР встановила, що більша частота предкової гомозиготи С/С мала статистичне значення лише за ПДР (р = 0,001). Гомозигота С/С асоціювалася з ПДР та у 3,8 раза підвищувала ризик її розвитку порівняно з іншими генотипами. Гаплотип G/C–C/C утричі збільшував шанси розвитку ДР при ЦД2Т. При ЦД2Т наявність гаплотипу G/G–C/A у 2–3 рази зменшувала шанси розвитку ПДР; наявність гаплотипу G/C–C/C — збільшувала ризик у 4–10 разів; гаплотип С/С–С/А був маркером ПДР (р < 0,05). Відзначене зниження коефіцієнта нерівноважного зчеплення алелей LD при ПДР (D’ = 0,42) порівняно з контрольною групою (D’ = 0,71). У результаті проведеного дослідження був установлений зв’язок поліморфізмів rs2010963 та rs699947 гена VEGFA з розвитком та прогресуванням ДР при ЦД2Т.
Among the complications of diabetes mellitus (DM), diabetic retinopathy (DR) is one of the most unfavorable, since it leads to blindness and disability of patients. Purpose: to study the relationship of rs2010963 and rs699947 polymorphisms of the VEGFA gene with the development and progression of diabetic retinopathy in patients with type 2 diabetes mellitus (DM2T). Three hundred and two patients were under observation. Of these, 98 did not have DM2T or DR. They were included in the control group. Two hundred and four patients were diagnosed with DM2T with different stages of DR (study group). All patients underwent generally accepted ophthalmological examinations. Polymorphic DNA loci of the VEGFA rs2010963 and rs699947 gene were studied using real-time polymerase chain reaction and unified test systems TaqMan Mutation Detection Assays Thermo Fisher Scientific (USA). Polymorphism rs2010963 is associated with DR; homozygote G/C increased the risk of developing DR by 1.6 times, minor homozygote — by 1.9 times; ancestral homozygote G/G reduced the risk of developing DR by 1.8 times. Stratification by DR stages showed that the statistical value of the distribution of rs2010963 genotypes and alleles was evident only for patients with proliferative DR (PDR). Polymorphism rs699947 is associated with DR; ancestral homozygote C/C increased the risk of developing DR by 2.2 times, while heterozygote and minor homozygote reduced such risks by 1.5 and 5.6 times, respectively. Stratification by stages of DR found that a high frequency of ancestral homozygote C/C was statistically significant only in case of PDR (p = 0.001). Homozygote C/C was associated with PDR and 3.8 times increased the risk of its development compared to other genotypes. G/C-C/C haplotype tripled the risk of developing DR in DM2T. In DM2T, the presence of G/G-C/A haplotype reduced the risk of developing PDR by 2–3 times; the presence of G/C-C/C haplotype 4–10 times increased this risk; C/C-C/A haplotype was a PDR marker (p < 0.05). There was a decrease in the coefficient of non-equilibrium adhesion of LD alleles in PDR (D’= 0.42) compared to the control group (D’= 0.71). The study established the association of rs2010963 and rs699947 polymorphisms of the VEGFA gene with the development and progression of DR in DM2T.
діабетична ретинопатія; цукровий діабет 2-го типу; поліморфізм rs2010963 гена VEGFA; поліморфізм rs699947 гена VEGFA; розвиток, прогресування
diabetic retinopathy; type 2 diabetes mellitus; rs2010963 polymorphism of the VEGFA gene; rs699947 polymorphism of the VEGFA gene; development; progression
Вступ
Матеріали та методи
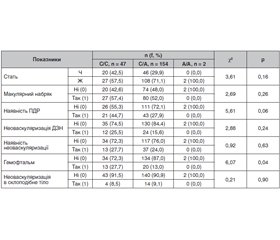
Результати та обговорення
Висновки
- Degtyarenko T.V., Bogdanova O.V. Vmіst yadernih nukleotidіv u rіznih populyacіyah lіmfoїdnih klіtin і stan іmunoreaktivnostі organіzmu u hvorih na dіabetichnі angіopatії ta retinopatії. Odes’kij med. zhurn. 2006. № 4 (96). S. 49-53. [in Ukrainian]
- Scott L.J., Mohlke K.L., Bonnycastle L.L. et al. A genome-wide association study of type 2 diabetes in Finns detects multiple susceptibility variants. Science. 2007. P. 1142382.
- Huang T., Qi Q., Zheng Y. et al. Genetic predisposition to central obesity and risk of type 2 diabetes: two independent cohort studies. Diabetes care. 2015. Vol. 38. № 7. P. 1306-1311.
- Global Guidеline for Type 2 Diabetes: recommendations for standard, comprehensive, and minimal care (IDF Clinical Guidеlines Task Forse). Diabet. Med. 2006. Vol. 23. P. 579-593.
- Maslova O.V., Suncov Y.U.I. Epidemiologiya saharnogo diabeta i mikrososudistyh oslozhnenij. Saharnyj diabet. 2011. № 3 (52). S. 6-11. [in Russian]
- Global Guideline for type 2 diabetes. The International Diabetes Federation. Brussels, 2012. 123 р.
- Kapetanakis V.V., Rudnicka A.R., Liew G. et al. A study of whether automated Diabetic Retinopathy Image Assessment could replace manual grading steps in the English National Screening Programme. J. med. screen. 2015. Vol. 22. № 3. P. 112-118.
- Komіsarenko Y.U. І. Korekcіya vіtamіnom D3 porushen’ metabolіchnih procesіv u pacієntіv іz cukrovim dіabetom 1-gota 2-go tipіv. Ukraїns’kij bіohіmіchnij zhurnal. 2014. T. 86. № 1. S. 111-116. [in Ukrainian]
- Gajdaev Yu.O., Moіseєnko R.O., Zhdanova M.P. i dr. Stan endokrinologіchnoї sluzhbi Ukraїni ta perspektivi rozvitku medichnoї dopomogi hvorim z endokrinnoyu patologієyu. Mezhdunarodnyj endokrinologicheskij zhurnal. 2006. № 2 (4). S. 9-14. [in Ukrainian]
- Tron’ko M.D., Chernobrov A.D. Epіdemіologіya cukrovogo dіabetu v Ukraїnі. Zdorov’ya Ukraїni. 2005. № 18 (127). S. 15. [in Ukrainian]
- Vlasenko M.V. Cukrovij dіabet: dіagnostika і monіtoring. Lіki Ukraїni. 2013. № 9–10. S. 17-18. [in Ukrainian]
- Kadzharyan V.G., Kapshitar’ N.I. Novoe v lechenii saharnogo diabeta 2 tipa. Zaporozhskij medicinskij zhurnal. 2014. № 1. S. 74-79. [in Russian]
- Anciferov M. Sovremennye standarty lecheniya bol’nyh saharnym diabetom 2 tipa (osnovnye polozheniya issledovaniya UKPDS). Vrach. 2000. № 1. S. 6-8. [in Russian]
- Neroev V.V., Kolchin A.A., Zueva M.V. i dr. Associacii narushenij funkcional’noj aktivnosti setchatki, metabolicheskih i gemodinamicheskih izmenenij u bol’nyh saharnym diabetom bez priznakov retinopatii. Rossijskij oftal’mologicheskij zhurnal. 2013. T. 6. № 1. S. 20-25. [in Russian]
- Kekhіopulo H.F. Pokazniki sistem koagulyacії ta fіbrinolіzu, markeri zapalennya u hvorih na cukrovij dіabet 2-go tipu z ozhirіnnyam. Klіnіchna endokrinologіya ta endokrinna hіrurgіya. 2013. № 2. S. 15-20. [in Ukrainian]
- Man’kovskij B.N. Sovremennye principy terapii SD 2 tipa. Aktual’nі problemi endokrinologії: materіali 46-ї nauk.-prakt. konf., Harkіv, 19–21 chervnya 2002 r. S. 39-42. [in Russian]
- Keymel S., Heinen Y., Balzer J. et al. Characterization of macro- and microvascular function and structure in patients with type 2 diabetes mellitus. Am. J. Cardiovasc. Dis. 2011. № 1(1). Р. 68-75.
- Bezdetko P.A., Gorbacheva E.V. Epidemiologiya i chastota saharnogo diabeta i diabeticheskoj retinopatii. Mezhdunarodnyj endokrinologicheskij zhurnal. 2006. № 4 (6). S. 76-80. [in Russian]
- Dedov I.I., Shestakova M.V., Milen’kaya T.M. Saharnyj diabet: retinopatiya, nefropatiya. M.: Medicina, 2001. 175 s. [in Russian]
- Pan’kіv V.І. Cukrovij dіabet: dіagnostichnі kriterії, etіologіya і patogenez. Mіzhnarodnij endokrinologіchnij zhurnal. 2013. № 8. S. 53-64. [in Ukrainian]
- Skripnik N.V., Grib V.A., Dіdushko O.M. Osoblivostі patogenezu ta lіkuvannya dіabetichnoї avtonomnoї nejropatії (oglyad lіteraturi). Lіki Ukraїni. 2012. № 2. S. 6-14. [in Ukrainian]
- Skrуpnуk R.L. Poshkodzhennya zorovogo nerva pri cukrovomu dіabetі (patogenez, klіnіka, dіagnostika, lіkuvannya): avtoref. dis. na zdobuttya nauk. stup. kand. med. nauk : spec. 14.01.08 «Ochnі hvorobi». Odesa, 2005. 37 s. [in Ukrainian]
- Skrуpnуk R.L., Skrypnichenko I.D., Dzyuba N.A. Povyshenie effektivnosti lecheniya pacientov s diabeticheskoj retinopatiej. Oftal’mol. Vost. Evropa. 2019. № 9 (2). S. 246-252. [in Russian]
- Donelly R., Emsly-Smith A.M., Gardner I.D., Morris A.D. Vascular complications of diabetes. BMJ. 2000. Vol. 15. № 320 (7241). Р. 1062-1066.
- Velichko P.B., Osmanov E.M. Sovremennye metodicheskie podhody k lecheniyu diabeticheskoj retinopatii. Vestnik TGU. 2013. T. 18. Vyp. 6. S. 3248-3249. [in Russian]
- Naumenko V.A. Integral’naya sistema rannej diagnostiki neproliferativnoj diabeticheskoj ratinopatii. Odes’kij medichnij zhurnal. 2010. № 3 (119). S. 58-61. [in Russian]
- Pasechnikova N.V., Naumenko V.A., Zborovskaya A. i dr. Sostoyanie gematoretinal’nogo bar’era pri diabeticheskoj retinopatii po dannym flyuorimetrii. Oftal’mol. zhurnal. 2008. № 5. S. 4-7. [in Russian]
- Bloomgarden Z. Screening for and managing diabetic retinopathy: current approaches. Am. j. health syst. pharm. 2007. Vol. 64. № 17 (suppl. 12). P. s8-s14.
- Agarwal A., Soliman M.K., Sepah Y.J. et al. Diabetic retinopathy: variations in patient therapeutic outcomes and pharmacogenomics. Pharmgenomics pers. med. 2014. Vol. 7. P. 399-409.
- Negre-Salvayre A., Salvayre R., Augé N. et al. Hyperglycemia and glycation in diabetic complications. Antioxid. redox signal. 2009. Vol. 11. № 12. P. 3071-3109.
- Pérez-Escamilla R., Damio G., Chhabra J. et al. Impact of a community health workers-led structured program on blood glucose control among latinos with type 2 diabetes: the DIALBEST trial. Diabetes care. 2015. Vol. 38. № 2. P. 197-205.
- Shchul’kin A.V., Kolesnikov A.V., Barenina O.I., Nikiforov A.A. Geneticheskie markery razvitiya diabeticheskoj retinopatii. Fundamental’nye issledovaniya. 2014. № 4–2. S. 411-414. [in Russian]
- Hallman D.M., Boerwinkle E., Gonzalez V.H. et al. A genome-wide linkage scan for diabetic retinopathy susceptibility genes in Mexican Americans with type 2 diabetes from Starr County, Texas. Diabetes. 2007. Vol. 56. P. 1167-1173.
- Cooke J.N., Ng M.C., Palmer N.D. et al. Genetic risk assessment of type 2 diabetes-associated polymorphisms in African Americans. Diabetes care. 2012. Vol. 35. № 2. P. 287-292.
- Grassi M.A., Tikhomirov A., Ramalingam S.S. et al. Genome-wide meta-analysis for severe diabetic retinopathy. Hum. Mol. Genet. 2011. Vol. 20. P. 2472-2481.
- Lange C.A., Stavrakas P., Luhmann U.F. et al. Intraocular oxygen distribution in advanced proliferative diabetic retinopathy. Am. J. Ophthalmol. 2011. Vol. 152. № 3. P. 406-412.
- Kempen J.H., O’Colmain B.J., Leske M.C. et al. The prevalence of diabetic retinopathy among adults in the United States. Arch. ophthalmol. 2004. Vol. 122. № 4. P. 552-563.
- Morello C. Etiology and natural history of diabetic retinopathy: an overview. Am. j. health syst. pharm. 2007. Vol. 64. № 17 (suppl. 12). s3-s7.
- Sarygina O.I., Neroev V.V., Levkina O.A. Rol’ sosudistogo endotelial’nogo faktora rosta v patogeneze diabeticheskoj retinopatii. Vestnik oftal’mologii. 2009. № 2. S. 58-60. [in Russian]
- Buraczynska M., Ksiazek P., Baranowicz-Gaszczyk I., Jozwiak L. Association of the VEGF gene polymorphism with diabetic retinopathy in type 2 diabetes patients. Nephrology dialysis transplantation. 2007. Vol. 22. № 3. P. 827-832.
- Mogіlevs’kij S.Yu., Bushuєva O.V. Rozpodіl genotipіv ta alelіv polіmorfіzmіv rs759853 і rs9640883 gena AKR1B1 u hvorih na dіabetichnu retinopatіyu, kataraktu і cukrovij dіabet 2 tipu. Arhіv oftal’mologії Ukraїni: naukovo-praktichnij medichnij zhurnal. 2016. T. 4. № 2. S. 44-49. [in Ukrainian]
- Mogilevskij S.Yu., Zyablicev S.V., Natrus L.V., Bushuєva O.V. Svyaz’ polimorfizmov rs759853 i rs9640883 gena AKR1B1 s kliniko-laboratornymi pokazatelyami pri diabeticheskoj retinopatii. Oftal’mologіchnij zhurnal. 2017. № 2. S. 3-7. [in Russian]

/14.jpg)
/15.jpg)