Резюме
Актуальність. Інфікування SARS-CoV-2 пацієнтів з хронічною хворобою нирок (ХХН) та артеріальною гіпертензією 1–2-го ступеня погіршує стан серцево-судинної системи та може сприяти реалізації негативних серцево-судинних подій та ниркових ризиків. Наявність хронічної хвороби нирок у поєднанні з артеріальною гіпертензією 1–2-го ступеня та її медикаментозною корекцією інгібіторами ренін-ангіотензин-альдостеронової системи (РААС) значно впливає на стан здоров’я пацієнтів, які інфіковані SARS-CoV-2. SARS-CoV-2 як інструмент для проникнення в клітину використовує РААС, а саме рецептор ангіотензинперетворюючого ферменту 2 (АПФ-2). Для вибору подальшої тактики лікування це поєднання трьох патологічних станів потребує ретельного аналізу і дослідження. Мета дослідження: вивчення функціонального стану нирок у пацієнтів з ХХН та артеріальною гіпертензією, інфікованих SARS-CoV-2. Матеріали та методи. Стаття є фрагментом дослідження BIRCOV (ARB, ACEi, DRi in COVID-19), яке виконано за дизайном POEM (Patient-Oriented Evidence that Matters). У проспективному дослідженні BIRCOV (двоцентрове відкрите ініціативне рандомізоване, у трьох паралельних групах) взяли участь 120 пацієнтів з ХХН та артеріальною гіпертензією 1–2-го ступеня, воно тривало 1 рік та було зареєстровано в ClinicalTrials.gov (NCT 04364984). Було відібрано 112 амбулаторних пацієнтів з артеріальною гіпертензією 1–2-го ступеня, 83 — у поєднанні з ХХН. Наприкінці дослідження залишилось 108 пацієнтів, результати дослідження яких з наступною статистичною обробкою, власне, і наведені в статті. Поділ на групи відбувався залежно від препаратів (іАПФ, БРА або прямий інгібітор реніну (ПІР)), які отримували пацієнти. Кінцевими точками були: розрахункова швидкість клубочкової фільтрації (рШКФ), середня величина артеріального тиску (АТ), рівень альбумінурії. 24 пацієнтам було зроблено аналіз співвідношення альбуміну та креатиніну сечі (САК) на початку SARS-CoV-2 та на 2, 4, 12, 24-му тижні від початку захворювання. Математична обробка та статистична оцінка результатів дослідження зроблені у пакеті медичної статистики. Результати. Усі пацієнти були розподілені на 3 групи залежно від прийому препарату (іРААС): БРА отримували 35 (32 %) пацієнтів, іАПФ — 42 (39 %), ПІР — 31 (29 %). При маніфестації SARS-CoV-2 було зафіксовано зниження показників АТ протягом перших двох тижнів від початку захворювання, а подальше повернення до вихідного рівня спостерігалося на 12-му тижні у групі пацієнтів, які отримували іАПФ, найменший показник — у групі ПІР. Порівняно з ПІР використання іАПФ та БРА у лікуванні артеріальної гіпертензії значно збільшувало ризик відміни (іАПФ: ВР 1,648, 95% ДІ 0,772–3,519, NNT 7,04; БРА: ВР 13,023, 95% ДІ 1,815–93,426, NNT 19). Протягом 24 тижнів спостереження у пацієнтів з ХХН була схожа динаміка варіабельності показників АТ. При ХХН отримано вищі значення середнього АТ порівняно з іншими учасниками дослідження BIRCOV. Зафіксовано одночасне зниження систолічного АТ та рШКФ, яке найбільш було виражене у пацієнтів із ХХН. Найменші результати виявлено у пацієнтів, які приймали іАПФ, від початку протягом 24 тижнів: коефіцієнт кореляції становив 0,815. Відмічався кореляційний зв’язок між зниженням рШКФ та стадією ХХН. У 28 осіб (іАПФ) протягом перших 4 тижнів від початку SARS-CoV-2 спостерігалось зниження рШКФ < 60 мл/хв, а в 22 пацієнтів (БРА або ПІР) абсолютний ризик становив 0,667 (ВР 2,00, 95% ДІ 1,337–2,92, NNT 3,0). Відносні ризики зниження рШКФ становили у групах відповідно 16,6 (95% ДІ 5,263–52,360, NNT 1,774) для пацієнтів, які отримували іАПФ, проти всіх пацієнтів з ХХН, 2,049 для БРА (95% ДІ 0,361–11,22) і 1,064 для ПІР проти всієї вибірки пацієнтів з ХХН (95% ДІ 0,116–9,797, NNT 431,6). Після 12 тижнів спостереження рШКФ майже повернулася до вихідного рівня при ХХН 2–3а ст. Зафіксовано підвищення САК (що не досягло вихідного рівня протягом 24 тижнів від початку захворювання) у пацієнтів з ХХН зі стабільною функцією нирок протягом перших 12 тижнів від початку SARS-CoV-2 (середні величини рШКФ статистично не відрізняються в діапазоні 2–24 тижнів). Причому пацієнти чоловічої статі мали вищий ризик прогресування ХХН до термінальної стадії. У пацієнтів з SARS-CoV-2 на другий тиждень від початку захворювання відмічалося зниження рШКФ з реципрокним підвищенням рівня сечової кислоти крові, що вірогідно відрізнялося від вихідних показників. Використання дексаметазону супроводжувалося зниженням рШКФ (Р ≤ 0,05) та збереженням цих порушень у пацієнтів з ХХН 3б–4-ї стадій до 24 тижнів спостереження (ВР 0,686, 95% ДІ 0,264–1,780, NNT 7,636). Висновки. У пацієнтів з артеріальною гіпертензією 1–2-го ступеня перебіг SARS-CoV-2 характеризувався розвитком значної артеріальної гіпотензії в групі, що приймала іАПФ, а у пацієнтів з ХХН та артеріальною гіпертензією, які приймали іАПФ, — зниженням рШКФ, артеріальною гіпотензією, збільшенням альбумінурії та САК, яке в основному мало минущий характер. У пацієнтів на БРА підвищення альбумінурії було менш значним, і вона була практично без змін у групі пацієнтів, які приймали ПІР. У групі найбільшого ризику несприятливого результату опинились пацієнти з ХХН 4-ї ст. та артеріальною гіпертензією 2-го ступеня. Авторами зроблено припущення щодо механізму впливу SARS-CoV-2 при використанні іАПФ, який був подібний до БРА («ефект БРА»), тобто, іншими словами, у пацієнтів, які приймали іАПФ, ефект зниження АТ був подібний до ефекту від подвійного блокування РААС за допомогою іАПФ + БРА.
Background. SARS-CoV-2 infection in patients with chronic kidney disease (CKD) and hypertension degree 1–2 worsens the state of the cardiovascular system and may contribute to cardiovascular events and adverse renal risks. The presence of CKD in combination with hypertension degree 1–2 and its medical correction with renin-angiotensin-aldosterone system (RAAS) inhibitors causes a significant impact on the health of patients infected with SARS-CoV-2. SARS-CoV-2 uses RAAS, namely the receptor for angiotensin-converting enzyme (ACE) 2, as a tool to enter the cell. To choose further approaches and treatment, this combination of three pathological conditions requires careful analysis and research. Objective: to study the functional state of the kidneys in patients with CKD and hypertension infected with SARS-CoV-2. Materials and methods. The article is a fragment of the BIRCOV (ARB, ACE inhibitors, DRi in COVID-19) trial, which was designed according to the POEM (Patient-Oriented Evidence that Matters). The BIRCOV (two-center, open-label, initiative-randomized, in three parallel arms) prospective study enrolled 120 patients with CKD and hypertension degree 1–2, it lasted for 1 year and was registered at ClinicalTrials.gov (NCT03336203). One hundred and twelve outpatients with degree 1–2 hypertension, 83 with combination with CKD, were selected. At the end of the study, 108 patients remained, their results are presented in the article with subsequent statistical processing. Division into groups occurred depending on the drugs received (ACE inhibitors, angiotensin receptor blockers (ARBs) or direct renin inhibitor (DRIs)). Endpoints were: estimated glomerular filtration rate (eGFR), average blood pressure, albuminuria level. In 24 patients, the urine albumin to creatinine ratio was analyzed at the beginning of SARS-CoV-2, then 2, 4, 12, 24 weeks after the onset of the disease. Mathematical processing and statistical evaluation of the research results was done in the medical statistics package. Results. All patients were divided into 3 groups depending on the drug: 35 (32 %) of them received ARBs, 42 (39 %) ACE inhibitors, 31 (29 %) DRIs. At the manifestation of SARS-CoV-2, a decrease in blood pressure was recorded during the first two weeks, with the subsequent return to baseline on week 12 in the group of people who received ACE inhibitors, the lowest indicator was in the DRI group. The use of ACE inhibitors (risk ratio (RR) 1.648, 95% confidence interval (CI) 0.772–3.519, number needed to treat (NNT) 7.0) and ARBs (RR 13.023, 95% CI 1.815–93.426, NNT 19) in the treatment of hypertension significantly increased the risk of withdrawal compared to DRIs. Patients with CKD had similar dynamics of blood pressure during 24 weeks of observation. In CKD, higher mean blood pressure values were obtained compared to other participants of the BIRCOV trial. A simultaneous decrease in eGFR and systolic blood pressure was documented, it was most pronounced in patients with CKD. The lowest results were in people who took ACE inhibitors for 0–24 weeks: the correlation coefficient was 0.815. A decrease in eGFR correlated with the degree of CKD. There was a decrease in eGFR of less than 60 ml/min during the first 4 weeks from the onset of SARS-CoV-2 in 28 people who took ACE inhibitors versus 22 who used ARBs or DRIs: absolute risk was 0.667 (RR 2.00, 95% CI 1.337–2.92, NNT 3.0). The relative risk of eGFR reduction was 16.6 (95% CI 5.263–52.360, NNT 1.774) for people receiving ACE inhibitors versus all patients with CKD, 2.049 for ARBs (95% CI 0.361–11.22, NNT 1.774) and 1.064 for DRIs versus the entire sample of people with CKD (95% CI 0.116–9.797, NNT 431.6). After 12 weeks of follow-up, eGFR almost returned to baseline in CKD stage 2–3a. An increase in the urine albumin to creatinine ratio (which did not reach the baseline within 24 weeks from the onset of the disease) was recorded in CKD patients with stable renal function during the first 12 weeks from the onset of SARS-CoV-2 (the mean values of eGFR were not statistically different within 2–24 weeks). Males had a higher risk of CKD progression to end-stage renal disease. In people with SARS-CoV-2, on the second week from the onset of the disease, a decrease in eGFR was observed with a reciprocal increase in the level of blood uric acid, which differed significantly from the baseline values. The use of dexamethasone was accompanied by a decrease in eGFR (Р ≤ 0.05) and the preservation of these disorders in people with CKD stage 3b-4 up to 24 weeks of observation (RR 0.686, 95% CI 0.264–1.780, NNT 7.636). Conclusions. The course of SARS-CoV-2 in people with hypertension degree 1–2 was characterized by the development of significant hypotension among those taking ACE inhibitors, and in patients with CKD and hypertension taking ACE inhibitors — by a decrease in GFR, hypotension, an increase in albuminuria and in the urine albumin to creatinine ratio, which was transient in most cases. Albuminuria increased less significantly in patients taking ARBs and was practically unchanged when using DRIs. Patients with CKD stage 4 and hypertension degree 2 had the greatest risks of an unfavorable prognosis. The authors hypothesized about the mechanism of SARS-CoV-2 effect when using ACE inhibitors that was similar to that of ARBs (ARB effect), i.e., in people who took ACE inhibitors, the effect of reducing blood pressure was comparable to that of the dual RAAS blockade with ACE inhibitors and ARBs.
Вступ
Серцево-судинні захворювання, як і хронічна хвороба нирок, входять до четвірки основних факторів ризику тяжкого перебігу COVID-19 [1]. Нерідко люди з артеріальною гіпертензією (АГ) не знають про наявність у них зниженої функції нирок, яка стає випадковою знахідкою на тлі вірусної інфекції. Зменшення розрахункової швидкості клубочкової фільтрації (рШКФ) у такій ситуації може мати транзиторний характер. Або ставати погіршуючим фактором вже існуючої, можливо, раніше не діагностованої хронічної хвороби нирок (ХХН).
Аналіз ниркових подій на тлі COVID-19 показав велику складність проблеми коронавірусної інфекції, що назвали синдемією [2]. «Синдемія» — термін, запропонований у 1990-х роках антропологом Мерріл Зінгер: «Дві або більше хвороби взаємодіють таким чином, що завдають більшої шкоди, ніж проста сума двох захворювань». Сенс такого процесу ще задовго був постульований в нефрології академіком АМН СРСР Є.М. Тареєвим [3].
Інфекція SARS-CoV-2 викликає генералізоване запалення ендотелію та вазодилатацію, що підтверджує причинність COVID-19 як судинного захворювання [4]. Таким чином, розвиток судинних реакцій визначає тканини-мішені при коронавірусній інфекції.
Вивчення особливостей функціонального стану нирок у людей з артеріальною гіпертензією 1–2-го ступеня, що захворіли на COVID-19, стало метою цієї статті.
Мета дослідження: вивчення особливостей функціонального стану нирок у людей з артеріальною гіпертензією 1–2-го ступеня, що захворіли на COVID-19.
Матеріали та методи
BIRCOV (ARB, ACEi, DRi in COVID-19) — двоцентрове відкрите ініціативне рандомізоване у трьох паралельних групах проспективне дослідження було зареєстровано у ClinicalTrials.gov за номером NCT 04364984 від 23.04.20 [5]. Проведено в Україні, його тривалість становила 1 рік.
Протокол дослідження. Було впроваджено дизайн POEM (Patient-Oriented Evidence that Matters, пацієнт-орієнтовані докази, які мають значення) [6] за участю пацієнтів, які страждають на артеріальну гіпертензію та інфіковані SARS-CoV-2. Ще до захворювання на коронавірусну інфекцію пацієнти з наявністю гіпертензії регулярно приймали інгібітори ренін-ангіотензин-альдостеронової системи (іРААС), а саме: інгібітори ангіо–тензинперетворюючого ферменту (іАПФ), блокатори рецепторів ангіотензину (БРА) або прямий інгібітор реніну (ПІР) для досягнення цільового систолічного артеріального тиску (АТ) < 140 мм рт.ст. (рис. 1).
Кількість людей, відібраних для дослідження, становила 120 осіб. Група дослідження: пацієнти з підтвердженим ПЛР-тестом на наявність антигену SARS-CoV-2 та попередньо встановленою артеріальною гіпертензією 1–2-го ступеня, які постійно отримували іРААС.
Метод вибірки: малоймовірна вибірка; мінімальний вік: 18 років; максимальний вік: 90 років; стать: чоловіча, жіноча.
Критерії включення: особи з гіпертензією 1–2-го ступеня.
Критерії виключення: особи з гіпертензією 3-го ступеня, серцева недостатність (за NYHA) 3–4.
Первинна кінцева точка: АТ, який був відомий хоча б за один тиждень до і був оцінений на початку дослідження, через 2, 4, 12, 24 тижні після початку SARS-CoV-2. Вторинні кінцеві точки, які були заявлені в дослідженні: кількість пацієнтів з лихоманкою (вище за 37,2 °C) до 3 тижнів після початку SARS-CoV-2; кількість пацієнтів з кашлем (тимчасові рамки: 12 тижнів); кількість пацієнтів з болем у горлі (тимчасові рамки: 2 тижні), кількість пацієнтів з діареєю (тимчасові рамки: 2 тижні) та кількість пацієнтів, яким була потрібна госпіталізація та лікування у відділенні інтенсивної терапії (тимчасові рамки: 24 тижні), представлені у звіті дослідження [7], а у цій статті аналіз цих результатів не наведений.
Інформована згода: усі пацієнти, які взяли участь у дослідженні BIRCOV, дали усну згоду на надання особистих даних.
Дослідження BIRCOV включило субаналіз пацієнтів із ХХН, які були серед відібраних пацієнтів. Первинною кінцевою точкою була оцінка рШКФ, вторинною кінцевою точкою — рівень альбумінурії (за шкалою А0–А2). 24 пацієнтам, коли це було технічно можливо, визначене співвідношення альбуміну/креатиніну (САК) у ранковій порції сечі через 0, 2, 12 та 24 тижні спостереження.
Математична обробка та статистична оцінка результатів дослідження проводилися у пакеті медичної статистики [8]. Ризик прогресування ниркової недостатності, що потребує діалізу або трансплантації (з використанням 6 критеріальних рівнянь ризику ниркової недостатності [9]), був розрахований для всіх пацієнтів ниркового відділення через 2, 4, 12 та 24 тижні від початку SARS-CoV-2.
Результати
Для участі у дослідженні було відібрано 120 амбулаторних суб’єктів, відповідали критеріям та увійшли до дослідження 112 осіб; 108 (96 %) завершили дослідження (4 померли протягом перших 2 місяців, двоє з них мали ХХН 2–3-ї стадії), їх аналіз поданий у цій статті. З них 60 (56 %) чоловіків та 48 (44 %) жінок, середній вік 55,00 ± 1,12 року (18–87; коефіцієнт варіації 0,210514, коефіцієнт асиметрії 0,261873). Госпіталізовано, у тому числі до відділення інтенсивної терапії, 4 (3,5 %) особи в дебюті COVID-19, до кінця другого тижня — 18 (16 %), до кінця третього залишалися у стаціонарі 4 особи (4 %), четвертого — 1 (1 %). У 14 осіб у терапії використовували дексаметазон.
Усі учасники дослідження мали артеріальну гіпертензію. Серед них 35 (32 %) осіб мали артеріальну гіпертензію 1-го ступеня, 73 (68 %) — 2-го ступеня. 83 (77 %) пацієнти мали ХХН 1–4-ї стадій: ХХН 1 — 23 (27 %), ХХН 2 — 46 (56 %), ХХН 3 — 10 (12 %), ХХН 4 — 4 (5 %). Серед них чоловіків було 44 (53 %), жінок — 39 (47 %). Імовірні причини розвитку ХХН наведені у табл. 1.
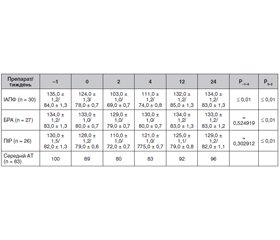
Як випливає з табл. 1, гіпертензія була причиною розвитку ХХН лише у 18 % пацієнтів. Це дозволяє трактувати наявність гіпертензії як супутнього діагнозу, що є важливим для подальшого аналізу. Усі учасники були розподілені на 3 групи залежно від прийому препарату з групи іРААС: іАПФ отримували 42 (39 %), БРА — 35 (32 %), а ПІР — 31 (29 %). 84 пацієнти (78 %) отримували комбіновану терапію з блокатором кальцієвих каналів та/або діуретиками, 17 (16 %) приймали комбінацію з бета-блокатором, 7 (6 %) — монотерапію іРААС. Причиною призначення іРААС та їх комбінації з представниками інших класів антигіпертензивних препаратів була наявність артеріальної гіпертензії. За тиждень до розвитку СOVID-19 амбулаторний артеріальний тиск становив 137,0 ± 0,9/83,0 ± 0,6 мм рт.ст. (коефіцієнт варіації 0,067728, коефіцієнт асиметрії 1,029771). Динаміка артеріального тиску у контрольних точках наведена в табл. 2.
/29.jpg)
У табл. 2 наведені вихідні значення АТ з наступним спостереженням протягом 2, 4, 12 та 24 тижнів у групах іАПФ, БРА та ПІР. Початкові значення систолічного АТ не перевищували 140 мм рт.ст. і не мали статистично значущих відмінностей між обраними ліками, що було однією із вимог при відборі пацієнтів для участі у дослідженні. У процесі розвитку коронавірусної інфекції було зафіксовано зниження АТ у перші два тижні захворювання на SARS-CoV-2 з його поступовим поверненням до вихідного рівня аж до 12-го тижня в групі пацієнтів, які отримували іАПФ, і меншою мірою така динаміка була характерна для пацієнтів, які приймали ПІР.
23 (21 %) пацієнти були змушені зменшити дозу або припинити прийом антигіпертензивних препаратів строком до 2 тижнів через тяжку артеріальну гіпотензію. Серед них 16 (38 %) осіб, які приймали іАПФ, та 7 (23 %) — ПІР. Рівень АТ після SARS-CoV-2 у більшості досліджуваних залишалися нижчим за вихідний рівень протягом наступних 4 тижнів. Більш суттєве зниження АТ спостерігали у пацієнтів з артеріальною гіпертензією 1-го ступеня: 20 (57 %) проти 29 (39 %) при гіпертензії 2-го ступеня (ВР 1,438, 95% ДІ 0,962–2,152, NNT 5,742) та у пацієнтів з ХХН: 15 (62 %) проти 9 (36 %) без ХХН (ВР 2,075, 95% ДІ 1,212–3,552, NNT 2,584). Це зниження не було пов’язане зі зневодненням через гіпертермію. У пацієнтів групи БРА не відмічалося значного зниження АТ.
Отримані дані показують, що використання іАПФ значно збільшує ризик їх відміни порівняно з ПІР (ВР 1,648, 95% ДІ 0,772–3,519, NNT 7,0) та БРА (ВР 13,023, 95% ДІ 1,815–93,426) при COVID-19.
Не менш цікавим був факт відновлення нормотензії після початку коронавірусної інфекції. Виявилося, що в групі тих, хто приймав ПІР, через 4 тижні практично не було значних відмінностей від вихідного АТ, а через 12 тижнів наслідки гіпотензії повністю ліквідувалися. Навпаки, у людей, які приймали іАПФ, нижчі показники АТ довго зберігалися у постковідний період.
4 особи померли за час проведення дослідження, таким чином, смертність серед учасників дослідження BIRCOV виявилася досить високою, становлячи 3,7 %. Двоє з пацієнтів отримували іАПФ, двоє — БРА, один із групи ХХН приймав БРА, другий із групи ХХН прий–мав іАПФ. Ризик смерті був найменшим для тих, хто отримував ПІР, абсолютний ризик для БРА порівняно з ПІР становив 0,057 (кількість хворих, яких необхідно лікувати (NNT), — 17 500), для іАПФ порівняно з ПІР — 0,048 (кількість хворих, яких необхідно лікувати, — 21 000); абсолютний ризик для БРА проти іАПФ становив 0,057 (ВР 1,200, 95% ДІ 0,178–8,087, NNT 105,0).
Динаміка варіабельності АТ у 83 пацієнтів з ХХН наведена у табл. 3.
Як випливає з наведених у табл. 3 даних, у пацієнтів з ХХН загалом відзначалася дуже схожа динаміка показників АТ протягом 24 тижнів спостереження. Привертає увагу відсутність вірогідних відмінностей у людей, які приймали ПІР у дебюті COVID-19 порівняно з вихідним доінфекційним процесом, та більш високі значення середнього артеріального тиску загалом у групі порівняно з усіма учасниками дослідження. Порівняння середнього артеріального тиску наведено на рис. 3.
Як випливає з наведених у табл. 3 та рис. 3 даних, середній артеріальний тиск був дещо вищим (статистично невірогідно) у групі пацієнтів з ХХН порівняно з усією вибіркою осіб, які увійшли до дослідження.
У табл. 4 наведені вихідні значення рШКФ з наступним спостереженням протягом 2, 4, 12 та 24 тижнів у групах іАПФ, БРА та ПІР.
Ми спостерігали одночасне зниження рШКФ та систолічного АТ, яке було більш виражене у пацієнтів із ХХН. Найбільше зниження відмічене у пацієнтів, які приймали іАПФ, протягом 0–24 тижнів: коефіцієнт кореляції становив 0,815, зв’язок між досліджуваними ознаками — прямий, сила за шкалою Чеддока — висока, число ступенів свободи становило 3, t-критерій Стьюдента дорівнює 2,43, хоча залежність ознак виявилася статистично незначимою (p = 0,135563).
Індивідуальний аналіз показав, що зниження рШКФ корелює зі стадією ХХН. Зниження рШКФ варіювало від 23 % при ХХН 1-ї ст. до 45 % при ХХН 4-ї стадії. 2 пацієнти мали потребу в короткочасному діалізі. Зниження рШКФ < 60 мл/хв протягом перших 4 тижнів від початку SARS-CoV-2 спостерігали у 28 пацієнтів, які приймали іАПФ, проти 22, які використовували БРА або ПІР: абсолютний ризик становив 0,667, відносний ризик — 2,00 (95% ДІ 1,2337–2,0, NNT 3,0). Зниження рШКФ у перші 4 тижні з переходом у більш тяжку стадію ХХН спостерігали у 18 (60 %) осіб з групи, яка отримувала іАПФ, у 2 (7,5 %) із групи БРА та в 1 пацієнта (4 %) із групи ПІР. Таким чином, відносні ризики зниження рШКФ становили в групах відповідно 16,6 (95% ДІ 5,263–52,360, NNT 1,774) для пацієнтів, які отримували іАПФ, проти всіх пацієнтів з ХХН, 2,049 для БРА (95% ДІ 0,366–11,6, NNT 26,365) і 1,064 для ПІР проти всієї вибірки осіб з ХХН (95% ДІ 0,116–9,797, NNT 431,6). Цікаво, що після 12 тижнів спостереження рШКФ практично повернулася до вихідних значень, що випливає з табл. 4.
Аналіз вторинної кінцевої точки показав, що у 24 (23 %) учасників дослідження BIRCOV без попередньої альбумінурії мала місце її поява в діапазоні А1–А2. Протягом 12 тижнів спостереження у 20 (83 %) пацієнтів альбумінурія спостерігалася в межах норми.
У пацієнтів з попередньою ХХН спостерігалося збільшення альбумінурії у 78 % (65 осіб) випадків, а її повернення до вихідного рівня спостерігалося лише у 19 (24 %) пацієнтів до 12-го тижня та 40 (48 %) — через 24 тижні.
САК було визначене у 24 пацієнтів з ХХН. Міжквартильний діапазон САК та рШКФ наведений у табл. 5.
Як випливає з наведених даних, при стабільній функції нирок (середні величини рШКФ статистично не відрізняються в діапазоні 2–24 тижні) у пацієнтів з ХХН протягом перших 12 тижнів від дебюту COVID-19 документовано підвищення співвідношення альбумін/креатинін сечі з подальшим зниженням показника протягом 4 тижнів, але вихідних значень він не досягає.
Міжквартильний діапазон САК у пацієнтів, які приймали іАПФ, БРА та ПІР, становив відповідно 530, 161,5 і 9, проте середні величини були статистично невірогідні через великий розкид величин, обумовлений різним ступенем тяжкості первинного ниркового процесу. Ризик триразового приросту САК у перші 2 тижні від дебюту COVID-19 становив для осіб, які приймали іАПФ, 2,068 (95% ДІ 0,816–5,241, NNT 3,043), БРА — 0,75 (95% ДІ 0,270–2,080, NNT 8,000), ПІР — 0,422 (95% ДІ 0,069–2,596, NNT 3,654). Для 24 пацієнтів з ХХН був розрахований дво- та п’ятирічний прогноз ризику розвитку термінальної ниркової недостатності [9], результати якого наведені в табл. 6.
Як випливає з наведених у табл. 6 даних, пацієнти чоловічої статі мали більш високий ризик термінальної ниркової недостатності. Водночас цей показник зазнав оборотного розвитку до 24 тижнів спостереження за учасниками дослідження. Рівень урикемії був доступний для 18 пацієнтів на всіх етапах контрольних точок. Його показники наведені у табл. 7.
Як випливає з наведених у табл. 7 даних, у людей із SARS-CoV-2 на другий тиждень від дебюту захворювання спостерігається зниження рШКФ і, ймовірно, реципрокне підвищення рівня сечової кислоти крові, що вірогідно відрізняються від вихідних показників. Порівняння двох показників у динаміці свідчить, що коефіцієнт кореляції дорівнює –0,871, зв’язок між досліджуваними ознаками зворотний, сила зв’язку за шкалою Чеддока висока, проте залежність ознак статистично незначуща (p = 0,091407). При цьому зниження рШКФ у пацієнтів з ХХН на 15–22 % більш значуще, як і підвищення урикемії, що перевищило в окремих пацієнтів 550 мкмоль/л.
Аналіз індивідуальних показників 14 пацієнтів, у яких у госпітальній терапії використовували дексаметазон понад 7 днів, показав, що рШКФ знизилася з 67,0 ± 1,9 до 46,0 ± 2,0 мл/хв/1,73 м2 (за CKD-EPI) (P ≤ 0,01) у терміни 3-тижневого спостереження. Коректно оцінити вплив інших факторів, крім використання дексаметазону, було неможливо. Відновлення рШКФ до вихідних показників на 24-му тижні моніторингу спостерігали у 10 пацієнтів (71 %). У 4 пацієнтів мала місце ХХН 3б–4-ї стадії, що говорить про більш високі ризики невідновлення функції нирок порівняно з усією групою, у цьому дослідженні відносний ризик становив 0,686 (95% ДІ 0,264–1,780, NNT 7,636).
Щеплення
Вакцину проти коронавірусу (Coronovac) та мРНК отримали 54 людини (22 пацієнти без ХХН та 32 з ХХН). Пацієнти без ХХН не показали помітного погіршення функції нирок або альбумінурії після обох вакцинацій. На відміну від цього пацієнти з ХХН 3–4, які отримували мРНК, мали виражене зниження функції нирок (n = 12, 30,0 ± 2,0 мл/хв/1,73 м2 до вакцинації та через 4 тижні після неї 16,0 ± 2,7 мл/хв/1,73 м2, p = 0,000378) та альбумінурію (n = 12, 131,0 ± 14,1 мг/ммоль до вакцинації та через 4 тижні після неї 216,0 ± 12,6 мл/хв/1,73 м2, p = 0,000199), в 1 пацієнта ХХН 4 прогресувала до ХХН 5, що потребує гемодіалізу.
Обговорення
У цьому дослідженні кількість хворих серед чоловіків на 12 % перевищувала таку в жінок, а серед людей з ХХН — лише на 3 %. Відомо, що особи чоловічої статі мають вищі рівні рецептора АПФ-2, зокрема, такий феномен є у людей із серцевою недостатністю [10]. SARS-CoV-2 використовує саме рецептор АПФ-2 для входу в клітину і агресивніший варіант Delta, що містить багато мутацій в субодиниці S1, поліпшує його здатність зв’язуватися з АПФ-2 [11]. Можливо, це пояснює різницю у більшій частоті захворюваності на SARS-CoV-2 у світі у чоловіків, так само як і їхньої смертності [12] у загальній популяції та серед пацієнтів із ХХН [13]. Дані дослідження BIRCOV, що наведені у табл. 6, також підтвердили більш високий ризик розвитку термінальної ниркової недостатності у чоловіків.
Дані цього дослідження показали, що більш значне зниження артеріального тиску спостерігали у пацієнтів, які приймали іАПФ, дещо меншою мірою — при прийомі ПІР та статистично непоказовою зміна АТ була при використанні БРА. Однакові умови входження в дослідження дозволяють припустити, що розвиток гіпотензії не був пов’язаний із зневодненням через гіпертермію. Раніше нами встановлено, що примусова гідратація може бути корисною при ХХН 1 і втрачає свій терапевтичний сенс з прогресуванням зниження функції нирок [14, 15]. Оскільки 73 % спостережуваних мали ХХН 2–4-ї ст., можна припустити наявність тенденції до затримки рідини у більшості учасників дослідження через певне обмеження водовидільної функції нирок. Ймовірно, тенденція до ретенції рідини при ХХН 2–4-ї ст. у певному сенсі може захищати людей при коронавірусній інфекції від надмірного зневоднення навіть на тлі гіпертермії.
J.B. Cohen із співавт. (2021) [16] припустили 3 можливі механізми впливу іАПФ та БРА при COVID-19: іАПФ/БРА несприятливі для перебігу інфекції, іАПФ/БРА допомагають організму та іАПФ несприятливі, а БРА нейтральні. Дослідження BIRCOV підтверджує третю версію цих авторів. Більш того, ми припускаємо, що SARS-CoV-2 через ланцюжок «рецептор АПФ-2 — рецептор Mas1» провокує вазодилатацію і, таким чином, у людей, які приймають іАПФ, клінічно схожий з комбінацією іАПФ + БРА. Тобто SARS-CoV-2 за своєю дією на РААС виявляє властивості БРА — «ефект БРА». Саме тому при коронавірусній інфекції в осіб, які приймають іАПФ, виникає клінічний варіант як у тих, які приймають ІАПФ + БРА і формується артеріальна гіпотензія, у тих, що приймають ПІР, механізм впливу подібний до ПІР + БРА і гіпотензія менш виражена, а у тих, які отримують БРА, ефект БРА + БРА не призводить до статистично значного зниження АТ. Можливо, пояснення полягає в аналізі доступних клінічних та лабораторних даних про те, що іАПФ не змінюють активність або помірно підвищують АПФ-2, БРА та антагоністи мінералокортикоїдних рецепторів підвищують як активність, так і експресію, а ПІР нейтральні або знижують експресію цього рецептора [17–19]. Питання про ризики гіперкаліємії при «ефекті БРА» не увій–шло до цього аналізу.
Встановлений у дослідженні BIRCOV феномен зниження АТ, можливо, через «ефект БРА» від SARS-CoV-2, важливо розглянути в аспекті летальності при SARS-CoV-2. Показово, що SARS-CoV-2, забезпечуючи ефект подвійної блокади РААС у людей, які отримують іАПФ або ПІР, не посилює гіпотензивного ефекту у тих, хто приймає БРА. У наведених даних не зафіксовано жодного летального результату при прийомі ПІР. Навпаки, навіть за скромної, але від того не менш трагічної статистики 4 смертей абсолютний і відносний ризик смерті для БРА вищий, ніж для іАПФ. Таким чином, ризик смерті був найвищий у тих пацієнтів з гіпертензією, які отримували БРА, незважаючи на наявність значної артеріальної гіпотензії в групі іАПФ.
Серед доступної літератури є аналіз 8910 пацієнтів із SARS-CoV-2, який показав більш високу летальність у пацієнтів із групи БРА порівняно з групою іАПФ, хоча статистично невірогідну: ризик госпітальної смерті, пов’язаний із застосуванням іАПФ (2,1 проти 6,1 %, коефіцієнт шансів 0,33; 95% ДІ 0,20–0,54) проти БРА (6,8 проти 5,7 %; коефіцієнт шансів 1,23; 95% ДІ 0,87–1,74) [20]. Докази рандомізованих клінічних випробувань свідчать про зниження ризику розвитку пневмонії у людей, які приймали іАПФ, що не спостерігалося при прийомі БРА, та значно менший ризик госпіталізації серед групи Medicare (HR, 0,61; P = 0,02), для іАПФ спостерігалося зниження на 40 % смертельних подій у пацієнтів Medicare [19].
За результатами дослідження ERACODA, смертність пацієнтів, які отримували діаліз (36 осіб), становила 33 % серед тих, хто отримував іАПФ, проти 67 %, які приймали БРА. Аналогічна тенденція була відзначена у реципієнтів ниркового трансплантата (n = 22) — 20 проти 25 % [21, 22]. Ми далекі від твердження про несприятливіший вплив на смертність і летальність БРА порівняно з іАПФ і ПІР, але звертаємо увагу на наявні дані.
Найменша вибірка пацієнтів з ХХН мала аналогічні тенденції у зниженні АТ, підтверджуючи «ефект БРА» у людей з артеріальною гіпертензією, які приймали іАПФ. Пацієнти з ХХН прагнули у зниженні АТ досягти цільового систолічного тиску < 130 мм рт.ст. Тому, ймовірно, їх початкові цифри АТ були дещо нижчими, ніж у загальній групі учасників дослідження BIRCOV. Навпаки, середній АТ був вищим, відображаючи, ймовірно, наявність ХХН.
Більш виражене зниження рШКФ відповідало найбільшому зниженню АТ, що відзначали у людей, які приймали іАПФ. При цьому наявність ХХН значно підвищувала ризик критичного порушення втрати функції нирок, яке потребує проведення нирково-замісної терапії. Зниження АТ пояснює зменшення рШКФ і може погіршувати клінічний стан пацієнтів, що є показовим, наприклад, при діабетичній нефропатії [23].
При гіпертензивній нефропатії зниження АТ може призводити до зменшення альбумінурії [24]. У цьому дослідженні зниження АТ не супроводжувалося одночасним зниженням альбумінурії та САК. Навпаки, ці показники мали 2–4-кратний приріст на тлі SARS-CoV-2, що, ймовірно, підкреслює токсичний характер впливу SARS-CoV-2 і не пов’язане з гемодинамічним компонентом. В експериментальних моделях показано, що експресія рецептора АПФ-2 у нирках значно знижується, але залишається незмінною у пацієнтів, які хворіють на COVID-19, що, очевидно, пояснює зниження рШКФ. При цьому використання олмесартану знижувало екскрецію альбуміну із сечею [25], що відзначено для всієї групи БРА у дослідженні BIRCOV.
Зниження рШКФ та реципрокне підвищення сечової кислоти, очевидно, має компенсаторне значення. Відомо, що сечова кислота підвищує тонус симпатичної системи, зокрема, через збільшення чутливості до натрію [26, 27].
Використання дексаметазону для зниження госпітальної смертності вважається виправданим за SARS-CoV-2 [28], загальна думка схиляється до його ефективності при цій інфекції [29]. Водночас відомо і про погіршення функціонального стану нирок при низькій рШКФ на тлі використання гормонів, що може бути пов’язано з процесами гіперфільтрації [30]. Можливо, при зниженій функції нирок збільшення фільтраційних процесів, що індукується дексаметазоном, дійсно може знижувати рШКФ до критичних значень. Цей механізм обговорювався нами раніше [14, 15]. З практичної точки зору видається очевидним, з одного боку, накопичувати досвід, а з іншого боку, не захоплюватися призначенням гормонів при SARS-CoV-2, особливо при зниженій функції нирок.
Висновки
Перебіг SARS-CoV-2 у людей з артеріальною гіпертензією 1–2-го ступеня супроводжувався розвитком значної артеріальної гіпотензії у пацієнтів, які прий–мають іАПФ. Такий характер зниження АТ дозволяє порівняти вплив SARS-CoV-2 з подібним БРА («ефект БРА»), тобто у пацієнтів, які приймали іАПФ, ефект зниження АТ був порівнянний з подвійним блокуванням РААС: іАПФ + БРА. Найбільш виражене зниження АТ відзначали у пацієнтів з артеріальною гіпертензією 1-го ступеня та пацієнтів з ХХН.
Розвиток артеріальної гіпотензії у пацієнтів з артеріальною гіпертензією 1–2-го ступеня, які приймали іАПФ, був нетривалим, супроводжувався реципрокним зниженням рШКФ і/або появою альбумінурії та гіперурикемії. Найбільш значне зниження рШКФ мало місце при ХХН 4-ї стадії.
Перебіг SARS-CoV-2 у пацієнтів з ХХН та артеріальною гіпертензією, які приймають іАПФ, супроводжувався значною артеріальною гіпотензією, зниженням рШКФ, підвищенням альбумінурії та САК, що мало в більшості випадків транзиторний характер. Найбільші ризики життєво небезпечних ускладнень мали пацієнти з ХХН 4 та артеріальною гіпертензією 2-го ступеня. Відновлення показників рШКФ та альбумінурії відзначено не у всіх таких пацієнтів у терміни до 24 тижнів від початку SARS-CoV-2.
Найменша кількість негативних ефектів відмічена у людей, які приймали ПІР як основну антигіпертензивну терапію при лікуванні артеріальної гіпертензії.
Викликає дискусії використання дексаметазону у пацієнтів з ХХН 3б–4-ї стадії з АГ 2-го ступеня при SARS-CoV-2 через значне зниження рШКФ.
Вакцинація у пацієнтів із ХХН може призвести до погіршення функції нирок, але це твердження потребує додаткових досліджень у паралельних групах.
Конфлікт інтересів. Авторка заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Інформація про фінансування. Спонсором дослідження виступило ТОВ «Медична практика проф. Д. Іванова»™.
Отримано/Received 11.01.2023
Рецензовано/Revised 24.01.2023
Прийнято до друку/Accepted 31.01.2023
Список литературы
1. Ivanov D.D., Gozhenko A.I., Ivanova M.D., Zavalnaya I.N. Effect of COVID-19 on kidney function in patients with arterial hypertension grade 1–2 and CKD. Nephrology (Saint-Petersburg). 2022. 26(1). 34-43 (In Russ.). doi: 10.24884/1561-6274-2022-26-1-34-43.
2. Leibler J.H., Keogh S.A., Jarquín E., Garcia-Trabanino R., Velázquez J.J.A., Pilarte D.L., et al. COVID-19 and CKD: Employment, Food Security and Healthcare in El Salvador. Ann. Glob. Health. 2022 Nov 9. 88(1). 101. doi: 10.5334/aogh.3820. PMID: 36415326; PMCID: PMC9650984.
3. Diamantidis C.J., Cook D.J., Dunning S., Redelosa C.K., Bartolome M.F.D., Romero R.A.A., et al. Missing Care: the Initial Impact of the COVID-19 Pandemic on CKD Care Delivery. J. Gen. Intern. Med. 2022 Dec. 37(16). 4241-4247. doi: 10.1007/s11606-022-07805-w. Epub 2022 Sep 26. PMID: 36163529; PMCID: PMC9512959.
4. Carriazo S., Villalvazo P., Ortiz A. More on the invisibility of chronic kidney disease… and counting. Clin. Kidney J. 2021 Nov 27. 15(3). 388-392. doi: 10.1093/ckj/sfab240. PMID: 35198154; PMCID: PMC8690216.
5. Huang W., Li B., Jiang N., Zhang F., Shi W., Zuo L., et al. Impact of the COVID-19 pandemic on patients with chronic kidney disease: A narrative review. Medicine (Baltimore). 2022 Jun 17. 101(24). e29362. doi: 10.1097/MD.0000000000029362. PMID: 35713437; PMCID: PMC9276167.
6. Niculae A., Peride I., Nechita A.M., Petcu L.C., Tiglis M., Checherita I.A. Epidemiological Characteristics and Mortality Risk Factors Comparison in Dialysis and Non-Dialysis CKD Patients with COVID-19-A Single Center Experience. J. Pers. Med. 2022 Jun 13. 12(6). 966. doi: 10.3390/jpm12060966. PMID: 35743751; PMCID: PMC9224649.
7. Banerjee S., Patel H.V., Engineer D.P., Gupta V., Patel H., Gupta A., et al. COVID-19 in Hemodialysis Patients: Experience from a Western Indian Center. Indian J. Nephrol. 2022 May-Jun. 32(3). 216-222. doi: 10.4103/ijn.IJN_575_20. Epub 2021 Dec 30. PMID: 35814322; PMCID: PMC9267078.
8. Park H.C., Lee Y.K., Ko E., Yu S., Cho A., Kim D.H., et al. COVID-19-related clinical outcomes among Korean hemodialysis patients. Kidney Res. Clin. Pract. 2022 Sep. 41(5). 591-600. doi: 10.23876/j.krcp.22.023. Epub 2022 Jun 21. PMID: 35791744; –PMCID: PMC9576454.
9. Ortiz A.; Asociación Información Enfermedades Renales Genéticas (AIRG-E), European Kidney Patients’ Federation (EKPF), Federación Nacional de Asociaciones para la Lucha Contra las Enfermedades del Riñón (ALCER), Fundación Renal Íñigo Álvarez de Toledo (FRIAT), Red de Investigación Renal (REDINREN), Resultados en Salud 2040 (RICORS2040), Sociedad Española de Nefrología (SENEFRO) Council, Sociedad Española de Trasplante (SET) Council, Organización Nacional de Trasplantes (ONT). –RICORS2040: the need for collaborative research in chronic kidney disease. Clin. Kidney J. 2021 Sep 23. 15(3). 372-387. doi: 10.1093/ckj/sfab170. PMID: 35211298; PMCID: PMC8862113.
10. Yang L., Li J., Wei W., Yi C., Pu Y., Zhang L., et al. Kidney health in the COVID-19 pandemic: An umbrella review of meta-analyses and systematic reviews. Front. Public Health. 2022 Sep 12. 10. 963667. doi: 10.3389/fpubh.2022.963667. PMID: 36172213; PMCID: PMC9511113.
11. Kouhpayeh H. Clinical features predicting COVID-19 mortality risk. Eur. J. Transl. Myol. 2022 Apr 12. 32(2). 10268. doi: 10.4081/ejtm.2022.10268. PMID: 35421918; PMCID: PMC9295175.
12. Ramamurthy P., Rajashekhar R., Kulkarni A., Prabhu D., Kumar A., Ravindra R., Ramamurthy P. Study of Disease Severity and Outcomes in COVID-19 Patients With Chronic Kidney Disease at a Tertiary Care Hospital in South India. Cureus. 2022 Jan 19. 14(1). e21413. doi: 10.7759/cureus.21413. PMID: 35103220; PMCID: PMC8769075.
13. Filev R., Rostaing L., Lyubomirova M., Bogov B., Kalinov K., Svinarov D. COVID-19 Infection in Chronic Kidney Disease Patients in Bulgaria: Risk Factors for Death and Acute Kidney Injury. J. Pers. Med. 2022 Oct 9. 12(10). 1676. doi: 10.3390/jpm12101676. PMID: 36294815; PMCID: PMC9605526.
14. Vahdat S. Clinical profile, outcome and management of kidney disease in COVID-19 patients — a narrative review. Eur. Rev. Med. Pharmacol. Sci. 2022 Mar. 26(6). 2188-2195. doi: 10.26355/eurrev_202203_28367. PMID: 35363369.
15. La Porta E., Baiardi P., Fassina L., Faragli A., Perna S., Tovagliari F., et al. The role of kidney dysfunction in COVID-19 and the influence of age. Sci. Rep. 2022 May 23. 12(1). 8650. doi: 10.1038/s41598-022-12652-0. PMID: 35606394; PMCID: PMC9125966.
16. Puicón-Suárez J.B., Zeña-Ñañez S., Failoc-Rojas V.E. Association between chronic kidney disease and mortality in patients with a confirmed COVID-19 diagnosis. Peer J. 2022 Jun 14. 10. e13437. doi: 10.7717/peerj.13437. PMID: 35722260; PMCID: PMC9205307.
17. Branco C.G., Duarte I., Gameiro J., Costa C., Marques F., Oliveira J., et al. Presentation and outcomes of chronic kidney disease patients with COVID-19. J. Bras. Nefrol. 2022 Jul-Sep. 44(3). 321-328. doi: 10.1590/2175-8239-JBN-2021-0071. PMID: 34762092; PMCID: PMC9518619.
18. Kesiena O., Papadopoulos P., Amakye D., Hama E., Ma–ckay R. COVID-19 associated collapsing glomerulopathy presenting as acute kidney injury on chronic kidney disease: a case report and review of the literature. CEN Case Rep. 2022 May. 11(2). 273-277. doi: 10.1007/s13730-021-00667-x. Epub 2021 Nov 26. PMID: 34825347; PMCID: PMC8616717.
19. Chiang K.C., Imig J.D., Kalantar-Zadeh K., Gupta A. Kidney in the net of acute and long-haul coronavirus disease 2019: a potential role for lipid mediators in causing renal injury and fibrosis. Curr. Opin. Nephrol. Hypertens. 2022 Jan 1. 31(1). 36-46. doi: 10.1097/MNH.0000000000000750. PMID: 34846312.
20. Ciceri P., Bono V., Magagnoli L., Sala M., d’Arminio Monforte A., Galassi A., et al. Cytokine and Chemokine Retention Profile in COVID-19 Patients with Chronic Kidney Disease. Toxins (Basel). 2022 Sep 28. 14(10). 673. doi: 10.3390/toxins14100673. PMID: 36287942; PMCID: PMC9611576.
21. Corrêa H.L., Deus L.A., Araújo T.B., Reis A.L., Amo–rim C.E.N., Gadelha A.B., et al. Phosphate and IL-10 concentration as predictors of long-covid in hemodialysis patients: A Brazilian study. Front. Immunol. 2022 Sep 30. 13. 1006076. doi: 10.3389/fimmu.2022.1006076. PMID: 36248863; PMCID: PMC9562993.
22. Aroca-Martínez G., Musso C.G., Avendaño-Echavez L., Vélez-Verbel M., Chartouni-Narvaez S., Hernandez S., et al. Diffe–rences between COVID-19-induced acute kidney injury and chronic kidney disease patients. J. Bras. Nefrol. 2022 Apr-Jun. 44(2). 155-163. doi: 10.1590/2175-8239-JBN-2021-0161. PMID: 35258071; PMCID: PMC9269183.
23. Ekin A., Coskun B.N., Dalkilic E., Pehlivan Y. The effects of COVID-19 infection on the mortality of patients receiving rituximab therapy. Ir. J. Med. Sci. 2022 Oct 19. 1–15. doi: 10.1007/s11845-022-03193-6. Epub ahead of print. PMID: 36258064; PMCID: PMC9579651.
24. Appelman B., Oppelaar J.J., Broeders L., Wiersinga W.J., Peters-Sengers H., Vogt L.; Covid Predict Study Group. Mortality and readmission rates among hospitalized COVID-19 patients with varying stages of chronic kidney disease: a multicenter retrospective cohort. Sci. Rep. 2022 Feb 10. 12(1). 2258. doi: 10.1038/s41598-022-06276-7. PMID: 35145189; PMCID: PMC8831646.
25. Zolotov E., Sigal A., Havrda M., Jeřábková K., Krátká K., Uzlová N., Rychlík I. Can Renal Parameters Predict the Mortality of Hospitalized COVID-19 Patients? Kidney Blood Press. Res. 2022. 47(5). 309-319. doi: 10.1159/000522100. Epub 2022 Jan 20. PMID: 35051925; PMCID: PMC9059033.
26. Goh B.L., Shanmuganathan M., Peariasamy K., Misnan N.A., Chidambaram S.K., Wong E.F.S., et al. COVID-19 death and kidney disease in a multiracial Asian country. Nephrology (Carlton). 2022 Jul. 27(7). 566-576. doi: 10.1111/nep.14045. Epub 2022 May 7. PMID: 35438223; PMCID: PMC9115296.
27. Frittoli M., Cassia M., Barassi A., Ciceri P., Galassi A., Conte F., et al. Efficacy and Safety of COVID-19 Vaccine in Patients on Renal Replacement Therapy. Vaccines (Basel). 2022 Aug 25. 10(9). 1395. doi: 10.3390/vaccines10091395. PMID: 36146472; PMCID: PMC9504940.
28. Mansouri L., Sendic S., Havervall S., Thålin C., Jacobson S.H., Lundahl J. Role of kidney function and concentrations of BAFF, sPD-L1 and sCD25 on mortality in hospitalized patients with COVID-19. BMC Nephrol. 2022 Sep 2. 23(1). 299. doi: 10.1186/s12882-022-02924-2. PMID: 36056305; PMCID: PMC9438228.
29. Jennifer K., Shirley S.B.D., Avi P., Daniella R.C., Naama S.S., Anat E.Z., et al. Post-acute sequelae of COVID-19 infection. Prev. Med. Rep. 2023 Feb. 31. 102097. doi: 10.1016/j.pmedr.2022.102097. Epub 2022 Dec 21. PMID: 36567743; PMCID: PMC9767882.
30. Rana R., Ranjan V., Kumar N., Chugh P., Khillan K., Gogia A., et al. Association of underlying comorbidities and progression of COVID-19 infection amongst 2586 patients hospitalised in the National Capital Region of India: a retrospective cohort study. Mol. Cell Biochem. 2023 Jan. 478(1). 149-160. doi: 10.1007/s11010-022-04485-2. Epub 2022 Jun 25. PMID: 35750979; PMCID: PMC9244570.
31. Cuevas-Budhart M.Á., Celaya Pineda I.X., Perez Moran D., Trejo Villeda M.A., Gomez Del Pulgar M., Rodríguez Zamora M.C., et al. Patient experience in automated peritoneal dialysis with telemedicine monitoring during the COVID-19 pandemic in Mexico: Qualitative study. Nurs Open. 2023 Feb. 10(2). 1092-1101. doi: 10.1002/nop2.1377. Epub 2022 Oct 13. PMID: 36229915; PMCID: PMC9834531.
/28.jpg)
/30.jpg)

/27.jpg)
/29.jpg)
/30_2.jpg)
/31.jpg)