Вступ
Гіпертензивні розлади під час вагітності (ГРВ) залишаються однією з основних причин материнської та внутрішньоутробної захворюваності та смертності, пов’язаної з вагітністю, в усьому світі. У такому випадку жінки, незалежно від наявності традиційних серцево-судинних ризиків, також мають підвищений ризик серцево-судинних захворювань у подальшому житті [1]. Прееклампсія (ПЕ) є найважчим розладом, спричиненим ГРВ, і є однією з основних причин материнської смертності [2]. Будучи найважливішою причиною ятрогенної недоношеності, ПЕ є основним фактором перинатальної смерті й затримки росту плода [3].
Плацентарна недостатність (або матково-плацентарна судинна недостатність) є ще однією важливою проблемою під час вагітності, яка ставить під загрозу ріст плода і підвищує ризики низької маси тіла при народженні, внутрішньоутробної затримки росту плода (ВЗРП), передчасних пологів і мертвонародження [4–7].
У нещодавно проведеному Goto [8] систематичному огляді й метааналізі досліджень на людях підтверджено патофізіологічну роль L-аргініну (L-Arg) щодо функції плаценти та еластичності судин, від яких можуть залежати результати вагітності [5], і повідомлено про сприятливі ефекти перорального прийому L-Arg у пренатальному періоді щодо результатів пологів.
L-Arg має потенціал щодо поліпшення результатів пологів при його використанні в період до і після зачаття, а також є корисним для вагітних жінок. Однак, незважаючи на те, що застосування аргініну вивчалося різними дослідниками, усе ще залишаються невивченими багато аспектів, у яких він може відігравати певну роль, наприклад, вплив на метаболічний профіль під час вагітності.
Метою даного систематичного огляду було узагальнення результатів основних досліджень, проведених на людях і тваринах, яким призначали L-аргінін перорально або внутрішньовенно під час вагітності, з точки зору наслідків вагітності й перинатального періоду, щоб остаточно підкреслити перспективи майбутніх досліджень цієї напівнезамінної амінокислоти.
Матеріали та методи
Літературний пошук і збір даних
Цей систематичний огляд був зроблений відповідно до рекомендацій PRISMA [9].
У PubMed (www.ncbi.nlm.nih.gov) було проведено комплексний пошук літератури щодо досліджень, опублікованих із січня до вересня 2022 року, за ключовими словами: «L-аргінін», або «аргінін», або «донор оксиду азоту», або «призначення аргініну і прееклампсія», або «високий ризик під час вагітності», або «затримка росту плода», або «гіпертензія», або «гіпертензія під час вагітності», або «перинатальні наслідки». На додаток до пошуку в базі даних ми провели повнотекстовий огляд досліджень, включених до метааналізів, у яких вивчався вплив на перинатальні результати застосування L-Arg під час вагітності з високим ризиком, вибравши ще 4 дослідження з двох метааналізів [8, 10].
Цей систематичний огляд включав дослідження як на людях, так і на тваринах. Ми обмежили наш пошук дослідженнями, опублікованими англійською мовою. Після пошуку оглядові статті були виключені зі списків літератури.
Відбір досліджень
Після відбору статей з PubMed було видалено їх дублікати, а в статтях, що залишилися, були оцінені заголовки та анотації, і невідповідні дослідження були виключені. Повні тексти досліджень, які вважалися релевантними, були детально переглянуті на відповідність критеріям включення. Були виключені рецензії, листи до редакції, описи зустрічей та інші статті, що повідомляють про дослідження, які не надали первинних даних.
Публікації включалися до підсумкового аналізу, якщо вони відповідали таким критеріям включення: дослідження, у яких вивчали ефекти L-аргініну під час вагітності або в прегестаційному й постнатальному періоді. Були виключені дослідження з неясними деталями лікування або з використанням комбінацій кількох амінокислот. Як первинна або вторинна кінцева точка використовувався принаймні один з таких результатів: артеріальна гіпертензія в матері, прееклампсія, обмеження/затримка росту плода, фетоплацентарна гемодинаміка, вага при народженні, перинатальні результати. У разі застосування L-Arg у людей розглядалися лише рандомізовані контрольовані дослідження і проспективні або ретроспективні когортні дослідження.
Було виключено: описові огляди, систематичні огляди й метааналізи, дослідження, що оцінюють патофізіологічні, а не клінічні результати, дослідження, опубліковані іншими мовами, крім англійської.
Аналіз
Результати, що оцінювалися, включали гіпертензивні розлади в матері, прееклампсію, обмеження/затримку росту плода і перинатальні результати. Гіпертензивні розлади в матері визначали як значення артеріального тиску понад 140/85 мм рт.ст., прееклампсію — як підвищення артеріального тиску, пов’язане з протеїнурією та/або наявністю порушень функції нирок або печінки, неврологічними ознаками, гемолізом або тромбоцитопенією і/або недорозвитком плода [11].
Обмеження росту плода визначалося як маса плода < 10-го перцентиля [12], тоді як перинатальні результати включали масу тіла при народженні, оцінку за шкалою Апгар, спосіб пологів, госпіталізацію у відділення інтенсивної терапії.
Якщо була можливість, ми також досліджували зв’язок між рівнями артеріального тиску в матері під час вагітності та наслідками для плода.
Результати
Блок-схема
Під час пошуку літератури було знайдено 1028 статей, з яких вилучено 21 дублікат. Решту 1007 статей було проаналізовано і встановлено, що 75 з них відповідали критеріям включення. Потім ці дослідження оцінювали на відповідність, у результаті чого були виключені 5 описових оглядів, 10 систематичних оглядів і метааналізів, 2 дослідження з неясними стратегіями лікування, 3 дослідження з оцінкою патофізіологічної основи захворювання і 4 дослідження з недоступним повним текстом. Отже, наш огляд був обмежений 51 дослідженням рис. 1.
Дослідження, проведені на людях
Дози і тривалість призначення
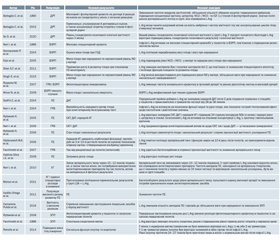
Серед 25 досліджень, проведених на людях, L-аргінін застосовували перорально в 16, внутрішньовенно — у 8, а в решті досліджень поєднували обидва способи ведення, як зазначено в табл. 1. Дози для перорального прийому коливалися від 1 г/добу [13] до 16 г/добу [14, 15], тривалість лікування становила від 8–10 днів [15] до всього терміну вагітності [16]. Внутрішньовенне введення в основному застосовували при невідкладній терапії гіпертензії, ПЕ або тяжкій ВЗРП, призначалися дози від 15 г (у 500 мл 5% глюкози) [17] до 30 г (у 100 мл фізіологічного розчину) [18]. Лікування зазвичай тривало один день, за винятком дослідження Xiao et al. [19], де жінкам з ВЗРП L-аргінін вводили протягом 7 днів.
L-аргінін і допоміжні репродуктивні технології
У трьох дослідженнях L-аргінін призначали жінкам, у яких використовували допоміжні репродуктивні технології (ДРТ) [14, 15, 20]; його призначали перорально на додаток до аналога гонадотропін-рилізинг гормону (ГРГ) і чистого фолікулостимулюючого гормону (чФСГ) [14, 15] або на додаток до фолієвої кислоти та вітаміну E [20]. У результаті лікування L-аргініном спостерігалося менше скасованих циклів, збільшувалася кількість ооцитів і перенесених ембріонів, збільшувався вміст нітритів/нітратів у плазмі й фолікулярній рідині, а також в одному дослідженні спостерігалося поліпшення потоку на доплерографії [15]. Повідомлялося про негативний вплив L-Arg на якість ембріона і частоту вагітності під час контрольованих циклів гіперстимуляції яєчників через обернену кореляцію між концентрацією нітритів/нітратів у фолікулярній рідині та якістю ембріона [14]. Навпаки, So [20] повідомив, що в разі призначення L-Arg, особливо у випадках чоловічого безпліддя, частота як біохімічної, так і клінічної вагітності вірогідно збільшувалася (табл. 2).
L-аргінін і затримка росту плода
У 7 дослідженнях L-аргінін застосовували в жінок, які виношували плід із ВЗРП: трьом із них L-аргінін вводили внутрішньовенно, тоді як решті 4 — перорально. Загалом дослідження продемонстрували, що інфузія L-аргініну впливає на матково-плацентарний кровообіг шляхом зниження індексу пульсації маткової артерії [18], поліпшення ваги при народженні [19, 21, 22], зменшення апоптозу плаценти й поліпшення функції плаценти й росту плода [17]. L-аргінін також знижує частоту аномального кровотоку в пупковій артерії та ранню діастолічну насічку в матковій артерії [23], будучи неефективним при тяжкій судинній ВЗРП, можливо, через затримку росту тяжкого ступеня (3-й процентиль) і недоношену вагітність (28 тижнів) [24] (табл. 2).
L-аргінін і гіпертензивні розлади під час вагітності
В 11 дослідженнях L-Arg використовувався для лікування жінок з гіпертензивними розладами вагітності, хронічною гіпертензією (ХГ) або прееклампсією. У трьох дослідженнях L-Arg вводили внутрішньовенно, у семи — перорально, а в одному — перорально або внутрішньовенно (у випадках неможливості перорального прийому) [25].
П’ять досліджень включали жінок з діагнозом ПЕ [25–29], і лікування тривало від 2 днів (невідкладне лікування) [27] до 3 тижнів [29]. L-аргінін знижував систолічний артеріальний тиск (САТ), діастолічний артеріальний тиск (САТ), середній артеріальний тиск і збільшував 24-годинну екскрецію NOx із сечею, а також рівні L-цитруліну в плазмі [26]. Крім того, L-Arg помітно поліпшив ріст плода [29], його самопочуття, неонатальний результат і тривалість вагітності [28]. L-аргінін також значно поліпшував артеріальний тиск і функцію нирок на 10-й день після пологів, не прискорюючи поліпшення стану жінок з ПЕ [25]. У жінок з ПЕ з тривалістю гестації від 28 до 36 тижнів невідкладна терапія за допомогою L-аргініну (призначали 4 г L-аргініну протягом 2 днів перорально) не привела до зниження середнього діастолічного артеріального тиску порівняно з плацебо (A.C. Staff).
Було проведено три дослідження за участю жінок із ГРВ [30–32], у них L-Arg вводили внутрішньовенно (20 г/день протягом максимум 5 днів). Інфузія L-Arg продемонструвала гострий гіпотензивний ефект як щодо систолічного, так і щодо діастолічного артеріального тиску [30, 31], не впливаючи на рухи плода і пролонгуючи вагітність [31].
Інші дослідження включали жінок з високим ризиком ПЕ [33, 34] або хворих на ХГ [16, 35]. Профілактичне застосування L-Arg пероральним шляхом почалося в першому триместрі і тривало від 10 тижнів до всього терміну вагітності (понад 30 тижнів). Хоча L-Arg не впливав на артеріальний тиск, призначення антигіпертензивних препаратів знадобилося меншому відсотку жінок [35]; було встановлено, що L-Arg поліпшував імпеданс маткової артерії [16]. ПЕ була менш вираженою, і частота ПЕ, накладеної на артеріальну гіпертензію, що є чинником ранніх пологів (< 34 тижні гестації), демонструвала тенденцію до зниження [33–35]. Лікування L-Arg також було пов’язане з більшою масою плода при народженні та меншою кількістю передчасних пологів [34].
Було проведено два дослідження за участю жінок із загрозою передчасних пологів (ЗПП), в одному з яких L-Arg використовували перорально в дозі 3 г/добу з моменту госпіталізації до пологів [28], тоді як в іншому L-Arg вводили внутрішньовенно 20 г/500 мл протягом 3 год [36]. Пероральні препарати L-аргініну посилили фетоплацентарний кровотік, у той час як при внутрішньовенному введенні зменшувалися скорочення матки, підвищувався рівень гормону росту й нітратів у сироватці крові.
Трансгенераційні/метаболічні ефекти L-аргініну
В одному дослідженні оцінювали систему L-Arg/NO та її роль у передачі сигналів інсуліну та функції ендотелію у вагітних жінок з різними індексами маси тіла (ІМТ) [37]. У жінок з надмірною вагою/ожирінням НЕ було виявлено порушення функції ендотелію та регуляції інсуліну. L-Arg знижував рівень інсуліну в першому триместрі, і тільки в разі нормальної ваги — у другому триместрі.
Дослідження, проведені на тваринах
Дози та розклад призначення препарату
У 23 із 26 досліджень на тваринах L-Arg вводили перорально розчиняючи його у питній воді або вводячи з їжею, тоді як у решті 3 досліджень його вводили внутрішньовенно [38–40] (табл. 3).
Дослідження були зосереджені на впливі L-Arg на репродуктивні функції (п’ять досліджень), рості плода (16 досліджень), гіперінсулінемії та/або гіпертонічних розладах (чотири дослідження), результатом ще одного дослідження була імунна відповідь.
L-аргінін та репродуктивні функції
Дослідження L-Arg проводилися на свинях [41–43], кобилах [44] та вівцях [38]. У кобил L-Arg зменшував накопичення рідини в матці, не змінюючи розвиток фолікулів, представляючи інструмент племінного контролю у післяпологовому періоді для підвищення репродуктивного успіху [44]. Крім того, у разі застосування L-Arg помітно збільшилася кількість живонароджених поросят на два [41] і збільшилася вага новонароджених тварин [43], а також покращилася лактація у свиноматок, які давали приплід вперше [42]. Не було виявлено жодних ефектів щодо ягнят [38] (табл. 4).
Препарати L-аргініну та ріст плода
Препарати (головним чином вони додавалися у питну воду або в їжу) досліджувалися на вівцях (шість досліджень), свинях (вісім досліджень), щурах (два дослідження).
Як правило, L-Arg збільшував вагу при народженні та вагу м’язів, а також позитивно впливав на дозрівання [39, 45, 46], можливо, через зміну кількості білка mTOR [39]. Жодного впливу на показники мертвонароджуваності не було виявлено у свиноматок [47], тоді як додавання L-Arg покращувало виживання плодів-поросят [48, 49]. У овець додавання L-Arg (і N-карбамілглутамату (NCG)) зменшувало рівень ВЗРП шляхом покращення метаболічного гомеостазу та через експресію генів соматотропної осі плода [50, 51]. Zhang et al. 2016 [52] підтвердили, що L-Arg сприяє фетально-плацентарному розвитку через покращення антиоксидантної активності.
У свиней L-Arg також стимулював ріст плаценти та васкуляризацію [53], хоча Li et al. [54] повідомили про зменшення розміру приплоду.
Після прийому препаратів L-Arg на пізніх термінах вагітності не відзначено його впливу на вагу поросят при народженні або лактацію [55], оскільки він не міг пом’якшити наслідки обмеженого харчування матері [56] (табл. 4).
Препарати L-аргініну та гіперінсулінемія/гіпертензивні розлади
Було проведено три дослідження на мишачих моделях хронічної екзогенної гіперінсулінемії, що призводить до гіпертензії та серцевої недостатності [57–59]. Інше дослідження використовувало L-NAME у щурів для створення моделі прееклампсії [60].
L-Arg запобіг ураженню ендотелію внаслідок впливу L-NAME і знизив артеріальний тиск на пізніх термінах вагітності [60], зменшив ступінь протеїнурії та частку уражень [58, 60, 61].
Препарат L-Arg збільшив вагу при народженні без будь-яких змін в рівнях інсуліну в плазмі або глюкози в сироватці [59, 60], але стимулював систему NO в плаценті [58] (табл. 4).
Ці дані, отримані на різних експериментальних моделях інсуліноіндукованої гіпертензії щурів, свідчать про прямий зворотний ефект введення L-Arg на гіпертензію та зміни ваги плода, активуючи системи NO в плаценті та нирках.
Імунна відповідь та L-аргінін
У вагітних щурів лінії Вістар, інфікованих Trypanosoma cruzi, що призвело до розвитку хвороби Шагаса [62], L-Arg сприяв зниженню рівня кортикостерону та зменшенню паразитемії та збільшив вагу плода та плаценти, а також зменшив навантаження амастиготами. Додавання L-Arg може покращити імунну відповідь організму під час гострої фази (табл. 4).
Безпека і переносимість L-аргініну
У жодному дослідженні на людях не повідомлялося про побічні явища, пов’язані з призначенням L-Arg під час вагітності, ні протягом тривалого періоду його застосування (3 місяці) [20], ні при призначенні високих доз для невідкладного лікування (20 або 30 г/100 мл фізіологічного розчину протягом 1 доби або 1 тижня) [18, 19]. Серед досліджень на тваринах лише в одному дослідженні, проведеному на свиноматках, повідомили про збільшення показників мертвонародження в групі, яка отримувала комбінацію Arg і рактопаміну (Rac) з 25-го по 53-й день вагітності [47], табл. 4. Однак невідомо, якій саме складовій даної комбінації можна приписати цей ефект.
Обговорення
У даному систематичному огляді літератури наведені дослідження, проведені на людях і тваринах протягом тривалого часу, що свідчить про актуальний інтерес до застосування L-Arg у репродуктології.
Загалом результати показали, що застосування L-Arg під час вагітності може бути корисним за кількох обставин, особливо при гіпертензії в матері та щодо росту плода, шляхом зниження рівня артеріального тиску, запобігання прееклампсії та поліпшення кровообігу, а також функції плаценти. Однак варто підкреслити, що багато з включених РКД проводилися понад 15 років тому і мали слабку потужність і неоднорідну популяцію. Крім того, немає даних про найтяжчі наслідки (тобто мертвонародження, відшарування плаценти або тяжку ВЗРП) на відміну від інших досліджень з донорами NO [63, 64], які, однак, не змогли продемонструвати ефективність щодо затримки росту плода (ЗРП), передчасних пологів і перинатальної смертності й захворюваності.
Хоча фармакологічні донори NO асоціюються з низькою ефективністю (Cochrane), L-Arg, який є фізіологічним субстратом ендотеліальної NO-синтази, демонструє кращий профіль ризик/користь. Можливо, при введенні амінокислоти не утворюються пероксинітрити внаслідок надлишкової біодоступності NO [65].
Однак короткострокове введення L-Arg, особливо на пізніх термінах вагітності, не призвело до поліпшення гемодинаміки в матері та не пом’якшило наслідків тяжкого ступеня ЗРП [25]. Це свідчить про те, що застосування L-Arg слід починати рано і продовжувати протягом усієї вагітності, щоб він мав позитивний вплив на артеріальний тиск або плацентарну судинну недостатність через шлях «аргінін — NO» [66].
Ці результати є підтвердженням висновків недавнього метааналізу Goto [8] (на основі лише 10 прийнятних статей), що L-аргінін слід рекомендувати жінкам з поганими результатами попередньої вагітності, тим, хто має високий ризик прееклампсії, а також тим, у кого вже є ГРВ. Однак ми погоджуємося з авторами, які стверджують, що для отримання більш переконливих висновків потрібно більше досліджень, оскільки ефекти невеликі.
Часткова ефективність L-Arg може бути пов’язана з екстракцією та метаболізмом аргініну, що часто перешкоджає його ефективності через можливу деградацію аргіназою. Дійсно, дослідження на тваринах, у яких використовувався цитрулін (прямий донор NO без деградації внутрішніх органів), повідомляли про поліпшення функції плаценти та росту плода на моделях ВЗРП у щурів завдяки залученню інсуліноподібного фактора росту 2 та ангіогенних факторів [67] і поліпшення функції судин у перинатальному й післяпологовому періоді на мишачій моделі прееклампсії [68]. Цитрулін ефективно підвищив доступність аргініну в плода, хоча він не зміг підвищити концентрацію незамінних амінокислот у плазмі плода на мишачих моделях ВЗРП [69]. На жаль, немає досліджень на людях щодо цитруліну і/або його комбінацій з L-Arg.
В іншому систематичному огляді [70] проаналізовано роль синтезу й метаболізму аргініну під час вагітності та надано докази зв’язку між порушенням метаболічного шляху аргініну і патогенезом скомпрометованої вагітності й програмуванням плода. Цікаво, що автори подали застосування L-аргініну як потенційну стратегію перепрограмування під час вагітності, щоб запобігти неінфекційним захворюванням у потомства. Багато доказів, що підтверджують таку ідею, зосереджуються на здатності поліпшувати ріст плода також у випадках, коли функція плаценти скомпрометована. Відповідно слід пам’ятати, що спостереження Barker про кореляцію низької ваги при народженні з пізнішим розвитком серцево-судинних захворювань у дорослої людини було віхою епігенетичних гіпотез [71].
Фетальна соматотропна стимуляція L-Arg очевидна також у кількох видів тварин завдяки використанню амінокислоти як прискорювача доступності NO в кровоносній системі плаценти. Крім того, ми знаємо на щурах, що L-Arg також виявляє свою дію у випадках, коли гіпертензія та обмеження росту поєднуються з хронічною гіперінсулінемією, що сприяє інсулінорезистентності [57–59]. Дійсно, окрім серцево-судинних переваг, концентрація глюкози в сироватці крові та вільних жирних кислот була знижена в жінок з надмірною вагою/ожирінням у фертильний період [72] і при діабеті 2-го типу [73]. Хоча про це повідомлялося лише в одному дослідженні, здатність L-Arg активувати залежну від ендотелію вазодилатацію у вагітних жінок з ожирінням, знижуючи рівень циркулюючого інсуліну, свідчить про можливе використання препаратів у разі інсулінорезистентного стану [37]. Цікаво, що серед можливих мішеней введення L-Arg також є жінки зі зниженим ІМТ до вагітності. У них були продемонстровані низькі рівні циркулюючого аргініну, які, здається, пов’язані з поганим результатом вагітності [79].
Нарешті, в овець, свиней і коней L-аргінін також поліпшив репродуктивні показники, ставши одним із втручань, здатних збільшити кількість тварин.
Серед включених в цей огляд досліджень жодне не повідомляло про серйозні побічні реакції на L-Arg, що підтверджує раніше зареєстрований профіль його безпеки під час вагітності [72]. Серйозні побічні ефекти були зареєстровані лише в популяції пацієнтів з нещодавно перенесеною ішемічною хворобою серця під час тривалого лікування (6 місяців) високими дозами (9 г/день) [74]. Крім того, у контрольованому дослідженні L-Arg було визнано безпечним при його застосуванні в дозі 15–30 г/добу протягом 90 днів без впливу на споживання енергії, білка, вуглеводів, вітамінів або мінералів. Однак варто зазначити, що донорська добавка NO під час вагітності все ще обговорюється, оскільки не всі донори NO вважаються безпечними під час вагітності. Силденафіл, наприклад, при застосуванні з приводу тяжкої ранньої затримки росту плода не тільки не зменшував ризик перинатальної смертності чи тяжкої неонатальної захворюваності, але й фактично збільшував ризик неонатальної легеневої гіпертензії [75].
Аргінін — це незамінна амінокислота, споживання якої з їжею (м’ясо, молочні продукти, горіхи тощо) у західних країнах, за оцінками, становить > 4 г/день [6], тоді як людям, які живуть у погіршених фінансових умовах, вона менш доступна [77]. Щодо багатьох мікроелементів, таких як залізо, йод, кальцій, вітамін D тощо, вагітність є станом відносного дефіциту [78]. Отже, незважаючи на те, що в нас відсутній стандарт споживання аргініну під час вагітності, здається цілком імовірним, що під час вагітності жінкам потрібно збільшити його споживання як через основні потреби (ріст плода), так і для покриття змін у харчовій поведінці (тобто недостатнє споживання м’яса).
Крім того, внутрішньовенне введення L-Arg асоціювалося з важливими ефектами на судини плода і матері [18, 32]. Однак ефект не був тривалим, що дозволяло в клінічних дослідженнях віддати перевагу пероральному аргініну.
Проте докази, висвітлені в цьому систематичному огляді, вказують на біологічну активність L-Arg, що підтверджує його потенціал терапевтичного засобу. Крім того, використання L-Arg не асоціювалося з побічними ефектами і/або побічними реакціями в даних дозах ні в людей, ні у тварин.
«Новизна» цього систематичного огляду полягає в тому, що в ньому вивчалися не тільки судинний, але й метаболічний ефект аргініну в дослідженнях як на тваринах, так і на людях. Зокрема, модель L-NAME оцінювалася стосовно добре консолідованої дії L-Arg, опосередкованої NO. Модель гіперінсулінемії на тваринах, з іншого боку, дозволяє вперше перенести можливі метаболічні ефекти на вагітність, які ще не були добре вивчені, на відміну від невагітних станів, щодо яких уже є різні докази метаболічного впливу аргініну як в експериментальних [80, 81], так і в дослідженнях на людях [81–83].
Оксид азоту (NO) є ключовим регулятором материнського і фетального гомеостазу під час вагітності незалежно від того, чи потребують більш детальної оцінки й проведення рандомізованих досліджень стратегії, у які включені попередники NO, донори NO, природні похідні або фармакологічні модулятори системи NO. Цей огляд свідчить про те, що певні форми L-аргініну (тобто його безсольова форма для внутрішньовенного введення або у флаконі для перорального застосування в дозі 3 г/день) не можуть просто використовуватися для корекції тимчасового дефіциту. Натомість завдяки серцево-судинним і метаболічним ефектам L-аргінін може розглядатися як засіб, сприятливий для матері та плода, принаймні при помірних клінічних розладах.
Список литературы
1. Garovic V.D., Dechend R., Easterling T. et al. Hypertension in pregnancy: diagnosis, blood pressure goals, and pharmacotherapy: a scientific statement from the American Heart Association. Hypertension. 2022. 79(2). e21-e41.
2. Saving mothers’ lives: reviewing maternal deaths to make motherhood safer: 2006–2008. BJOG: Int. J. Obstet. Gynaecol. 2011. 118. 1-203.
3. Ananth C.V., Vintzileos A.M. Maternal-fetal conditions necessitating a medical intervention resulting in preterm birth. Am. J. Obstet. Gynecol. 2006. 195(6). 1557-1563.
4. Morgan T. Role of the placenta in preterm birth: a review. Am. J. Perinatol. 2016. 33(3). 258-266.
5. Goto E. Meta-regression analysis to evaluate relationships between maternal blood levels of placentation biomarkers and low delivery weight. Int. J. Gynaecol. Obstet. 2018. 142(2). 148-155.
6. Gaccioli F., Lager S. Placental nutrient transport and intrauterine growth restriction. Front. Physiol. 2016. 7. 40.
7. Nigam J., Misra V., Singh P. et al. Histopathological study of placentae in low birth weight babies in India. Ann. Med. Health Sci. Res. 2014. 4(Suppl. 2). S79-S83.
8. Goto E. Effects of prenatal oral L-arginine on birth outcomes: a meta-analysis. Sci. Rep. 2021. 11(1). 22748.
9. PRISMA transparent reporting of systematic reviews and meta-analyses. 2021. Available from: https://prisma-statement.org.
10. Zhu Q., Yue X., Tian Q.-Y. et al. Effect of L-arginine supplementation on blood pressure in pregnant women: a meta-analysis of placebo-controlled trials. Hypertens. Pregnancy. 2013. 32(1). 32-41.
11. SIGO. I Disordini Ipertensivi in Gravidanza: Classificazione, Diagnosi e Terapia. Raccomandazioni di Buona Pratica Clinica AIPE (Associazione Italiana Preeclampsia). 2020. Available from: https://www.sigo.it/wp-content/uploads/2020/11/RaccomandazioniAIPE-Disordini_Ipertensivi_Gravidanza.pdf.
12. Fetal growth restriction. Obstet. Gynecol. 2021. 137(2). e16-e28.
13. Borisova L.V., Martinussen P.E., Rydland H.T. et al. Public evaluation of health services across 21 European countries: the role of culture. Scand. J. Public Health. 2017. 45(2). 132-139.
14. Battaglia C., Regnani G., Marsella T. et al. Adjuvant L-arginine treatment in controlled ovarian hyperstimulation: a double-blind, randomized study. Hum. Reprod. 2002. 17(3). 659-665.
15. Battaglia C., Salvatori M., Maxia N. et al. Adjuvant L-arginine treatment for in-vitro fertilization in poor responder patients. Hum. Reprod. 1999. 14(7). 1690-1697.
16. Monari F., Menichini D., Pignatti L. et al. Effect of L-arginine supplementation in pregnant women with chronic hypertension and previous placenta vascular disorders receiving aspirin prophylaxis: a randomized control trial. Miner. Obstet. Gynecol. 2021. 73(6). 782-789.
17. Shen S., Hua C. Effect of L-arginine on the expression of bcl-2 and bax in the placenta of fetal growth restriction. J. Matern. Neonatal. Med. 2011. 24(6). 822-826.
18. Neri I., Mazza V., Galassi M.C. et al. Effects of L-arginine on utero-placental circulation in growth-retarded fetuses. Acta Obstet. Gynecol Scand. 1996. 75(3). 208-212.
19. Xiao X.M., Li L.P. L-arginine treatment for asymmetric fetal growth restriction. Int. J. Gynaecol. Obstet. 2005. 88(1). 15-18.
20. So S., Yamaguchi W., Murabayashi N. et al. Beneficial effect of L-arginine in women using assisted reproductive technologies: a small-scale randomized controlled trial. Nutr. Res. 2020. 82. 67-73.
21. Sieroszewski P., Suzin J., Karowicz-Bilińska A. Ultrasound evaluation of intrauterine growth restriction therapy by a nitric oxide donor (L-arginine). J. Matern. Neonatal Med. 2004. 15(6). 363-366.
22. Singh S., Singh A., Sharma D. et al. Effect of L-arginine on nitric oxide levels in intrauterine growth restriction and its correlation with fetal outcome. Indian J. Clin. Biochem. 2015. 30(3). 298-304.
23. Ropacka M., Szymanski P., Kowalska J. et al. Effect of oral supplementation with nitric oxide donor on fetomaternal hemodynamic. Ultrasound Obstet. Gynecol. 2007. 30(4). 632-632.
24. Winer N., Branger B., Azria E. et al. L-arginine treatment for severe vascular fetal intrauterine growth restriction: a randomized double-bind controlled trial. Clin. Nutr. 2009. 28(3). 243-248.
25. Hladunewich M.A., Derby G.C., Lafayette R.A. et al. Effect of L-arginine therapy on the glomerular injury of preeclampsia. Obstet. Gynecol. 2006. 107(4). 886-895.
26. Rytlewski K., Olszanecki R., Korbut R. et al. Effects of prolonged oral supplementation with L-arginine on blood pressure and nitric oxide synthesis in preeclampsia. Eur. J. Clin. Invest. 2005. 35(1). 32-37.
27. Staff A.C., Berge L., Haugen G. et al. Dietary supplementation with L-arginine or placebo in women with pre-eclampsia. Acta Obstet. Gynecol. Scand. 2004. 83(1). 103-107.
28. Rytlewski K., Olszanecki R., Lauterbach R. et al. Effects of oral L-arginine on the pulsatility indices of umbilical artery and middle cerebral artery in preterm labor. Eur. J. Obstet. Gynecol. Reprod. Biol. 2008. 138(1). 23-28.
29. Valdivia-Silva J.E., López-Molina K., Macedo R. Efecto de la terapia temprana con L-arginina en el crecimiento intrauterino restringido en la preclampsia. Estudio aleatorizado en mujeres latinoamericanas. Prog. Obstet. Ginecol. 2009. 52(2). 89-98.
30. Neri I., Blasi I., Facchinetti F. Effects of acute L-arginine infusion on non-stress test in hypertensive pregnant women. J. Mat. Fet. Neonat. Med. 2004. 16(1). 23-26.
31. Facchinetti F., Saade G.R., Neri I. et al. L-arginine supplementation in patients with gestational hypertension: a pilot study. Hypertens. Pregnancy. 2007. 26(1). 121-130.
32. Neri I., Jasonni V.M., Gori G.F. et al. Effect of L-arginine on blood pressure in pregnancy-induced hypertension: a randomized placebo-controlled trial. J. Matern. Neonatal. Med. 2006. 19(5). 277-281.
33. Vadillo-Ortega F., Perichart-Perera O., Espino S. et al. Effect of supplementation during pregnancy with L-arginine and antioxidant vitamins in medical food on pre-eclampsia in high risk population: randomised controlled trial. BMJ. 2011. 342. d2901.
34. Camarena Pulido E.E., García Benavides L., Panduro Barón J.G. et al. Efficacy of L-arginine for preventing preeclampsia in high-risk pregnancies: a double-blind, randomized, clinical trial. Hypertens. Pregnancy. 2016. 35(2). 217-225.
35. Neri I., Monari F., Sgarbi L. et al. L-arginine supplementation in women with chronic hypertension: impact on blood pressure and maternal and neonatal complications. J. Matern. Neonatal. Med. 2010. 23(12). 1456-1460.
36. Facchinetti F., Neri I., Genazzani A.R. L-arginine infusion reduces preterm uterine contractions. J. Perinat. Med. 1996. 24(3). 283-285.
37. Petrella E., Pignatti L., Neri I. et al. The L-arginine/nitric oxide pathway is impaired in overweight/obese pregnant women. Pregnancy Hypertens. 2014. 4(2). 150-155.
38. Crane A.R., Redden R.R., Van Emon M.L. et al. Impacts of supplemental arginine on the reproductive performance of fall lambing ewes. J. Anim. Sci. 2016. 94(8). 3540-3549.
39. Sales F., Sciascia Q., van der Linden D.S. et al. Intravenous maternal L-arginine administration to twin-bearing ewes, during late pregnancy, is associated with increased fetal muscle mTOR abundance and postnatal growth in twin female lambs. J. Anim. Sci. 2016. 94(6). 2519-2531.
40. De Boo H.A., Van Zijl P.L., Smith D.E.C. et al. Arginine and mixed amino acids increase protein accretion in the growth-restricted and normal ovine fetus by different mechanisms. Pediatr. Res. 2005. 58(2). 270-277.
41. Mateo R.D., Wu G., Moon H.K. et al. Effects of dietary arginine supplementation during gestation and lactation on the performance of lactating primiparous sows and nursing piglets. J. Anim. Sci. 2008. 86(4). 827-835.
42. Mateo R.D., Wu G., Bazer F.W. et al. Dietary L-arginine supplementation enhances the reproductive performance of gilts. J. Nutr. 2007. 137(3). 652-656.
43. Li J., Xia H., Yao W. et al. Effects of arginine supplementation during early gestation (day 1 to 30) on litter size and plasma metabolites in gilts and sows. J. Anim. Sci. 2015. 93(11). 5291-5303.
44. Kelley D.E., Warren L.K., Mortensen C.J. Oral L-arginine supplementation impacts several reproductive parameters during the postpartum period in mares. Anim. Reprod. Sci. 2013. 138(3–4). 233-240.
45. Madsen J.G., Mueller S., Kreuzer M. et al. Milk replacers supplemented with either L-arginine or L-carnitine potentially improve muscle maturation of early reared low birth weight piglets from hyperprolific sows. Animal. 2018. 12(1). 43-53.
46. Quesnel H., Quiniou N., Roy H. et al. Supplying dextrose before insemination and L-arginine during the last third of pregnancy in sow diets: effects on within-litter variation of piglet birth weight. J. Anim. Sci. 2014. 92(4). 1445-1450.
47. Garbossa C.A.P., Júnior F.M.C., Silveira H. et al. Effects of ractopamine and arginine dietary supplementation for sows on growth performance and carcass quality of their progenies. J. Anim. Sci. 2015. 93(6). 2872-2884.
48. Bérard J., Bee G. Effects of dietary L-arginine supplementation to gilts during early gestation on foetal survival, growth and myofiber formation. Animal. 2010. 4(10). 1680-1687.
49. Li X., Bazer F.W., Johnson G.A. et al. Dietary supplementation with L-arginine between days 14 and 25 of gestation enhances embryonic development and survival in gilts. Amino Acids. 2014. 46(2). 375-384.
50. Sun L., Zhang H., Fan Y. et al. Metabolomic profiling in umbilical venous plasma reveals effects of dietary rumen-protected arginine or N-carbamylglutamate supplementation in nutrient-restricted Hu sheep during pregnancy. Reprod. Domest. Anim. 2017. 52(3). 376-388.
51. Sun L., Zhang H., Wang Z. et al. Dietary rumen-protected arginine and N-carbamylglutamate supplementation enhances fetal growth in underfed ewes. Reprod. Fertil. Dev. 2018. 30(8). 1116-1127.
52. Zhang H., Sun L., Wang Z. et al. N-carbamylglutamate and L-arginine improved maternal and placental development in underfed ewes. Reproduction. 2016. 151(6). 623-635.
53. Gao K., Jiang Z., Lin Y. et al. Dietary L-arginine supplementation enhances placental growth and reproductive performance in sows. Amino Acids. 2012. 42(6). 2207-2214.
54. Li X., Bazer F.W., Johnson G.A. et al. Dietary supplementation with 0.8% L-arginine between days 0 and 25 of gestation reduces litter size in gilts. J. Nutr. 2010. 140(6). 1111-1116.
55. Bass B.E., Bradley C.L, Johnson Z.B. et al. Influence of dietary-arginine supplementation of sows during late pregnancy on piglet birth weight and sow and litter performance during lactation. J. Anim. Sci. 2017. 95(1). 248-256.
56. Peine J.L., Jia G., Van Emon M.L. et al. Effects of maternal nutrition and rumen-protected arginine supplementation on ewe performance and postnatal lamb growth and internal organ mass. J. Anim. Sci. 2018. 96(8). 3471-3481.
57. Bursztyn M., Podjarny E., Dahan R. et al. Insulin‐induced hypertension, L‐arginine, and endothelial nitric oxide synthase in pregnant rats. Hypertens. Pregnancy. 2003. 22(3). 267-274.
58. Sharkey L.C., McCune S.A., Yuan O. et al. Spontaneous pregnancy-induced hypertension and intrauterine growth restriction in rats. Am. J. Hypertens. 2001. 14(10). 1058-1066.
59. Podjarny E., Bursztyn M., Rashed G. et al. Chronic exogenous hyperinsulinaemia-induced hypertension in pregnant rats: effect of chronic treatment with L-arginine. Clin. Sci. 2001. 100(6). 667-671.
60. Helmbrecht G.D., Farhat M.Y., Lochbaum L. et al. L-arginine reverses the adverse pregnancy changes induced by nitric oxide synthase inhibition in the rat. Am. J. Obstet. Gynecol. 1996. 175(4 Pt 1). 800-805.
61. Altun Z.S., Uysal S., Guner G. et al. Effects of oral L‐arginine supplementation on blood pressure and asymmetric dimethylarginine in stress‐induced preeclamptic rats. Cell. Biochem. Funct. 2008. 26(5). 648-653.
62. Da Costa C.M.B., de Freitas M.R.B., Brazão V. et al. Does L-arginine availability during the early pregnancy alters the immune response of Trypanosoma cruzi infected and pregnant Wistar rats? Expю Parasitol. 2014. 142ю 59-66.
63. Groten Tю, Lehmann Tю, Städtler M. et al. Effect of pentaerythritol tetranitrate (PETN) on the development of fetal growth restriction in pregnancies with impaired uteroplacental perfusion at midgestation — a randomized trial. Am. J. Obstet. Gynecol. 2023. 228(1). 84.e1-84.e12.
64. Duckitt K., Thornton S. Nitric oxide donors for the treatment of preterm labour. Cochrane Database of Syst. Rev. 2002. (3). CD002860.
65. Nanetti L., Giannubilo S., Raffaelli F. et al. Nitric oxide and peroxynitrite platelet levels in women with small-for-gestational-age fetuses. BJOG. 2008. 115(1). 14-21.
66. McDonald C.R., Cahill L.S., Gamble J.L. et al. Malaria in pregnancy alters L-arginine bioavailability and placental vascular development. Sci. Transl. Med. 2018. 10(431). eaan6007.
67. Tran N.-T., Amarger V., Bourdon A. et al. Maternal citrulline supplementation enhances placental function and fetal growth in a rat model of IUGR: involvement of insulin-like growth factor 2 and angiogenic factors. J. Matern. Neonatal. Med. 2017. 30(16). 1906-1911.
68. Gemmel M., Sutton E.F., Brands J. et al. L-citrulline supplementation during pregnancy improves perinatal and postpartum maternal vascular function in a mouse model of preeclampsia. Am. J. Physiol. Regul. Integr. Comp. Physiol. 2021. 321(3). R364-R376.
69. Bourdon A., Hannigsberg J., Misbert E. et al. Maternal supplementation with citrulline or arginine during gestation impacts fetal amino acid availability in a model of intrauterine growth restriction (IUGR). Clin. Nutr. 2020. 39(12). 3736-3743.
70. Hsu C.-N., Tain Y.-L. Impact of arginine nutrition and metabolism during pregnancy on offspring outcomes. Nutrients. 2019. 11(7). 1452.
71. Barker D. The fetal and infant origins of adult disease. BMJ. 1990. 301(6761). 1111.
72. McNeal C.J., Meininger C.J., Wilborn C.D. et al. Safety of dietary supplementation with arginine in adult humans. Amino Acids. 2018. 50(9). 1215-1229.
73. Ivy J.L. The use of L-arginine supplements for cardiovascular disease and related disorders is questionable. Nov. Tech. Nutr. Food Sci. 2020. 5(1). 406-412.
74. Schulman S.P., Becker L.C., Kass D.A. et al. L-arginine therapy in acute myocardial infarction. JAMA. 2006. 295(1). 58-64.
75. Pels A., Derks J., Elvan-Taspinar A. et al. Maternal sildenafil vs placebo in pregnant women with severe early-onset fetal growth restriction. JAMA Netw. Open. 2020. 3(6). e205323.
76. Institute of Medicine. Dietary reference intakes for energy, carbohydrate, fiber, fat, fatty acids, cholesterol, protein, and amino acids. Washington (DC). The National Academies Press. 2005.
77. Schönfeldt H.C., Gibson Hall N. Dietary protein quality and malnutrition in Africa. Br. J. Nutr. 2012. 108(S2). S69-S76.
78. Gernand A.D., Schulze K.J., Stewart C.P. et al. Micronutrient deficiencies in pregnancy worldwide: health effects and prevention. Nat. Rev. Endocrinol. 2016. 12(5). 274-289.
79. Kurpad A.V., Kao C., Dwarkanath P. et al. In vivo arginine production and nitric oxide synthesis in pregnant Indian women with normal and low body mass indices. Eur J. Clin. Nutr. 2009. 63(9). 1091-1097.
80. De Castro Barbosa T., Jiang L.Q., Zierath J.R. et al. L-arginine enhances glucose and lipid metabolism in rat L6 myotubes via the NO/c-GMP pathway. Metabolism. 2013. 62(1). 79-89.
81. Hu S., Han M., Rezaei A. et al. L-arginine modulates glucose and lipid metabolism in obesity and diabetes. Curr. Protein Pept. Sci. 2017. 18(6). 599-608.
82. Hadi A., Arab A., Moradi S. et al. The effect of L-arginine supplementation on lipid profile: a systematic review and meta-analysis of randomised controlled trials. Br. J. Nutr. 2019. 122(9). 1021-1032.
83. Jobgen W.S., Fried S.K., Fu W.J. et al. Regulatory role for the arginine-nitric oxide pathway in metabolism of energy substrates. J. Nutr. Biochem. 2006. 17(9). 571-588.
Матеріал розміщено за підтримки донатора оксиду азоту — Тівортін
Оригінал статті надрукований в The Journal of Maternal-Fetal & Neonatal Medicine 2023. Vol. 36. № 1. 2217465. doi: 10.1080/14767058.2023.2217465

/77.jpg)
/77_2.jpg)
/14.jpg)
/78.jpg)
/78_2.jpg)