Международный неврологический журнал Том 20, №3, 2024
Вернуться к номеру
Структурно-функціональні зіставлення при когнітивних порушеннях у хворих на розсіяний склероз
Авторы: Тесленко О.С., Товажнянська О.Л., Каук О.І., Марковська О.В., Шапкін А.С.
Харківський національний медичний університет, м. Харків, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
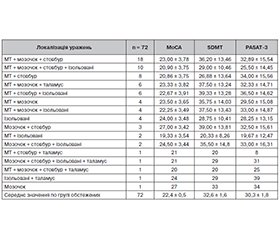
Актуальність. Розсіяний склероз (РС) — це запальне демієлінізуюче та нейродегенеративне захворювання, що характеризується широким різноманіттям неврологічної симптоматики. Когнітивні порушення є важливим клінічним аспектом РС і вимагають ретельного опитування та нейропсихологічного тестування для їх виявлення. Основним методом діагностики РС є магнітно-резонансна томографія (МРТ) з контрастним підсиленням, яка допомагає підтвердити наявність та оцінити поширення структурних пошкоджень у головному та спинному мозку. Метою дослідження було визначити наявність та вираженість когнітивних порушень у хворих на рецидивуюче-ремітуючий тип розсіяного склерозу з урахуванням локалізації вогнищ ураження головного мозку за даними МРТ. Матеріали та методи. Було обстежено 72 пацієнти зі встановленим діагнозом РС, рецидивуюче-ремітуючий тип перебігу, відповідно до критеріїв McDonald (2017 рік). Усі пацієнти у цьому дослідженні пройшли ретельне неврологічне, нейропсихологічне і інструментальне обстеження. Середня тривалість захворювання становила 8,2 ± 0,8 року. Середній бал за розширеною шкалою інвалідизації (EDSS) становив 3,38 ± 0,18. Для оцінки нейропсихологічного статусу хворих були використані тести SDMT, PASAT-3 та МоСА. Всім пацієнтам було проведено МРТ головного мозку 1,5 Т з контрастним підсиленням дотавістом. Результати. Ретельне опитування обстежених пацієнтів з РС визначило наявність скарг на когнітивне зниження у 91,67 % випадків (66 хворих). Cередній показник в групі обстежених за тестом SDMT становив 32,6 ± 1,6 знака (контроль — 57,1 ± 0,9), за тестом PASAT-3 — 30,3 ± 1,8 знака (у контролі — 56,8 ± 0,5), оціночний бал за шкалою МоСА був 22,4 ± 0,5 порівняно з контрольною групою — 28,4 ± 0,2 бала. Проведений кореляційний аналіз виявив статистично значущі негативні кореляції у мозолистому тілі (MoCA: r = –0,255; SDMT: r = –0,263; PASAT: r = –0,171 (p < 0,05)) та у стовбурі мозку (MoCA: r = –0,191; SDMT: r = –0,209; PASAT: r = –0,214 (p < 0,05)). Результати аналізу дисперсії (ANOVA) підтвердили описані вище кореляції між локалізацією уражень у головному мозку і результатами нейропсихологічного тестування та виявили статистично значущі різниці у результатах тестів MoCA і SDMT залежно від локалізації уражень (MoCA: F(14, 57) = 5,052, p < 0,001; SDMT: F(14, 57) = 2,609, p < 0.05). Висновки. У пацієнтів з рецидивуюче-ремітуючим розсіяним склерозом досить часто виявляються когнітивні порушення, що підтверджується результатами нейропсихологічного тестування. Кореляційний аналіз виявив значущий негативний зв’язок між локалізацією вогнищ у мозолистому тілі та стовбурі мозку й зниженням когнітивних функцій за результатами тестів (MoCA, SDMT, PASAT). Результати нашого дослідження підтверджують наявність структурно-функціональних зв’язків між локалізацією вогнищевого ураження головного мозку й розвитком когнітивних порушень, що має важливе діагностичне та прогностичне значення.
Background. Multiple sclerosis (MS) is an inflammatory demyelinating and neurodegenerative disease characterized by a variety of neurological symptoms. Cognitive impairment is an important clinical aspect of MS and require careful interviewing and neuropsychological testing to detect it. Contrast-enhanced magnetic resonance imaging (MRI) is the primary diagnostic method in MS, which helps confirm the presence and assess the extent of structural damage to the brain and spinal cord. The purpose of the study was to determine the frequency and severity of cognitive impairment in patients with relapsing-remitting multiple sclerosis, taking into account the localization of brain lesions according to MRI. Materials and methods. Seventy-two patients with a diagnosis of relapsing-remitting MS according to the McDonald criteria (2017) were examined. All of them underwent a thorough neurolo-gical, neuropsychological, and instrumental examination. The average duration of the disease was 8.2 ± 0.8 years. The average score on the Expanded Disability Status Scale was 3.38 ± 0.18 points. Symbol Digit Modalities Test (SDMT), Paced Auditory Serial Addition Test 3 (PASAT-3), and Montreal Cognitive Assessment (MoСA) were used to assess the neuropsychological status of patients. All participants underwent a 1.5T MRI of the brain with dotavist contrast enhancement. Results. A thorough survey of examined patients with MS revealed the presence of complaints of cognitive decline in 91.67 % of cases (66 patients). The average score on the SDMT was 32.6 ± 1.6 (controls 57.1 ± 0.9), on the PASAT-3 — 30.3 ± 1.8 (controls 56.8 ± 0.5), the evaluation score on the MoСA was 22.4 ± ± 0.5 points compared to the control group (28.4 ± 0.2 points). The conducted correlation analysis revealed statistically significant negative correlations in the corpus callosum (MoCA: r = –0.255; SDMT: r = –0.263; PASAT-3: r = –0.171; p < 0.05) and in the brainstem (MoCA: r = –0.191; SDMT: r = –0.209; PASAT-3: r = –0.214; p < 0.05). The results of the analysis of variance confirmed the correlations described above between the localization of brain lesions and the results of neuropsychological testing and revealed statistically significant differences in the scores on the MoCA and SDMT depending on the localization of lesions (MoCA: F(14, 57) = 5.052, p < 0.001; SDMT: F(14, 57) = 2.609, p < 0.05). Conclusions. Patients with relapsing-remitting multiple sclerosis quite often have cognitive impairment, which is confirmed by the results of neuropsychological testing. Correlation analysis revealed a significant negative relationship between the localization of foci in the corpus callosum and the brainstem and cognitive decline according to the results of tests (MoCA, SDMT, PASAT-3). The results of our study confirm the presence of structural and functional connections between the localization of focal brain lesions and the development of cognitive disorders, which has important diagnostic and prognostic value.
розсіяний склероз; когнітивні порушення; нейропсихологічне тестування; магнітно-резонансна томографія; локалізація уражень
multiple sclerosis; cognitive impairment: neuropsychological testing; magnetic resonance imaging; localization of lesions
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Dobson R, Giovannoni G. Multiple sclerosis — a review. European Journal of Neurology. 2019;26(1):27-40. doi: 10.1111/ene.13819.
- Doshi A, Chataway J. Multiple sclerosis, a treatable disease. Clinical Medicine. 2016;16(6): s53. https://doi.org/10.7861/clinmedicine.16-6-s53.
- Meca-Lallana V, Gascón-Giménez F, Ginestal-López RC, Higueras Y, Téllez-Lara N, Carreres-Polo J, et al. Cognitive impairment in multiple sclerosis: diagnosis and monitoring. Neurological Sciences. 2021 Dec;42(12):5183-5193. https://doi.org/10.1007/s10072-021-05165-7.
- Benedict RH, Amato MP, DeLuca J, Geurts JJG. Cognitive impairment in multiple sclerosis: clinical management, MRI, and therapeutic avenues. Lancet Neurology. 2020 Oct;19(10):860-871. https://doi.org/10.1016/S1474-4422(20)30277-5.
- Riccitelli GC, Pagani E, Rodegher M, et al. Imaging patterns of gray and white matter abnormalities associated with PASAT and SDMT performance in relapsing-remitting multiple sclerosis. Mult Scler. 2019 Feb;25(2):204-216. https://doi.org/10.1177/1352458517743091.
- Sonder JM, Burggraaff J, Knol DL, et al. Comparing long-term results of PASAT and SDMT scores in relation to neuropsychological testing in multiple sclerosis. Mult Scler. 2014 Apr;20(4):481-8. https://doi.org/10.1177/1352458513501570.
- Freitas S, Batista S, Afonso AC, et al. The Montreal Cognitive Assessment (MoCA) as a screening test for cognitive dysfunction in multiple sclerosis. Appl Neuropsychol Adult. 2018 Jan-Feb;25(1):57-70. https://doi.org/10.1080/23279095.2016.1243108.
- Kolb H, Al-Louzi O, Beck ES, Sati P, Absinta M, Reich DS. From pathology to MRI and back: Clinically relevant biomarkers of multiple sclerosis lesions. NeuroImage Clinical. 2022;36:103194. https://doi.org/10.1016/j.nicl.2022.103194.
- Simon JH. MRI in Multiple Sclerosis. Physical Medicine and Rehabilitation Clinics of North America. 2005;16(2):383-409. https://doi.org/10.1016/j.pmr.2005.01.012.
- Paul F. Pathology and MRI: exploring cognitive impairment in MS. Acta Neurol Scand. 2016 Sep;134 Suppl 200:24-33. doi: 10.1111/ane.12649.
- Hemond CC, Bakshi R. Magnetic Resonance Imaging in Multiple Sclerosis. Cold Spring Harb Perspect Med. 2018 May 1;8(5):a028969. https://doi.org/10.1101/cshperspect.a028969.
- Thompson AJ, Banwell BL, Barkhof F, et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neuro-logy. 2018;17(2):162-173. doi: 10.1016/S1474-4422(17)30470-2.
- Solomon AJ, Naismith RT, Cross AH. Misdiagnosis of multiple sclerosis: Impact of the 2017 McDonald criteria on clinical practice. Neurology. 2019;92(1):26-33. doi: 10.1212/WNL.0000000000006659.
- Filippi M, Rocca MA, Ciccarelli O, De Stefano N, Evangelou N, Kappos L, et al.; MAGNIMS Study Group. MRI criteria for the diagnosis of multiple sclerosis: MAGNIMS consensus guidelines. Lancet Neurology. 2016 Mar;15(3):292-303. doi: 10.1016/S1474-4422(15)00393-2. Epub 2016 Jan 26.
- Hoseinipourasl M, Zandkarimi M, Abdolmohammadi J, Sharifi K, Miraki S. Evaluation of FLAIR Sensitivity and DWI Post-inject in Comparison with Delayed Enhancement T1w for Better Detection of Active MS Lesions. J Biomed Phys Eng. 2018 Dec 1;8(4):365-374. doi: 10.31661/jbpe.v0i0.1009.
- Huang SY, Fan Q, Machado N, Eloyan A, Bireley JD, Russo AW, et al. Corpus callosum axon diameter relates to cognitive impairment in multiple sclerosis. Annals of Clinical and Translational Neurology. 2019 May;6(5):882-892. doi: 10.1002/acn3.760.
- Ozturk A, Smith SA, Gordon-Lipkin EM, Harrison DM, Shiee N, Pham DL, et al. MRI of the corpus callosum in multiple sclerosis: association with disability. Mult Scler. 2010 Feb;16(2):166-177. doi: 10.1177/1352458509353649.
- Platten M, Brusini I, Andersson O, Ouellette R, Piehl F, Wang C, Granberg T. Deep learning corpus callosum segmentation as a neurodegenerative marker in multiple sclerosis. J Neuroimaging. 2021 May;31(3):493-500. doi: 10.1111/jon.12838.
- Brownlee WJ, Hardy TA, Fazekas F, et al. Diagnosis of multiple sclerosis: progress and challenges. Lancet. 2017;389(10076):1336-1346. doi: 10.1016/S0140-6736(16)30959-X.
- Garg N, Smith TW. An update on immunopathogenesis, diagnosis, and treatment of multiple sclerosis. Brain Behav. 2015 Sep;5(9):e00362. doi: 10.1002/brb3.362. Epub 2015 Aug 3.
- Schiess N, Calabresi PA. Multiple Sclerosis. Semin Neurol. 2016 Aug;36(4):350-6. doi: 10.1055/s-0036-1585456. Epub 2016 Sep 19.