Международный неврологический журнал Том 21, №2, 2025
Вернуться к номеру
Оцінка змін у системі гемостазу в пацієнтів із хронічною ішемією мозку після одужання від COVID-19
Авторы: M.O. Mykhailichenko (1), V.S. Melnyk (2), T.I. Halenova (3), N.G. Raksha (3), T.B. Vovk (3), L.I. Kot (3), O.O. Savchuk (3), L.I. Ostapchenko (3)
(1) - University Clinic of the Bogomolets National Medical University, Kyiv, Ukraine
(2) - Bogomolets National Medical University, Kyiv, Ukraine
(3) - Educational and Scientific Center “Institute of Biology and Medicine”, Taras Shevchenko National University of Kyiv, Kyiv, Ukraine
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
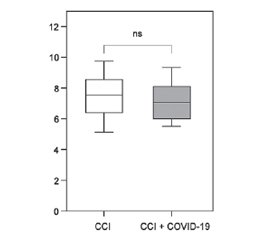
Актуальність. COVID-19 асоціюється з порушеннями в системі згортання крові, які можуть зберігатися навіть після гострої фази хвороби, особливо в пацієнтів із наявними цереброваскулярними розладами. Дослідження спрямоване на оцінку змін основних показників прокоагулянтної, антикоагулянтної та фібринолітичної ланок системи гемоcтазу в осіб із хронічною ішемією мозку (ХІМ) після одужання від COVID-19. Матеріали та методи. У дослідженні взяли участь 100 пацієнтів віком від 43 до 74 років iз діагнозом ХІМ, яких розподілено на дві експериментальні групи: групу «ХІМ + COVID-19» — 60 хворих, які перенесли COVID-19, та групу ХІМ — 40 осіб без інфекції SARS-CoV-2 в анамнезі. Плазмові рівні показників системи гемостазу, як-от протромбін, протеїн C, тромбомодулін, плазміноген, тканинний активатор плазміногену, інгібітор активатора плазміногену-1 та фактор фон Вілебранда, визначали за допомогою імуноферментного аналізу. Результати. У дослідженні не спостерігалося значних відмінностей у рівнях протромбіну та протеїну С між пацієнтами з ХІМ із COVID-19 та за відсутності його в анамнезі. Проте відмічалося збільшення на 20,9 % умісту тромбомодуліну в плазмі крові хворих на ХІМ, які перенесли COVID-19, порівняно з тими, хто не мав інфекції в анамнезі. Виявлено збільшення рівня інгібітора активатора плазміногену-1 на 19,4 % у групі «ХІМ + COVID-19» проти групи ХІМ, у той час як значних відмінностей у вмісті плазміногену та його тканинного активатора не встановлено. Важливо, що фактор фон Вілебранда не мав статистично значущих відмінностей між групами, що могло свідчити про поступову корекцію порушень ендотелію після COVID-19 iз часом. Висновки. Отримані дані вказують на складність постковідних гемостатичних змін у пацієнтів iз ХІМ, які характеризуються стійким запаленням низького ступеня та можливим інгібуванням фібринолізу. Водночас результати дозволяють зробити припущення, що ендотеліальна дисфункція може не бути вираженою ознакою в більш віддалені терміни після COVID-19.
Background. COVID-19 is associated with disorders in the blood coagulation system that may persist beyond the acute phase of the disease, particularly in individuals with pre-existing cerebrovascular conditions. This research purposed to evaluate changes in key parameters of the procoagulant, anticoagulant, and fibrinolytic links of the hemostatic system in patients with chronic cerebral ischemia (CCI) following recovery from COVID-19. Materials and methods. The study involved 100 patients aged 43 to 74 years diagnosed with CCI and divided into two experimental groups: the CCI + COVID-19 group, which included 60 patients with a history of COVID-19, and the CCI group, consisted of 40 patients without SARS-CoV-2 infection in the past. Plasma levels of hemostatic markers, such as prothrombin, protein C, thrombomodulin, plasminogen, tissue plasminogen activator, plasminogen activator inhibitor-1, and von Willebrand factor, were measured using enzyme-linked immunosorbent assay. Results. The study did not observe significant differences in prothrombin or protein C levels between CCI patients with and without a history of COVID-19. However, there was a 20.9 % increase in plasma thrombomodulin levels in participants with CCI who had recovered from COVID-19 compared to those without prior infection. An increase in plasminogen activator inhibitor-1 content by 19.4 % was found in the CCI + COVID-19 group compared to the CCI group, while no significant differences in the levels of plasminogen and its tissue activator were established. Notably, von Willebrand factor levels did not show statistically significant differences between the groups, which could indicate a gradual correction of endothelial disturbances in post-COVID-19 over time. Conclusions. The data obtained indicate the complexity of post-COVID-19 hemostatic changes in patients with CCI, characterized by persistent low-grade inflammation and possible fibrinolysis inhibition. At the same time, the results suggest that endothelial dysfunction may not be a pronounced feature in the late post-COVID-19 period.
хронічна ішемія мозку; пост-COVID-19; інфекція SARS-CoV-2; система гемостазу; коагуляція; фібринолітична система
chronic cerebral ischemia; post-COVID-19; SARS-CoV-2 infection; hemostatic system; coagulation; fibrinolytic system