Архив офтальмологии Украины Том 13, №1, 2025
Вернуться к номеру
Ефективність лікування пацієнтів з гострою неартеріїтною оптичною судинною нейропатією з використанням етилметилгідроксипіридину сукцинату (Мексикор®)
Авторы: Коновалова Н.В. (1, 2), Гузун О.В. (1), Храменко Н.І. (1), Ковтун О.В. (2)
(1) - ДУ «Інститут очних хвороб і тканинної терапії ім. В.П. Філатова НАМНУ», м. Одеса, Україна
(2) - Одеський національний медичний університет, м. Одеса, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
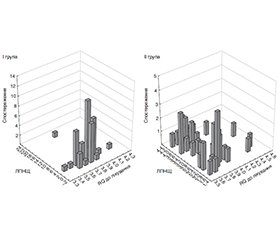
Актуальність. Судина патологія зорового нерва й сітківки є однією з провідних причин сліпоти. Захворювання, обумовлені порушеннями кровообігу, становлять 10–15 % від загальної кількості очних захворювань. У нозологічній структурі захворювань органа зору, що призводять до необоротної сліпоти, переважають судинні захворювання органа зору. У сучасній офтальмології питання нейропротекції є актуальними в лікуванні гострої оптичної судинної нейропатії. Мета: визначити ефективність лікування пацієнтів з гострою неартеріїтною оптичною судинною нейропатією з використанням етилметилгідроксипіридину сукцинату (Мексикор®). Матеріали та методи. Було обстежено 92 пацієнтів (92 ока) з гострою судинною оптичною неартеріїтною нейропатією. Курс стаціонарного лікування становив 10–12 діб. Хворі були довільно розподілені на дві групи. І група (основна) — 50 хворих, усі вони після проведеного стаціонарного лікування з використанням етилметилгідроксипіридину сукцинату (Мексикор®) в ін’єкціях по 2,0 мл продовжували приймати препарат у капсулах по 100 мг 2 рази на добу упродовж 3 місяців. З них 7 хворих не з’явилися на контрольний огляд, що відбувався через 1 і 3 місяці. У ІІ групу (група контролю) увійшли 42 пацієнти, які не отримували етилметилгідроксипіридину сукцинат (Мексикор®). Проводили клінічне, загальноофтальмологічне й морфофункціональне обстеження. Загальний термін спостереження становив 3 місяці. Результати. Через 3 місяці спостереження в обох групах було відзначено поліпшення максимально коригованої гостроти зору (р = 0,000), однак у пацієнтів І групи воно було у 2,1 раза більшим, ніж у хворих ІІ групи. Завдяки нормалізації клінічних показників імовірний ризик розвитку кардіоваскулярної патології через 3 місяці в І групі, що отримувала етилметилгідроксипіридину сукцинат (Мексикор®), був нижче на 24,5 % порівняно з ІІ групою, що не приймала препарат. Висновки. Мексикор® є сучасним, ефективним, безпечним і патогенетично обґрунтованим фармакологічним препаратом для лікування пацієнтів з гострою оптичною судинною нейропатією. Для профілактики рецидиву захворювання й відновлення зорових функцій потрібен пролонгований прийом препарату протягом 3 місяців для отримання стійкого позитивного ефекту як щодо нормалізації клінічних показників, так і щодо стабілізації зорових функцій. Підвищення показника МКГЗ у групі пацієнтів, які приймали етилметилгідроксипіридину сукцинат (Мексикор®), було у 2,1 раза більшим, ніж у контрольній групі. Виявлено значний (р < 0,05) позитивний кореляційний зв’язок між ефективністю та тривалістю лікування, поліпшення клінічних показників електричної чутливості зорового нерва за фосфеном, гемодинаміки, і, як наслідок, спостерігається нормалізація і поліпшення зорових функцій.
Vascular pathology of the optic nerve and retina is one of the leading causes of blindness. Diseases caused by circulatory disorders account for 10–15 % of the total number of eye diseases. In the nosological structure of eye diseases that lead to irreversible blindness, vascular eye diseases prevail. In modern ophthalmology, the issues of neuroprotection are relevant in the treatment of acute optic vascular neuropathy. Purpose: to determine the effectiveness of treatment of patients with acute non-arteritic optic vascular neuropathy using the infusion of ethylmethylhydroxypyridine succinate (Mexicor®). Materials and methods. Ninety-two patients (92 eyes) with acute vascular optic non-arteritic neuropathy were examined. The inpatient treatment course was 10–12 days. Patients were randomly assigned to two groups. Group I (main one) included 50 patients (50 eyes), all of them after inpatient treatment with ethylmethylhydroxypyridine succinate (Mexicor®) in injections of 2.0 ml continued to take the drug in capsules of 100 mg 2 times a day for 3 months. Of these, 7 patients did not attend the follow-up examination after 1 and 3 months. Group II (controls) consisted of 42 patients who did not received ethylmethylhydroxypyridine succinate (Mexicor®). Clinical, general ophthalmological and morphofunctional tests were carried out. The total observation period was 3 months. Results. After 3 months of observation, there was an improvement in the best corrected visual acuity (p = 0.000) in both groups, however, in patients of group I, it was 2.1 times higher than in group II. Due to the normalization of clinical indicators, the probable risk of developing hypertension after 3 months in group I, which received ethylmethylhydroxypyridine succinate (Mexicor®), was 24.5 % lower compared to group II, which did not take the drug. Conclusions. Mexicor® is a modern, effective, safe and pathogenetically justified pharmacological drug for the treatment of patients with acute optic vascular neuropathy. To prevent the recurrence of illness and restore visual functions, prolonged use of the drug for 3 months is required to obtain a stable positive effect in terms of normalization of clinical indicators and stabilization of visual functions. An increase in the best corrected visual acuity in the group of patients who took ethylmethylhydroxypyridine succinate (Mexicor®) was was 2.1 times greater than in control group. A significant (p < 0.05) positive correlation was found between the effectiveness and duration of treatment, improvement in clinical indicators of electrical sensitivity of the optic nerve by phosphene, hemodynamics, and, as a result, normalization and improvement of visual functions were observed.
гостра оптична судинна нейропатія; діагностика; гемодинаміка; етилметилгідроксипіридину сукцинат
acute optic vascular neuropathy; diagnosis; hemodynamics; ethylmethylhydroxypyridine succinate
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Hayreh SS. Ischemic optic neuropathies — where are we now? Graefes Arch Clin Exp Ophthalmol. 2013 Aug;251(8):1873-84. doi: 10.1007/s00417-013-2399-z. Epub 2013 Jul 3. PMID: 23821118.
- Le HG, Shakoor A. Diabetic and Retinal Vascular Eye Disease. Med Clin North Am. 2021 May;105(3):455-472. doi: 10.1016/j.mcna.2021.02.004. Epub 2021 Apr 2. PMID: 33926641.
- An update on optic neuritis. J Neurol. 2023 Oct;270(10):5113-5126. doi: 10.1007/s00415-023-11920-x. Epub 2023 Aug 5. PMID: 37542657.
- Badla O, Badla BA, Almobayed A, Mendoza C, Kishor K, Bhattacharya SK. Ischemic Optic Neuropathy: A Review of Current and Potential Future Pharmacotherapies. Pharmaceuticals (Basel). 2024 Sep 27;17(10):1281. doi: 10.3390/ph17101281. PMID: 39458922; PMCID: PMC11510045.
- Hayreh SS. Ischaemic optic neuropathy. Indian J Ophthalmol. 2000 Sep;48(3):171-94. Erratum in: Indian J Ophthalmol. 2000 Dec;48(4):317. PMID: 11217249.
- Uzakgider NK, Karaca Adiyeke S, Aytogan H. Understanding the Etiopathogenesis of Non-Arteritic Anterior Ischemic Optic Neuropathy with Laboratory Findings. Beyoglu Eye J. 2024 Mar 1;9(1):8-13. doi: 10.14744/bej.2023.09815. PMID: 38504965; PMCID: PMC10944851.
- Abdul-Salam State SE, Sfredel V, Mocanu CL, Albu CV, Bălășoiu AT. Optic neuropathies post-Covid-19 — review. Rom J Ophthalmol. 2022 Oct-Dec;66(4):289-298. doi: 10.22336/rjo.2022.54. PMID: 36589322; PMCID: PMC9773110.
- Kraker JA, Chen JJ. An update on optic neuritis. J Neurol. 2023 Oct;270(10):5113-5126. doi: 10.1007/s00415-023-11920-x. Epub 2023 Aug 5. PMID: 37542657.
- Xie JS, Donaldson L, Margolin E. Papilledema: A review of etiology, pathophysiology, diagnosis, and management. Surv Ophthalmol. 2022 Jul-Aug;67(4):1135-1159. doi: 10.1016/j.survophthal.2021.11.007. Epub 2021 Nov 20. PMID: 34813854.
- Коновалова Н.В., Гузун О.В., Храменко Н.І., Ковтун О.В. Особливості перебігу та лікування гострої судинної оптичної нейропатії. Практикуючий лікар. 2023;4:63-71.
- Вакалюк І.П., Ковтун Ю.С. Ефективність застосування мексикору у відновному лікуванні хворих, що перенесли гострий інфаркт міокарда. Ліки України. 2010;2(138):58-62.
- Buioni D, Nardi P, Ruvolo G. Thrombocytopenia and coagulation disorders due to COVID 19 infection with concomitant cardiovascular diseases requiring anti-platelet and anticoagulant therapy, which strategy? Clin Chim Acta. 2020 Sep;508:109. doi: 10.1016/j.cca.2020.05.031. Epub 2020 May 14. PMID: 32417209; PMCID: PMC7224673.
- Hayreh S, Zimmerman M. Fundus changes in central retinal vein occlusion. Retina. 2015;1(35):29-42. DOI: 10.1097/IAE.0000000000000256.
- Balducci N, Morara M, Veronese S, et al. Optical coherence tomographic angiography in acute arteritic and non-arterial anterior ischemic optic neuropathy. Graefes Arch Clin Exp Ophthalmol. 2017;255:2255-2261.
- Храменко Н.І., Коновалова Н.В., Серебріна Т.М., Івани–цька О.В. Регіонарна гемодинаміка ока при невриті зорового нерва. Офтальмологічний журнал. 2023;2:3-10.

/100.jpg)
/100_2.jpg)
/101.jpg)