Журнал «Внутренняя медицина» 5-6(11-12) 2008
Вернуться к номеру
Сравнение in vitro эффективности цефтриаксона и цефтриаксона/сульбактама в отношении БЛРС-продуцирующих штаммов семейства Enterobacteriaceae
Авторы: Р.С. Козлов, А.А. Мартинович, А.В. Дехнич, НИИ антимикробной химиотерапии ГОУ ВПО «Смоленская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию», Россия
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
Введение
Одной из наиболее важных проблем в медицине в настоящее время является проблема нозокомиальных инфекций. Данная патология ухудшает прогноз заболевания, увеличивает вероятность летального исхода и вынуждает врачей назначать дополнительную терапию, что ведет к повышению затрат на лечение, диагностику и пребывание пациентов в стационаре. Нозокомиальная флора наиболее часто представлена грамотрицательными микроорганизмами, в частности энтеробактериями. До недавнего времени для терапии этих инфекций успешно применялись цефалоспорины и пенициллины. Однако в последние годы наблюдается значимый рост резистентности энтеробактерий к этим группам антибиотиков, что преимущественно обусловлено продукцией бета-лактамаз расширенного спектра (БЛРС).
Для борьбы с бактериями, продуцирующими бета-лактамазы широкого спектра, в 80-е годы прошлого столетия в практику были внедрены цефалоспорины III поколения, устойчивые к их действию. Для того чтобы подчеркнуть эту особенность, III поколение цефалоспоринов было названо препаратами с расширенным спектром активности. Но уже через год их использования появились сообщения об обнаружении новых бета-лактамаз, разрушающих и эти антибиотики [1]. Эта новая группа ферментов по аналогии с препаратами была названа бета-лактамазами расширенного спектра.
Наибольшее же значение среди БЛРС имеют цефотаксимазы СТХ-М типа (Cefotaximase-Munich) — CTX-M-3, CTX-M-5, CTX-M-9, CTX-M-15 [2]. Это сравнительно новая, но стремительно распространяющаяся группа бета-лактамаз, которая сейчас имеет ключевое значение в придании резистентности бактериям семейства Enterobacteriaceae. CTX-M-β-лактамазы эффективно гидролизуют многие оксиимино-бета-лактамы — цефотаксим, цефтриаксон, азтреонам, менее активны в отношении цефтазидима.
На данный момент опубликовано множество работ в различных странах мира, описывающих значимость инфекций, вызванных БЛРС-продуцирующими энтеробактериями, и постоянный рост числа микроорганизмов, способных к выработке данных ферментов.
Бороться с данной проблемой можно несколькими путями. Во-первых, предотвратить распространение БЛРС-продуцирующих микроорганизмов. Для этого необходимо соблюдать правила инфекционного контроля как медицинскому персоналу, так и пациентам и их посетителям; обрабатывать оборудование и предметы ухода за пациентами. Во-вторых, своевременно выявлять БЛРС-продуцирующие бактерии и избегать селекции резистентных штаммов, т.е. адекватно использовать антибиотики, проводить скрининг на выработку БЛРС, при необходимости менять антимикробную терапию. В-третьих, бороться с уже резистентными возбудителями. Этого добиваются добавлением к антибиотикам специфических ингибиторов. Ингибиторы бета-лактамаз — это вещества, имеющие бета-лактамную структуру, способные необратимо связывать бета-лактамазы микроорганизмов, защищая антибиотики от гидролиза данными ферментами.
Следует помнить, что на другие механизмы резистентности ингибиторы бета-лактамаз не действуют. Также неактивны они и в отношении природно-резистентных к бета-лактамам микроорганизмов. В настоящее время наиболее часто используют три ингибитора бета-лактамаз: сульбактам, тазобактам и клавуланат. Стоит отметить, что сульбактам имеет собственную выраженную антибактериальную активность в отношении ряда микроорганизмов, наиболее важными из которых являются Acinetobacter spp. и Bacteroides spp. Антибиотик, выпускаемый в комбинации с ингибитором, называют защищенным.
В настоящее время существует и успешно применяется ряд комбинаций пенициллинов и цефалоспоринов с ингибиторами, что позволяет использовать эти препараты в отношении резистентных к незащищенным антибиотикам штаммов. Хотя некоторые авторы и предлагают использовать в подобных случаях цефепим (цефалоспорин IV поколения), ссылаясь на его высокую клиническую эффективность [3], данные зарубежных микробиологических исследований показывают, что не менее чем 20 % БЛРС-продуцирующих энтеробактерий нечувствительны к цефепиму [4]. Более того, ряд ученых считает терапию цефепимом фактором риска продукции БЛРС и неблагоприятного клинического исхода [5]. Активными остаются только карбапенемы, но они являются дорогостоящими и считаются препаратами резерва. Разработка принципиально новых препаратов очень дорога и требует много времени. Поэтому создают новые комбинации ингибиторов бета-лактамаз со «старыми» антибиотиками. И хотя применение подобных препаратов порождает множество дискуссий и разногласий, они успешно используются на практике и имеют определенное клиническое значение. Одним из таких препаратов является комбинация цефалоспорина III поколения цефтриаксона с ингибитором бета-лактамаз сульбактамом.
В то же время установлено, что сульбактам обладает собственной антимикробной активностью в отношении ацинетобактеров, гонококков и бактероидов, за счет этого указанная комбинация имеет большую активность по сравнению с цефтриаксоном в отношении этих возбудителей, а также некоторых бета-лактамазопродуцирующих микроорганизмов.
Комбинация цефтриаксон/сульбактам имеет показания к применению у детей, а также у беременных, если ожидаемая польза превышает потенциальный риск для плода. Цефтриаксон очень хорошо проникает через гематоэнцефалический барьер (ГЭБ). При воспалении мозговых оболочек проникновение через ГЭБ существенно увеличивается у сульбактама с достижением терапевтических концентраций.
Целью данного исследования являлась сравнительная оценка in vitro активности комбинации цефтриаксона/сульбактама и цефтриаксона в терапии нозокомиальных инфекций, вызванных БЛРС-продуцирующими энтеробактериями, а также определение потенциального спектра активности данной комбинации антибактериальных препаратов.
Материалы и методы
Для исследования было отобрано 528 штаммов — представителей семейства Enterobacteriaceae, продуцирующих различные виды БЛРС (табл. 1). Исходное соотношение различных групп продуцируемых бета-лактамаз в общей популяции энтеробактерий было сохранено. Все изучаемые микроорганизмы были условно отнесены к одной из двух групп в зависимости от продукции (или ее отсутствия) природных AmpC-бета-лактамаз. Минимальные подавляющие концентрации (МПК) для цефтриаксона и цефтриаксона/сульбактама (2 : 1) определялись методом разведений в агаре Мюллера — Хинтон. Оценка результатов проводилась согласно критериям Института по клиническим лабораторным стандартам США (CLSI, 2007). Оценка результатов определения чувствительности проводилась согласно критериям для цефтриаксона.
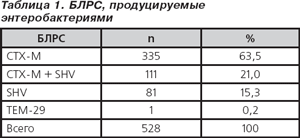
Активность in vitro исследуемых препаратов в отношении БЛРС-продуцирующих штаммов
Общие данные об уровнях резистентности приведены в табл. 2. По результатам проведенного исследования видно, что исходные значения МПК50 и МПК90 цефтриаксона были очень высокими для всех изучаемых микроорганизмов. Штаммы Enterobacter spp., Morganella morganii и Providencia spp., также продуцирующие AmpC-бета-лактамазы, имели МПК50, равную 128 мг/л, тогда как остальные микроорганизмы имели уровни МПК50 ≥ 256 мг/л (концентрации антибиотика свыше 256 мг/л не изучались). МПК90 ≥ 256 мг/л была отмечена для всех исследуемых штаммов бактерий, за исключением Pantoea spp. (МПК90 = 64 мг/л).
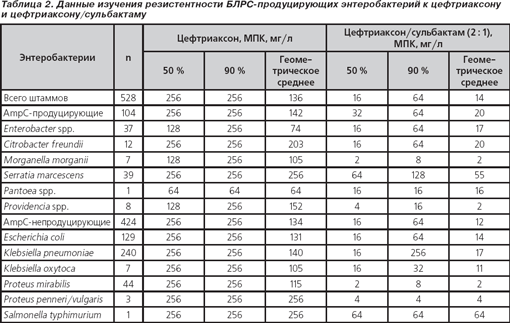
Добавление сульбактама к цефтриаксону оказало наиболее заметное действие на AmpC-непродуцирующие штаммы Proteus mirabilis, снизив МПК50 и МПК90 с ≥ 256 мг/л до 2 и 8 мг/л соответственно. Не менее выраженная эффективность отмечена у штаммов Proteus penneri/vulgaris, также отрицательных по AmpC (уменьшение МПК50 и МПК90 с ≥ 256 до 4 мг/л), и AmpC-продуцирующих штаммов Morganella morganii (МПК50 128 мг/л → 2 мг/л, МПК90 ≥ 256 мг/л → 8 мг/л). МПК50, равная 4 мг/л, была и у Providencia spp., однако МПК90 у этого же микроорганизма достигает 16 мг/л (умеренно резистентные штаммы). К группе умеренно резистентных микроорганизмов относятся штаммы Pantoea spp. (МПК50 и МПК90 = 16 мг/л) и Klebsiella oxytoca (МПК50 = 16 мг/л, МПК90 = 32 мг/л). У остальных штаммов также происходит снижение значений МПК50 и МПК90, но во всех случаях как минимум одно из этих значений по-прежнему остается на уровне более 64 мг/л, что оставляет эти микроорганизмы в группе резистентных как к цефтриаксону, так и к комбинации его с сульбактамом.
Заключение
Согласно полученным данным, протестированные микроорганизмы оказались чувствительными к цефтриаксону в 16,3 % случаев, в то время как чувствительность к комбинации цефтриаксона и сульбактама составила 82,9 %.
Использование цефтриаксона, как и других цефалоспоринов, в эмпирической терапии инфекций, вызываемых БЛРС-продуцирующими энтеробактериями, недопустимо ввиду высокого уровня резистентности к данному препарату.
Комбинация цефтриаксона с сульбактамом (2 : 1) потенциально может иметь клинический эффект, если предполагаемым или доказанным возбудителем нозокомиальной инфекции являются Proteus spp., Morganella morganii или Providencia spp. Также возможно ожидать положительных результатов при терапии цефтриаксоном/сульбактамом инфекций, вызванных Pantoea spp. и Klebsiella oxytoca. В то же время основополагающими в выборе оптимального препарата являются данные клинических исследований, адаптированные с учетом ситуации с резистентностью, указанной выше.
1. Страчунский Л.С. β-лактамазы расширенного спектра — быстро растущая и плохо осознаваемая угроза // Клин. микробиол. антимикроб. химиотер. — 2005. — 7(1). — 92-96.
2. Эйдельштейн М.В., Страчунский Л.С., исследовательская группа РОСНЕТ. Динамика распространенности и чувствительности БЛРС-продуцирующих энтеробактерий к различным антимикробным препаратам в ОРИТ России // Клин. микробиол. антимикроб. химиотер. — 2005. — 7(4). — 323-336.
3. Ромашов О.М., Яковлев С.В., Сидоренко С.В., Березин А.Г. Эффективность цефепима при лечении нозокомиальных инфекций, вызванных энтеробактериями-продуцентами бета-лактамаз расширенного спектра. Опубликовано на сайте: http://www.antimicrob.ru/effect.htm
4. David L. Paterson, Wen-Chien Ko, Anne Von Gottberg, Jose Maria Casellas, Lutfiye Mulazimoglu, Keith P. Klugman, Robert A. Bonomo, Louis B. Rice, Joseph G. Mccormack, Victor L. Yu. Outcome of Cephalosporin Treatment for Serious Infections Due to Apparently Susceptible Organisms Producing Extended-Spectrum —Lactamases: Implications for the Clinical Microbiology Laboratory // J. Clin. Microbiol. — 2001. — 6. — 2206-2212.
5. Fernando Bellissimo-Rodrigues, Ana Carolina Frade Gomes, Afonso Dinis Costa Passos, Jorge Alberto Achcar, Gleici da Silva Castro Perdona, Roberto Martinez. Clinical outcome and risk factors related to extended-spectrum beta-lactamase-producing Klebsiella spp. infection among hospitalized patients // Mem. Inst. Oswaldo Cruz, Rio de Janeiro. — 2006. — 6, 101(4). — 415-421.
6. Williams J.D. Аntibacterial agents // Clin. Inf. Dis. — 2000. — 24. — 494-7.
7. Williams J.D. Interaction between antibiotics and beta-lactamase inhibitors // Complications Surg. — 1993. — 12 (Suppl. A). — 15-21.
