Журнал «Болезни и антибиотики» 1(1) 2009
Вернуться к номеру
Проблема лечения тяжелых нозокомиальных инфекций
Авторы: Белобородов В.Б., Российская медицинская академия последипломного образования, г. Москва, Россия
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
Введение
Нозокомиальные инфекции — это инфекции, возникающие у госпитализированных пациентов после 48 часов лечения в стационаре, признаков которых не было на момент поступления и при этом пациенты не находились в инкубационном периоде инфекции. Актуальность этих инфекций появилась и значительно возросла за последние 40–50 лет, что по времени совпало с развитием анестезиологии и реаниматологии, со значительным расширением возможностей хирургического лечения и внедрением новых инвазивных методов диагностики и лечения. Социальным аспектом нозокомиальных инфекций является рост летальности и дополнительные экономические потери, связанные с ними. Мировым медицинским сообществом направлены значительные усилия на разработку мер по ограничению распространения, совершенствование диагностики и лечения этих инфекций. Одной из важнейших особенностей нозокомиальных инфекций являются возбудители, отличающиеся своей устойчивостью к антибактериальным препаратам, которые традиционно применяются для лечения аналогичных инфекций, вызванных внебольничной флорой. К настоящему времени выделяется более 30 нозологических форм нозокомиальных инфекций, однако наибольшую угрозу для жизни представляют нозокомиальная пневмония (НП), особенно связанная с применением искусственной вентиляции легких (НПивл), и ангиогенные (тяжелый сепсис, септический шок) инфекции.
Резистентность флоры
Резистентность возбудителей нозокомиальных инфекций к антибиотикам (АБ) является важной причиной, оказывающей влияние на летальность и потребление ресурсов [1]. Быстрый рост и распространение резистентности к АБ госпитальной флоры наблюдается во всем мире, но этот процесс происходит неравномерно. Грамотрицательные и грамположительные микроорганизмы являются основными возбудителями нозокомиальных инфекций [2–5]. Наиболее проблемными микроорганизмами являются резистентные к метициллину S.aureus (MRSA) и грамотрицательные бактерии — продуценты β-лактамаз расширенного спектра (ESBLs), так как именно они обладают резистентностью ко многим АБ [6–11].
Отделения реанимации и интенсивной терапии (ОРИТ) оказываются наиболее актуальными отделениями с точки зрения появления резистентности флоры к АБ. Это обусловлено несколькими причинами: 1) высокой частотой неэффективной стартовой терапии и продолжительным применением АБ широкого спектра действия; 2) концентрацией наиболее тяжелых больных в помещениях с относительно небольшой площадью; 3) невысокой экономической заинтересованностью среднего медицинского персонала в обучении и применении на практике методов ограничения контактного распространения резистентной флоры; 4) увеличением количества госпитализированных пациентов с острой и хронической патологией, нуждающихся в продолжительном лечении и являющихся источником бактерий, резистентных к АБ [1, 12–13].
Преодоление резистентности к АБ
Идеальная антибактериальная терапия должна обеспечивать адекватную (активную в отношении выделенного возбудителя) стартовую терапию и ограничивать рост и распространение резистентности. Сравнительно недавно основные идеи такой программы были представлены в виде 12 принципов профилактики резистентности в стационаре. Одним из ключевых элементов этой программы является участие в решении этой проблемы экспертов в данной области (инфекционистов, клинических эпидемиологов, микробиологов, клинических фармакологов), особенно при разработке методов оптимизации лечения и ограничения резистентности к АБ.
Важнейшим методом совершенствования применения антибиотиков является принцип деэскалационной антибактериальной терапии (АБТ) [14]. Деэскалационная АБТ является методом повышения адекватности стартового режима с целью снижения риска неблагоприятного исхода инфекции у наиболее тяжелой категории пациентов и одновременно с этим — ограничения избыточного или необоснованного применения АБ (рис. 1).
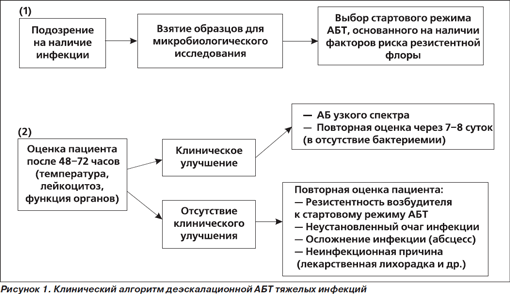
1. Подозрение на наличие тяжелой нозокомиальной инфекции.
2. Оценка стартового режима АБТ после получения микробиологических данных.
3. Завершение курса АБТ — продолжение мониторинга.
Резистентность к АБ: факторы риска и их влияние на исход
Факторы риска появления резистентности к АБ
АБ стимулируют появление резистентности, поэтому меры, направленные на ограничение их применения, напрямую связаны с ограничением резистентности. Во многих исследованиях выявлена тесная связь между применением АБ и появлением резистентности бактерий к нему [15–17]. Имеются другие факторы риска роста резистентности к АБ: продолжительная госпитализация; применение инвазивных устройств (интубационные трубки, сосудистые катетеры), вероятно, в результате образования биопленки на поверхности этих устройств; проживание в домах инвалидов и престарелых; неэффективные меры инфекционного контроля [13].
Появление новых штаммов возбудителей во внебольничных условиях приводит к попаданию этой резистентной флоры в стационар. Сравнительно недавно доказано появление и распространение внебольничных штаммов S.aureus, резистентных к оксациллину (CA-MRSA) [17–20]. Продолжительное применение АБ является наиболее важным фактором появления резистентности к нему, причем это влияние может быть существенно ослаблено рациональной АБТ [21–22].
Последствия неадекватной АБТ
Повышение летальности. Показано, что эмпирическая АБТ тяжелых инфекций препаратами, неактивными в отношении возбудителей, т.е. неадекватная стартовая АБТ, приводит к достоверному повышению летальности — примерно в 2 раза. Недавно подобные данные были получены у больных сепсисом [23–31]. Изменение режима АБТ жизнеугрожающих инфекций после получения данных микробиологического исследования существенно не улучшало результаты лечения из-за возникновения тяжелых осложнений: септического шока, кровотечений и других причин [24, 26]. В этих исследованиях показано, что рост резистентности госпитальной флоры приводил к увеличению летальности из-за низкой эффективности стандартных режимов эмпирической АБТ. Недавно в рекомендациях Американского торакального общества и Общества инфекционистов (ATS/IDSA) по лечению нозокомиальной пневмонии была подчеркнута значимость неадекватной АБТ как причины роста госпитальной летальности [32]. Эти рекомендации подчеркивают важность: 1) мониторинга чувствительности к АБ локальной флоры (постоянного обновления данных для всей больницы и отдельных ОРИТ для обеспечения адекватности выбора эмпирических режимов АБТ); 2) правильного дозирования АБ (для оптимизации тканевых концентраций).
Возрастание затрат. В основном рост затрат связан с нозокомиальными инфекциями, которые обычно бывают вызваны флорой, резистентной к АБ [17, 33]. Установлено, что инфекции, вызванные MRSA, по сравнению с инфекциями, вызванными чувствительными к метициллину/оксациллину S.aureus (MSSA), являются причиной более высокой летальности. В метаанализе 30 исследований было показано, что MRSA-бактериемия независимо от других причин повышает риск смерти [34]. При оценке атрибутивной летальности MRSA и MSSA разница составила около 25 % [35]. Причинами этих различий, как полагают, являются: 1) тяжесть течения инфекции; 2) применение неадекватной эмпирической АБТ. Обычно у пациентов с инфекциями, вызванными MRSA, отмечалось более тяжелое течение заболевания и в момент поступления в стационар, и в момент диагностики инфекции. Кроме того, больные нуждались в более продолжительной госпитализации.
При ретроспективном анализе большой группы пациентов со стафилококковыми нозокомиальными пневмониями, связанными с ИВЛ, также выявлена большая продолжительность госпитализации в ОРИТ и более высокие затраты у больных с инфекцией MRSA [36]. Независимые переменные, определяющие продолжительность лечения в ОРИТ (тяжесть инфекции, продолжительность ИВЛ, назначение адекватной АБТ), у пациентов с инфекцией MRSA были выше примерно на 50 %. Изучение показателей использования ресурсов с помощью анализа продолжительности лечения в ОРИТ подтвердило диспропорциональное их увеличение у пациентов с инфекциями MRSA. Приблизительная оценка дополнительных затрат на день пребывания в ОРИТ составила в США около $2000, что с учетом средней продолжительности НПивл приводило к их увеличению на $10 000–$15 000 на каждого пациента. Поэтому, кроме клинической важности, имеется существенная экономическая мотивация снижения резистентности нозокомиальной флоры. Подобные исследования уже были проведены и в отношении инфекций, вызванных другими резистентными к АБ возбудителями, в том числе Pseudomonas aeruginosa [37, 38].
Факторы, оказывающие влияние на выбор стартовой АБТ
Адекватный режим АБТ. При определении режима эмпирической АБТ необходимо учитывать 4 важнейших фактора: 1) наличие инфекции (установленный или предполагаемый диагноз инфекционного заболевания); 2) вероятность этиологической значимости тех или иных возбудителей при определенных видах нозокомиальных инфекций (этиологическая структура нозокомиальных инфекций); 3) спектр циркулирующих микробов в данном учреждении и особенности их резистентности к антибиотикам (мониторинг локальной флоры); 4) наличие у пациента факторов риска инфекции, вызванной резистентной флорой. В идеальном случае должны учитываться все указанные выше факторы.
Наличие инфекции. Многие критические состояния сопровождаются генерализованной воспалительной реакцией, клинические и лабораторные признаки которой существенно не отличаются от признаков инфекции. В случаях госпитализации пациентов в ОРИТ с неинфекционными заболеваниями появление признаков инфекции (первичный очаг, признаки генерализованной инфекции, повышенный уровень цитокинов, белков острой фазы, прокальцитонина), как правило, не вызывает диагностических сложностей. Однако при тяжелой политравме, ожоговой токсемии, деструктивном панкреатите, послеоперационных хирургических инфекционных осложнениях, полиорганной недостаточности возникает генерализованное воспаление, которое нередко создает значительные дифференциально-диагностические трудности в исключении нозокомиальной инфекции и приводит к существенному расширению применения антибактериальных препаратов, в том числе широкого спектра.
Особенности возбудителей. Данные Национальной системы контроля нозокомиальных инфекций (NNIS) позволяют определить наиболее частых возбудителей инфекций в многопрофильных стационарах США. Эта система была организована в 1970 году и первоначально создавалась для учета наиболее распространенных инфекций. С 1986 года в эту системы были включены инфекции, возникающие в ОРИТ. С 2000 года большинство составили инфекции, связанные с применением различных медицинских устройств: в 83 % случаев нозокомиальная пневмония возникала на фоне ИВЛ; при катетеризации мочевого пузыря у 7 % пациентов возникали уроинфекции; в 87 % случаев первичные ангиогенные инфекции наблюдались у пациентов с катетерами в центральных венах [39]. В более поздних публикациях результатов NNIS представлены данные о распределении возбудителей относительно локусов инфекции и проведено сравнение данных 1975 и 2003 года (табл. 1) [40]. В целом отмечается тенденция к возрастанию количества госпитальных инфекций, вызванных флорой с наличием резистентности к АБ (S.aureus, P.aeruginosa) [39, 40].
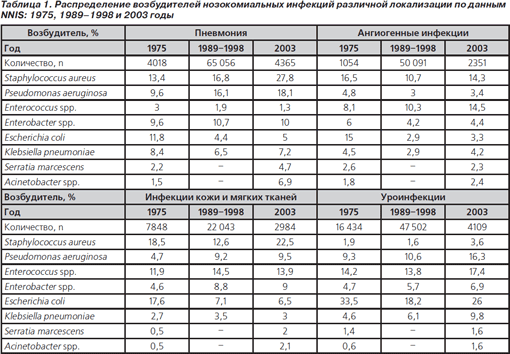
Данные NNIS указывают на изменение спектра бактериальных инфекций у пациентов с нозокомиальной пневмонией: грамотрицательные аэробы (65,9 %) с 2003 года уступили лидерство S.aureus. При первичных ангиогенных инфекциях коагулазонегативные стафилококки (42,9 %) остаются наиболее частым возбудителем, а частота выделения S.aureus (14,3 %) сравнялась с таковой энтерококков (14,5 %). У больных уроинфекциями наиболее частыми возбудителями были Escherichia coli (26 %), однако повысилась роль P.aeruginosa (16,3 %) по сравнению с 1989–1998 годами (10,6 %). Значимость грамотрицательной флоры при раневых инфекциях достоверно снизилась в последние 20 лет. Грамположительные возбудители в настоящее время чаще становятся причиной ангиогенных инфекций и инфекций кожи и мягких тканей, грамотрицательные аэробы остаются важнейшими возбудителями пневмонии и уроинфекций.
Увеличение количества и резистентности грамотрицательных неферментирующих бактерий. Одной из наиболее важных тенденций является рост актуальности Acinetobacter spp. у больных с уроинфекциями, пневмонией и раневыми хирургическими инфекциями [39–41]. Несмотря на низкий относительный вклад ацинетобактерий (~2,0 %), их количество достоверно увеличилось. Кроме того, имеются данные об увеличении числа случаев внебольничных пневмоний, вызванных этими бактериями [42]. Наибольшую озабоченность вызывает рост резистентности ацинетобактерий к карбапенемам и аминогликозидам, который выявлен у 20 % штаммов; этот показатель имеет постоянную тенденцию к увеличению с 1990 года [39–40]. Указанным бактериям свойственна низкая чувствительность к АБ и полирезистентность, что представляет реальную опасность неэффективности лечения ввиду отсутствия активных антибактериальных препаратов. В сочетании с ростом резистентности к цефалоспоринам 3-го поколения у E.coli (6,4 %) и K.pneumoniae (14,2 %) возникает практическая необходимость выявления продукции β-лактамаз расширенного спектра у таких полирезистентных бактерий [40, 43].
Мониторинг локальной флоры и резистентности к АБ
Влияние других факторов, в том числе ИВЛ. Распространенность полирезистентной флоры существенно различается в зависимости от патологии пациентов, типа больниц и отделений. Полирезистентные возбудители наиболее часто выделяются от тяжелых пациентов, пациентов с хроническими заболеваниями, например с наличием факторов риска пневмонии, связанной с оказанием медицинской помощи (табл. 2) и пациентов с поздней нозокомиальной пневмонией. Факторы риска НПивл, вызванной полирезистентной флорой, были изучены у 135 пациентов, находившихся на ИВЛ [17]. Продолжительность ИВЛ до начала пневмонии и предшествующее назначение АБ (в течение 15 дней, предшествующих НПивл) были достоверными факторами риска НПивл, вызванной резистентной флорой. Поздняя НПивл (возникшая после 5 суток интубации трахеи) у пациентов, получавших до этого АБ, вызывалась обычно полирезистентной флорой: P.aeruginosa, Acinetobacter baumannii, Stenotrophomonas maltophilia, MRSA. Эти данные еще раз указывают на необходимость рационального применения АБ у пациентов, которым проводится ИВЛ, и учета предшествующей антибактериальной терапии как основного фактора риска НПивл, вызванных полирезистентной флорой. Этим же определяется необходимость выбора в режиме эмпирической терапии НПивл (до получения результатов микробиологического исследования) препаратов широкого спектра действия, способных преодолевать основные известные механизмы резистентности нозокомиальной флоры для повышения адекватности эмпирического режима АБТ.

Различия госпитальной флоры в разных ОРИТ одной больницы
Проведено исследование, посвященное изучению различных полирезистентных возбудителей инфекций в разных ОРИТ одной больницы [44]. Выявлены существенные различия в чувствительности возбудителей в хирургическом, травматологическом и общем ОРИТ. Обнаружена низкая чувствительность Acinetobacter spp. к имипенему в хирургическом и высокая чувствительность в травматологическом ОРИТ. Подобные наблюдения были сделаны в ОРИТ других стран [45, 46]. Эти данные подтверждают необходимость согласования общих рекомендаций по антимикробной терапии и локальных данных о чувствительности (в стране, городе, больнице и ОРИТ). Это помогает учитывать особенности грамотрицательной флоры, например частоту выделения продуцентов β-лактамаз расширенного спектра среди K.pneumoniae или E.coli; резистентных к фторхинолонам P.aeruginosa, резистентных к карбапенемам A.baumannii. При высокой вероятности инфекций, вызванных этими возбудителями, необходимо вносить коррективы в режимы эмпирической терапии.
Особенности пациентов, способные влиять на резистентность флоры к АБ
В дополнение к местным или регионарным особенностям флоры имеется много особенностей пациентов, которые повышают вероятность выделения резистентной флоры. Поэтому выбор эмпирической терапии должен быть основан на данных мониторинга локальной флоры с учетом особенностей пациентов. При наличии факторов риска инфекций, вызванных госпитальными штаммами S.aureus, P.aeruginosa, Acinetobacter spp., из-за высокой вероятности резистентности существенно возрастает летальность [47–51]. Инфекции, вызванные резистентной флорой, обычно возникают у госпитализированных пациентов с длительным лечением в стационаре, длительной катетеризацией сосудов, применением антибиотиков, при наличии пролежней, раневой хирургической инфекции, зондовом питании и проведении гемодиализа.
Распространенность нозокомиальной флоры в стационаре
Некоторые виды медицинской помощи, например гемодиализ, химиотерапия, хирургические стационары одного дня, приводят к увеличению количества пациентов, которые получают лечение в условиях стационара [52]. Пневмония и ангиогенные инфекции, связанные с оказанием медицинской помощи, часто классифицируются как внебольничные инфекции и поначалу лечатся с применением соответствующих рекомендаций. Однако частое общение между пациентами и работниками здравоохранения, которые работают в стационарах, приводит к тому, что колонизирующая флора таких пациентов начинает отличаться от внебольничной и становится более похожей на нозокомиальную. Например, MRSA, выделенные от пациентов, инфицированных в условиях стационара, резко отличаются от внебольничных и обладают различной чувствительностью к АБ [19].
Кроме того, за последнее десятилетие происходит существенное изменение в резистентности внебольничной флоры. Streptococcus pneumoniae остается основным возбудителем внебольничной пневмонии, однако эта инфекция вызывается и другими возбудителями (Chlamydia pneumoniae, Mycoplasma pneumoniae, Acinetobacter spp., MRSA, Legionella spp.), распространенность которых существенно отличается в разных регионах и продолжает изменяться [42, 53, 63, 81]. Распространение резистентности к АБ возбудителей внебольничных инфекций существенно осложняет их лечение, требует внесения изменений в соответствии с микробиологическими и эпидемиологическими данными [54]. Все это приводит к необходимости отделить инфекции, связанные с оказанием медицинской помощи, от инфекций, которые традиционно относили к внебольничным [17, 32, 55, 56].
Заключение
Рост резистентности к АБ является важнейшей проблемой на пути эффективного клинического применения АБ. Сложность сохранения равновесия между необходимостью проведения адекватной АБТ и ограничением роста резистентности флоры диктуют необходимость поиска новых подходов к стратегии применения АБ. Несмотря на то что новые АБ расширяют возможности лечения, их создание может не успевать за ростом резистентности флоры. Если в отношении актуальных грамположительных возбудителей в настоящее время имеются препараты, способные решать все проблемы резистентности, в отношении актуальных грамотрицательных бактерий таких препаратов нет. Это еще раз подчеркивает важность стратегического мышления при применении АБ в клинических условиях, способного привести к соблюдению баланса между эффективностью их применения и ограничением роста резистентности возбудителей.
1. Carlet J., Ben Ali A., Chalfine A. Epidemiology and control of antibiotic resistance in the intensive care unit // Curr. Opin. Infect. Dis. — 2004. — 17. — 309-316.
2. Jones R.N., Sader H.S., Beach M.L. Contemporary in vitro spectrum of activity summary for antimicrobial agents tested against 18569 strains non-fermentative gram-negative bacilli isolated in the SENTRY Antimicrobial Surveillance Program (1997–2001) // Int. J. Antimicrob. Agents. — 2003. — 22. — 551-556.
3. Livermore D.M. Bacterial resistance: origins, epidemiology, and impact // Clin. Infect. Dis. — 2003. — 36 (suppl. 1). — S11-S23.
4. Dellinger R.P., Carlet J.M., Masur H. et al; Surviving Sepsis Campaign Management Guidelines Committee. Surviving Sepsis Campaign guidelines for management of severe sepsis and septic shock // Crit. Care Med. — 2004. — 32. — 858-873.
5. Neuhauser M.M., Weinstein R.A., Rydman R. et al. Antibiotic resistance among gram-negative bacilli in US intensive care units: implications for fluoroquinolone use // JAMA. — 2003. — 289. — 885-888.
6. Van Looveren M., Goossens H. Antimicrobial resistance of Acinetobacter spp. in Europe // Clin. Microbiol. Infect. — 2004. — 10. — 684-704.
7. Canton R., Coque T.M., Baquero F. Multi-resistant Gram-negative bacilli: from epidemics to endemics // Curr. Opin. Infect. Dis. — 2003. — 16. — 315-325.
8. Pagani L., Colinon C., Migliavacca R. et al. Nosocomial outbreak caused by multidrug-resistant Pseudomonas aeruginosa producing IMP-13 metallo-beta-lactamase // J. Clin. Microbiol. — 2005. — 43. — 3824-3828.
9. Naiemi N.A., Duim B., Savelkoul P.H. et al. Widespread transfer of resistance genes between bacterial species in an intensive care unit: implications for hospital epidemiology // J. Clin. Microbiol. — 2005. — 43. — 4862-4864.
10. Cartolano G.L., Cheron M., Benabid D. et al; Association of Hospital Bacteriologists, Virologists and Hygiene Professionals. Methicillin-resistant Staphylococcus aureus (MRSA) with reduced susceptibility to glycopeptides (GISA) in 63 French general hospitals // Clin. Microbiol. Infect. — 2004. — 10. — 448-451.
11. Jones R.N. Microbiological features of vancomycin in the 21st century: minimum inhibitory concentration creep, bactericidal/static activity, and applied breakpoints to predict clinical outcomes or detect resistant strains // Clin. Infect. Dis. — 2006. — 42 (suppl. 1). — S13-S24.
12. Kollef M.H., Fraser V.J. Antibiotic resistance in the intensive care unit // Ann. Intern. Med. — 2001. — 134. — 298-314.
13. Kollef M.H. Gram-negative bacterial resistance: evolving patterns and treatment paradigms // Clin. Infect. Dis. — 2005. — 40 (suppl. 2). — S85-S88.
14. Kollef M.H., Micek S.T. Strategies to prevent antimicrobial resistance in the intensive care unit // Crit. Care Med. — 2005. — 33. — 1845-1853.
15. Zaoutis T.E., Goyal M., Chu J.H. et al. Risk factors for and outcomes of bloodstream infection caused by extended-spectrum beta-lactamase-producing Escherichia coli and Klebsiella species in children // Pediatrics. — 2005. — 115. — 942-949.
16. Del Mar Tomas M., Cartelle M., Pertega S. et al. Hospital outbreak caused by a carbapenem-resistant strain of Acinetobacter baumannii: patient prognosis and risk-factors for colonisation and infection // Clin. Microbiol. Infect. — 2005. — 11. — 540-546.
17. Kollef M.H., Micek S.T. Methicillin-resistant Staphylococcus aureus: a new community-acquired pathogen // Curr. Opin. Infect. Dis. — 2006. — 19. — 161-168.
18. Naimi T.S., LeDell K.H., Como-Sabetti K. et al. Comparison of community- and health care-associated methicillin-resistant Staphylococcus aureus infection // JAMA. — 2003. — 290. — 2976-2984.
19. Clark N.M., Hershberger E., Zervosc M.J., Lynch J.P. III. Antimicrobial resistance among gram-positive organisms in the intensive care unit // Curr. Opin. Crit Care. — 2003. — 9. — 403-412.
20. Chastre J., Wolff M., Fagon J.Y. et al. Comparison of 8 vs 15 days of antibiotic therapy for ventilator-associated pneumonia in adults: a randomized trial // JAMA. — 2003. — 290. — 2588-2598.
21. Dennesen P.J., van der Ven A.J., Kessels A.G. et al. Resolution of infectious parameters after antimicrobial therapy in patients with ventilator-associated pneumonia // Am. J. Respir. Crit.Care Med. — 2001. — 163. — 1371-1375.
22. Ibrahim E.H., Sherman G., Ward S. et al. The influence of inadequate antimicrobial treatment of bloodstream infections on patient outcomes in the ICU setting // Chest. — 2000. — 118. — 146-155.
23. Harbarth S., Ferriere K., Hugonnet S. et al. Epidemiology and prognostic determinants of bloodstream infections in surgical intensive care // Arch. Surg. — 2002. — 137. — 1353-1359.
24. Ibrahim E.H., Ward S., Sherman G. et al. Experience with a clinical guideline for the treatment of ventilator-associated pneumonia // Crit. Care Med. — 2001. — 29. — 1109-1115.
25. Kollef M.H. Inadequate antimicrobial treatment: an important determinant of outcome for hospitalized patients // Clin. Infect. Dis. — 2000. — 31 (Suppl. 4). — S131-S138.
26. Micek S.T., Lloyd A.E., Ritchie D.J. et al. Pseudomonas aeruginosa bloodstream infection: importance of appropriate initial antimicrobial treatment // Antimicrob Agents Chemother. — 2005. — 49. — 1306-1311.
27. Dhainaut J.F., Laterre P.F., LaRosa S. et al. The clinical evaluation committee in a large multicenter phase 3 trial of drotrecogin alfa (activated) in patients with severe sepsis (PROWESS): role, methodology, and results // Crit. Care Med. — 2003. — 31. — 2291-2301.
28. Harbarth S., Garbino J.K., Pugin J. et al. Inappropriate initial antimicrobial therapy and its effects on survival in a clinical trial of immunomodulating therapy for severe sepsis // Am. J. Med. — 2003. — 115. — 529-535.
28. Garnacho-Montero J., Garcia-Garmendia J.L., Barrero-Almodovar A. et al. Impact of adequate empirical antibiotic therapy on the outcome of patients admitted to the intensive care unit with sepsis // Crit. Care Med. — 2003. — 31. — 2742-2751.
30. Micek S.T., Isakow W., Shannon W., Kollef M.H. Predictors of hospital mortality for patients with severe sepsis treated with Drotrecogin alfa (activated) // Pharmacotherapy. — 2005. — 25. — 26-34.
31. American Thoracic Society, Infectious Diseases Society of America. Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia // Am. J. Resp. Crit. Care Med. — 2005. — 171. — 388-416.
32. Rello J., Ollendorf D.A., Oster G. et al. Epidemiology and outcomes of ventilator-associated pneumonia in a large US database // Chest. — 2002. — 122. — 2115-2121.
33. Cosgrove S.E., Sakoulas G., Perencevich E.N. et al. Comparison of mortality associated with methicillin-resistant and methicillin-susceptible Staphylococcus aureus bacteremia: a meta-analysis // Clin. Infect. Dis. — 2003. — 36. — 53-59.
34. Blot S.I., Vandewoude K.H., Hoste E.A., Colardyn F.A. Outcome and attributable mortality in critically Ill patients with bacteremia involving methicillin-susceptible and methicillin-resistant Staphylococcus aureus // Arch. Intern. Med. — 2002. — 162. — 2229-2235.
35. Shorr A.F., Combes A., Kollef M.H. et al. Methicillin-resistant Staphylococcus aureus prolongs intensive care unit length of stay in ventilator-associated pneumonia, despite initially appropriate antibiotic therapy // Crit. Care Med. — 2006. — 34. — 700-706.
36. Carmeli Y., Troillet N., Karchmer A.W., Samore M.H. Health and economic outcomes of antibiotic resistance in Pseudomonas aeruginosa // Arch. Intern. Med. — 1999. — 159. — 1127-1132.
37. Niederman M S. Impact of antibiotic resistance on clinical outcomes and the cost of care // Crit. Care Med. — 2001. — 29 (Suppl.). — N114-N120.
38. National Nosocomial Infections Surveillance (NNIS) system report, data summary from January 1992 — April 2000, issued June 2000 // Am. J. Infect. Control. — 2000. — 28. — 429-448.
39. Gaynes R., Edwards J.R.; National Nosocomial Infections Surveillance System. Overview of nosocomial infections caused by gram-negative bacilli // Clin. Infect. Dis. — 2005. — 41. — 848-854.
40. Richards M.J., Edwards J.R., Culver D.H., Gaynes R.P. Nosocomial infections in combined medical-surgical intensive care units in the United States // Infect. Control. Hosp. Epidemiol. — 2000. — 21. — 510-515.
41. Leung W.S., Chu C.M., Tsang K.Y. et al. Fulminant community-acquired Acinetobacter baumannii pneumonia as a distinct clinical syndrome // Chest. — 2006. — 129. — 102-109.
42. Paterson D.L., Bonomo R.A. Extended-spectrum beta-lactamases: a clinical update // Clin. Micro Rev. — 2005. — 18. — 657-686.
43. Namias N., Samiian L., Nino D. et al. Incidence and susceptibility of pathogenic bacteria vary between intensive care units within a single hospital: implications for empiric antibiotic strategies // J. Trauma. — 2000. — 49. — 638-645.
44. Rello J., Sa-Borges M., Correa H. et al. Variations in etiology of ventilator-associated pneumonia across four treatment sites // Am. J. Respir. Crit. Care Med. — 1999. — 160. — 608-613.
45. Masterton R.G., Kuti J.L., Turner P.J., Nicolau D.P. The OPTAMA programme: utilizing MYSTIC (2002) to predict critical pharmacodynamic target attainment against nosocomial pathogens in Europe // J. Antimicrob. Chemother. — 2005. — 55. — 71-77.
46. Crouch Brewer S., Wunderink R.G., Jones C.B., Leeper K.V. Ventilator-associated pneumonia due to Pseudomonas aeruginosa // Chest. — 1996. — 109. — 1019-1029.
47. Combes A., Luyt C.E., Fagon J.Y. et al. Impact of methicillin resistance on outcome of Staphylococcus aureus ventilator-associated pneumonia // Am. J. Respir. Crit. Care Med. — 2004. — 170. — 786-792.
48. Cosgrove S.E., Qi Y., Kaye K.S. et al. The impact of methicillin resistance in Staphylococcus aureus bacteremia on patient outcomes: mortality, length of stay, and hospital charges // Infect. Control. Hosp. Epidemiol. — 2005. — 26. — 166-174.
49. Paterson D.L., Ko W.C., Von Gottberg A. et al. International prospective study of Klebsiella pneumoniae bacteremia: implications of extended-spectrum-beta-lactamase production in nosocomial infections // Ann. Intern. Med. — 2004. — 140. — 26-32.
50. Quale J., Bratu S., Landman D., Heddurshetti R. Molecular epidemiology and mechanisms of carbapenem resistance in Acinetobacter baumannii endemic in New York City // Clin. Infect. Dis. — 2003. — 37. — 214-220.
51. Tacconelli E., Venkataraman L., De Girolami P.C., D’Agata E.M. Methicillin-resistant Staphylococcus aureus bacteraemia diagnosed at hospital admission: distinguishing between community-acquired versus healthcare-associated strains // J. Antimicrob. Chemother. — 2004. — 53. — 474-479.
52. Tablan O.C., Anderson L.J., Besser R. et al. Guidelines for preventing health-care-associated pneumonia, 2003. Recommendations of the CDC and the Healthcare Infection Control Practices Advisory Committee // MMWR Recomm. Rep. — 2004. — 53:1-36.
53. Vidaur L., Sirgo G., Rodriguez A.H., Rello J. Clinical approach to the patient with suspected ventilator-associated pneumonia // Respir. Care. — 2005. — 50. — 965-974.
54. Torres A., Aznar R., Gatell J.M. et al. Incidence, risk, and prognosis factors of nosocomial pneumonia in mechanically ventilated patients // Am. Rev. Respir. Dis. — 1990. — 142. — 523-528.
55. Mandell L.A., Bartlett J.G., Dowell S.F. et al. Update of practice guidelines for the management of community-acquired pneumonia in immunocompetent adults // Clin. Infect. Dis. — 2003. — 37. — 1405-1433.
56. Micek S.T., Heuring T.J., Hollands J.M. et al. Optimizing antibiotic treatment for ventilator-associated pneumonia // Pharmacotherapy. — 2006. — 26. — 204-213.
