Журнал «Болезни и антибиотики» 1(1) 2009
Вернуться к номеру
Инфекции у больных сахарным диабетом
Авторы: Богун Л.В., Харьковская медицинская академия последипломного образования
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
Инфекционные заболевания остаются одной из важнейших причин заболеваемости и смертности у больных сахарным диабетом (СД). Больные СД не только подвержены более частому и тяжелому течению инфекционных заболеваний, но и наоборот, инфекция является наиболее частой причиной дестабилизации СД, а в 20–25 % случаев служит первым проявлением СД [1]. Более того, некоторые инфекции характерны только для больных СД и практически никогда не встречаются у лиц без нарушений углеводного обмена: злокачественный наружный отит (ЗНО), риноцеребральный мукоромикоз, эмфизематозные инфекции (табл. 1) [2, 3].

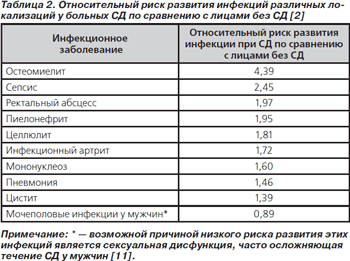
Общий риск развития инфекционного заболевания при СД повышается в 1,21 раза, варьируя от 0,89 до 4,39 для различных инфекций, а риск смерти от инфекционного заболевания — в 1,84 раза (табл. 2) [4].
Повышенная восприимчивость больных СД к инфекциям обусловлена двумя группами факторов, которые условно можно отнести к генерализованным или местным причинам снижения противоинфекционной защиты. Генерализованные нарушения иммунологической реактивности связаны с нарушением функции полиморфноядерных лейкоцитов (нарушение миграции, фагоцитоза, внутриклеточного киллинга, хемотаксиса) вследствие сниженной текучести их мембраны, а также с нарушением функции моноцитов и лимфоцитов [6]. Вторая группа причин имеет значение при развитии осложнений сахарного диабета: макро- и микрососудистых осложнений, автономной невропатии, а также при отсутствии адекватного контроля гликемии — и обусловливает повышенную восприимчивость к инфекциям определенных локализаций. Например, нарушение микроциркуляции приводит к более медленному ответу на инфекцию и ухудшению заживления повреждений кожи и слизистых, нарушению их барьерной функции, результатом чего является повышенная частота развития инфекций кожи, слизистых и подлежащих мягких тканей [2, 6]. Присоединение на этом фоне нарушений чувствительности нижних конечностей вследствие сенсорной невропатии сопровождается бессимптомным течением микротравм этой локализации и еще больше повышает риск инфекции, наиболее характерным примером чего является развитие одного из типичных осложнений СД — диабетической стопы. Дисфункция мочевого пузыря в результате автономной невропатии и, как следствие, задержка мочи и пузырно-мочеточниковый рефлюкс способствуют колонизации микроорганизмами мочевого тракта, а высокая концентрация глюкозы в моче благоприятствует их росту, что объясняет еще одну характерную локализацию инфекций при СД — инфекцию мочевыводящих путей [7–9].
Более тяжелое течение инфекций у больных СД 2-го типа объясняется также изменениями фармакокинетики антимикробных препаратов (АМП). Сопутствующие ожирению патофизиологические нарушения приводят к изменению распределения, выведения и метаболизма АМП. Для больных СД 2-го типа характерен повышенный уровень липопротеинов, холестерина и свободных жирных кислот, способных конкурентно связываться с альбумином сыворотки крови, в результате чего ингибируется связывание альбумина с другими лекарственными препаратами. Кроме того, объем распределения лекарственного препарата в значительной мере определяется его липофильностью [10]. При септическом шоке описано снижение пенетрации бета-лактамных антибиотиков в очаг инфекции [11, 12]. Было также продемонстрировано значительное снижение концентрации бета-лактамов в подкожной жировой клетчатке по сравнению с концентрацией в сыворотке крови [13]. Поскольку чаще всего инфекция локализуется в интерстициальной жидкости, а не в плазме, снижение пенетрации АМП в очаг инфекции может служить одной из причин неэффективности антимикробной терапии при септическом шоке, даже если концентрация АМП в плазме крови превышает минимальную подавляющую концентрацию возбудителя, что было описано, например, для линезолида [13].
Инфекции головы и шеи
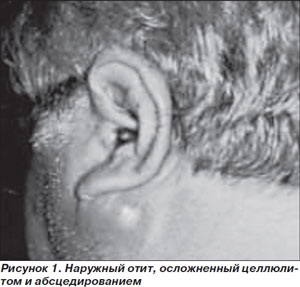
Злокачественный (некротизирующий инвазивный) наружный отит представляет собой инвазивную инфекцию наружного слухового прохода с вовлечением прилегающих мягких тканей и костных структур. Заболевание встречается очень редко, причем почти исключительно — у больных СД. В последние годы оно диагностируется чаще, что связывают с повышением осведомленности и настороженности врачей. В подавляющем большинстве случаев (до 86–90 %) ЗНО поражает больных СД пожилого и старческого возраста [14]. Клиническими проявлениями инфекции служат выраженная и упорная головная боль или боль в ухе, выделения из наружного слухового прохода, снижение слуха при отсутствии лихорадки и изменений барабанной перепонки (рис. 1). Для ЗНО характерно несоответствие между минимальными объективными изменениями и значительной выраженностью субъективной симптоматики, что отличает его от обычного наружного отита, при котором болевой синдром менее выражен, а также от среднего отита, при котором выявляется перфорация барабанной перепонки. Данный признак очень важен для дифференциальной диагностики ЗНО и обычного наружного отита, который чаще всего ошибочно диагностируют у больных ЗНО, что приводит к задержке в постановке правильного диагноза на 6–8 недель [15]. Нарушение сознания, парез черепно-мозговых нервов свидетельствуют о развитии осложнений ЗНО — остеомиелита костей черепа, височно-челюстных суставов, формировании внутримозговых абсцессов [15], резко ухудшающих прогноз заболевания.
Типичным возбудителем ЗНО является Pseudomonas aeruginosa, на долю которого приходится более 98 % случаев заболевания [14].
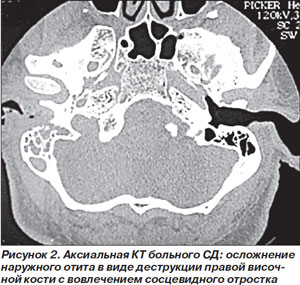
Обязательным является микробиологическое исследование (образцы для которого следует брать из глубоколежащих пораженных слоев) с окрашиванием материала по Граму и культуральным исследованием. Диагноз ЗНО подтверждается при магнитно-резонансной томографии (МРТ) с гадолинием, при котором хорошо выявляется вовлечение в инфекционный процесс мягких тканей и костей (рис. 2). Скорость оседания эритроцитов, повышенная при ЗНО, может служить хорошим критерием активности заболевания и использоваться для контроля за эффективностью терапии [16].
Лечение заключается в проведении повторных хирургических обработок пораженной области и назначении системной антимикробной терапии антисинегнойными препаратами, например ципрофлоксацином или цефтазидимом. При тяжелом течении инфекции показана комбинация бета-лактамов с аминогликозидами. Длительность антимикробной терапии составляет в среднем 6–8 недель.
Рекомендовавшееся ранее топическое применение антибиотиков [3] в настоящее время признано нецелесообразным, поскольку оно может приводить к искажению результатов микробиологического исследования [2].
При подтверждении грибковой этиологии ЗНО показано назначение системных противогрибковых антибиотиков (амфотерицин В, вориконазол), в ряде случаев допустима ступенчатая схема терапии, предусматривающая последующий переход на пероральный прием итраконазола [2].
Риноцеребральный мукоромикоз (РЦМ) относится к группе инфекций, встречающихся преимущественно у больных СД. Представляет собой инвазивный микоз, возбудителями которого являются высокоинвазивные ангиотропные плесневые грибы класса Zygomycetes семейства Mucoraceae (Rhizopus spp., Absidia spp., Mucor spp.).
Зигомицеты могут вызывать инвазивный микоз различных локализаций, но в типичных случаях поражаются нос и околоносовые пазухи [2]. Самым значимым фактором риска РЦМ является СД: 50–75 % всех случаев РЦМ приходится на долю больных СД [17], и, как правило, толчком к развитию РЦМ служит диабетический кетоацидоз [18]. Восприимчивость больных СД к данному микозу обусловлена рядом причин. Rhizopus spp. обладают ферментом кетон-редуктазой, которая позволяет им существовать в условиях гликемии и ацидоза; кроме того, сыворотка больных СД в отличие от сыворотки здоровых лиц теряет способность ингибировать их рост [19]. Высокий уровень железа в сыворотке крови у больных СД вследствие низкого связывания его с трансферрином приводит к повышенному потреблению Rhizopus spp. железа, что стимулирует рост этого патогена [20].
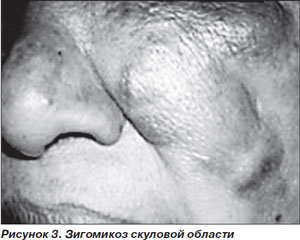
Заболевание проявляется болями и отеком в области околоносовых пазух и глазниц на фоне фебрильной лихорадки, что часто трактуется как острый синусит (рис. 3). РЦМ быстро прогрессирует с вовлечением близлежащих структур — неба, глазниц, паренхимы мозга. О распространении инфекции за пределы околоносовых пазух свидетельствуют деструкция носовых раковин, выпячивание глазного яблока, отек конъюнктивы, а также появление черных некротических струпьев на носовых раковинах или твердом небе, весьма характерных для этой инфекции. Появление офтальмоплегии, снижение зрения в результате пареза черепно-мозговых нервов свидетельствуют о тромбозе кавернозного синуса. При тромбозе сонной артерии или яремной вены может возникать гемипарез (рис. 3) [3].
Диагноз РЦМ подтверждается при биопсии, выявляющей проникающие в ткани, широкие, не имеющие перегородок гифы с беспорядочным угловым ветвлением [2]. Культуральные методы исследования не информативны, поскольку дают в большинстве случаев отрицательные результаты [3]. Распространенность процесса уточняют при МРТ [21].
При неадекватном лечении РЦМ практически всегда приводит к летальному исходу [22], своевременное же и агрессивное лечение снижает этот показатель до 20 % [23]. Агрессивная тактика лечения предусматривает обязательную широкую хирургическую обработку очага инфекции и дренаж инфицированных синусов. Столь же обязательны контроль гликемии и купирование ацидоза. Этиотропная терапия заключается в назначении системных антимикотических препаратов, из которых препаратом выбора является амфотерицин В [22], поскольку другие антифунгальные препараты (флуконазол, итраконазол, вориконазол, каспофунгин) не обладают достаточной активностью в отношении зигомицет [2].
Инфекции ротовой полости. Патология периодонта настолько закономерно возникает у больных СД, что периодонтит называют шестым осложнением диабета, ставя его в один ряд с невропатией, нефропатией, ретинопатией, микро- и макрососудистыми поражениями [24]. В ряде исследований продемонстрирована взаимообусловленная связь между СД и периодонтитом: имеются убедительные доказательства того, что эффективный контроль за инфекцией периодонта позволяет более эффективно контролировать гликемию, что, в свою очередь, проявляется снижением потребности в инсулине и снижением уровня гемоглобина А1с [25].
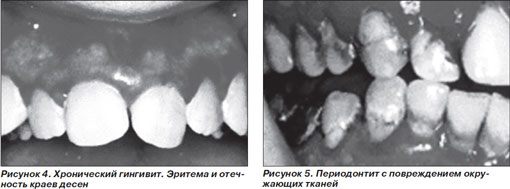
Клиническая картина периодонтита обусловлена образованием налета и камней, в которых скапливаются бактерии, что ведет к деструкции тканей периодонта и резорбции костной ткани альвеолярных отростков. Периодонтиту практически всегда предшествует гингивит — начальная, легко поддающаяся лечению стадия воспалительного заболевания десен. Непосредственной причиной гингивита является зубной налет, представляющий собой мягкую, плотно связанную с подлежащей поверхностью бесцветную бактериальную биопленку, постоянно образующуюся на зубах и деснах. В типичных случаях при периодонтите выделяют грамотрицательные палочки, из которых важнейшую роль играют Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis и Bacteroides forsythus [26].
К классическим симптомам гингивита относятся покраснение, отек, уплотнение и кровоточивость десен (рис. 4). При отсутствии лечения гингивит прогрессирует в периодонтит. Образование зубно-десневых карманов свидетельствует о поражении периодонтальных структур и костной ткани (рис. 5).
Лечение поражения периодонта и десен заключается в устранении инфекции путем удаления налета и камней, уменьшении выраженности ответной воспалительной реакции и контроле за гликемией. Больной должен соблюдать гигиену полости рта, посещать стоматолога не реже одного раза в полгода для профессионального удаления налета и камней.
Рекомендуется полоскать рот растворами, содержащими антисептики, например хлоргексидина глюконат, триклозан [27]. При далеко зашедших формах заболевания необходима более агрессивная тактика лечения, сочетающая хирургическое вмешательство, назначение системной или местной антимикробной терапии.
Острая инфекция ротовой полости у больного СД требует неотложного вмешательства. Пациент должен быть проконсультирован стоматологом для проведения специфического лечения, обязательным является назначение АМП. Чаще всего применяется амоксициллин, при аллергии на пенициллины показан клиндамицин. Антибиотики назначаются в обычных терапевтических дозах (750–1000 мг/сут амоксициллина и 1200 мг/сут клиндамицина) сроком на 7 дней. При неконтролируемом СД дозы препаратов и длительность курса увеличиваются [26].
Пневмония
По данным метаанализа, включившего более 33 000 больных [28], и проспективного когортного исследования, выполненного в Нидерландах [29], у больных СД отсутствует значительное повышение риска возникновения пневмонии и смертности при неосложненном ее течении [28]. Однако в случае развития пневмонии у больных СД повышается риск бактериемии, которая может сопровождаться более высокой смертностью. Согласно результатам датского популяционного исследования, проведенного по методу «случай — контроль», риск пневмококковой бактериемии при внебольничной пневмонии у больных СД повышается в 1,5 раза [30].
У лиц, страдающих СД, можно выделить две важных с микробиологической точки зрения особенности пневмонии. Во-первых, повышается этиологическая значимость определенных возбудителей (Staphylococcus aureus, грамотрицательные палочки, прежде всего Klebsiella pneumoniae). Во-вторых, установлена склонность к более тяжелому и осложненному течению пневмонии, вызванной Streptococcus pneumoniae, за счет более частого развития бактериемии [3]. Еще одним отличием респираторных инфекций у этой категории больных является более частое развитие при гриппе бактериальной суперинфекции и кетоацидоза [31]. Исходя из вышеизложенного, больным СД показана противопневмококковая и противогриппозная вакцинация [31].
Выбор антимикробных препаратов для лечения пневмонии у больных СД не имеет существенных особенностей и определяется тяжестью заболевания, предшествующим приемом антибиотиков, анамнестическими указаниями на аллергические реакции и сопутствующей патологией, как и у пациентов без СД. Для больных с нетяжелым течением заболевания рекомендуются макролиды (азитромицин, кларитромицин) или амоксициллин, выбор между которыми зависит от того, принимал ли пациент АМП (если да, то какие именно) в предшествующие нынешнему заболеванию 3 месяца, и от индивидуальной переносимости препаратов. Альтернативой макролидам и бета-лактамам служат респираторные фторхинолоны. Более тяжелое течение заболевания требует назначения комбинации бета-лактамов и макролидов, альтернативой которым также являются респираторные фторхинолоны.
Абдоминальные инфекции
Гепатит С. Эпидемиологические исследования показывают высокую распространенность антител к вирусу гепатита С (HCV) у больных СД 2-го типа [32]. Получены доказательства того, что инфицирование вирусом гепатита С предшествует развитию СД, что легло в основу гипотезы о данной инфекции как факторе риска СД 2-го типа [33]. Незначительное повышение уровня печеночных ферментов, часто встречающееся у больных СД, отражает, как правило, жировой гепатоз, но требует тем не менее исключения HCV-инфекции [34].
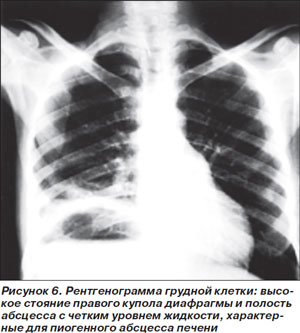
Пиогенный абсцесс печени (ПАП) чаще всего развивается вследствие гематогенного распространения инфекции из отдаленных источников или из желчевыводящих путей. Заболевание характеризуется высокой смертностью — от 11 до 31 % [35]. Диагноз ПАП часто вызывает затруднения из-за неспецифического характера клинических проявлений: наиболее характерными жалобами являются лихорадка, озноб, рвота. Боли в животе отмечают только 50–70 % больных, лейкоцитоз выявляется в 2/3 случаев (рис. 6). Наиболее частым возбудителем данной патологии является Klebsiella pneumoniae. Лечение предусматривает дренирование абсцесса, желательно катетером, под контролем визуализирующих методик, и системную антимикробную терапию [34].
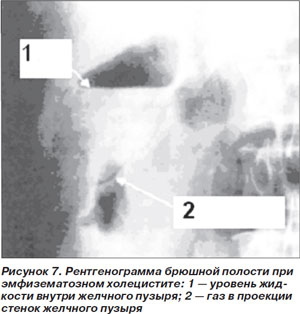
Эмфизематозный холецистит (ЭХ) — это тяжелая редкая инфекция желчного пузыря, характерной особенностью которой является образование газа; 35 % случаев заболевания регистрируется у больных СД [3]. На начальном этапе ЭХ проявляется симптомами, типичными для острого холецистита: болью в верхнем правом квадранте живота, лихорадкой, тошнотой и рвотой. Камни желчного пузыря обнаруживают только у 50 % больных [34]. В отличие от острого холецистита ЭХ чаще развивается у лиц мужского пола. Патогномоничным симптомом является крепитация при пальпации живота; выявление этого признака прогностически неблагоприятно, поскольку свидетельствует об обширности поражения [36]. Летальность при неосложненном ЭХ составляет 4 %, при присоединении таких типичных осложнений, как гангрена и перфорация желчного пузыря, этот показатель повышается до 15 % [35].
Диагноз подтверждается при рентгенографии или компьютерной томографии (КТ) брюшной полости в случае обнаружения газа в просвете и стенках желчного пузыря либо в прилежащих тканях (рис. 7) [37].
Инфекция практически всегда носит полимикробный характер. Характерна ассоциация анаэробов, из которых чаще всего выделяют Clostridium spp., и грамотрицательных бацилл; могут встречаться и стрептококки [2].
Лечебная тактика заключается в обязательном ургентном проведении холецистэктомии [3]. Показано назначение антибиотиков широко спектра действия, активных в отношении анаэробов, например ампициллина/сульбактама [2].
Инфекции мочевыводящих путей
Бактериурия диагностируется при выявлении микроорганизмов в титре 105 и более колониеобразующих единиц в 1 мл мочи при отсутствии какой-либо симптоматики со стороны мочевыводящих путей. У больных СД она встречается в 2–4 раза чаще, чем у лиц, не страдающих этим заболеванием [17], причем ее распространенность возрастает по мере увеличения длительности диабета: каждые 10 лет существования СД сопровождаются возрастанием частоты бактериурии в 1,9 раза [39]. Однако подобные различия выявлены только у женщин; у мужчин, страдающих СД, бактериурия выявляется с такой же частотой, как и у лиц без СД [40].
При бактериурии на фоне СД так же, как и у лиц без СД, чаще всего выделяют Escherichia coli [41]. Тем не менее этиологическая значимость кишечной палочки при СД несколько ниже, возрастает удельный вес других возбудителей, таких как Staphylococcus saprophyticus, Proteus spp., Klebsiella spp., Enterococcus spp. [42].
Вопрос о целесообразности лечения бессимптомной бактериурии при СД дискутируется на протяжении многих лет [40]. Согласно руководству Американского общества инфекционных заболеваний (IDSA), скрининг и лечение бессимптомной бактериурии у женщин с СД не рекомендуется, поскольку нет доказательств положительного влияния этой стратегии на долгосрочный прогноз [41].
Цистит. Клиническая картина заболевания при СД не имеет существенных отличий от таковой у лиц без СД: характерны дизурия, поллакиурия и боли/дискомфорт в надлобковой области. Диагноз подтверждается клиническим и микробиологическим исследованием мочи. Спектр возбудителей аналогичен таковому при бессимптомной бактериурии, и выбор АМП для лечения цистита у больных СД существенных отличий не имеет. Рекомендуются фторхинолоны, могут применяться цефалоспорины III поколения, нитрофурантоин. Длительность антимикробной терапии также является предметом дискуссии. Некоторые авторы рекомендуют более длительное (до 7–14 дней) применение АМП у больных СД для предотвращения распространения инфекции на верхние отделы мочевыводящих путей [42].
Острый пиелонефрит встречается в 4–5 раз чаще у лиц с СД, чем без него [43]. Клинические проявления заболевания на фоне СД существенных отличий не имеют, за исключением более частого двустороннего поражения почек. Характерны боли в пояснице или верхней части живота, лихорадка, возможны тошнота, рвота [43]. В этиологической структуре преобладает кишечная палочка, реже встречаются S.saprophyticus, Proteus spp., Klebsiella spp. и энтерококки.
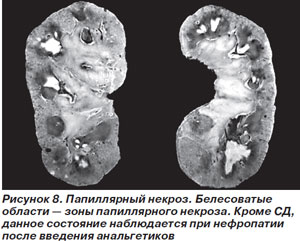
Лечебная тактика заключается в парентеральной антимикробной терапии, препаратами выбора являются фторхинолоны, цефтриаксон. Отсутствие положительной динамики на фоне адекватной антимикробной терапии свидетельствует о присоединении осложнений — папиллярного некроза или перинефрального абсцесса [44], клинические проявления которых сами по себе не всегда специфичны.
Симптомы папиллярного некроза включают боли в пояснице или в животе, лихорадку, для подтверждения диагноза применяют ретроградную пиелографию (рис. 8) [36].
Перинефральный абсцесс в большинстве случаев (80 %) возникает в результате восходящей инфекции, причем наиболее частыми возбудителями являются кишечная палочка и протей. В остальных случаях инфекция распространяется гематогенным путем, чаще всего в результате диссеминации S.aureus [3].
Типичные местные признаки перинефрального абсцесса — выявление объемного образования при осмотре или пальпации поясницы или живота — высоко специфичны для этой патологии, однако они встречаются довольно редко, всего в 25 % случаев [3]. С этой точки зрения особый интерес представляет исследование Thorley с соавт., по результатам которого сохранение лихорадки на протяжении 4 суток и более от начала антимикробной терапии является наиболее значимым клиническим признаком, свидетельствующим об осложненном течении пиелонефрита, чаще всего о перинефральном абсцессе [45].
Диагноз перинефрального абсцесса подтверждается при КТ или ультрасонографии почек.
Лечение заключается в дренировании полости абсцесса и назначении системной антимикробной терапии.
Эмфизематозный пиелонефрит (ЭП). Редкое заболевание, возникающее в результате газообразующей вирулентной инфекции паренхимы почек или окружающих тканей. Высоко специфическая для СД инфекция: на долю больных СД приходится от 70 до 90 % всех случаев ЭП. Встречается в 2 раза чаще у женщин, чем у мужчин [42, 43]. Клиническая картина довольно неспецифична: боли в пояснице, лихорадка, отсутствие положительной динамики на фоне адекватной антимикробной терапии по поводу пиелонефрита. Примерно у половины больных выявляется объемное образование в области поясницы, реже определяется крепитация в пораженной области, причем последний признак патогномоничен для ЭП [18].
Наличие газа в ренальной области, подтверждающее диагноз, выявляется при проведении визуализирующих методов исследования. Наиболее чувствительным из них считается КТ, чувствительность же обычной рентгенографии находится в пределах 33 % (рис. 9) [46].
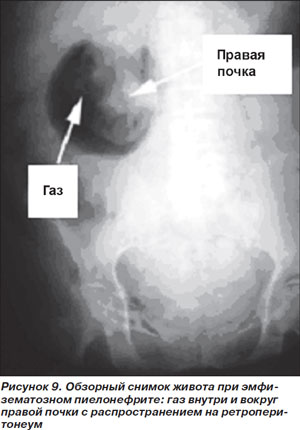
Этиология ЭП: наиболее частым возбудителем является E.coli, затем следуют грамотрицательные бактерии Enterobacter aerogenes, Klebsiella spp. и Proteus spp.; еще реже выявляются Streptococcus spp. и Candida spp. [47].
Лечение ЭП предусматривает сочетание хирургических и медикаментозных методов, что позволяет снизить смертность с 60–80 до 20 % [2]. При обширном поражении почки или распространении процесса за ее пределы, а также при отсутствии ответа на антимикробную терапию операцией выбора является нефрэктомия. При локализованном поражении почки у клинически стабильных пациентов можно применять чрескожное дренирование под контролем визуализирующих методик [48].
Антимикробная терапия предусматривает парентеральное введение фторхинолонов, цефалоспоринов III–IV поколения, в ряде случаев с добавлением препаратов с антианаэробной активностью (клиндамицин, метронидазол, ингибиторозащищенный бета-лактам).
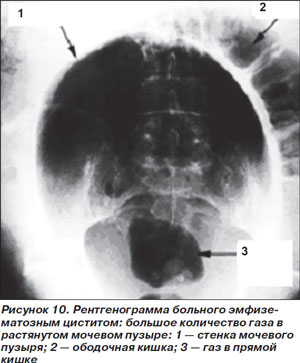
Эмфизематозный цистит (ЭЦ) – очень редкое осложнение острого цистита, возникающее преимущественно у больных СД. Типичные возбудители в порядке убывания значимости — E.coli, Klebsiella spp., другие грамотрицательные палочки, изредка выявляется Сandida spp. [2]. Наряду с типичными клиническими симптомами острого цистита (боль, дизурия, лихорадка) для ЭЦ характерно наличие гематурии, пневматурии и выявление газа в стенках или просвете мочевого пузыря при рентгенографическом исследовании или, предпочтительнее, при КТ, чувствительность которой значительно выше (рис. 10) [49]. В отличие от других эмфизематозных инфекций ЭЦ хорошо поддается консервативному лечению. Антимикробные препараты должны «перекрывать» наиболее вероятных возбудителей с учетом результатов микробиологического исследования мочи у конкретного больного. Чаще всего назначают фторхинолоны, цефалоспорины III–IV поколений в сочетании с препаратами с антианаэробной активностью.
Инфекции кожи и мягких тканей
Диабетическая стопа — наиболее частая по локализации инфекция мягких тканей [50]. Такое частое вовлечение тканей стопы обусловлено рядом причин: нарушением целостности кожи из-за частых паронихий и грибкового поражения стоп, что облегчает развитие вирулентных инфекций; периферической невропатией, делающей малозаметными для больного микротравмы данной локализации; микро- и макрососудистой ангиопатией, при которой недостаточное кровоснабжение зоны инфекции отрицательно влияет на репаративные процессы и способствует снижению концентрации антибактериальных препаратов в locus morbi [2].
В зависимости от тяжести инфекции стопы делят на нетяжелые (не угрожающие ампутацией конечности) и тяжелые (угрожающие ампутацией конечности).
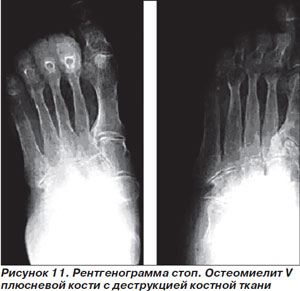
Нетяжелые инфекции проявляются в виде поверхностных язв с вовлечением окружающих тканей в виде целлюлита шириной менее 2 см; явления общей интоксикации отсутствуют. Типичными патогенами являются грамположительные кокки, такие как S.aureus и стрептококки, поэтому при выборе антимикробной терапии не следует ориентироваться на данные о полимикробной этиологии в образцах из поверхностных слоев язвы (мазки тампоном или отделяемое из необработанной язвы). Рекомендуется взятие образцов из глубоких слоев ткани посредством кюретажа или биопсии; результаты такого микробиологического исследования адекватны для выбора этиотропной антимикробной терапии. Больным с легкой формой инфекции, не принимавшим ранее антибиотики, проведение микробиологического исследования необязательно [51]. Глубокое зондирование язвы — достаточно информативный метод для выявления остеомиелита, хотя невозможность достичь зондом кости не позволяет исключить остеомиелит с достаточной точностью [52]. Диагноз остеомиелита подтверждается при рентгенографии (рис. 11), в диагностически неясных случаях прибегают к радиоизотопным исследованиям (с меченными индием лейкоцитами и/или с технецием–99), МРТ, биопсии кости [2].
Антимикробная терапия проводится препаратами, активными в отношении грамположительной флоры (оксациллин, цефалексин, клиндамицин), возможен прием антибиотиков внутрь. Показана хирургическая обработка раны. Отсутствие ответа на эмпирическую антимикробную терапию, нетипичные клинические проявления инфекции или необходимость в особой, согласно результатам микробиологического исследования, этиотропной терапии с применением нефро- и гепатотоксических препаратов требуют более тщательного наблюдения за больным, в ряде случаев — с привлечением специалиста по инфекционным заболеваниям.
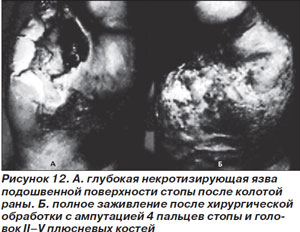
Тяжелые инфекции стопы проявляются в виде глубоких язв с периферическим целлюлитом более 2 см. Часто имеются признаки общей интоксикации, ишемии, гипергликемии. Эти инфекции закономерно носят полимикробный характер с ассоциацией грамположительных (например, S.aureus), анаэробных (например, Bacteroides fragilis) и грамотрицательных (E.coli) микроорганизмов (рис. 12).
Выявление глубоких абсцессов, обширного вовлечения кости или сустава, гангрены, крепитации, подозрение на некротизирующий фасциит требуют привлечения хирурга — специалиста по диабетической стопе. При обработке раны или ампутации конечности обязательным является взятие образцов кости или глубоких тканей для микробиологического исследования с целью коррекции последующей антимикробной терапии. Остеомиелит развивается у 50–60 % больных с тяжелой инфекцией стопы, подтверждением диагноза является выделение возбудителя из костной ткани [53].
Антимикробная терапия предусматривает парентеральное введение антибиотиков широкого спектра, например ампициллина/сульбактама, и сочетается с хирургической обработкой язвы. При высокой вероятности метициллинрезистентных штаммов S.aureus (MRSA) и тяжелом течении инфекции добавляют ванкомицин. Длительность терапии антибиотиками составляет обычно 2 недели, при остеомиелите лечение продлевают до 4–6 недель, однако локализованные формы остеомиелита с ограниченной ампутацией (например, ампутация пальца стопы) позволяют довольствоваться более короткими, 2-недельными курсами антимикробной терапии [2].
Дополнительные методы лечения, эффективность которых доказана по крайней мере в одном рандомизированном контролируемом исследовании, требуют тем не менее более детального изучения. К этой группе относятся гипербарическая оксигенация, пневматическая компрессия стопы для уменьшения отека, подкожное введение гранулоцитарного колониестимулирующего фактора. В некоторых клиниках для удаления некротизированных тканей используют личинок мух, но данный метод изучен еще меньше по сравнению с предыдущими [53].
Некротизирующий фасциит (НФ) — тяжелая инфекция, характеризующаяся обширной деструкцией тканей, общей интоксикацией и высокой (около 40 %) смертностью [54].
Инфекция первоначально развивается в подкожной клетчатке, затем быстро распространяется по фасциальным поверхностям; чаще всего вовлекаются верхние и нижние конечности, передняя брюшная стенка.
В зависимости от этиологии и особенностей клинической картины выделяют два варианта НФ.
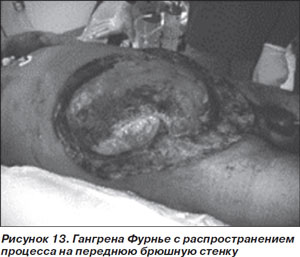
Вариант I у больных СД встречается намного чаще, составляя до 90 % всех случаев НФ. Вызывается смешанной анаэробной (Peptostreptococcus spp., Prevotella spp., Porphyromonas spp., Bacteroides fragilis и Clostridium spp.) и аэробной (S.aureus, E.coli и стрептококки группы А) флорой. Разновидностью этого варианта является гангрена Фурнье, или НФ мужских половых органов, при которой процесс может распространяться также на промежность и переднюю брюшную стенку (рис. 13).
Вариант II, составляющий около 10 % всех случаев НФ, вызывается преимущественно стрептококками группы А, иногда в сочетании с различными видами стафилококков.
Оба варианта относятся к инфекциям, встречающимся преимущественно у больных СД.
Клинически НФ проявляется локальной болью, эритемой, отеком, буллезными изменениями. Характерна обратная зависимость между выраженностью болевого синдрома и тяжестью заболевания, вплоть до локальной анестезии при тяжелом буллезном поражении в результате окклюзии артериол кожи. Крепитация считается важным диагностическим признаком, но выявляется не более чем у половины больных. Газ в подкожных структурах чаще определяется при рентгенографии.
Лечение наряду с агрессивной неотложной хирургической обработкой инфицированной области включает назначение антимикробных препаратов широкого спектра действия. Антибиотики вводятся внутривенно, их спектр активности должен перекрывать всех потенциальных возбудителей. Препаратами выбора являются пенициллин и клиндамицин. Учитывая серьезный прогноз при НФ и возможность резистентности к клиндамицину, применяют комбинацию пенициллина и клиндамицина, к которой, в зависимости от результатов микробиологического исследования, добавляют аминогликозиды [3]. Имеются сообщения об эффективности ампициллина/сульбактама в сочетании с метронидазолом или клиндамицином [2].
При втором варианте НФ, вызываемом стрептококком группы А, эффективность клиндамицина превышает эффективность бета-лактамов, возможно, за счет большего подавления токсинообразования [55].
Дерматофития стоп. Поверхностные грибковые инфекции кожи и ногтей встречаются у больных СД намного чаще, чем у здоровых. В подавляющем большинстве случаев возбудителями являются Trichophyton spp., Epidermophyton spp., Microsporum spp. [2].
Клинические проявления грибковой инфекции варьируют в зависимости от иммунного статуса, места поражения, возбудителя, но наиболее типичным изменением является зудящая, покрытая чешуйками кольцевидная эритема с центральным непораженным участком. Поражение стоп проявляется в виде бессимптомного образования чешуек на подошвенной и пяточной поверхностях стопы, при распространении на боковые поверхности поражение происходит по типу «мокасина».
Онихомикоз проявляется в виде изменения цвета ногтевой пластинки, приобретающей белый, желтый или коричный цвет. Поражение начинается с дистального края ногтевой пластинки с последующим распространением вплоть до кутикул. Характерны гипертрофия, ломкость ногтя; вовлекается обычно сразу несколько ногтей.
При ограниченных нетяжелых формах с локализацией в области тела, голени, стоп возможно топическое лечение дерматофитии с применением антигрибковых кремов/мазей, например клотримазола [56].
Для системного лечения всех дерматофитий (за исключением онихомикозов) наиболее безопасным и эффективным препаратом является гризеофульвин.
Онихомикоз требует назначения системных антимикотиков, преимуществами обладают итраконазол и тербинафин, способные сохраняться в ногтевой пластинке до 6 мес.
Кандидозное поражение кожи и слизистых. Наиболее частая локализация кандидоза кожи — подмышечные впадины, складки под молочной железой и паховая область [57]. Поражения имеют вид красных папул.
При плохо контролируемом СД может развиваться кандидоз полости рта в виде белых налетов на слизистой, часто сопровождаемых чувством жжения. При появлении дисфагии и болезненности при глотании можно думать о распространении процесса на пищевод. У женщин с СД имеется также предрасположенность к кандидозному вульвовагиниту.
Лечение кандидоза кожи и слизистых показано при наличии соответствующей симптоматики и выявлении Candida spp. при микроскопии. Кандидоз кожи, полости рта можно лечить топическими противогрибковыми препаратами (нистатин, леворин, клотримазол и т.д.). Неэффективность местной терапии, а также кандидоз других локализаций требуют системного применения антимикотических средств. Препаратом выбора является флуконазол, альтернативой служат итраконазол, кетоконазол [3].
Возбудители, характерные для инфекций при СД
Для больных СД характерен повышенный риск развития инфекции, вызванной определенными микроорганизмами. Например, среди взрослых больных с бактериемией, вызванной стрептококками группы В, на долю пациентов с СД приходится 27,5 % [3]; вторая категория лиц, для которых характерно инфицирование данными микроорганизмами, — беременные женщины.
Также высока доля больных СД (от 30 до 60 %) среди пациентов с инфекциями различной локализации, вызванными Klebsiella spp., включая бактериемию, абсцесс печени, эндофтальмит и абсцесс щитовидной железы [3].
СД является фактором риска инфекций, вызванных Salmonella enteriditis [58]. Распространенность туберкулеза среди больных СД в 3–4 раза выше по сравнению с общей популяцией [3].
Отмечается более частое развитие инфекций, вызванных золотистым стафилококком, хотя результаты доступных в настоящее время исследований не позволяют точно установить величину риска у этого контингента больных [3].
1. Chiasson J.-L., Aris-Jilwan N., Belanger R., Bertrand S., Beauregard H., Ekoe J.-M., Fournier H., Havrankova J. Diagnosis and treatment of diabetic ketoacidosis and the hyperglycemic hyperosmolar state // Can. Med. Assoc. J., Apr 2003; 168: 859-866.
2. Chin-Hong P.V. Infections in patients with diabetes mellitus: importance of early recognition, treatment and prevention // Adv. Stud. Med. 2006; 6(2): 71-81.
3. Joshi N., Caputo G.M., Weitekamp M.R., Karchmer A.W. Infections in patients with diabetes mellitus // N. Engl. J. Med. 1999; 341: 1906-1912.
4. D’Agata E., Eliopoulos G. Infections in the diabetic patient. www.nfid.org/publications/id_article/diabetic.html
5. Hakim L.S., Goldstein I. Diabetic sexual dysfunction // Endocrinol. Metabol. Clin. North Am. 1996; 25: 379-400.
6. Masuda M., Markami T., Egawa H., Murata K. Decreased fluidity of polymorphonuclear leukocyte membrane in streptozocin-induced diabetic rats // Diabetes 1990; 39: 466-70.
7. Ellenberg M., Weber H. The incipient asymptomatic diabetic bladder // Diabetes 1967; 16: 331-35.
8. Hosking D.J., Bennett T., Hampton J.R. Diabetic autonomic neuropathy // Diabetes 1978; 27: 1043-54.
9. Murphy D.P., Tan J.S., File T.M. Infectious complications in diabetic patients //Primary Care 1981; 8: 695-714.
10. Marik P., Varon J. The obese patient in the ICU // Chest 1998; 113: 492-498.
11. Joukhadar C., Frossard M., Mayer B.X., Brunner M., Klein N., Siostrzonek P., Eichler H.G., Muller M. Impaired target site penetration of beta-lactams may account for therapeutic failure in patients with septic shock // Crit. Care Med. 2001; 29: 385-391.
12. Zeitlinger M.A., Erovic B.M., Sauermann R., Georgopoulos A., Muller M., Joukhadar C. Plasma concentrations might lead to overestimation of target site activity of piperacillin in patients with sepsis // J. Antimicrob. Chemother. 2005; 56: 703-708.
13. Buerger С., Plock N., Dehghanyar P., Joukhadar C., Kloft C. Pharmacokinetics of unbound linezolid in plasma and tissue interstitium of critically ill patients after multiple dosing using microdialysis // Antimicrob. Agents Chemother. 2006; 50: 2455-63.
14. Rubin Grandis J., Bransletter B.F., Yu V.L. The changing face of malignant (necrotozing) external otitis: clinical, radiological and anatomic correlations // Lancet Infect. Dis. 2004; 4: 34-39.
15. Slattery W.H. 3rd, Brackmann D.E. Skull base osteomyelitis: malignant external otitis // Otolaryngol. Clin. North Am. 1996; 29: 795-806.
16. Rubin J., Yu V.L. Malignant external otitis: insights into pathogenesis, clinical manifestations, diagnosis and therapy // Am. J. Med. 1988; 85: 391-98.
17. Greenberg R.N., Scott L.J., Veughn H.H., Ribes J.A. Zygomycosis (mucormycosis): emerging clinical importance and new treatments // Curr. Opin. Infect. Dis. 2004; 17: 517-22.
18. Rajagopalan S. Serious infections in elderly patients with diabetes mellitus // Clin. Inf. Dis. 2005; 40: 990-96.
19. Gale G.R., Welch A.M. Studies of opportunistic fungi. I. Inhibition of Rhizopus oryzae by human serum // Am. J. Med. Sci. 1961; 241: 604-12.
20. De Lochi M., Boelaerti J.R., Schneider Y.J. Iron uptare from ferrioxamine and from ferrirhizoferrin by germinating spores of Rhizopus microsporus // Biochem. Pharmacol. 1994; 47: 1843-50.
21. Howells R.C., Ramadan H.H. Usefulness of computed tomography and magnetic resonance in fulminant invasive fungal rhinosinusitis // Am. J. Rhinol. 2001; 15: 255-61.
22. Roden M.M., Zaoutis T.E., Buchanan W.L. et al. Epidemiology and outcome of zygomycosis: a review of 929 reported cases // Clin. Infect. Dis. 2005; 41: 634-653.
23. Peterson K.L., Wang A.M., Canalis R.F., Abemayor E. Rhinocerebral mucormycosis: evolution of the disease and treatment options // Laryngoscope 1977; 107: 855-62.
24. Loe H. Periodontal disease: the sixth complication of diabetes mellitus // Diabetes Care 1993; 16: 329-334.
25. Danesh J., Appleby P. Persistent infection and vascular disease: a systematic review // Expert Opin. Invest. Drugs 1998; 7: 691-713.
26. Li X., Kolltveit K.M., Tronstadt L., Olsen I. Systemic diseases caused by oral infection // Clin. Microbiol. Rev. 2000; 13: 547-58.
27. Lowe G.D. The relationship between infection, inflammation, and cardiovascular disease: an overview // Ann. Periodontol. 2001; 6: 1-8.
28. Fine M.J., Smith M.A., Carson C.A. et al. Prognosis and outcomes of patients with community-acquired pneumonia. A meta-analysis // JAMA, 1996; 275: 134-141.
29. Qvist R., Larkins R.G. Diminished productionof thromboxane B2 and prostaglandin E by stimulated polymorhonuclear leukocytes from insulin-treated diabetic subjects // Diabetes 1983; 32: 622-6.
30. Thomsen R.W., Hundborg H.H., Lervang H.H., Johnsen S.P., Schonheyder H.C., Sorensen H.T. Risk of community-acquired pneumococcal bacteremia in patients with diabetes: a population-based case-control study // Diabetes Care 2004; 27: 1143-1147.
31. Koziel H., Koziel M.J. Pulmonary complications of diabetes mellitus. Pneumonia // Infect. Dis. Clin. North Am. 1995; 9: 65-96.
32. Ferri C., Fallahi P. et al. Hepatitis C virus infection: evidence for an association with type 2 diabetes // Diabetes Care 2005; 28: 2548-2550.
33. Lecube A., Hernandez C., Genesca J., Simo R. Glucose abnormalities in patients with hepatitis C virus infection: epidemiology and pathogenesis // Diabetes Care 2006; 29: 1140-1149.
34. Deasy J.A.. Infections in the diabetic patient. www.jobsoneducation.com/clinicianscme/index.asp?show=lesson&page=courses/105376
35. Rahimian J., Wilson T., Oram V., Holzman R.S. Pyogenic liver abscess: recent trends in etiology and mortality // Clin. Infect. Dis. 2004; 39: 1654-1659.
36. Smitherman K.O., Peacock J.E. Jr. Infectious emergencies in patients with diabetes mellitus // Med. Clin. North Am. 1995; 79: 53-77.
37. Mentzer R.M. Jr, Golden G.T., Chandler J.G., Horsley J.S. 3rd. A comparative appraisal of emphysematous cholecystitis // Am. J. Surg. 1975; 129: 10-15.
38. Keane E.M., Boyko E.J., Reller L.B., Hamman R.F. Prevalence of asymptomatic bacteriuria in subjects with NIDDM in San Luis Valley of Colorado // Diabetes Care 1988; 11: 708-12.
39. Nicolle L.E. Urinary tract infection in diabetes // Curr. Opin. Infect. Dis. 2005; 18: 49-53.
40. Geerlings S.E., Stolk R.P., Camps M.J. et al. Asymptomatic bacteriuria may be considered a complication in women with diabetes. Diabetes Mellitus Women Asymptomatic Bacteriuria Utrecht Study Group // Diabetes Care 2000; 23: 744-749.
41. Nicolle L.E., Bradley S., Colgan R., Rice J.C., Schaeffer A., Hooton T.M. Infectious Diseases Society of America guidelines for the diagnosis and treatment of asymptomatic bacteriuria in adults // Clin. Infect. Dis. 2005; 40: 643-654.
42. Stamm W.E., Hooten T.M. Management of urinary tract infections in adults // N. Engl. J. Med. 1993; 329: 1328-1334.
43. Calvet H.M., Yoshikawa T.T. Infections in diabetes // Infect. Dis. Clin. North Am. 2001; 15: 407-421.
44. Wheat L.J. Infection and diabetes mellitus // Diabetes Care 1980; 3: 187-197.
45. Thorley J.D., Jones S.R., Sanford J.P. Perinephric abscess // Medicine 1974; 53: 441-451.
46. Tierney M.R., Baker A.S. Infections of the head and neck in diabetes mellitus // Infect. Dis. Clin. North Am. 1995; 9: 195-216.
47. Patterson J.E., Andriole V.T. Bacterial urinary tract infections in diabetes // Infect. Dis. Clin. North Am. 1997; 11: 735-50.
48. Chen M.T., Huang C.N., Chou Y.H., Huang C.H., Chiang C.P., Liu G.C. Percutaneous drainage in the treatment of emphysematous pyelonephritis: 10-year experience // J. Urol. 1997; 157: 1569-73.
49. Klein D.E., Mahoney S.A., Youngen R., Schneider D.H. Renal emphysema // J. Urol. 1966; 95: 625–9.
50. Van Baal J.G. Surgical treatment of the infected diabetic foot // Clin. Infect. Dis. 2004; 39(2): S123-S128.
51. Lipsky B.A., Berendt A.R., Deery H.G. et al. Diagnosis and treatment of diabetic foot infections // Clin. Infect. Dis. 2004; 39: 885-910.
52. Grayson M.L., Gibbons G.W., Balogh K., Levin E., Karchmer A.W. Probing to bone in infected pedal ulcers. A clinical sign of underlying osteomyelitis in diabetic patients // JAMA, 1995; 273: 721-723.
53. Lipsky B.A. Medical treatment of diabetic foot infections // Clin. Infect. Dis. 2004; 39(2): S104-S114.
54. Wilson B. Necrotizing fasciitis // Am. Surg. 1952; 18: 416-431.
55. Stevens D.L., Gibbons A.E., Bergstrom R., Winn V. The Eagle effect revisited: efficacy of clindamycin, erythromycin, and penicillin in the treatment of streptococcal myositis // J. Infect. Dis. 1988; 158: 23-28.
56. Zuber T.J., Baddam K. Superficial fungal infection of the skin. Where and how it appears help determine therapy // Postgrad. Med. 2001; 109: 117-120, 123-126, 131-132.
57. Joshi N., Caputo G.M., Weitekamp M.R., Karchmer A.W. Infections in patients with diabetes mellitus // N. Engl. J. Med. 1999; 341: 1906-1912.
58. Telzak E.E., Greenberg M.S.Z., Budnick L.D., Singh T., Blum S. Diabetes mellitus: a newly described risk factor for infection from Salmonella enteritidis // J. Infect. Dis. 1991; 164: 538-541.
