Журнал «Болезни и антибиотики» 1(1) 2009
Вернуться к номеру
Амоксициллин: портрет на фоне внебольничных пневмоний
Авторы: Березняков И.Г., Харьковская медицинская академия последипломного образования
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
Большинство больных с внебольничными пневмониями (ВП) могут лечиться в амбулаторных условиях, главными достоинствами которых являются удобство и комфорт для пациента, возможность перорального приема антибиотиков, а также меньшая стоимость лечения для системы здравоохранения в целом (по данным зарубежных исследований, лечение больных с ВП в госпиталях обходится в 20–25 раз дороже, чем в домашних условиях) [1, 2]. Важным условием амбулаторной терапии является минимальный риск неблагоприятного исхода (замедленного выздоровления, развития осложнений и/или смерти). Соответственно, основными кандидатами на лечение в домашних условиях будут больные с нетяжелой ВП.
Для амбулаторного лечения больных с нетяжелой ВП обычно используют антибиотики в лекарственных формах для приема внутрь. С учетом этиологической значимости в возникновении ВП как типичных (S.pneumoniae, H. influenzae), так и атипичных микроорганизмов (M.pneumoniae, C.pneumoniae) следовало бы ожидать, что оптимальными антибиотиками для лечения ВП будут препараты, охватывающие весь спектр предполагаемых возбудителей. В целом этому критерию удовлетворяют макролиды, тетрациклины (доксициклин) и респираторные фторхинолоны. Именно эти антибиотики рекомендуются для монотерапии больных с ВП в домашних условиях экспертами IDSA и ATS [3], причем препараты первых двух классов рассматриваются в качестве средств первого ряда, а респираторные фторхинолоны — как альтернативные. Американские эксперты особый акцент делают на активности перечисленных классов антибиотиков в отношении атипичных возбудителей. С другой стороны, в согласительных документах, изданных во многих европейских странах (в том числе в Великобритании, Франции, России, Украине) [4–7], препаратами выбора для лечения больных с нетяжелыми ВП без сопутствующих заболеваний и модифицирующих факторов являются β-лактамы (амоксициллин) и макролиды. При этом амоксициллин превосходит макролиды по активности в отношении S.pneumoniae, но не действует на атипичных бактерий. Данный недостаток, по мнению специалистов, нивелируется тем обстоятельством, что ВП, вызванные атипичными микроорганизмами, склонны к спонтанному разрешению, а основная угроза неблагоприятных исходов ассоциируется с пневмококковыми пневмониями.
Таким образом, налицо 2 различных подхода к лечению одинаковых категорий пациентов с одним и тем же заболеванием. Первый, условно говоря, «американский», в качестве препаратов выбора предлагает антибиотики, активные в отношении атипичных микроорганизмов, — макролиды, респираторные фторхинолоны, доксициклин. Другой, «европейский» (принятый и в нашей стране), исходит из того, что β-лактамы не исчерпали своих возможностей в амбулаторной терапии больных с ВП [8].
1. Должен ли антибиотик выбора для лечения нетяжелых ВП проявлять активность в отношении атипичных патогенов?
Эффективность β-лактамов и антибиотиков, активных в отношении внутриклеточных возбудителей (фторхинолоны, макролиды), при лечении нетяжелых ВП проанализирована в недавнем метаанализе [9]. В него включали больных с рентгенологически верифицированной ВП в возрасте ≥ 18 лет, получавших лечение пероральными антибиотиками в амбулаторных условиях. В окончательный анализ вошли 13 двойных слепых рандомизированных клинических исследований (РКИ) (всего 3402 человека, из них 53 % мужчин, средний возраст пациентов 49 лет). Частота излечения и улучшения в проанализированных РКИ составила в среднем 90 %, смертность — 0,7 %.
Клиническая эффективность антибиотиков, активных в отношении атипичных патогенов, не отличалась от таковой у β-лактамов: относительный риск (ОР) 0,98; 95% доверительный интервал (ДИ) 0,93–1,04 (рис. 1). Не было выявлено и различий в смертности при использовании сравниваемых групп антибиотиков.
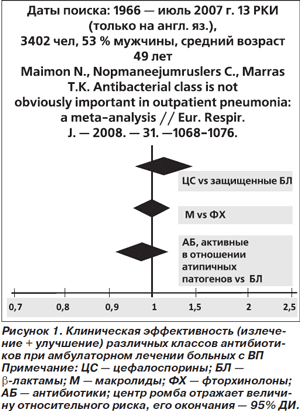
Авторы метаанализа предложили несколько возможных объяснений отсутствия различий между группами сравнения. Во-первых, это недостаточная мощность анализируемых РКИ. Если исходить из 90% клинической эффективности в контрольной группе, для обнаружения разницы в 2 % между контролем и группой вмешательства (92% эффективность) в каждую из групп пришлось бы включать > 3200 больных, а для обнаружения разницы в 1 % — более 13 000 пациентов. Исходя из смертности в 0,7 %, для обнаружения снижения риска в 2 раза (в абсолютном исчислении — на 0,35 %) в каждую из групп пришлось бы включить > 6700 больных. Эти расчеты базируются на методе двух пропорций [10].
Другим вероятным объяснением может быть то обстоятельство, что у значительной части больных с нетяжелой ВП заболевание вызывается вирусами и склонно к самоизлечению [11]. Нельзя исключить, что атипичные бактерии могут быть копатогенами, при том что возбудителей ВП уничтожают β-лактамы [12]. Возможно также, что антибиотики, активные в отношении атипичных патогенов, ускоряют выздоровление больных с ВП, вызванными атипичными бактериями, однако сроки выздоровления трудно анализировать в связи с ограниченностью доступных данных [9].
К недостаткам данного метаанализа следует отнести возможность учета только первоначальной АБТ. В отсутствие улучшения и в случаях ухудшения выбор антибиотика следует пересмотреть.
Вывод, к которому пришли авторы исследования, сводится к тому, что исходы нетяжелых ВП, леченных в амбулаторных условиях, обычно хорошие — независимо от того, активен ли антибиотик в отношении атипичных патогенов, но при условии, что он активен в отношении S.pneumoniae. Поэтому выбор антибиотика в подобных случаях должен, по-видимому, базироваться на профиле нежелательных лекарственных явлений (НЛЯ), стоимости, предпочтениях врача и пациента, учете риска индукции резистентности [9].
2. Пенициллины: историческая справка
Первым антибиотиком, нашедшим широкое клиническое применение, по праву считается пенициллин. Он зарекомендовал себя высокоэффективным средством лечения инфекций, вызванных многими грамположительными и анаэробными микроорганизмами. В то же время значительное большинство грамотрицательных микроорганизмов обладали естественной (природной) устойчивостью к пенициллину. Более того, ряд грамотрицательных и грамположительных бактерий, первоначально чувствительных к пенициллину, с течением времени становились к нему устойчивыми.
Другим недостатком пенициллина было отсутствие лекарственной формы для перорального приема. Внедрение в клиническую практику феноксиметилпенициллина, который не разрушался в кислой среде желудка и назначался внутрь, было, несомненно, шагом вперед. К сожалению, этот препарат заметно уступал пенициллину по абсолютной антимикробной активности, а спектр его антибактериального действия не охватывал микроорганизмов, обладавших естественной и/или приобретенной устойчивостью (резистентностью) к пенициллину.
Механизмы приобретенной устойчивости бактерий к антибиотикам включают:
— синтез ферментов, разрушающих антибиотики;
— структурную или пространственную модификацию мишеней для действия антибиотиков;
— нарушение проницаемости клеточных стенок и мембран бактерий для антибиотиков;
— синтез ферментов, модифицирующих антибиотики;
— активное удаление (выкачивание) антибиотиков из клетки с помощью мембранных насосов;
— создание новых метаболических путей.
Для пенициллинов, в частности, наибольшее значение имеют первые три механизма. Причем последний из них — нарушение проницаемости клеточных стенок и мембран бактерий для антибиотиков — обусловливает у пенициллинов не столько приобретенную, сколько природную устойчивость. Структурная или пространственная модификация мишеней для действия антибиотиков приводит к тому, что медикамент утрачивает способность связываться с определенными компонентами микробной клетки и становится, таким образом, неэффективным. Образно эту ситуацию можно обрисовать так: врач, назначая антибиотик, пытается открыть им, как ключом, дверной замок бактерии. Но замок уже новый, а ключ — старый, и к новому замку он уже не подходит. Поэтому нужен другой ключ-антибиотик. (Возможны, правда исключения: например, старый антибиотик является не столько «ключом», сколько универсальной «отмычкой»; либо чтобы открыть дверной замок бактерии, врач приложил дополнительные усилия (скажем, «нажал на дверь», т.е. увеличил дозу препарата) или воспользовался «вспомогательными средствами» — добавил другой антибиотик, обладающий способностью усиливать действие первого и т.д.).
Тем не менее наибольший урон природные пенициллины (бензилпенициллин и феноксиметилпенициллин) понесли от бактерий, приобретших способность синтезировать пенициллиназы. Последние представляют собой ферменты, разрушающие (и следовательно, инактивирующие) антибиотики. Одними из первых синтезировать пенициллиназы «научились» стафилококки.
Таким образом, в конце 40-х годов XX в. медицина столкнулась с двумя проблемами. Во-первых, необходимо было разрабатывать новые пенициллины, которые были бы устойчивы к действию бактериальных (прежде всего стафилококковых) пенициллиназ. Во-вторых, нужны были новые пенициллины, эффективные не только в отношении грамположительных, но и грамотрицательных микробов. Создать антибиотик, который бы удовлетворял обоим этим требованиям, не удалось. Однако каждая из задач была решена по отдельности.
Первым антибиотиком, устойчивым к действию бактериальных пенициллиназ, стал метициллин. К сожалению, ни он сам, ни последующие препараты группы пенициллиназоустойчивых пенициллинов (оксациллин, клоксациллин, диклоксациллин и др.) не были активны в отношении грамотрицательных микроорганизмов. Стрептококки и пневмококки оказались более чувствительными к природным, чем к пенициллиназоустойчивым пенициллинам. Поэтому область применения новой группы антибиотиков фактически ограничилась лечением инфекций, вызванных чувствительными к метициллину стафилококками.
Открытие же полусинтетических пенициллинов широкого спектра действия оказалось одним из замечательных достижений человечества в борьбе с инфекциями. Основными представителями этой группы антибиотиков (современное название которой — аминопенициллины) стали ампициллин и амоксициллин. Они разрушались бактериальными пенициллиназами, не действовали на синегнойную палочку, уступали бензилпенициллину по антимикробной активности в отношении чувствительных к последнему стрептококков, пневмококков и стафилококков. Однако спектр их действия оказался настолько широким, что стало возможным эффективное лечение большинства инфекций, вызываемых клинически значимыми грамотрицательными бактериями.
Дальнейшая эволюция пенициллинов протекала в двух направлениях. С одной стороны, были созданы и внедрены в клиническую практику антисинегнойные пенициллины (карбенициллин, тикарциллин, пиперациллин и т.д.). С другой — увенчались успехом попытки защитить некоторые известные антибиотики от разрушения ферментами бактерий. Так появились защищенные пенициллины, которые представляют собой комбинации антибиотиков с ингибиторами бактериальных β-лактамаз: ампициллин + сульбактам, амоксициллин + клавулановая кислота, тикарциллин + клавулановая кислота и др.
3. Какому β-лактаму следует отдавать предпочтение при лечении нетяжелых ВП?
В клинической практике наиболее употребительными пероральными β-лактамами для лечения больных с нетяжелой ВП являются аминопенициллины (амоксициллин и амоксициллин/клавуланат). Могут использоваться и цефалоспорины II–III поколений, однако активность амоксициллина в отношении S.pneumoniae — ключевого возбудителя ВП — более предсказуема [13].
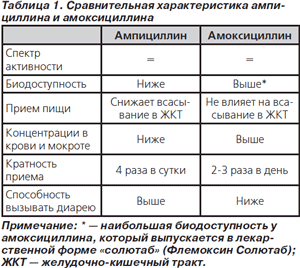
Из двух пероральных аминопенициллинов, зарегистрированных в Украине (ампициллин и амоксициллин), клиническое значение в терапии ВП сохраняет только последний. Сравнительная характеристика обоих антибиотиков представлена в табл. 1.
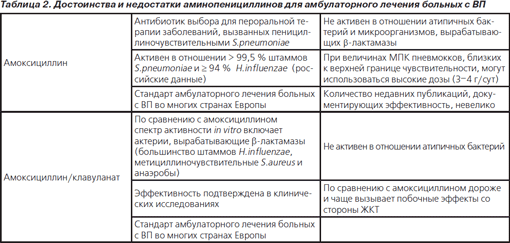
Достоинства и недостатки аминопенициллинов как препаратов выбора для лечения больных с ВП в амбулаторных условиях суммированы в табл. 2 [13, с изменениями].
В последние годы в отечественной практике наблюдается тенденция к назначению амоксициллина/клавуланата в амбулаторных условиях всем больным с нетяжелыми ВП. Такой подход не вызывает возражений, если речь идет о больных, у которых имеются те или иные сопутствующие заболевания (хроническое обструктивное заболевание легких, хроническая сердечная или почечная недостаточность и др.) или модифицирующие факторы (возраст старше 65 лет, структурные заболевания легких (бронхоэктазы, муковисцидоз), истощение и т.д.). А вот у больных с нетяжелой ВП без сопутствующих заболеваний и модифицирующих факторов предпочтение следует отдавать амоксициллину. Аргументов в его пользу несколько.
1. Амоксициллин проявляет высокую активность в отношении пневмококков, частота выделения которых у больных с ВП достигает 14–36 % [14–16], а истинная роль в возникновении заболевания, по-видимому, еще больше. Применение комбинации амоксициллина с клавулановой кислотой в этом случае не рационально, поскольку пневмококки не вырабатывают пенициллиназу.
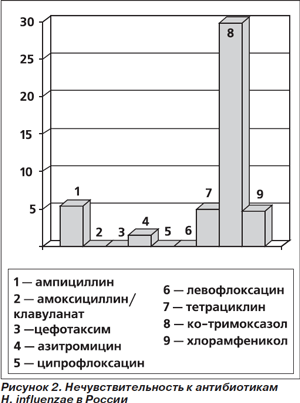
2. Амоксициллин эффективен в лечении заболеваний, вызванных гемофильной палочкой (0,5–10 % всех случаев ВП). К сожалению, часть этих микроорганизмов вырабатывает пенициллиназу. Однако распространенность таких штаммов в окружающей среде, скорее всего, невелика. В частности, в России в настоящее время нечувствительность (умеренная резистентность + резистентность) H. influenzae к ампициллину (и амоксициллину) составляет 5,2 %, амоксициллину/клавуланату — 0 %, в то время как к ко-тримоксазолу она достигает 29,8 % (рис. 2) [17]. Результаты экспериментальных и клинических исследований свидетельствуют, что при небольшом уровне резистентности (< 20 %) эффективность антибактериальной терапии не снижается.
3. Переносимость амоксициллина существенно лучше, чем комбинации амоксициллина с клавуланатом. В частности, НЛЯ со стороны пищеварительного тракта регистрируются статистически значимо реже при назначении амоксициллина, чем его комбинации с клавуланатом. Следовательно, большее количество пациентов будет соблюдать предписанный режим терапии, что имеет значение как для пациента (скорейшее выздоровление), так и общества в целом (предотвращение возникновения и распространения резистентных штаммов микроорганизмов). Внедрение новых технологий (создание Флемоксина Солютаб) обеспечивает максимальную биодоступность амоксициллина и комфорт при его использовании. Повышение биодоступности означает, что максимальное количество антибиотика всасывается и достигает очага инфекции, а не остается в кишечнике и не нарушает равновесие его микробной флоры с появлением НЛЯ. Комфорт (возможность принимать Флемоксин Солютаб внутрь в виде таблеток, растворять и принимать в виде сиропа с приятным запахом) не менее важен. Обычные таблетки, содержащие хотя бы 1 г амоксициллина, трудно проглатывать, а возможность выбора удобного способа применения допускается только для лекарственной формы «солютаб» и не предусмотрена для других, в том числе микрокристаллических.
4. Применение именно амоксициллина (или макролидов) у больных с ВП без сопутствующих заболеваний и модифицирующих факторов предписывается действующим в нашей стране «Протоколом оказания медицинской помощи больным с внебольничной пневмонией» (введен в действие приказом Министерства здравоохранения Украины № 128 от 19.03.2007 г.). Поэтому назначение в подобных случаях комбинации амоксициллина с клавуланатом не только неразумно, но и является нарушением регламентирующих медицинскую деятельность документов.
Заключение
В последние десятилетия доказательная медицина все активнее вторгается в клиническую практику и во многом ее определяет. Тем большего внимания заслуживают высказывания людей, много сделавших для становления доказательной медицины. В завершение статьи хотелось бы процитировать слова ныне покойного J.D. Williams, бывшего в недалеком прошлом президентом Европейской ассоциации химиотерапевтов и редактором Antibiotic Chemotherapy. На рубеже веков, в сентябрьском выпуске 1999 г. упомянутого бюллетеня, он написал:
«...Совершенных клинических исследований или совершенных рекомендаций [по лечению] не существует...
В наш век пенициллинорезистентных пневмококков, Chlamydia pneumoniae и множества других микроорганизмов, вызывающих пневмонию, у меня есть просьба к нашим медикам: если я попаду с пневмонией в ваши руки, пожалуйста, лечите меня сначала амоксициллином (в большой дозе, пожалуйста, и чаще чем дважды в день)» [18].
1. Lave J.R., Lin C.J., Fine M.J., Hughes-Cromwick P. The cost of treating patients with community-acquired pneumonia // Seminars in Respiratory and Critical Care Medicine. — 1999. — 20. — 189-97.
2. Niederman M.S., McCombs J.S., Unger A.N., Kumar A., Popovian R. The cost of treating community-acquired pneumonia // Clin. Ther. — 1998. — 20. — 820-37.
3. Mandell L.A., Wunderink R.G., Anzueto A., Bartlett J.G., Campbell G.D., Dean N.C. et al. Infectious Diseases Society of America / American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults // Clin. Infect. Dis. — 2007. — 44 (Suppl. 2). — S27-S72.
4. Macfarlane J.T., Boldy D. 2004 update of BTS pneumonia guidelines: what’s new? // Thorax. — 2004. — 59. — 364-366.
5. Agence française de sécurité sanitaire des produits de santé. Systemic antibiotic treatment in upper and lower respiratory tract infections: official French guidelines // Clin. Microbiol. Infect. — 2003. — 9. — 1162-78.
6. Чучалин А.Г., Синопальников А.И., Яковлев С.В., Страчунский Л.С., Козлов Р.С., Рачина С.А. Внебольничня пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике: Пособие для врачей. — Смоленск, 2003.
7. Протокол надання медичної допомоги хворим на негоспітальну та нозокоміальну (госпітальну) пневмонію у дорослих осіб: етіологія, патогенез, класифікація, діагностика, антибактеріальна терапія. Затверджений наказом МОЗ України від 19.03.2007 р. № 128.
8. Березняков И.Г. Внебольничные пневмонии. — Донецк: Издатель Заславский А.Ю., 2009.
9. Maimon N., Nopmaneejumruslers C., Marras T.K. Antibacterial class is not obviously important in outpatient pneumonia: a meta-analysis // Eur. Respir. J. — 2008. — 31. — 1068-1076.
10. Browner W.S., Newman T.B., Cummings S.R., Hulley S.B. Estimating sample size and power: the nitty gritty // Hulley S.B., Cummings S.R., Browner W.S., Grady D., Hearst N., Newman T.B., eds. Designing Clinical Research. — Philadelphia: Lippincott Williams & Wilkins, 2001. — Р. 65-91.
11. Riley P.D., Aronsky D., Dean N.C. Validation of the 2001 American Thoracic Society criteria for severe community-acquired pneumonia // Crit. Care Med. — 2004. — 32. — 2398-402.
12. Creer D.D., Dilworth J.P., Gillespie S.H. et al. Aetiological role of viral and bacterial infections in acute adult lower respiratory infection (LRTI) in primary care // Thorax. — 2006. — 61. — 75-9.
13. Mandell L.A., Bartlett J.G., Dowell S.F., File T.M. Jr., Musher D.M., Whitney C. Update of practice guidelines for the management of community-acquired pneumonia in immunocompetent adults // Clin. Inf. Dis. — 2003. — 37. — 1405-33.
14. Jokinen C., Heiskanen L., Juvonen H. et al. Incidence of community-acquired pneumonia in the population of four municipalities in eastern Finland // Am. J. Epidemiol. — 1993. — 137. — 977-88.
15. Woodhead M.A., Macfarlane J.T., McCracken J.S. et al. Prospective study of the aetiology and outcome of pneumonia in the community // Lancet. — 1987. — 1. — 671-4.
16. Almirall J., Bolibar I., Vidal J. et al. Epidemiology of community-acquired pneumonia in adults: a population-based study // Eur. Respir. J. — 2000. — 15. — 757-63.
17. Решедько Г.К., Козлов Р.С. Состояние резистентности к антиинфекционным химиопрепаратам в России // Практическое руководство по антиинфекционной химиотерапии / Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова.— Смоленск: МАКМАХ, 2007. — С. 32-46.
18. Williams J.D. Opinion: a rash rush of guidelines // Antibiotic Chemotherapy. — 1999. — 3(3). — 12.
