Журнал «Болезни и антибиотики» 1(1) 2009
Вернуться к номеру
Современные медицинские технологии в профилактике нозокомиальной инвазивной инфекции в отделении интенсивной терапии
Авторы: Черний В.И., Колесников А.Н., Городник Г.А., Мустафин Т.А., Снегина М.Н., Донецкий национальный медицинский университет им. М. Горького, кафедра анестезиологии, интенсивной терапии и медицины неотложных состояний ФИПО, Донецкое областное клиническое территориальное медицинское объединение (ДОКТМО)
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
Актуальность
Нозокомиальные инфекции в отделениях интенсивной терапии (ОИТ) остаются серьезной проблемой, невзирая на широкое использование антибиотиков. При этом вера врача во всесильность антибактериальной терапии приводит к тому, что забываются или игнорируются стандартные постулаты санитарно-эпидемиологического режима. Как показывает практика, возникновение нозокомиальной инфекции, как правило, является вопросом ятрогении и зачастую неадекватно применяемых противоэпидемических мероприятий. На современном этапе на первое место выходит проблема нозокомиальных инфекций, связанных с инвазивными технологиями, широко и рутинно применяющимися в современной медицине неотложных состояний. К часто и повсеместно применяемым инвазивным вмешательствам относятся длительная катетеризация мочевого пузыря, катетеризация периферических и центральных венозных доступов [1–3]. Следует отметить, что ОИТ являются специфическими в плане катетеризации одной, двух и более вен или артерий, при этом каждое вмешательство повышает риск возникновения ангиогенного сепсиса на 5–10 %, а в случаях тяжелого полиорганного поражения (APACHE > 20 баллов) — более чем на 15–20 % [2, 4]. Необходимо подчеркнуть, что в этом случае входными воротами является кожа (ее мацерация) вокруг катетера, инфицирование ложа катетера и самое главное — инфицирование под защитной пластырной или марлевой повязкой. При этом под стандартными пластырными наклейками создаются идеальные условия для развития анаэробной патогенной флоры.
В отличие от других вариантов нозокомиальных инфекций (пневмония, сепсис, хирургическая инфекция) нозокомиальная инфекция мочевыводящих путей (НИМП) у пациентов ОИТ практически не обсуждается. Около 95 % всех инфекций мочевыводящих путей у пациентов отделений интенсивной терапии связаны с мочевыми катетерами [5]. Нозокомиальная бактериурия или кандидурия развивается у 25 % пациентов с мочевыми катетерами, используемыми более 7 дней, с ежедневным увеличением риска на 5 % [6]. НИМП является, возможно, наибольшим из известных резервуаров устойчивых к антибиотикам патогенных микроорганизмов [7].
В некатетеризованном мочевом пузыре имеются два главных механизма иммунной защиты против инфекции мочевыводящих путей — механический клиренс микроорганизмов и собственные антибактериальные свойства стенки мочевого пузыря [8]. Предположительные механизмы повышения риска бактериурии у катетеризованных пациентов включают: присутствие остаточной мочи в мочевом пузыре [9]; ишемическое повреждение слизистой оболочки мочевого пузыря [10]; механическое раздражение от присутствия катетера; формирование биопленки, обусловленное присутствием инородного тела [11]. Взаимодействие всех этих механизмов, вовлеченных в патогенез колонизации и инфекции мочевыводящих путей, чрезвычайно затрудняет предотвращение НИМП у пациентов с мочевыми катетерами.
За исключением редкого гематогенно-обусловленного пиелонефрита, возбудителями которого почти всегда являются Staphylococcus aureus, большинство НИМП обусловлено проникновением микроорганизмов извне. Источниками наружной колонизации являются периуретральная зона или руки персонала во время установки катетера. При длительном использовании мочевого катетера источником наружного инфицирования становится слизистое содержимое уретры из-за возрастающей концентрации в нем микроорганизмов. Внутрипросветное загрязнение происходит при рефлюксе содержимого загрязненного дренажного мешка либо при нарушении герметичности дренажной системы с проникновением в нее микроорганизмов. Наружный и внутрипросветный пути колонизации имеют приблизительно одинаковую частоту, однако возможности профилактики проникновения инфекции или снижения степени контаминации для этих путей различны. Если во время катетеризации мочевого пузыря тщательная обработка периуретральной зоны растворами антисептиков и соблюдение правил асептики предупреждают контаминацию, то эффективных средств, предотвращающих колонизацию уретры в период пребывания в ней катетера, не существует. В то же время внутрипросветный путь проникновения инфекции может надежно контролироваться.
Таким образом, актуальны поиск и разработка эффективных профилактических мер по предупреждению инвазивной нозокомиальной инфекции в ОИТ.
Целью работы являлась оценка эффективности закрытых стерильных мочевыводящих систем фирмы «Уномедикал» для профилактики развития восходящей уроинфекции и защитных фиксирующих повязок для периферических венозных катетеров NIKO-FIX фирмы «Уномедикал» для профилактики развития ангиогенной инфекции у пациентов, находящихся в критическом состоянии.
Материалы и методы
Исследование проводилось в отделении нейрореанимации областного нейрохирургического центра ДОКТМО. Группу исследуемых составили пациенты отделения, находившиеся на лечении по поводу тяжелой черепно-мозговой травмы, острых нарушений мозгового кровообращения, состояния после оперативного вмешательства в связи с новообразованиями головного мозга. Состояние оценивалась как тяжелое и среднетяжелое (показатель по шкале ком Глазго на уровне 6–8 баллов), сознание нарушено на уровне сопор — кома 1. Критериями включения пациентов были отсутствие острой или хронической инфекционной патологии, подтвержденной данными бактериологического исследования крови, мочи, а также отсутствие воспалительных изменений в формуле крови.
Эффективность профилактики восходящей уроинфекции исследовалась у 35 больных (25 мужчин и 10 женщин) в возрасте от 21 до 60 лет. Пациенты были разделены на три группы случайным способом.
В группу 1 (контрольную) вошли 15 человек, у которых после идентичной катетеризации мочевого пузыря выпускник просто удлиняли в емкость для сбора мочи (то есть не закрытая система).
В группу 2 вошли 10 пациентов, которым после стандартной обработки промежности и входа в уретру антисептиком в асептических условиях проводилась катетеризация мочевого пузыря стандартным мочевым катетером с подсоединением оригинальной стерильной мочевыводящей системы фирмы «Уномедикал» (закрытая система).
В группу 3 вошли 10 человек, которым после стандартной обработки промежности и входа в уретру антисептиком в асептических условиях проводилась катетеризация мочевого пузыря новым одноразовым катетером Фолея с подсоединением оригинальной стерильной мочевыводящей системы фирмы «Уномедикал» (закрытая система).
В исследуемых группах проводился динамический мониторинг общего анализа мочи (ежесуточно), бактериологический анализ мочи (ежесуточно), учитывалось время стояния уретрального катетера; после удаления катетер и остаточную порцию мочи в стерильных условиях направляли для бактериологического исследования.
Эффективность профилактики ангиогенной инфекции исследовалось у 50 больных, 25 мужчин и 25 женщин, в возрасте от 35 до 55 лет. Пациенты были разделены на две группы случайным выбором. В группе 1 (основной), включавшей 30 человек, после обработки хирургического поля раствором антисептика в асептических условиях проводилась катетеризация периферической вены в области локтевой ямки или кисти с последующей фиксацией катетера защитной фиксирующей повязкой NIKO-FIX фирмы «Уномедикал».
В группе 2 (контрольной), состоявшей из 20 человек, после идентичной обработки хирургического поля и катетеризации периферической вены фиксация катетера проводилась стандартным способом — лейкопластырем.
В исследуемых группах проводился динамический мониторинг посевов с ложа катетера (ежесуточно), контроль показателей лейкограммы (ежесуточно), визуальный контроль за местом стояния катетера (наличие мацераций, флебита и др.), контроль температуры тела. Отмечалось время начальных проявлений флебита в группах 1 и 2, после чего катетер удаляли и в стерильных условиях отправляли для бактериологического исследования.
В ДОКТМО в течение 10 лет эффективно работает экспертно-аналитическая система микробиологического мониторинга (ЭАСММ), благодаря которой в различных отделениях ДОКТМО проводится динамический контроль за состоянием чувствительности основных патогенов к антибактериальным препаратам (АБП), учитываются динамические изменения соотношения патогенных микроорганизмов и их чувствительность к АБП во времени, в разных отделениях и в различных биологических средах (кровь, моча, мокрота, ликвор, раневая поверхность и т.д.). Благодаря функционированию данной системы существовала возможность дифференцировать нозокомиальную инфекцию и эндогенную флору пациентов в проводимом исследовании.
Результаты и обсуждение
Оценивая полученные в ходе исследования данные, можно подтвердить сказанные в начале статьи слова о том, что врачи зачастую недооценивают роль восходящей уроинфекции, особенно у пациентов, находящихся в критическом состоянии. Поэтому вопросы профилактики этого состояния напрямую связаны с проблемой широкого использования закрытых мочеприемных систем с целью недопущения нозокомиального инфицирования. Полученные данные представлены в табл. 1.
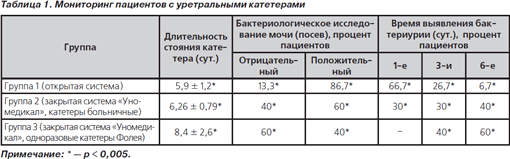
Так, положительные результаты бактериального посева в группе, в которой не использовалась закрытая мочеприемная система «Уномедикал», составили 86,7 %, причем в первые сутки данное осложнение было выявлено у 66,7 % пациентов. Результаты бактериального мониторинга в группах 2 и 3 характеризуют эффективность использования специальной системы клапанов для сбора мочи и отбора нужной порции для анализа в мочеприемниках фирмы «Уномедикал», позволяющей оставлять систему закрытой и, таким образом, эффективно препятствовать нозокомиальному инфицированию пациентов. При этом постановка однократно катетера Фолея сразу при поступлении пациентов является наиболее эффективной (группа 3). В то же время следует отметить, что, невзирая на принципиальное удлинение времени использования без смены уретрального катетера до 7–10 дней в группе 2 и 3, следует признать 3-и сутки критическими в реализации нозокомиального инфицирования у 30 и 40 % пациентов с положительными данными бактериологических исследований мочи (посевы).
Однако, оценивая данные микроскопии осадка, следует указать, что ни у одного пациента групп 2 и 3 не выявлено признаков воспаления, поэтому данный процесс скорее можно назвать колонизацией, что косвенно подтверждается уровнем грибковой флоры. Напротив, в группе 1 у 33,3 % пациентов уже к концу 1-х суток обнаружены явления пиурии.
При сравнительной оценке данных микробиологического исследования мочи пациентов и данных микрофлоры в посевах мочи в разных отделениях интенсивной терапии ДОКТМО по «стабильным» патогенам в клинике (табл. 2) выявлена схожесть микробиологического пейзажа с превалированием грамотрицательной микрофлоры, в частности многочисленного семейства Enterobacteriaceae. Однако в группе 1 обращает на себя внимание тенденция к микст-инфекции из грамположительных и грамотрицательных бактерий (Enterobacteriaceae + Enterococcus spp. + Pseudomonas spp.). Такое сочетание микроорганизмов, возможно, и давало клинику пиурии, что, исходя из чувствительности к АБП, создает значительные трудности для адекватной терапии.
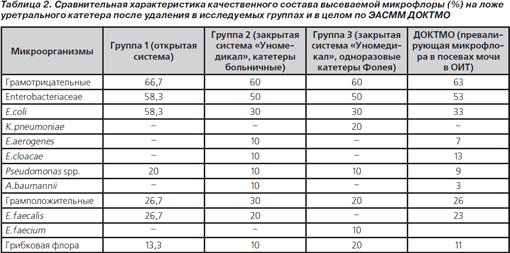
Однако, по-видимому, не стоит использовать данные системы более 3–4 суток, так как это может повысить риск инфицирования (прежде всего колонизации грибковой флорой), даже при использовании закрытых систем.
Оценивая полученные данные в группах пациентов с венозными катетерами, следует обратить внимание на то, что все пациенты получали стандартную терапию (в том числе и антибактериальную), при этом мы не учитывали уровень гипертермии, который зачастую был связан с основной патологией пациентов.
Полученные данные представлены в табл. 3.

Таким образом, наглядно представлено, что применение защитной фиксирующей повязки NIKO-FIX фирмы «Уномедикал» позволяет использовать венозные катетеры до 5 суток, при этом время первичных проявлений флебита достоверно различается в группах 1 и 2, составляя в основной группе в среднем 4 суток, тогда как в группе контроля — 2,5–3 суток. Наиболее показательными явились данные бактериологического исследования, согласно которым в основной группе (повязка NIKO-FIX фирмы «Уномедикал») даже после первых явлений мацерации посев роста не дал, в то время как в контрольной группе в 20 % случаев высевался S.aureus.
Оценивая данные бактериального мониторинга за 2007–2008 годы по нейрохирургическому центру ДОКТМО, следует обратить внимание, что отмечен рост грамположительной флоры, в частности S.aureus, при снижении удельного веса грамотрицательной флоры, что скорее всего является временным процессом, хотя полностью отражает тенденцию по всем отделениям ДОКТМО, в которых в 2007–2008 году грамположительная флора составляет 51 %, грамотрицательная — 41 %.
При оценке показателей лейкоцитоза в основной и контрольной группах достоверных различий выявлено не было.
Таким образом, следует отметить, что, несмотря на крайнюю тяжесть состояния и специфику пациентов отделения нейрореанимации, правильное использование системы ЭАСММ и противоэпидемические мероприятия позволяют проводить эффективную профилактику нозокомиальной инфекции. При этом у 20 % пациентов контрольной группы, у которых был обнаружен в посевах S.aureus, клинически выявились признаки инфекции, появление же признаков флебита на 3-и сутки полностью соответствует условиям использования венозных катетеров, длительность стояния которых не должна превышать 3 суток.
В то же время использование защитных повязок NIKO-FIX фирмы «Уномедикал» позволяет более длительное использование венозных катетеров (до 5 суток), создавая при этом надежную защиту от нозокомиальной инфекции, что характеризуется отсутствием роста в бактериологических посевах, несмотря на начинающиеся признаки флебита.
Выводы
Таким образом, проведенное исследование выявило высокий риск возникновения восходящей уроинфекции у пациентов, находящихся в критическом состоянии, и доказало эффективность закрытых стерильных мочевыводящих систем фирмы «Уномедикал» для профилактики этих осложнений. Полученные результаты позволяют рекомендовать данные высокие технологии к повсеместному применению. Однако никакие технологии и новые антибактериальные препараты не смогут должным образом использоваться без постоянного бактериального мониторинга и соблюдения норм санитарно-эпидемиологического режима.
1. Козлов Р.С. Нозокомиальные инфекции: эпидемиология, патогенез, профилактика, контроль // Клин. микробиол. антимикроб. химиотер. —2000. — 2(2). — 16-30.
2. Страчунский Л.С., Решедько Г.К., Рябкова Е.Л. и др. Рекомендации по оптимизации антимикробной терапии нозокомиальных инфекций, вызванных грамотрицательными бактериями в отделениях реанимации и интенсивной терапии. Пособие для врачей. — Смоленск: Боргес, 2002.
3. Черний В.И., Колесников А.Н., Кузнецова И.В. Антибактериальная терапия в медицине критических состояний. — Донецк: Новый мир, 2005.
4. Шалимов А.А., Грубник В.В., Ткаченко А.И. и др. Инфекционный контроль в хирургии. — К., 2001.
5. Richards M. еt al. Nosocomial infections in medical intensive care units in the United States // Crit. Care Med. — 1999. — 27. — 887-92.
6. Stark R.P., Maki D.G. Bacteriuria in the catheterized patient // N. Engl. J. Med. — 1984. — 311. — 560-4.
7. Bryan C.S., Reynolds K.L. Hospital-acquired bacteremic urinary tract infection: epidemiology and outcome // J. Urol. — 1984. — 132. — 494-8.
8. Norden C., Green G., Kass E. Antibacterial mechanisms of the urinary bladder // J. Clin. Invest. — 1968. — 47. — 2689-700.
9. Merritt J.L. Residual urine volume: correlate of urinary tract infection in patients with spinal cord injury // Arch. Phys. Med. Rehabil. — 1981. — 62. — 558-61.
10. Lapides J., Diokno A., Lowe B., Kalish I. Follow-up on unsterile, intermittent self-catheterization // J. Urol. — 1974. — 111. — 184-7.
11. Nickel J., Costeron J., McLean R., Olson M. Bacterial biofilms: influence on the pathogenesis, diagnosis and treatment of urinary tract infections // J. Antimicrob. Chemother. — 1994. — 33. — 31-41.
