Журнал «Здоровье ребенка» 3 (24) 2010
Вернуться к номеру
Вивчення ефективності застосування покрокового алгоритму лікарської тактики у дітей з неконтрольованою бронхіальною астмою
Авторы: БЕШ Л.В., Боднарчук В.О., Кафедра педіатрії Львівського національного медичного університету імені Данила Галицького
Рубрики: Педиатрия/Неонатология
Версия для печати
У статті наведено результати застосування покрокового алгоритму діагностичної та лікувальної програми в дітей із неконтрольованою бронхіальною астмою та проаналізовано динаміку показників контролю хвороби. Показано, що найшвидше досягається ефект від лікування щодо нічних симптомів, а відповідь на лікування з боку денних симптомів астми розвивається найповільніше. Доведено, що при оцінці контролю астми лише за окремими показниками існує вірогідність переоцінити рівень контролю хвороби в пацієнтів.
Алгоритм, бронхіальна астма, лікування, діти.
Актуальність теми
Бронхіальна астма (БА) сьогодні є одним із найбільш поширених захворювань. Протягом останніх років науковці всього світу працюють над вирішенням проблеми досягнення та утримання контролю БА. Автори багатьох видань роблять акцент саме на тому, що в наш час є достатньо засобів, які дозволяють хворим із БА контролювати перебіг свого захворювання і жити повноцінним життям. На жаль, чимало пацієнтів не розуміють, що БА не можна, а необхідно контролюти, щоб хвороба не впливала на якість життя [14]. Щороку переглядаються і вдосконалюються критерії її діагностики й лікування, однак багато питань залишаються до кінця не вирішеними. Згідно з даними різних авторів, неконтрольований перебіг БА реєструється у 70–95 % хворих [10]. Показники контролю БА поліпшилися протягом останніх років. Так, за результатами дослідження NHWS (The National Health and Wellness Survey), до 2006 року контролю БА було досягнуто у 45 % хворих, що є вищим порівняно з 1999 роком; згідно з даними дослідження AIRE (The Asthma Insights and Realities in Europe), контроль БА був лише у 5 % пацієнтів. Більше того, в дослідженні NHWS зареєстровано, що найкращий рівень контролю є у Великобританії та Іспанії (45 %), а найгірший — у Німеччині (72 %) [14].
Існуючі наукові та практичні дані стверджують, що фактором ризику неконтрольованого перебігу БА є низька якість її моніторування і терапії [10, 15]. Незважаючи на те що сьогодні ніхто не сумнівається в потребі застосування інгаляційних глюкокортикостероїдів (ІГКС) у разі тяжкого перебігу хвороби, значна частина пацієнтів такого лікування не отримує. І це в той час, коли ІГКС вважаються золотим стандартом лікування БА [2, 15].
Активно обговорюються нині й різні підходи до терапії цими препаратами (об''єм, дозування, тривалість) [3, 9, 11, 12]. Ряд дослідників вважають, що розпочинати терапію слід з призначення високих доз ІГКС, а після досягнення ефекту поступово їх знижувати [16, 20]. Але існують праці, в яких доведено потребу призначати мінімально ефективні дози цих препаратів [5, 16]. Така складна і неоднозначна ситуація породжує розгубленість і невизначеність у практичній медицині. Протягом останніх років з''являється все більше публікацій, присвячених дитячій БА, в яких ідеться про те, що розпочинати терапію ІГКС треба з призначення середніх доз препаратів [5, 17]. Якщо таке дозування не дозволяє досягти ефекту, рекомендується або підвищити дозу ІГКС, або додати до ІГКС інші ліки ( b 2 -агоністи тривалої дії, антилейкотрієнові препарати, теофіліни) [1, 3, 6, 13, 18]. Результати проведених у наш час досліджень доводять, що кращим вирішенням у педіатрії є призначення середніх доз ІГКС, але їх слід поєднувати з b 2 -агоністами тривалої дії (серевент, формотерол) [8, 9, 11, 19]. Сьогодні на фармацевтичному ринку України є препарати, що містять в одному інгаляторі ІГКС (фліксотид, будесонід) і пролонгований b 2 -агоніст (серевент, формотерол). Існують дослідження, в яких описано, що лише в поодиноких випадках, у разі доведення відсутності чутливості до кортикостероїдів, їх застосування є недоцільним [24, 25]. Деякі автори рекомендують замісну терапію з уведенням імуноглобулінів, антитіл до IgЕ [10].
За результатами дослідження AIRE, у 55 % пацієнтів спостерігалися денні, у 37 % — нічні симптоми БА, у 47 % — симптоми, викликані фізичним навантаженням, у 30 % — госпіталізації чи звернення за невідкладною допомогою, однак при цьому 43 % пацієнтів розцінювали свою хворобу як добре контрольовану, 34 % — як «повністю контрольовану, 17 % — як частково контрольовану і лише 5 % — як погано контрольовану чи повністю неконтрольовану; 60 % хворих використовували для лікування БА лише швидкодіючі бронхолітики і лише 23 % — ІГКС [15].
У дослідження INSPIRE (2005) показано, що, незважаючи на те що всім пацієнтам призначались ІГКС поєднано з пролонгованими b 2 -агоністами чи без таких, 74 % пацієнтів використовували принаймні одну інгаляцію b 2 -агоністів короткої дії як невідкладну терапію щоденно; 51 % пацієнтів за останній рік потребували госпіталізації. У той час при частково контрольованій БА 87 % пацієнтів розцінювали свій контроль як відносно добрий, 55 % пацієнтів із неконтрольованою БА оцінили рівень контролю як відносно добрий, 88 % константували, що вони можуть самостійно контролювати погіршення БА; 70 % пацієнтів самостійно корегували підтримуючу терапію [15].
Можливість досягнення та утримання контролю БА була доведена в багатьох мультицентрових дослідженнях, виконаних у різних країнах, однак критерії оцінки контролю хвороби, що піддавались аналізу, були різними. В окремих публікаціях підкреслюється, що не можна обмежуватися оцінкою окремого симптому астми, що сприяє підвищенню оцінки реального контролю [4]. Саме тому GINA (2006) впроваджує ще одне нове поняття — тест контролю астми (АСТ), що дозволяє швидко і лише на підставі даних анамнезу оцінити рівень контролю хвороби. Цей тест був запропонований R.A. Nathan і співавт. й опублікований ще у 2004 році, більше того, він дає можливість оцінити контроль БА самим пацієнтом у будь-який час [ 21, 23].
Суттєво впливають на досягнення контролю БА освітні програми для пацієнтів та їх оточення. Велике значення має наявність у пацієнта письмового плану довготривалої терапії і ведення загострення, вміння контролювати перебіг хвороби і лікування шляхом ведення щоденника самоспостереження з реєстрацією симптомів, даних пікфлуометрії та отриманих ліків [19]. Навчання пацієнтів сприяє формуванню партнерських взаємовідносин між усіма учасниками лікувального процесу.
Однак не можна і сьогодні бути до кінця задоволеними показниками контролю БА. Викладена вище ситуація диктує необхідність подальшого пошуку способів досягнення контролю БА, що й зумовило потребу в проведенні нашого дослідження.
Мета дослідження — підвищити показники контрольованості БА у дітей шляхом вдосконалення діагностичного алгоритму і лікувальної тактики.
Матеріали і методи дослідження
Для досягнення мети та вирішення завдань дослідження обстежено 252 дітей віком від 6 до 18 років з персистуючою БА тяжкого і середньотяжкого перебігу (згідно із загальновизнаною класифікацією — III, IV ступінь тяжкості захворювання [7]), яким як базисну терапію призначали ІГКС. Усі пацієнти спостерігалися на базі Львівського міського дитячого алергологічного центру (Львівська міська дитяча клінічна лікарня).
Захворювання вважали контрольованим за наявності таких показників: мінімальні денні симптоми БА (максимум двічі на тиждень); відсутність нічних пробуджень, зумовлених астмою; мінімальне застосування b 2 -агоністів короткої дії (в ідеалі — відсутня потреба їх призначати); відсутність загострень і екстрених викликів швидкої допомоги; немає обмежень фізичної активності [22]. Для оцінки контролю БА застостосовували АСТ, що є зрозумілим і простим для виконання пацієнтами, а його показники зручні для інтерпретації [21, 23]. Результати тестування підтверджували даними cпірометричних досліджень.
Виокремлення дітей для формування груп дослідження проводилося на підставі застосування спеціально опрацьованого покрокового алгоритму лікарської тактики. Дані тестування, об''єктивного та додаткового досліджень заносилися до спеціально розробленої карти. Комплекс імунологічних обстежень включав: визначення в сироватці крові рівня загального IgE; рівня антитіл IgG, IgA до Chlamydia pneumoniae ; антитіл IgG, IgM до Mycoplasma pneumoniae ; антитіл IgG до Toxocara canis . Для статистичного опрацювання результатів застосований пакет комп''ютерних програм Statistica 6,0 (StatSoft, США) та Microsoft Exel 2000.
Результати досліджень та їх обговорення
Перший етап дослідження включав опитування пацієнтів із застосуванням АСТ БА. Наступний етап передбачав перевірку результатів тестування шляхом проведення комп''ютерної спірометрії.
За результатами, отриманими в процесі застосування АСТ, лише у 28 з 252 хворих (11,11 %) БА була повністю контрольованою (КБА), у 43 пацієнтів (17,06 %) — зареєстровано її частковий контроль (ЧКБА), а в решти пацієнтів (181 — 71,83 %) перебіг хвороби був неконтрольований (НКБА).
На підставі попередньо опрацьованих критеріїв включення відібрано 140 дітей, яких було розподілено на дві групи дослідження. До першої (основної) групи ввійшло 70 дітей із неконтрольованим перебігом хвороби, до групи порівняння — 70 пацієнтів, серед яких у 42 (60 %) БА була частково контрольованою, у 28 пацієнтів (40 %) — повністю контрольованою.
У 70 дітей із НКБА застосовано покроковий алгоритм лікувально-діагностичної тактики, що включав: корекцію базисної терапії (призначення адекватного дозування ІГКС та пролонгованих b 2 -агоністів); заходи, направлені на поліпшення співпраці між учасниками лікувального процесу (освітня індивідуальна робота з пацієнтом і його родиною під час кожного візиту до лікаря, вивчення спеціальної літератури); виявлення й лікування супутньої патології (у разі діагностики алергічного риніту — антигістамінні препарати в комбінації з протизапальними засобами місцевої дії; за умови виявлення гастроезофагеальної рефлюксної хвороби — корекція харчування плюс мотиліум) та пошук додаткових тригерних факторів (алергени, вірусні інфекції, екологічні фактори, куріння, ліки тощо). Потреби в проведенні повторної диференціальної діагностики не було. Її ефективність оцінювали на підставі обстеження й динамічного спостереження на кожному із запланованих етапів (до включення в дослідження, через 6 і 12 тижнів після лікування), шляхом динамічної оцінки клінічної симптоматики, показників функції зовнішнього дихання (ОФВ 1 ) та результатів застосування АСТ. Для оцінки клінічних симптомів використовувалася 5-бальна шкала, запропонована в АСТ, яка дозволяє оцінити контроль БА на підставі оцінки впливу БА на можливість виконувати дитиною звичні обов''язки (у школі чи вдома), частоти задишки та пробуджень вночі або під ранок (швидше, ніж зазвичай) унаслідок проявів БА (свистяче дихання, кашель, задишка, стискання в ділянці грудної клітки), виникнення потреби в застосуванні b 2 -агоністів швидкої дії, оцінки дитиною контролю своєї БА протягом останніх 4 тижнів. У разі загальної суми оцінок у 25 балів реєструвалася КБА, 20–24 бали — ЧКБА, нижче 20 балів — НКБА.
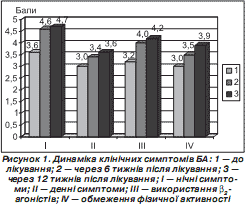
Динаміка кожного окремого клінічного симптому в 70 дітей основної групи подана на рис. 1. Позитивна динаміка клінічних проявів, що відзначалася вже на першому тижні лікування, була більш вираженою наприкінці 1,5-місячної терапії і зберігалася та поліпшувалася протягом усього періоду спостереження. Вірогідне зниження загальної кількості денних симптомів (нападів ядухи, утрудненого видиху, свистячого дихання, кашлю, стискання в ділянці грудної клітки) мало місце вже на 6-му тижні терапії: середня бальна оцінка зросла з 3,00 ± 0,07 до 3,40 ± 0,19 (p < 0,001). Більш помітні зміни відбулися в нічній симптоматиці, зокрема, нічні напади ядухи до лікування становили 3,60 ± 0,21 бала, а після закінчення 3-місячного курсу терапії — 4,70 ± 0,13 бала, тобто можна вважати, що не спостерігались (p < 0,001). Зменшення проявів нічних симптомів переважно спостерігалося протягом 1,5-місячної терапії (середня бальна оцінка зросла на 27,78 %) і незначно поліпшився стан хворих через 12 тижнів після лікування (середня бальна оцінка зросла лише на 2,17 %).
Застосування базисної терапії впродовж шести тижнів істотно знизило потребу у використанні b 2 -агоністів швидкої дії при співставленні з початковим рівнем, що позначилося на підвищенні бальної оцінки: (3,20 ± 0,14 і 4,00 ± 0,21 відповідно (p < 0,001)), та продовжувало знижуватися до кінця 12-го тижня (бальна оцінка — 4,20 ± 0,19 бала). Проведена терапія позитивно впливала на поліпшення фізичної активності пацієнта: 3,00 ± 0,27 бала — обмеження фізичної активності до терапії, 3,5 ± 0,2 бала — на закінчення 6-го тижня терапії та 3,90 ± 0,24 бала — через 12 тижнів після лікування (p < 0,001).
Загалом денні клінічні прояви БА під впливом 12-тижневого курсу терапії поліпшилися на 20,00 %, нічні симптоми хвороби — на 30,56 %, скоротилася потреба у використанні бронхолітиків на 28,13 %, поліпшилась фізична активність на 30,00 %. Загальний «астма-рахунок» досягнення контролю найсуттєвіше поліпшився через 6 тижнів терапії — на 24,14 %, однак продовжував зростати і до кінця 12-го тижня терапії зріс ще на 7,22 %.
Ми проаналізували динаміку окремих симптомів порівняно із загальним контролем (табл. 1). Уже через 1,5 місяця терапії можна було помітити, що серед дітей, які досягли контролю за окремими показниками, переважали ті, в яких не було нічних прокидань, спровокованих БА. Вже на першому етапі спостереження ми побачили, що відсоток дітей, в яких було досягнуто поліпшення за окремими показниками, зокрема нічними симптомами (44 — 62,86 %) і потребою у використання b 2 -агоністів (25 — 35,71 %), був більшим, ніж пацієнтів, у яких критерії оцінювали комплексно (16 — 22,86 %). Через 3 місяці спостереження подібні відмінності простежувалися лише стосовно нічної симптоматики, без нічних приступів — 53 (75,71 %), при досягнені загального контролю — у 32 (45,71 %) пацієнтів.
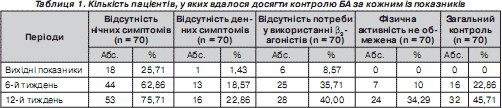
Установлено, що час відповіді на терапію за кожним із критеріїв оцінки був різним. Найшвидше отримано позитивний ефект щодо нічних пробуджень, спровокованих БА. Найповільніше зменшувалася частота денних симптомів астми.
При продовженні терапії чисельність пацієнтів, у яких вдавалося контролювати симптоми астми, поступово збільшувалася, паралельно спостерігалося зменшення кількості випадків застосування препаратів для купірування приступів.
На рис. 2 наведено час появи відповіді на лікування за кожним із критеріїв.
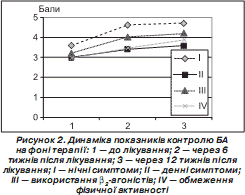
Наведені дані підтверджують, що контроль нічних симптомів досягається швидше, ніж денних. Паралельно з поліпшенням денної і нічної симптоматики спостерігається зменшення використання b 2 -агоністів. Хоча до початку дослідження в пацієнтів була найнижча середня бальна оцінка обмеження фізичної активності, на першому етапі ми отримали стрімке поліпшення показників, які продовжували зростати на другому етапі дослідження.
Отже, вже через 6 тижнів дослідження ми змогли досягти у 10,00 % пацієнтів повного та у 12,86 % часткового контролю. До закінчення 12-го тижня терапії кількість пацієнтів, у яких було досягнуто повного контролю, ще незначно збільшилася і становила 11,43 %, а також суттєво підвищився відсоток дітей, у яких було досягнуто часткового контролю, — 34,29 %.
Застосування покрокової лікарської тактики дозволило поліпшити контрольованість за кожним із показників, однак темпи і тенденції приросту були різними і відповідали ступеню досягнення кінцевого загального контролю.
Відмінна тенденція прослідковувалася щодо нічної симптоматики. Зокрема, бальна оцінка до початку дослідження була приблизно однаковою в обох групах (3,70 ± 0,33 бала — у групі дітей, в якій досягнуто контроль хвороби, і 3,50 ± 0,28 бала — у групі дітей, в якій не було досягнуто контролю хвороби (р > 0,05). До кінця 6-го тижня цей показник в обох групах значно зріс і становив 4,80 ± 0,15 (29,73 %) та 4,40 ± 0,21 (25,71 %) бала відповідно (р < 0,05). До кінця 12-го тижня спостереження нічні симптоми продовжували зменшуватися (на 2,08 і 2,27 % відповідно). Після закінчення 3-місячного спостереження у групі дітей, в якій досягнуто контроль хвороби, нічна симптоматика була відсутня (4,90 ± 0,09 бала) і практично не спостерігалася в групі дітей, які не досягли контролю (4,50 ± 0,21 бала) (р < 0,05). Динаміка інших клінічних проявів у дітей залежно від ступеня досягнення кінцевого контролю суттєво відрізнялася. Так, середня бальна оцінка денних симптомів у дітей, які досягли контролю через 6 тижнів, зросла на 25,81 % (3,10 ± 0,13 бала до дослідження і 3,90 ± 0,34 бала через 6 тижнів, p < 0,001), до кінця 12-го тижня — ще на 7,69 % і становила 4,20 ± 0,32 бала (p < 0,001). У групі дітей, які не досягли контролю, поліпшення денної симптоматики було несуттєвим (на 3,45 % — через 6 тижнів лікування та утримувалося на цьому ж рівні до 12-го тижнів), і на кінець 12-го тижня середня бальна оцінка становила 3,00 ± 0,12. Через 6 тижнів після лікування використання b 2 -агоністів зменшилося в обох групах, що підтверджується зростанням середньої бальної оцінки в групі дітей, які досягли контролю, — на 29,41 %, та в групі дітей, які не досягли контролю, — на 20,00 %. Однак через 12 тижнів після лікування поліпшення цього показника суттєво відрізнялося (лише 6,82 і 2,78 % відповідно) і бальна оцінка на кінець дослідження (12-й тиждень) становила 4,70 ± 0,17 і 3,70 ± 0,24 відповідно. Показники фізичної активності поліпшувалися протягом усього катамнестичного спостереження в групі дітей, які досягли контролю хвороби: на першому етапі збільшилися на 10,81 %, на другому етапі — ще на 17,07 %, досягнувши 4,80 ± 0,16 бала, тобто майже не спостерігалось обмеження фізичної активності. У групі дітей, які не досягли контролю, поліпшення цього показника було інтенсивнішим на першому етапі (на 24,00 %). Дещо поліпшилася середня бальна оцінка до кінця 12-го тижня спостереження (ще на 3,23 %), однак на кінець 3-го місяця вона становила 3,20 ± 0,24 бала.
На рис. 3 відображено час появи відповіді на лікування за кожним показником контролю БА в групах дітей відповідно до ступеня досягнення контролю БА в кінцевому результаті.
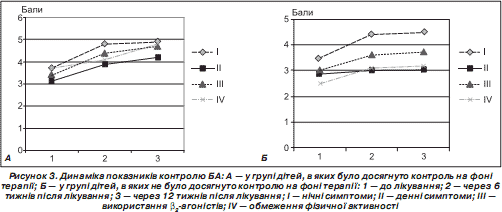
На рис. 3 показано, що контроль нічних симптомів порівняно з денними був досягнутий швидше в обох групах. Паралельно з поліпшенням нічної симптоматики спостерілося зменшення використання b 2 -агоністів. Динаміка денних симптомів у групах відрізнялася. На рис. 3Б проілюстровано, що денна симптоматика у групі дітей, в яких не було досягнуто контролю, майже не поліпшилася на відміну від групи порівняння, в якій поліпшення денних симптомів відбувалося паралельно з динамікою нічної симптоматики та застосуванням b 2 -агоністів, однак на нижчому рівні (рис. 3А). На графіках динаміки обмеження фізичної активності зображено, що на першому етапі цей показник однаково поліпшувався в дітей обох груп, однак на другому етапі суттєве поліпшення спостерігалося лише в групі дітей, в яких було досягнуто контроль БА. Таким чином, у групі дітей, в яких не було досягнено контролю хвороби під впливом терапії, відзначалося менш інтенсивне підвищення середньої бальної оцінки більшості показників клінічної симптоматики. Порівнюючи середню бальну оцінку загального контролю БА на кожному етапі катамнестичного спостереження в дітей залежно від досягнення контролю, ми виявили, що в групі дітей, у яких було досягнуто контроль, на початку дослідження середня бальна оцінка контролю була вищою на 2,5 бала, ніж у групі порівняння. Більше того, серед цих пацієнтів значна інтенсивність збільшення цього показника простежувалася вже в першому періоді дослідження і становила на 6-му тижні 20,50 ± 1,17 бала, що на 22,44 % більше, ніж у групі порівняння.
За даними аналізу показників бронхіальної прохідності в дітей основної групи, ОФВ 1 збільшився через 1,5 місяця лікування з 59,6 ± 2,83 % до 65,80 ± ± 2,73 % (p > 0,05), а через 12 тижнів лікування досягнув 70,70 ± 2,75 % (p > 0,05).
У результаті застосування першого етапу діагностичної та лікувальної програми у 38 (54,29 %) пацієнтів ми не досягли контролю БА, і саме ці пацієнти разом із 30 дітьми з контрольованим перебігом хвороби були обстежені на наявність атипової флори і токсокар. Результати імунологічного тестування дозволили виявити атипову флору і/або токсокари у 30 дітей із неконтрольованим перебігом хвороби; ці діти отримали лікування із застосуванням модифікованого терапевтичного комплексу: у разі позитивних гострих тестів до Chlamydia pneumoniae і Mycoplasma pneumoniae у комплекс базисної терапії включали антибіотики з групи макролідів (кларитроміцин, спіраміцин) курсом 14 днів та через 4 тижні повторювали антибактеріальну терапію препаратом тієї ж групи курсом 7 днів; у разі виявлення токсокарозу призначали 10-денний курс терапії препаратом ворміл (альбендазол). Оцінка ефективності запропонованого модифікованого терапевтичного комплексу проводилася до початку лікування, на 6-му і 12-му тижні. Для оцінювання динаміки і ступеня контролю захворювання використовувалася 5-бальна шкала, описана вище. Позитивна динаміка клінічних проявів відзначалася вже на 1-му місяці лікування, була виразнішою наприкінці 1,5-місячної терапії і зберігалася та поліпшувалася протягом усього періоду спостереження.
Час відповіді на терапію за кожним з критеріїв оцінки був різним. Найшвидше виявлявся терапевтичний ефект щодо нічних пробуджень, спровокованих БА. Слід відзначити, що протягом усього періоду спостереження він був приблизно однаковим. Найповільніше зменшувалася частота денних симптомів астми. Інша ситуація простежувалася з потребою використання b 2 -агоністів швидкої дії, зокрема, істотно знизилася потреба через 6 тижнів та незначно продовжувала знижуватися до кінця 12-го тижня.
Висновки
Застосування запропонованої діагностичної та лікувальної програми дозволило значно підвищити показники контрольованості БА і забезпечити її контроль у 58 (82,86 %) пацієнтів, що суттєво вище, ніж вихідні (28,17 %) та загальностатистичні показники.
Проведені дослідження дають підставу стверджувати, що час відповіді на терапію за кожним із критеріїв оцінки (нічні симптоми, денні симптоми, використання b 2 -агоністів, обмеження фізичної активності, загальний контроль БА) був різним. Найшвидше досягається контрольованість щодо нічних симптомів.
1. Артюх А. Раннее вмешательство с целью предупреждения развития обострения бронхиальной астмы: суть исследования STAY. Реферативный обзор статьи Paul M. O’Byrne // Клінічна імунологія. Алергологія. Інсектологія. — 2008. — № 2. — С. 77-80.
2. Глобальная стратегия лечения и профилактики бронхиальной астмы (Global Initiative for Astma, пересмотр 2002 г.): Пер. с англ. — М.: Атмосфера, 2002. — 160 с.
3. Константинович-Чичирельо Т.В. Клинико-функциональ-ный контроль среднетяжелого и тяжелого течения персистирующей бронхиальной астмы на фоне применения беклазона и саламола // Український медичний часопис. — 2000. — № 5. — С. 37-40.
4. Bateman E.D. et al. Контроль астмы по комплексной оценке показателей. Анализ исследования GOAL // Новости медицины и фармации. — 2007. — № 18. — С. 6-8.
5. Курашова О.М. Клініко-лабораторний аналіз ефективності і безпечності інгаляційних глюкокортикостероїдів у базисній терапії бронхіальної астми у дітей різного віку: Автореф. дис... канд. мед. наук. — К., 2001. — 20 с.
6. Карпушкина А.И. и др. Многоцентровое открытое рандомизированное клинико-экономическое исследование различных режимов фармакотерапии при лечении среднетяжелой и тяжелой бронхиальной астмы у детей // Аллергология. — 2004. — № 3. — С. 3-11.
7. Наказ МОЗ України № 767 від 27.12.2005 р. «Про затвердження Протоколів діагностики та лікування алергологічних хвороб у дітей».
8. Огородова Л.М. и др. Новые подходы к ведению пациентов с тяжелой неконтролируемой бронхиальной астмой (результати открытого многоцентрового рандомизированного исследования BRILLIANT). Ч. І // Аллергология. — 2002. — № 1. — С. 3-12.
9. Петров В.И. и др. Оптимизация терапии тяжелой бронхиальной астмы у детей с позиции анализа «затраты/эффективность» // Аллергология. — 2003. — № 1. — С. 32-35.
10. Петровский Ф.И. Тяжелая и терапевтически резистентная астма у детей // Аллергология. — 2004. — № 2. — С. 48-55.
11. Пінчук Н.М. Порівняльна оцінка клінічної ефективності застосування комбінованої та монотерапії інгаляційними глюкокортикостероїдами у дітей з бронхіальною астмою // Современная педиатрия. — 2005. — № 2. — С. 185-189.
12. Пономарева Ю.В. Оптимизация применения лекарственных средств для лечения тяжелой бронхиальной астмы у детей: Автореф. дис… канд. мед. наук. — Волгоград, 2003. — 20 с.
13. Кожем’яка А.І. та ін. Порівняльна оцінка ефективності лікування бронхіальної астми у дітей // ПАГ. — 2000. — № 2. — С. 25-26.
14. Савустьяненко А.В. Ты можешь контролировать свою астму! // Укр. пульмонологічний журнал. — 2008. — № 2. — С. 30-32.
15. Солдатченко С.С., Донич С.Г., Игнатонис И.П. Приверженность к лечению больных бронхиальной астмой: современное состояние вопроса // Укр. пульмонологічний журнал. — 2008. — № 2. — С. 35-38.
16. Петров В.И. и др.Ступенчатая схема лечения бронхиальной астмы у детей: step by step или step down? // Пульмонология. — 2000. — № 2. — С. 62-70.
17. Огородова Л.М. и др.Тяжелая бронхиальная астма у детей: результаты многоцентрового национального исследования НАБАТ // Аллергология. — 2004. — № 2. — С. 3-9.
18. Чучалин А.Г. и др. Фармакоэпидемиология детской астмы: результаты многоцентрового российского ретроспективного исследования // Пульмонология. — 2001. — Прил. — 34 с.
19. Фещенко Ю.И., Яшина Л.А. Достижение контроля — современная стратегия ведения бронхиальной астмы // Астма та алергія. — 2007. — № 1–2. — С. 5-8.
20. Яшина Л.О., Горовенко Н.Г., Гогунська І.В. Ефективність інгаляційних кортикостероїдів у високих дозах у лікуванні загострень бронхіальної астми // Укр. пульмонологічний журнал. — 2001. — № 3. — С. 21-25.
21. Nathan R.A. et al. Development of the asthma control test: a survey for assessing asthma control // J. Allergy Clin. Immunol. — 2004. — № 113. — Р. 59-65.
22. Global strategy for asthma management and prevention (updated 2005): Global Initiative for Asthma (GINA). URL: http: // www.ginasthma.org; 2005.
23. Kupczyk M., Kuna P. Test kontroli asthmy — Asthma Control Test (ACTTM ) — na tle zalecen GINA 2006 // Terapia. — 2007. — № 4. — S. 17-19.
24. Difficult/therapy-resistant asthma. ERS Task Force on // Eur. Respir. J. — 1999. — № 13. — Р. 1198.
25. McKenzie S.A. Difficult asthma in children // Eur. Respir. Rev. — 2000. — № 69. — Р. 18.
