Журнал «Здоровье ребенка» 4 (25) 2010
Вернуться к номеру
Інформативність різних методів діагностики грибкової гіперчутливості в дітей, хворих на сезонний алергічний риніт, та фактори ризику її виникнення
Авторы: Кузнєцова О.Д., Недельська С.М., Запорізький державний медичний університет
Рубрики: Педиатрия/Неонатология
Версия для печати
У статті наведені результати власного дослідження проблеми сезонної алергії в контексті поєднаної пилково-грибкової гіперчутливості. Встановлено, що прик-тест не повинен бути єдиним методом її діагностики, оскільки в патогенезі алергії до мікроміцетів можуть брати участь не-IgE-опосередковані алергічні реакції. Для діагностики грибкової гіперчутливості необхідні поєднання прик-тестування, внутрішньошкірних та патч-тестів з оцінкою місцевої реакції через 6–8 та 24 години, а також докладний аналіз анамнестичних даних із визначенням рівня специфічного IgE в сироватці крові. Уточнені основні фактори ризику формування грибкової гіперчутливості в дітей із полінозом, побудована логістична модель обчислення цієї ймовірності з метою поліпшення профілактичних заходів.
Сезонний алергічний риніт, грибкова гіперчутливість, діти
Діагностика будь-якого алергічного захворювання, включаючи сезонну алергію (СА), етапна і складається з вивчення скарг та анамнестичних даних, об''єктивного обстеження, шкірних алергопроб, тестів in vitro з використанням радіоалергосорбент-тесту або імуноферментного аналізу, проведення функціональних і лабораторних досліджень, консультації вузьких фахівців [1, 3, 7].
Важливу роль у верифікації СА відіграють анамнестичні дані. Ретельно зібраний анамнез дозволяє визначити сезонний характер захворювання, терміни максимального прояву симптомів із боку верхніх та нижніх дихальних шляхів. При цьому в нагоді стають дані аеробіологічного моніторингу, що використовують для встановлення остаточного діагнозу [6].
Шкірні проби — найпростіший метод визначення наявності сенситизації. Зазвичай використовують прик-тест (укольний), що є золотим стандартом шкірних алергопроб, та внутрішньошкірний [1, 4]. Результати прик-тесту корелюють з анамнезом, рівнем специфічних IgE in vitro та провокаційними тестами, причому найменш значуща кореляція саме при грибковій гіперчутливості (ГГ). Є дані, що негативний результат прик-тесту не виключає наявності алергії і свідчить про те, що в її патогенезі беруть участь не-IgE-залежні реакції [12].
Невідповідність між результатами прик-тестів, рівнем специфічних IgE та/або анамнестичними даними є показанням для проведення внутрішньошкірних проб [2, 11]. І хоча, за даними літератури, результати внутрішньошкірних тестів рідко корелюють з тестами in vitro та дають більшу кількість хибнопозитивних результатів, негативний результат має високу негативну прогностичну значимість [8]. Визначення специфічних IgE у сироватці зазвичай доповнює шкірні проби, а їх низькі рівні не виключають наявність алергії. Тому науковці вважають доцільним використовувати обидва методи для більшої інформативності [13].
Зазвичай для верифікації пилкової алергії достатньо даних анамнезу, шкірних алергопроб та/або наявності специфічних IgE, оскільки поліноз перебігає за класичним реагіновим типом алергічної реакції [4, 9]. У формуванні ж ГГ беруть участь різноманітні патогенетичні ланки, що утруднює її діагностику. Перш за все це стосується можливих пізніх (late-phase) та уповільнених (delayed) реакцій шкіри. Пусковою ланкою патогенезу пізньої реакції є IgE-опосередкована рання фаза. Уповільнені реакції шкіри зумовлені лише Т-клітинною не-IgE-залежною інфільтрацією. Тому, проводячи шкірне алерготестування грибковими алергенами, потрібно оцінювати результат через 6–12 годин [5].
Клітинноопосередкований механізм грибкової гіперчутливості також можна підтвердити патч-тестами (patch-tests) [11, 12]. Наприклад, серед обстежених пацієнтів з алергією до японського кедру 20 % мали позитивні результати патч-тестів, але лише 5 % вказували на наявність висипу після контакту з рослиною. N. Gule (2006) проводив патч-тестування в пацієнтів із позитивними прик-тестами та високими рівнями специфічного IgE. 25 % хворих мали позитивні результати, однак кореляції з розміром папули прик-тесту, ФЗД, статтю, рівнем загального та специфічного IgE не виявлено [10].
Метою нашої роботи було вдосконалення діагностики поєднаної пилково-грибкової гіперчутливості (ПГГ) в дітей із сезонними проявами алергічного риніту (АР) та встановлення факторів ризику її виникнення.
Об''єкт та методи дослідження
Під нашим спостереженням знаходилися 154 дитини з сезонним АР, середній вік — 12,3 ± 0,27 року. Діти були розподілені на 2 групи. Першу становили 100 пацієнтів із наявністю грибкової гіперчутливості, другу — 54 дитини з ізольованою пилковою алергією. Методи дослідження включали анамнестичне опитування, шкірне алерготестування різними методами (прик-, внутрішньошкірний, патч-тести), визначення рівнів загального та специфічного IgE методом імуноферментного аналізу, еозинофільного катіонного білка (ЕКБ) в сироватці крові, а також аеробіологічний моніторинг вмісту пилку рослин та спор грибів в атмосферному повітрі м. Запоріжжя.
Результати та їх обговорення
При алерготестуванні прик-методом шкірна гіперчутливість до мікроміцетів була встановлена в 55,2 % дітей, хворих на сезонний алергічний риніт (САР). Однак результати додаткового тестування та виявлення пізніх реакцій шкіри та слизових оболонок у деяких дітей свідчать про те, що прик-тест повинен бути не єдиним методом діагностики ГГ. Його внесок у визначення загальної поширеності ГГ становить 42 %.
Тому для встановлення оптимальної комбінації діагностичних методів ми вивчили кореляційні зв''язки між різними методами діагностики, аналізуючи індивідуальний патерн шкірної гіперчутливості, анамнезу, рівня загального та специфічного IgE, еозинофільного катіонного білка у сироватці крові в кожного пацієнта на прикладі підвищеної чутливості до Alternaria як найпоширенішого мікроміцету атмосферного повітря. Так, результат анкетування вважався позитивним, якщо симптоматика спостерігалася поза періодом цвітіння бур''яну, восени, коли рівень спор зазначеного виду мікроміцетів перевищував нормативні, при загостренні симптомів після прогулянок у парку. Важливим показником ми вважали наявність нормального рівня загального IgE в періоді загострення щодо нормативних значень для кожного пацієнта. Результати наведені в табл. 1 у вигляді кореляційного коефіцієнту Спірмана.
Наведені дані засвідчують, що серед обраних методів виявлення підвищеного рівня ЕКБ не відіграє ніякої ролі в діагностиці поєднаної сенситизації, оскільки вірогідні відмінності з будь-якими іншими методами у групах відсутні. Навпаки, анамнестичним даним надається максимальне значення, причому найсильніший прямий зв''язок (r = +0,88) характерний для внутрішньошкірного тестування. Також інформативними є комбінації даних анамнезу з прик-тестом та підвищенням рівня специфічного IgE (табл. 1).
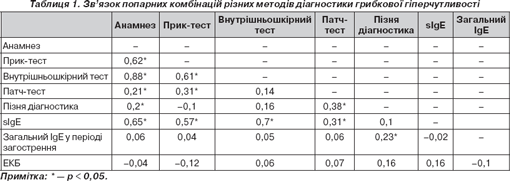
Дуже важливим, на наш погляд, є наявність кореляції між пізньою місцевою реакцією шкіри на Alternaria , відсутністю підвищення рівня загального IgE в періоді загострення САР та позитивним патч-тестом, що дозволяє припустити, що для діагностики не-IgE-опосередкованої гіперчутливості необхідно використовувати комбінацію цих трьох методів.
З урахуванням усіх методів діагностики нами був проведений індивідуальний аналіз результатів як золотий стандарт віднесення кожної дитини до групи дітей з ізольованою або поєднаною алергією, а потім визначення чутливості (Se), специфічності (Sp), прогностичної значимості позитивного та негативного результатів (PV+ та PV–), а також діагностичну ефективність (DE) кожного з них (табл. 2).
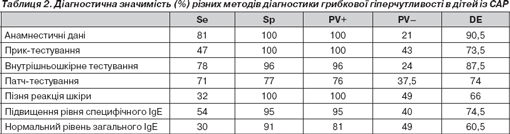
Найбільшу чутливість мають анамнестичні дані (81 %) та внутрішньошкірне тестування (78 %). Позитивні патч-тести зустрічаються майже в 1/2 дітей, однак вони є недостатньо інформативними. Стовідсоткову специфічність та відповідно максимальну інформативність у разі позитивного результату мають прик-тестування, анамнестичні дані та пізня реакція шкіри. Анамнестичні дані мають максимальну діагностичну ефективність (90,5 %), що підтверджує важливість та першорядність збору анамнезу в дітей із алергопатологією.
Слід зазначити, що жодний метод не має достатньої негативної прогностичної значимості, тобто при негативних результатах не можна вірогідно говорити про відсутність ГГ у пацієнтів із пилковою алергією.
За результатами дискримінантного аналізу ми перевірили якість розпізнавання грибкової гіперчутливості за комплексною оцінкою вищенаведених показників. Матриця класифікації як результат лінійної дискримінантної функції наведена в табл. 3 (для матриці значення р < 0,0005).

Із 61 об''єкта спостереження, які ми віднесли до 1-ї групи, 54 віднесені до неї правильно (якість розпізнавання 88,5 %). У той же час усі 25 пацієнтів 2-ї групи правильно віднесені до своєї групи (якість розпізнавання 100 %). Середня якість розпізнавання 94,25 %.
Тому запропоновані комбінації діагностичних заходів слід вважати вельми інформативними для діагностики грибкової гіперчутливості.
САР відносять до мультифакторіальних захворювань. Виникнення й розвиток його тісно пов''язані з дією генетичних та факторів оточуючого середовища, взаємодія яких визначає фенотип хворого. Ми вирішили дослідити роль факторів у двох підгрупах хворих із метою виявлення сприятливих факторів формування САР із грибковою гіперчутливістю.
При аналізі спадковості ми не виявили вірогідного впливу жодного фактора (БА, АР, харчової алергії у матері, батька та близьких родичів, а також інших алергічних захворювань родичів) на формування грибково-пилкової алергії (міжгрупові відмінності, р > 0,05). При цьому RR (risk ratio) не перевищував 1,5. З огляду на отримані дані можна зробити висновок, що вид гіперчутливості є не лише генетично обумовленим.
Порівняльна оцінка даних перинатального періоду та раннього дитинства продемонструвала, що при частих ГРВІ (4 та більше на рік) відносний ризик виникнення ГГ вірогідно збільшується (р < 0,0001). Можливо, це пояснюється тим, що грибкові алергени є інфекційними на відміну від пилкових. При вірусних хворобах полегшуються інфікування та сенситизація організму до мікроміцетів (А.В. Соболев). 26,4 % дітей з ізольованою пилковою гіперчутливістю мали 4 та більше епізодів ГРВІ порівняно з 63,3 % у групі з поєднаною алергією. Патологія періоду новонародженості також може вплинути на формування ПГГ (р < 0,05). Вона мала місце у 17,8 % дітей основної групи та у 3,7 % пацієнтів групи порівняння (р < 0,05). Вищенаведені факти свідчать про важливу роль частих респіраторних захворювань, необхідність їх профілактики та санації хронічних вогнищ інфекції для попередження виникнення ПГГ.
Серед тригерних факторів оточуючого середовища ми вивчали: поверх, на якому живе дитина, наявність у помешканні килимів, рослин, тварин, підвищеної вологості (суб''єктивно) на момент проживання або раніше, протікань води у ванній кімнаті, видимих ознак пліснявого зростання, наявність гіпоалергенного ліжка, частоту вологого прибирання, паління у квартирі (табл. 4).
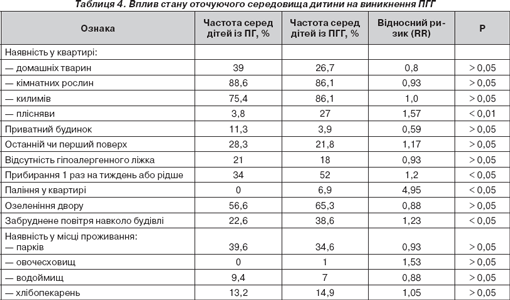
Як свідчать наведені дані, серед факторів довкілля ризик формування поєднаної СА має місце при наявності забрудненого повітря, що турбувало 22,6 % пацієнтів із пилковою та 38,6 % із поєднаною гіперчутливістю (p < 0,05). Паління в квартирі (RR = 4,95) та частота вологого прибирання 1 раз на тиждень або рідше (RR = 1,2) також сприяють розвитку поєднаної сенситизації (р < 0,05).
Відомо, що реалізація атопії в алергію відбувається перш за все під впливом антигенного навантаження: чим вища концентрація антигенів, які оточують дитину, тим вищий ризик формування підвищеної чутливості до них у схильної популяції населення. Тому контроль за оточуючим середовищем фахівцями ВООЗ вважається провідним у контролі за формуванням та перебігом алергічних захворювань.

Результати проведеного аеробіологічного моніторингу свідчать про високий рівень спор грибів в атмосферному повітрі протягом майже всього року. Додаткове вивчення житлових умов показало, що ознаки пліснявого зростання та/або запаху вологості в оселі були наявними в будинках 27 % дітей (у групі порівняння — 3,8 %, р < 0,05). Для формування СА це дуже важливо, оскільки пилок рослин наявний лише в атмосферному повітрі, а спори пліснявих грибів і в приміщенні, тому дітям, які мешкають у квартирах із наявністю цвілі, уникнути контакту з алергенами мікроміцетів неможливо у зв''язку з їх паралельно високим умістом і в атмосферному повітрі, що підвищує ризик виникнення ПГГ (RR = 1,57)
(табл. 4).
За допомогою методу логістичної регресії ми встановили внесок кожного зі статистично значущих прогностичних факторів у загальну модель регресії з метою прогнозування ймовірності розвитку ГГ у дітей із СА при ізольованій пилковій алергії (табл. 5). Значимість моделі р = 0,00011.
Приклад. Хворий Сашко М., 10 років, має сенситизацію до амброзії, соняшника та лободи. Кількість ГРВІ — 4 на рік, ознаки плісняви в кімнаті. Імовірність формування ГГ дорівнює:
Y = –0,97 + 1,06 + 1,11 = 1,19;
P = 1/1+2,72 –1,19 = 0,77, або 77 %.
Висновки
1. Формування грибкової гіперчутливості є складним, у ньому беруть участь не-IgE-залежні механізми, які спростовують золотий стандарт діагностики (прик-тест) та зумовлюють недооцінку справжньої поширеності ГГ.
2. Важливим етапом діагностики є докладний аналіз анамнестичних даних у комплексі з проведенням прик- та внутрішньошкірного тестування з оцінкою реакції шкіри через 6–8 та 24 год та визначенням специфічного IgE.
3. Нормальний рівень загального IgE в пацієнтів із клінічними проявами сезонної алергії в сукупності з іншими позитивними критеріями діагностики ГГ є статистично інформативним для підтвердження наявності ГГ.
4. З метою обчислення ймовірності розвитку ГГ у пацієнта із пилковою алергією та подальших профілактичних заходів необхідно використовувати розраховані прогностичні критерії факторів ризику.
1. Зайков С.В. Раннее выявление и лечение аллергических заболеваний — актуальная задача семейной медицины // Сімейна медицина. —2005. — № 2. — С. 5-7.
2. Ласиця О.Л. Алергологія дитячого віку. — К.: Книга плюс, 2004. — 367 с.
3. Пухлик Б.М. Сезонные аллергические риноконъюнктивиты: распространенность, методы диагностики и лечения // Здоров''я України. — 2007. — № 9. — С. 65.
4. Хаитов Р.М. Клиническая аллергология. — М.: МЕДпресс-информ, 2002. — 623 с.
5. Bernstein Leonard I., James T. Li, David I. Bernstein Allergy diagnostic testing: an apdated practice parameter // Annals of asthma, allergy and immunology. — 2008. — Vol. 100(3), suppl. 3. — 148 p.
6. Bilisik A., Yenigun A., Bicakci A. An observation study of airborne pollen fall in Didim (SW Turkey): years 2004–2005 // Aerobiologia. — 2008. — Vol. 24. — P. 61-66.
7. Bousquet N., Khaltaev A.A. Cruz et al. // Allergy. — 2008. — Vol. 63 ( Suppl. 86). — Р . 8-160.
8. Calabria W.C., Hagan L. The role of intradermal skin testing in inhalant allergy // Annals of Allergy, Asthma and Immunology. — 2008. — Vol. 101, № 4. — Р. 337-347.
9. Gilles S., Mariani V., Bryce M. et al. Pollen allergens do not come alone: pollen associated lipid mediators (PALMS) shift the human immue systems towards a Th2-dominated response // Allergy, Asthma and Clinical Immunology. — 2009. — Vol. 5(3). — P. 1492-1495.
10. Gule N., Kirerleri E., Tamay Z. Atopy patch testing in children with asthma and rhinitis symptoms allergic to house dust mite // Pediatric Allergy and Immunology. — 2006. — Vol. 17, Issue 5. — P. 346-350.
11. Koshak E. Do in vitro IgE tests have a role in identifying atopic asthma? // Current Allergy and Clinical Immunology. — 2006. — Vol. 19, № 1. — P. 4-7.
12. Morris A. Testing for immediate hypersensitivity — the good, the bad, the ugly // Current Allergy and Clinical Immunology. — 2005. — Vol. 18, № 3. — Р . 140-142.
13. O''Driscoll B.R., Powell G., Chew F. Comparison of skin prick tests with specific serum immunoglobulin E in the diagnosis of fungal sensitization in patients with severe asthma // Clin. Exp. Allergy. — 2009. — № 4. — Р.158-161.
