Журнал «Здоровье ребенка» 4 (25) 2010
Вернуться к номеру
Клініко-інструментальні й лабораторні зіставлення в дітей із тетрадою Фалло до та після оперативної корекції
Авторы: ГОНЧАРЬ М.О., Національний медичний університет, кафедра педіатрії № 1 і неонатології, м. Харків
Рубрики: Педиатрия/Неонатология
Версия для печати
У статті подані власні спостереження за 133 пацієнтами з тетрадою Фалло, у яких досліджено морфологію серця, систолічну і діастолічну функції міокарда, частоту й характер аритмій серцевої діяльності, плазмову концентрацію тропоніну І. Проведені клініко-інструментальні й лабораторні зіставлення до та після оперативної корекції з метою ранньої діагностики міокардіальної дисфункції і профілактики маніфестації серцевої недостатності.
Вроджені вади серця, тетрада Фалло, тропонін І, міокардіальна дисфункція, діагностика
Тетрада Фалло (ТФ) — комбінована природжена аномалія серця, яку зараховують до вад ціанотичного типу зі збідненням малого кола кровообігу [1, 2]. ТФ анатомічно складається зі стенозу або атрезії вихідного відділу правого шлуночка (ПШ), високого дефекту міжшлуночкової перегородки (ДМШП), гіпертрофії міокарда ПШ і декстрапозиції аорти [2, 3]. Вважається найбільш поширеною серед вад «синього» типу [1, 4]. Природний перебіг ТФ є несприятливим, хірургічна корекція залишається єдиним засобом лікування. Тяжкість вади і клініко-гемодинамічну ситуацію визначають ступінь стенозу легеневої артерії і розміри дефекту міжшлуночкової перегородки [3, 5], а також тяжкість стану та вік хворого [6]. Радикальна операція включає резекцію інфундибулярного стенозу, пластику ДМШП, реконструкцію вивідного тракту правого шлуночка [1–3]. Метою паліативної операції є накладання системно-легеневих анастомозів для тимчасового поліпшення стану дитини у разі неможливості проведення радикальної операції [7, 8]. За відсутності значних гемодинамичних порушень, тяжкої гіпоксії, ядухо-ціанотичних нападів рекомендованим в Україні віком для проведення корекції вади є друге півріччя життя [3, 6]. У реальних умовах нерідко хірургічне лікування проводиться пізніше. У той же час, за даними морфологів, у міру розвитку гіпертрофії міокарда в дітей віком після 3 місяців життя з тетрадою Фалло прогресує гіперплазія кардіоміоцитів і ретикулінових волокон строми серця. Подальші дистрофічні зміни міокарда можуть призводити до розвитку мікронекрозів, незворотних змін — ядерної дегенерації і міжклітинного фіброзу [9, 10], тобто до ушкодження міокарда і порушення його функції [6, 9]. На нашу думку, дослідження функціонального стану міокарда в дітей з тетрадою Фалло до операції й у віддаленому катамнезі після хірургічної корекції, діагностика доклінічних проявів міокардіальної дисфункції лівого і правого шлуночків можуть бути корисними для оптимізації заходів індивідуальної реабілітації та профілактики інвалідизації цих хворих.
Мета дослідження : вивчити поширеність і варіанти міокардіальної дисфункції у пацієнтів з уродженими вадами конотрункусу на підставі клініко-інструментального обстеження й дослідження плазмової концентрації тропоніну І (TnІ) до операції та у віддаленому катамнезі після хірургічної корекції з метою оптимізації заходів індивідуальної реабілітації і профілактики розвитку недостатності кровообігу.
Матеріал і методи
133 пацієнтам віком від 1 місяця до 16 років з тетрадою Фалло проведене клініко-анамнестичне та інструментальне дослідження, що включало ЕКГ у 12 відведеннях, доплер-ЕхоКГ із визначенням стану систолічної функції лівого шлуночка (ЛШ) і припливного відділу правого шлуночка за методом Simpson, діастолічної функції шлуночків на основі аналізу трансмітрального і транстрикуспідального потоків. Виділяли три типи діастолічної дисфункції (ДД): І (уповільненого розслаблення), при якому більша частина крові надходить у шлуночок у фазу передсердного наповнення, відношення швидкості кровотоку в фазу швидкого наповнення (Е) до швидкості кровотоку в фазу передсердного наповнення (А) Е/А < 1; ІІ (псевдонормалізація), коли 1 < Е/А < 2, але зменшується час ізометричного розслаблення і змінюється час уповільнення потоку в фазу швидкого наповнення; ІІІ (рестриктивний), при якому Е/А > 2 [11].
44 пацієнтам з тетрадою Фалло проведене визначення плазмової концентрації тропоніну І (DAI, США) як золотого стандарту ушкодження міокарда [12]. До аномальних показників TnІ зараховували концентрацію в плазмі, що вища за 0,5 нг/мл.
Для статистичної обробки отриманих результатів використовували пакет програм обробки даних загального призначення Statistica for Windows версії 6.0 і пакет аналізу Microsoft Office Excel.
Результати та їх обговорення
Серед обстежених було 85 (63,9 %) хлопчиків і 48 (36,1 %) дівчаток, у тому числі 31 (23,3 %) хворий до оперативної корекції вади і 102 (76,7 %) дитини у віддалені строки післяопераційного спостереження. Розподіл досліджених з тетрадою Фалло за статтю в групах до та після оперативної корекції вади наведено в табл. 1.

Середній вік пацієнтів до оперативної корекції становив 0,75 ± 0,23 року, в групі післяопераційного спостереження до трьох років після операції — 1,89 ± 0,23 року, понад 3 роки — 11,13 ± 0,48 року.
Середні показники зросту і маси тіла до оперативної корекції вади мали тенденцію до зниження щодо вікової норми (маса тіла — 8,19 ± 1,77 кг, зріст — 68,12 ± 4,32 см). Маса тіла при народженні дорівнювала 3180 ± 188 г, але в подальшому на першому році життя у 15 (48,4 %) хворих (переважно з наявністю ціанозу) швидко прогресувала гіпотрофія. Діагноз було встановлено в перші дні життя 107 (80,5 %) хворим, протягом першого півріччя життя — 21 (15,8 %), віком до 2 років — 3 (2,26) і понад 2 роки — 2 (1,5 %) дітям. Батьки пред''являли скарги на підвищену втомлюваність дитини, пітливість, утруднення при годуванні, задишку, тахікардію. У 6 (19,4 %) дітей розвинулись ядухо-ціанотичні напади. У 16 (51,6 %) обстежених спостерігалась затримка психомоторного розвитку. Ціаноз шкіри і слизових оболонок виявлено у 25,8 % дітей із ТФ у доопераційному періоді. При аускультації вислуховувались органічні систолічні шуми дефекту міжшлуночкової перегородки у 3–4-му міжребер''ї зліва від грудини і стенозу вихідного відділу ПШ у 2-му міжребер''ї, послаблення 2-го тону над легеневою артерією (100 %).
Порушення систолічної функції лівого шлуночка встановлене у 45,2 % обстежених у доопераційному періоді, правого шлуночка — у 22,6 % обстежених. Клінічні ознаки серцевої недостатності виявлені в 35,5 % пацієнтів.
Середній вік проведення хірургічної корекції становив 2,45 ± 0,56 року. Одразу радикально були прооперовані 80 (78,4 %) пацієнтів, які мали достатні розміри лівого шлуночка та відповідний діаметр гілок легеневої артерії. Паліативна корекція передувала радикальній у 15 (14,7 %) дітей, проводилась у пацієнтів віком 0,75 ± 0,35 року (анастомоз Вlalоск — Таussing).
У післяопераційному періоді у 7 (6,9 %) дітей виявлені шуми решунтування ДМШП, у 88 (86,3 %) — шум недостатності клапанів легеневої артерії, переважно помірного ступеня вираженості. У групі неоперованих пацієнтів виявлене компенсаторне збільшення рівня гемоглобіну, середні значення якого становили 141,8 ± 4,6 г/л, коливаючись від 139 до 202 г/л. Поліцитемія, що розвинулась внаслідок хронічної гіпоксії, довготривало (протягом місяців і навіть років) зберігалась після оперативної корекції у 38,2 % дітей; рівень гемоглобіну в прооперованих у середньому становив 134,8 ± 2,6 г/л; кількість еритроцитів дорівнювала 4,66 ± 0,13 млн і 4,49 ± 0,08 млн до і після операції відповідно. Сатурація кисню в досліджених у доопераційному періоді, за даними пульсоксиметрії, коливалась від 52 до 85 %. У 14 хворих була діагностована анемія.
Дані ЕКГ-обстеження в дітей з тетрадою Фалло в групах до та після оперативної корекції вади наведені в табл. 2.

Розбіжності між тривалістю інтервалів ЕКГ у дітей в групах до та після оперативної корекції обумовлені різним віком пацієнтів. Електрична вісь серця, що значно відхилена вправо до оперативної корекції, мала тенденцію до нормалізації після операції. Різниця між показниками ЧСС пояснювалась не тільки різним віком обстежених, але й меншою кількістю дітей з серцевою недостатністю в групі прооперованих. Патологічні ЕКГ-ознаки в обстежених пацієнтів наведені в табл. 3.

Зростання частоти аритмій у прооперованих дітей більше ніж у 2,5 раза (табл. 3) могло бути обумовлене ремоделюванням серця зі збільшенням порожнини правого шлуночка, розвитком фіброзу в гіпертрофованому міокарді на тлі пролонгованої гіпоксії, ушкодженням провідних шляхів під час операції. Велике значення мали зміни в центральній нервовій системі прооперованих дітей як перинатального походження, так і пов''язані з тяжкою і тривалою гіпоксією до операції, тривалістю наркозу і штучного кровообігу під час операції. Певну роль як предикторів виникнення аритмій відіграють мікроструктурні аномалії серця (аберантні хорди, особливості трабекулярного апарату, пролапси атріовентрикулярних клапанів, клапанів магістральних судин), що були виявлені нами в 59 % прооперованих з аритміями й у 20 % пацієнтів без аритмій.
Дані ультразвукового дослідження серця наведені в табл. 4.
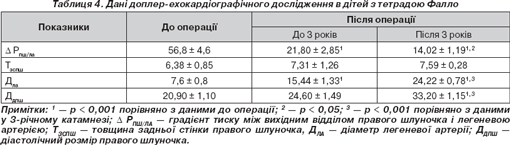
Висока вірогідність розбіжностей між розміром ПШ, діаметром легеневої артерії, градієнтом тиску між вихідним відділом правого шлуночка і ЛА до та після операції підтверджують ефективність проведеної хірургічної корекції. Індексовані показники систолічної функції шлуночків наведені в табл. 5. Відомо, що використання методу дисків за Simpson дозволяє проводити оцінку об''ємних параметрів тільки припливного відділу правого шлуночка, адже припливний і відпливний відділи ПШ розташовуються в різних площинах і одномоментна їх візуалізація неможлива [5]. Оскільки ці відділи ПШ мають приблизно рівні розміри, ряд авторів вважають за можливе використовувати оцінку систолічної функції припливного відділу ПШ за наведеним вище методом для отримання інформації щодо систолічної функції ПШ у цілому [5]. У віддаленому катамнезі порушення систолічної функції лівого шлуночка встановлене у 19,6 %, правого — у 22,5 % обстежених. Клінічні ознаки серцевої недостатності спостерігалися у 5,9 % обстежених.
Як свідчать дані табл. 5, у перші місяці й роки після операції вірогідно збільшується кінцево-діастолічний індекс лівого шлуночка, що пов''язане з нормалізацією внутрішньосерцевої гемодинаміки. У той же час звертає увагу тенденція до зниження фракції викиду ЛШ у віддаленому катамнезі по три роки післяопераційного спостереження. Середні показники фракції викиду ПШ вірогідно не змінюються, систолічна функція не є зниженою. Ймовірно, що зростання об''ємних характеристик ПШ залежить від вираженості недостатності клапана легеневої артерії, що, за нашими даними, виникає після усунення стенозу або реконструкції вихідного відділу ПШ у 86,3 % прооперованих.

Показники, що характеризують діастолічну функцію шлуночків, наведені в табл. 6.
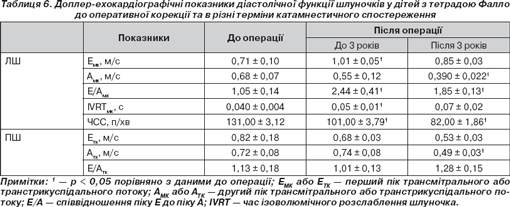
Вірогідні зміни співвідношення Е/А трансмітрального кровотоку в післяопераційному катамнезі обумовлені стрімким зростанням навантаження на ЛШ після проведення анатомічної корекції і свідчать про тенденцію до формування порушень рестриктивного типу (р < 0,01). Виявлені варіанти діастолічної дисфункції шлуночків у дітей з тетрадою Фалло до та після оперативної корекції вади подані в табл. 7.
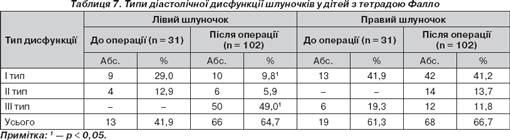
Таким чином, у доопераційному періоді в дітей з тетрадою Фалло превалює І тип (уповільненого розслаблення) ДД (29 % лівого і 41,9 % правого шлуночків), що вважається енергозалежним і реалізується при недостатній кількості вільних макроергів у скоротливому міокарді [11]. До того ж збільшення участі правого передсердя в діастолічному наповненні ПШ пов''язане з гіпертрофією стінки шлуночка і наявністю стенозу легеневої артерії як складових частин означеної вади. У післяопераційному катамнезі, коли вищеназвані обставини купірувані, частота діастолічної дисфункції ЛШ І типу вірогідно зменшується. Але значно зростає частота порушень діастоли рестриктивного типу, досягаючи 49 % і зумовлюючи зростання частоти порушень діастолічного розслаблення міокарда в цілому (табл. 7).
Питома вага рестриктивних порушень діастоли у пацієнтів із «синіми» вадами скоріше за все пояснюється незворотними змінами в міокарді в умовах тривалої гіпоксії або вкрай тяжкого сполучення гіпоксії і серцевої недостатності (67,7 %). За цих умов важливим фактором погіршення діастолічного наповнення стає тахікардія. Окрім впливу на міокард у доопераційному періоді рестриктивної фізіології правого шлуночка, слід ураховувати значення особливостей, обсягу, тривалості й успішності операційного втручання. Ці фактори обумовлюють вірогідність зниження еластичності вентрикулярної камери навіть у віддалені строки після корекції. Вищевикладене підтверджують встановлені кореляційні зв''язки між ДДЛШ і гіпертрофією міокарда ЛШ (r = +0,56), ДДЛШ и порушеннями провідності (r = +0,34), ДДЛШ и ЧСС (r = +0,52). Аналіз залежності діастолічної дисфункції від наявності або відсутності аритмій свідчив про зростання її частоти в дітей з порушеннями серцевого ритму і провідності (р < 0,05).
Середні значення тропоніну І у досліджених становили: медіана показника в доопераційному періоді — Ме = 0,207 нг/мл, інтерквартильний розмах (тобто діапазон, до якого належить 50 % варіації) — 0,027–1,205 нг/мл; медіана показника у віддаленому катамнезі після операції — Ме = 0,123 нг/мл, інтерквартильний розмах — 0,100–0,300 нг/мл. Підвищення рівня тропоніну І встановлене у 9 (20,5 %) досліджених, у яких медіана показника середньої концентрації — Ме = 1,0 нг/мл, інтерквартильний розмах — 0,96–1,76 нг/мл, вірогідно відрізняючись від середніх значень у групі дітей з нормальним ТnІ, де Ме [1] = 0,12 нг/мл, інтерквартильний розмах — 0,08–0,19 нг/мл (p < 0,01). Серед пацієнтів з підвищеним рівнем TnІ 75 % обстежених мали перинатальне ураження ЦНС, 50 % — низьку масу тіла при народженні, 100 % — гіпотрофію та затримку психомоторного розвитку. Клінічні ознаки НК діагностовано у 50 % хворих з підвищеним рівнем ТnІ.
У віддаленому післяопераційному періоді гіпертропонінемію виявлено у 6 дітей, серед яких 4 мали решунтування ДМШП, 6 — значну дилатацію порожнини ПШ, 6 — гіпертрофію стінки ПШ, 4 — значну регургітацію на клапані легеневої артерії. За даними ЕКГ, у них виявлені повна блокада правої гілки пучка Гіса (75 %), виражені порушення процесів реполяризації шлуночків (100 %). У більшості пацієнтів з підвищеним умістом тропоніну радикальній корекції вади передувало накладення анастомозу. Статистичний аналіз надав можливість виявити значущі кореляційні залежності між тропоніном І і фракцією викиду ЛШ (r = –0,63; р = 0,001), між тропоніном І і порушенням діастолічної функції ЛШ (r = 0,31; р = 0,02).
Пацієнти з нормальним і підвищеним рівнем TnІ мали вірогідні розбіжності за показниками наявності діастолічної дисфункції лівого шлуночка (р = 0,02), транспульмональної регургітації (р = 0,03), залишкового градієнта тиску на клапані легеневої артерії (р = 0,03) з вірогідним підвищенням значень ТnІ за наявності означеної патології.
Висновки
Таким чином, у дітей з тетрадою Фалло в до- та післяопераційному періоді спостереження виявлена міокардіальна дисфункція шлуночків (систолічна та діастолічна), наявність якої передує клінічній маніфестації серцевої недостатності. Діастолічна дисфункція як уповільнене розслаблення превалює в пацієнтів до кардіохірургічної корекції, рестриктивний тип — після операції. Розвиток порушення діастоли рестриктивного типу можна прогнозувати у випадках довготривалого збереження ознак ремоделювання серця після хірургічної корекції, у пацієнтів з решунтуванням септальних дефектів, зі значною регургітацією на клапані легеневої артерії, аритмією серцевої діяльності.
Встановлені кореляційні залежності між плазмовою концентрацією тропоніну І, трофічним статусом дитини, порушенням систолічної і діастолічної функції міокарда, вираженістю процесів ремоделювання серця обгрунтовують доцільність його використання в дітей з тетрадою Фалло для поліпшення діагностики міокардіальної дисфункції й ушкодження міокарда, прогнозування розвитку серцевої недостатності, індивідуалізації терапії та реабілітаційних заходів.
Виявлені порушення функціонального стану серцево-судинної системи, такі як систолічна або діастолічна дисфункція шлуночків у дітей з тетрадою Фалло в доопераційному періоді й у віддалені строки після оперативної корекції, обгрунтовують доцільність їх поглибленого обстеження та призначення індивідуальних терапевтичних заходів і реабілітації.
1. Мутафьян О.А. Пороки сердца у детей и подростков. — М.: ГЭОТАР, 2009. — 556 с.
2. Шарыкин А.С. Врожденные пороки сердца: Руководство для педиатров, кардиологов, неонатологов. — М.: Теремок, 2005. — 381 с.
3. Сухарева Г.Е. Результаты и функциональная адаптация сердечно-сосудистой системы после хирургического лечения тетрады Фалло у детей, проживающих в АР Крым // Таврич. медико-биол. вестн. — 2006. — № 2. — С. 16-22.
4. Воробьев А.С., Бутаев Т.Д. Клиническая эхокардиография у детей и подростков. — СПб.: Специальная литература, 1999. — 423 с.
5. Бокерия Л.А., Сокольская Н.О. Эхокардиографическая оценка функции миокарда у больных с врожденными пороками сердца в раннем послеоперационном периоде. — М.: Изд-во НЦССХ им. А.Н. Бакулева РАМН, 2004. — 76 с.
6. Педіатричні аспекти ведення дітей з природженими вадами серця / За ред. О.П. Волосовця, Г.С. Сенаторової, М.О. Гончарь. — Тернопіль: ТДМУ: Укрмедкнига. — 2008. — С. 82-83.
7. Лазоришинець В.В., Руденко Н.М., Книшів Г.В. Невідкладна допомога при основних патологічних синдромах у немовлят з уродженими вадами серця. — К.: УкрНДІСВД, 2001. — 90 с.
8. Волосовець О.П. Природжені вади серця у новонароджених: стратегія і тактика лікаря у ранньому постнатальному періоді // Перинатологія та педіатрія. — 1999. — № 2. — С. 28-33.
9. Егорова И.Ф., Серов Р.А., Туманян М.Р., Шарыкин А.С. Результаты анализа интраоперационных биопсий миокарда у детей с тетрадой Фалло // Грудная и сердечно-сосудистая хирургия. — 2001. — № 4. — С. 8.
10. Струков А.І., Сєров В.В.. Патологічна анатомія. — Харків: ФАКТ, 2004. — С. 693-694.
11. Терещенко С.Н., Демідова И.В., Александрія Л.Г., Агєєв Т.Ф. Діастолічна дисфункція ЛШ і її роль у розвитку хронічної серцевої недостатності // Сердечная недостаточность. — 2000. — Т. 1, № 2. — С. 61-65.
12. Егорова М.О. // Биохимическое обследование в клинической практике. — Практическая медицина. — М., 2008. —
С. 120-122.
