Журнал «Здоровье ребенка» 4 (25) 2010
Вернуться к номеру
Особливості діагностики обструкції дихальних шляхів у дітей раннього віку з уродженими вадами розвитку
Авторы: СЛЄПОВ О.К., СОРОКА В.П., БЕНЗАР І.М., ДЖАМ О.П., РУДЕНКО Є.О., РИЖЕНКО О.В., ПОНОМАРЕНКО О.П., Відділення хірургічної корекції вроджених вад розвитку у дітей, Державна установа «Інститут педіатрії, акушерства і гінекології», м. Київ
Рубрики: Педиатрия/Неонатология
Версия для печати
Основним завданням дослідження було узагальнення клінічних проявів і створення діагностичних алгоритмів при обструкції дихальних шляхів у дітей раннього віку, що спричинена уродженими аномаліями. Проаналізовано 30 клінічних випадків. Діти з обструкцією дихальних шляхів перебували на стаціонарному лікуванні у відділенні хірургічної корекції вад розвитку у дітей у період з січня 1997 по грудень 2008 року. Вік пацієнтів становив від 1 місяця до 3 років. Серед них хлопчиків було 18, дівчаток — 12. Обструкція дихальних шляхів була спричинена трахеомаляцією, зовнішньою компресією при судинних кільцях та новоутвореннях середостіння. Незалежно від етіології обструкція дихальних шляхів проявлялась респіраторними розладами та супроводжувалась схожими ускладненнями, зокрема запальними бронхолегеневими захворюваннями, обструктивною емфіземою, ателектазом легень, вторинною трахеомаляцією. Діагностичний алгоритм створювався з огляду на етіологічні чинники і включав оглядову рентгенографію органів грудної клітки, езофагографію, трахеобронхоскопію, ангіографію, ультразвукове дослідження, магнітно-резонансну та комп’ютерну томографію.
Обструкція дихальних шляхів, трахеомаляція, судинне кільце, новоутворення середостіння
Вступ
Обструкція дихальних шляхів у дітей раннього віку нерідко обумовлена вродженими вадами розвитку, що потребують ранньої хірургічної корекції. Це, зокрема, первинна трахеомаляція (ТМ), аномалії магістральних судин із формуванням судинного кільця, кісти і пухлини середостіння. Рецидивуючі пневмонії, гостра дихальна недостатність, асфіксія, аорто-стравохідна кровотеча ускладнюють перебіг цих захворювань та є безпосередніми чинниками смерті дітей або їх тяжкої інвалідизації [1]. Зважаючи на тяжкість ускладнень, високу летальність за умов природного перебігу захворювань (наприклад, до 80–90 % дітей віком до 1 року при повному судинному кільці [2, 3]), не викликає сумніву важливість своєчасної діагностики органічних причин обструкції дихальних шляхів (ДШ) у дітей.
Трахеомаляція характеризується втратою каркасності хрящових півкілець трахеї, розширенням її мембранозної стінки та зменшенням передньо-заднього розміру. Ці фактори сприяють колапсу трахеї, особливо під час збільшення швидкості руху повітря, зокрема під час кашлю, плачу, годування [4].
Трахеомаляція може бути асоційованою з атрезією стравоходу, виникати вторинно як результат зовнішньої компресії судинними кільцями та/або об''ємними утвореннями середостіння, а також зустрічається як первинний ідіопатичний стан [5]. Симптоми ТМ коливаються від надсадного кашлю та експіраторного стридору до більш тяжких проявів, зокрема нападів апное, що часто виникають під час або через декілька хвилин після годування, під час сну [6]. Найбільш тяжку групу становлять пацієнти з ТМ, ускладненою рецидивуючими пневмоніями та частими епізодами апное [7].
Судинне кільце є відносно рідкісною вродженою аномалією, при якій дуга аорти зміненої конфігурації та/або інші великі судини формують повне або неповне кільце, що охоплює трахею, головні бронхи, стравохід [8]. Основні симптоми (стридор, епізоди апное, рецидивуючі пневмонії, дисфагія) пов''язані з компресією в судинному кільці трахеї, стравоходу, головних бронхів [9].
Найчастіше причиною обструкції ДШ у дітей є такі судинні аномалії: подвійна дуга аорти (ПДА), правобічна дуга аорти в поєднанні з лівобічною артеріальною зв''язкою/протокою (ПрДА), лівобічна дуга аорти з аберантною правою підключичною артерією (ППА), петля легеневої артерії, аномальний плечоголовний стовбур (АПГС).
Причиною обструкції ДШ у дітей раннього віку також можуть бути пухлини і кісти середостіння, серед яких найчастіше зустрічаються судинні пухлини, тератодермоїди, пухлини вилочкової залози, бронхогенні кісти тощо.
Мета дослідження : розробити діагностичні алгоритми при обструкції дихальних шляхів різної етіології у дітей раннього віку.
Матеріали і методи дослідження
Проведено аналіз перебігу захворювань, що супроводжувались обструкцією ДШ уродженого генезу, у 30 дітей, які перебували на стаціонарному лікуванні у відділенні хірургічної корекції вад розвитку у дітей ДУ «ІП АГ АМН України» з січня 1997 по грудень 2008 року. Вік пацієнтів становив від 1 місяця до 3 років. Віком до 1 року обстежено 16 дітей, від 1 до 3 років — 14. Серед них хлопчиків було 18, дівчаток — 12.
Причинами обструкції дихальних шляхів були: первинна трахеомаляція (n = 5); зовнішня компресія при вадах розвитку магістральних судин (n = 12) та новоутвореннях середостіння (НС) (n = 10).
Первинна ТМ була ідіопатичною (n = 3) та асоційованою з атрезією стравоходу (n = 2).
Причинами обструкції ДШ судинного походження були: подвійна дуга аорти (n = 6), правобічна дуга аорти з лівобічною артеріальною зв''язкою/протокою (n = 3), лівобічна дуга аорти з аберантною правою підключичною артерією (n = 1) та аномалія відгалуження плечеголовного стовбура (n = 2).
У 10 дітей обструкція ДШ була спричинена новоутвореннями середостіння, зокрема судинними пухлинами (n = 3) (лімфангіоміомою (n = 1) та гемангіомою (n = 2)), пухлиноподібними утвореннями вилочкової залози (n = 4) (тимомами: гранулематозною (n = 1) та лімфоцитарною (n = 2), гіперплазією залози (n = 1)); тератодермоїдними пухлинами (n = 2) (тератодермоїд і тератобластома) та бронхогенною (паратрахеальною) кістою (n = 1). Новоутворення середостіння, які спричинювали обструкцію дихальних шляхів, локалізувались у передньому (n = 5), задньому (n = 4) і в передньому та задньому (n = 1) межистінні. Бронхогенна кіста (n = 1) та пухлиноподібні утворення вилочкової залози (n = 4) знаходились в основному у верхньому відділі середостіння, тоді як судинні та тератодермоїдні пухлини були великих або гігантських розмірів і знаходились у верхній і середній (n = 1) або в усіх відділах середостіння (n = 3).
Рентгенологічне поліпозиційне обстеження проводили на рентгеноскопічному апараті з електронно-оптичним перетворювачем (TUR-100 (НДР) з ЕОП).
Ультразвукове дослідження грудної клітки проводили на апараті Biomedika SIM 7000 з використанням датчика з частотою 3–5 мГц.
Езофагографію дітям раннього віку проводили під загальним знеболенням. Використовували водорозчинні рентгеноконтрастні речовини, які вводили в стравохід через зонд, щоб запобігти аспірації. Дослідження виконували в прямій та бокових проекціях при тугому заповненні стравоходу контрастом.
Трахеобронхоскопію (ТБС) виконували за допомогою бронхоскопа Фріделя (НДР) із застосуванням оптики.
Для визначення анатомо-фізіологічних особливостей судинних аномалій проводили ангіографічне дослідження — дигітальну субтракційну ангіографію (ДСА). При підозрі на обструкцію дихальних шляхів пухлинного генезу використовували магнітно-резонансну (МРТ) або комп''ютерну томографію (КТ) органів грудної клітки.
Результати дослідження
Для побудови діагностичного алгоритму ми керувалися основними клінічними симптомами та синдромами, що дозволяє попередньо встановити етіологічний чинник обструкції.
Первинна ТМ проявлялась такими симптомами: стридор (n = 3), утруднене дихання (n = 4), задишка (n = 4), напади ядухи (n = 2), ортопное — закидання голови назад під час сну (n = 2), рецидивуючі запальні бронхолегеневі захворювання (n = 4), сухий кашель (n = 4), причому в одному випадку — «гавкаючий», з металевим відтінком, поперхування при вживанні рідкої їжі (n = 1). Клінічні прояви з''являлись з моменту народження дитини (n = 3) або протягом першого місяця життя (n = 2) і зустрічались у різних комбінаціях. У цих пацієнтів розвинулись такі ускладнення: інфекції дихальних шляхів та легень (n = 4); обструктивна емфізема легень (n = 3); гостра дихальна недостатність (n = 4).
Основними клінічними ознаками обструкції ДШ судинного генезу були: стридор (n = 9), утруднене дихання (n = 9), задишка (n = 12), напади ядухи (n = 3), ортопное (n = 9) — закидання голови назад (рис. 1) (n = 7) або колінно-ліктьового положення (n = 2), рецидивуючі запальні бронхолегеневі захворювання (n = 9), кашель (n = 11), ціаноз (n = 4), поперхування, зригування (n = 3).
Задишка змішаного характеру, але з переважанням експіраторного компоненту спостерігалася в усіх обстежених дітей за різних анатомічних варіантів судинних аномалій і була пов''язана з порушенням вентиляції легень внаслідок компресійного звуження та інфекції дихальних шляхів. На тлі тахіпное відзначалось западання яремної ямки, втягування міжреберних проміжків, роздування крил носа.
При повному судинному кільці (ПДА, ПрДА) у більшості (n = 8) дітей відмічено ортопное у вигляді закидання голови назад, частіше під час сну. У такому положенні відбувається натягнення стінок трахеї, збільшення її протидії стискаючій судині, покращення каркасності та прохідності. У двох дітей з ПДА ортопное проявлялось колінно-ліктьовим положенням, при якому тиск судини на передню стінку трахеї є мінімальним, що поліпшує її прохідність і легеневу вентиляцію.
Перші клінічні ознаки обструкції дихальних шляхів судинного генезу з''явились з моменту народження (n = 4), на першому місяці життя (n = 2) та протягом першого півріччя (n = 6).
Природний перебіг обструкції ДШ судинного генезу супроводжувався такими ускладненнями: запальними захворюваннями бронхолегеневої системи (n = 12), одно- (n = 2) чи двобічною (n = 3) обструктивною емфіземою легень, вторинною трахеомаляцією.
Основними симптомами обструкції ДШ пухлинного генезу були: стридор (n = 6), утруднене дихання (n = 4), задишка (n = 10), напади ядухи (n = 2), рецидивуючі запальні бронхолегеневі захворювання (n = 3), кашель (n = 8), ціаноз шкіри (n = 2), гіпертермія (n = 2). В окремих випадках виникали: стовщення кінцівки, ортопное, блювота, неспокій, набряк обличчя, деформація грудної клітки.
Клінічні ознаки з''явились з народження (n = 3), на першому місяці життя (n = 2), протягом першого півріччя (n = 4) та після першого року життя (n = 1).
Обструктивні ураження ДШ пухлинного генезу супроводжувались ускладненнями, а саме: інфекцією дихальних шляхів і легень (n = 10); обструктивною емфіземою (n = 5) (однієї (n = 1) або обох (n = 2) легень, однієї частки легені (n = 2)); ателектазом легені (n = 1); вторинною трахеомаляцією (n = 3).
При побудові діагностичного алгоритму для обстеження дітей з обструкцією дихальних шляхів ми керувалися такими критеріями: діагностична цінність, чутливість, інвазивність, доступність, технічна складність, необхідність наркозу та спеціальної підготовки, вартість. Збір анамнезу та фізикальне обстеження надали можливість виділити провідні клінічні синдроми та побудувати послідовність обстежень, враховуючи ймовірні етіологічні чинники. Специфічні діагностичні методики застосовували у порядку зростання їх інвазивності та складності, необхідності спеціальної підготовки.
Розроблений нами діагностичний алгоритм при обструкції ДШ, що зумовлена первинною ТМ, включав:
— оглядову рентгенографію органів грудної клітки (ОГК) у прямій та боковій проекціях;
— езофагографію;
— ТБС;
— ангіографію;
— ультразвукове дослідження (УЗД) середостіння.
Рання діагностика судинного кільця повинна базуватись на симптомах трахеостравохідної обструкції з наступним документуванням зовнішньої судинної компресії трахеї і стравоходу. Розроблений діагностичний алгоритм при обструкції ДШ судинного генезу включає:
— оглядову рентгенографію ОГК;
— езофагографію;
— ангіографію;
— УЗД;
— ТБС.
Послідовність діагностичних процедур при обструктивних ураженнях ДШ пухлинного генезу є такою:
— рентгенографія в 2 проекціях (багатоосьова рентгеноскопія) ОГК;
— ТБС;
— езофагографія;
— УЗД;
— МРТ або КТ;
— ангіографія.
Оглядовою рентгенографією ОГК у вертикальному положенні тіла починали обстеження пацієнтів з підозрою на обструкцію дихальних шляхів. Рентгенографію проводили в прямій і в боковій проекції. За необхідності проводили поліпозиційне обстеження на рентгеноскопічному апараті з електронно-оптичним перетворювачем.
Аналізуючи результат, звертали увагу на стан середостіння та легеневих полів, рівень стояння куполів діафрагми, наявність деформації грудної клітки, вільного газу в черевній порожнині. За даними оглядової рентгенографії ОГК виявляли непрямі ознаки обструкції ДШ — емфізему, запальні вогнищеві зміни, ателектази тощо. У випадку об''ємних утворень середостіння та легень можна визначити їх локалізацію, розміри, форму.
Езофагографія є технічно простою високоінформативною методикою. Хоча езофагографія не дає вичерпної інформації про наявність ТМ, вона є надзвичайно важливою для виключення інших причин обструкції ДШ, а саме варіантів судинного кільця, новоутворень середостіння, стравохідних ускладнень після корекції атрезії стравоходу. Крім того, під час езофагографії (-скопії) можливо візуалізувати зменшення товщини повітряного стовпа трахеї при проходженні контрастної речовини, що є ознакою трахеомаляції.
При ПДА, ПрДА з лівобічною артеріальною зв''язкою/протокою, лівобічній дузі аорти з аберантною ППА на езофагограмі в бічній проекції визначається типова для цих аномалій компресійна деформація задньобокових стінок аортального сегмента стравоходу. Причому при ПДА, ПрДА з лівобічною артеріальною зв''язкою/протокою деформація задньої стінки стравоходу є значною і відповідає діаметру магістральної судини, що стискає його та має горизонтальний напрямок.
Лівобічна дуга аорти з аберантною ППА супроводжується косою спіралеподібною деформацією задньої стінки стравоходу (рис. 1), що відповідає діаметру підключичної артерії, яка при цьому йде знизу вверх і зліва направо.
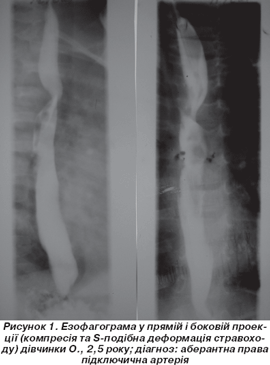
При аномалії плечоголовного стовбура на езофагограмах деформацій стравоходу не виявлено. Дані езофагографії також недостатньо інформативні для виявлення ТМ, проте її проведення важливе для виключення вторинного ураження стравоходу.
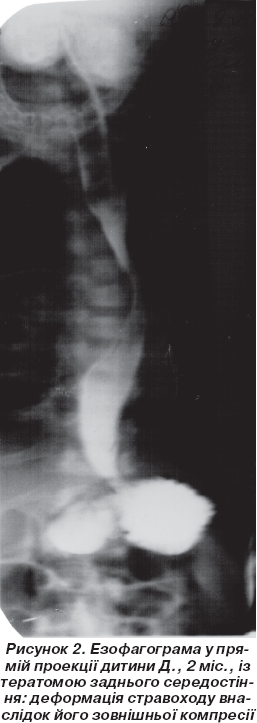
У дітей з пухлинними захворюваннями ОГК езофагографію (n = 5) виконували для визначення взаємозв''язку між НС і стравоходом, а також виявлення зовнішньої компресії стравоходу (рис. 2).
Ультразвукове дослідження має ряд незаперечних переваг: це доступна, неінвазивна, високоінформативна методика, що дає можливість визначити анатомо-топографічні особливості паренхіматозних органів, оцінити розміщення, структуру, розміри новоутворень середостіння.
УЗД середостіння та серця дозволяє виявити супутні вади серця, що також можуть спричинювати обструкцію ДШ, патологію вилочкової залози тощо. УЗД (n = 9) дало можливість не тільки визначити особливості НС (локалізацію, розміри, структуру, зв''язок із сусідніми органами), але й виявити супутні вади розвитку і захворювання.
Трахеобронхоскопія — це високоінформативна діагностична процедура, що дозволяє виявити анатомічні зміни дихальної трубки, її прохідність, стан хрящових напівкілець, локалізацію, протяжність та ступінь компресійного звуження.
Діагноз трахеомаляції встановлюється під час бронхоскопії, яка продовжується при спонтанному диханні. Виділяють три ключових моменти діагностики: 1) визначення тяжкості маляції; 2) визначення локалізації та протяжності процесу, особливо у випадку можливого поєднання з бронхомаляцією; 3) вплив позитивного тиску в дихальних шляхах на тяжкість маляції. Ендоскопічними ознаками ТМ були: відсутність (n = 1) або недостатня візуалізація (n = 2) хрящів, зменшення довжини їх дуги, розширення та гіпотонія мембранозної стінки, її пролабування у просвіт трахеї (n = 1). Унаслідок маляції хрящів трахея втрачає стабільність. Під час форсованого вдиху або кашлю спостерігали сплющення просвіту трахеї за рахунок змикання передньої і задньої стінок (n = 2) або пролабування задньої стінки (n = 2). За умови штучної вентиляції легень у ділянці ТМ просвіт трахеї зменшувався від 50 до 80 %, при спонтанному диханні обструкція збільшувалась на 10–25 % і просвіт трахеї набував щілиноподібного вигляду. ТМ локалізувалась у нижній (n = 2) або середній (n = 2) третині трахеї, на 1–2,5 см вище від біфуркації і мала протяжність від 1 до 3 см . Крім того, ТБС дає змогу виявити зміни слизової оболонки дихальних шляхів. Двобічний дифузний ендобронхіт спостерігали в усіх пацієнтів з ТМ: катаральний (n = 3) та катарально-гнійний (n = 1).
ТБС відіграла значну роль у деталізації анатомії та функціонального стану трахео-бронхіального дерева, визначенні ступеня обструкції дихальних шляхів, спричинених аномаліями магістральних судин. Обструкція виключно трахеї спостерігалась у 7 хворих, трахеї та обох головних бронхів — у двох пацієнтів. Ступінь звуження трахеї коливався в межах від 40 до 80 % (у середньому 65 %) її просвіту, головних бронхів — 30–70 % (у середньому 52,8 %). Звуження в трахеї локалізувалось у нижній її третині на відстані 0,5–2 см (у середньому 1,2 см) над кариною і мало протяжність 0,7–3 см (у середньому 1,5 см).
Під час ТБС виявлено вторинну трахеомаляцію (ВТ) у ділянці зовнішньої компресії трахеї судиною (n = 5). При цьому кільця трахеї в ділянці маляції не візуалізувались (n = 1) або контурувались недостатньо (n = 4). При спонтанному диханні в ділянці ВТ збільшувалась обструкція трахеї на 10–30 % (у середньому 20 %).
Слід підкреслити, що ТБС у дітей з компресією трахеї судинного генезу виконують безпосередньо перед операцією, оскільки травматизація слизової оболонки під час маніпуляції може спричинити посилення обструкції та необхідність тривалої інтубації трахеї.
У дітей з новоутвореннями середостіння (n = 8) під час ТБС ізольовану компресію трахеї виявлено у 4 випадках, трахеї та головного бронха — у 3, тільки головного бронха — в одному.
Ступінь звуження трахеї в результаті компресії її НС коливався в межах від 50 до 80 % її просвіту (у середньому 65,7 %), а головного бронха — від 50 до 70 % (у середньому 65 %). Протяжність обструкції трахеї становила 1–5 см (у середньому 3,2 см). Вторинну трахеомаляцію виявлено в 3 хворих. При цьому в ділянці ВТ погано візуалізувались хрящові кільця, обструкція трахеї при спонтанному диханні дитини збільшувалась на 10–20 % (у середньому 15 %). У всіх пацієнтів виявлено двобічний дифузний ендобронхіт (катаральний (n = 4) і катарально-гнійний (n = 4)).
Дигітальна субтракційна ангіографія в дітей дає можливість вірогідно виявити анатомо-топографічні особливості аномалій розвитку аорти та магістральних судин, що викликають обструкцію дихальних шляхів, а також діагностувати супутні вади серця та легень, що має неабияке значення для вироблення оптимальної лікувальної тактики. За отриманими даними, при ПДА частіше функціонували обидві дуги аорти (n = 4) і рідше спостерігалась атрезія однієї з дуг — лівої, між відходженням лівої підключичної артерії і низхідною частиною грудної аорти (n = 2). Серед пацієнтів, у яких функціонували обидві аортальні дуги, переважала права дуга аорти (n = 2), ліва (n = 1) або дуги були рівноцінними (n = 1). При обструкції ДШ, спричинених АПГС (n = 2), при ангіографії виявлено два варіанти аномалії плечеголовних судин: дистальне відгалуження плечоголовного стовбура (n = 1), при якому ця судина відходила від дуги аорти ліворуч від трахеї та перетинала її в косопоперечному напрямку, спричиняючи передню компресію, і аномальне відгалуження лівої загальної сонної артерії від плечоголовного стовбура (трифуркація) (n = 1).
При МРТ або КТ є можливість виявити НС і деталізувати його, а також виявити зв''язок новоутворення з іншими органами, визначити точну локалізацію компресійного звуження, його ступінь та протяжність.
Висновки
1. Обструкція дихальних шляхів у дітей раннього віку, незалежно від її причини, супроводжується клінічними ознаками респіраторних розладів у різних комбінаціях і подібними ускладненнями — запальними бронхолегеневими захворюваннями, обструктивною емфіземою, ателектазом легень, вторинною трахеомаляцією.
2. Для визначення етіологічних чинників обструкції дихальних шляхів у дітей раннього віку використовують рентгенологічні (у тому числі контрастні), ендоскопічні, ультразвукові та ангіографічні методи дослідження.
3. Дотримання алгоритму, що побудований з урахуванням імовірного етіологічного чинника, дозволяє оптимізувати ранню діагностику в умовах стаціонару, попередити можливі ускладнення та вибрати раціональну лікувальну тактику.
1. Кривченя Д.Ю., Слепов А.К., Заводий В.Г., Чумакова Л.Ф., Голопапа Г.В. Хирургическая коррекция внутригрудной компрессии дыхательных путей, обусловленной двойной дугой аорты, у детей // Клінічна хірургія. — 2000. — № 6. — С. 27-30.
2. Bonnard A., Auber F., Fourcade L., Marchac V., Emond S., Revillon Y. Vascular Ring Abnormalities: A Retrospective Study of 62 // J. Pediatr. Surg . — 2003. — Vol . 38, № 4. — P . 539-543.
3. Слепов А.К. Диагностика и лечение вторичной трахеомаляции при внутригрудной компрессии дыхательных путей, обусловленной аномалией сосудистого кольца, у детей // Клінічна хірургія. — 2000. — № 1. — С. 46-48.
4. Qi B. Q., Merei J., Farmer P., Hasthorpe S., Hutson J.M., Myers N.A., Beasley S.W. Tracheomalacia With Esophageal Atresia and Tracheoesophageal Fistula in Fetal Rats // J. Pediatr. Surg . — 1997 . — Vol. 32 , № 11 . — Р . 1575 -1579.
5. Dave S., Currie G. The role of aortopexy in severe tracheomalacia // J . Pediatr. Surg. — 2006. — Vol . 41, № 4. — P . 533-537.
6. Rutter M. J. Evaluation and management of upper airway disorders in children // Seminars in Ped. Surg. — 2006. — Vol. 15. — P. 116‑123.
7. Valerie E.P., Durrant A.C., Forte V., Wales P., Chait P., Kim P.C.W. A decade of using intraluminal tracheal/bronchial stents in the management of tracheomalacia and/or bronchomalacia: is it better than aortopexy? // J. Pediatr. Surg. — 2005. — Vol . 40, № 8. — P . 904-907.
8. Al-Bassama A., Mallicka M.S., Al-Qahtania A., Al-Tokhaisa T., Gadoa A., Al-Boukaib A., Thalagc A., Alsaadi M. Thoracoscopic division of vascular rings in infants and children // J. Pediatr. Surg. — 2007. — Vol. 42. — P. 1357-1361.
9. McLaren C.A., Elliott M.J., Roebuck D.J. Vascular compression of the airway in children // Pediatr. Respiratory Reviews. — 2008. — Vol. 9. — P. 85-94.
