Журнал «Здоровье ребенка» 4 (25) 2010
Вернуться к номеру
Атриомегалия: дифференциально-диагностический подход в педиатрии
Авторы: Волосовец А.П., Кривопустов С.П., Мороз Т.С., Фищук Н.И., Лисовский П.Л., Национальный медицинский университет им. А.А. Богомольца, г. Киев, Киевская городская детская клиническая больница № 2
Рубрики: Педиатрия/Неонатология
Версия для печати
Статья посвящена дифференциальной диагностике заболеваний, сопровождающихся увеличением предсердий у детей. Даны клиническая характеристика, нарушения гемодинамики, принципы диагностики и прогноз заболеваний, сопровождающихся атриомегалией.
Атриомегалия (atriomegalia; атрио- — предсердие + греч. megas, megalu s — большой) — резкое увеличение предсердия, обусловленное его дилатацией.
Увеличение предсердий является вторичным процессом, развивающимся на фоне различной врожденной и приобретенной патологии сердечно-сосудистой системы. В большинстве случаев увеличение предсердий развивается вследствие регургитации крови из желудочков при недостаточности атриовентрикулярных клапанов либо при повышении давления в полостях сердца при их стенозе, реже — при врожденных пороках сердца (ВПС), заболеваниях миокарда и перикарда, а также при различных заболеваниях органов и систем, сопровождающихся перегрузкой правых отделов сердца (тяжелая пневмония, портальная гипертензия). Как правило, увеличение правого или левого предсердия сопровождается увеличением соответствующего желудочка, однако встречается и изолированная атриомегалия.
Изменения на митральном клапане в результате ревматического процесса, инфекционного эндокардита, дисплазии соединительной ткани приводят к развитию митрального порока и, как следствие, к нарушению внутрисердечной гемодинамики. Сужение левого атриовентрикулярного отверстия затрудняет прохождение крови из левого предсердия в левый желудочек, вызывая тоногенную перегрузку левого предсердия. При митральной недостаточности обратный ток крови во время систолы левого желудочка через митральный клапан в полость левого предсердия приводит к объемной перегрузке левого предсердия. В результате этих патологических явлений происходит увеличение полости левого предсердия. В ряде случаев размеры левого предсердия и объем его достигают крайних степеней, и тогда используются термины «аневризматическое увеличение левого предсердия», «гигантское предсердие», «атриомегалия». (Е.В. Ловягин, 1975;Б.А. Константинов с соавт., 1981, 1990; В.И. Бураковский, Л.А. Бокерия, 1989; В.И. Маколкин, 1992, 1997).
По данным разных авторов, развитие атриомегалии у пациентов с митральным пороком сердца встречается от 0,3 % ( R . G . Armstrong et al.,1972) до 10 % случаев (М.А. Иваницкая, 1970; И.Х. Рабкин с соавт., 1975; Б.А. Константинов с соавт., 1990; G . P . Piccok et al ., 1984; D . E . Babliak et al ., 1997). J. Plaschkes et al. (1971) установил, что осложнение митрального порока развитием «гигантского левого предсердия» отмечается в 12 % случаев.
Среди других причин, ведущих к развитию увеличения левого предсердия, можно выделить патологию аорты (недостаточность, стеноз, двухстворчатый аортальный клапан, коарктация аорты), при которой возникает объемная либо тоногенная перегрузка и, как следствие, увеличение левого предсердия (0,5–3 % случаев).
Следует отметить, что увеличение левого предсердия может возникать при опухолях сердца, в частности при миксоме левого предсердия. Миксома является самой распространенной первичной доброкачественной опухолью сердца. Она имеет эндокардиальное происхождение и отличается довольно значительной подвижностью благодаря хорошо выраженной ножке. В подавляющем большинстве случаев (около 75 %) миксома локализуется в левом предсердии, реже (примерно в 18 % случаев) — в правом, прикрепляясь к межпредсердной перегородке (МПП), как правило, вблизи овального окна. Примерно в 5 % случаев опухоль исходит из свободной стенки левого или правого желудочка. Изредка встречаются множественные миксомы. Ее диаметр колеблется от 1 до 15 см . Миксома сердца довольно быстро растет, вызывая появление симптомов обструкции предсердий: левого, когда достигает примерно 7 см в диаметре, и правого, когда диаметр ее превышает 10–12 см.
В клинической картине миксомы доминируют системные проявления (субфебрилитет, снижение массы тела, анемия, увеличение СОЭ, диспротеинемия, синдром Рейно). В 30–40 % случаев возникает рецидивирующая эмболия с фрагментами опухоли и тромботическими массами в различные бассейны большого круга кровообращения (при локализации в левом предсердии), вызывая транзиторные ишемические атаки при эмболии в сосуды головного мозга, нарушения зрения (вплоть до отслойки сетчатки) при эмболии в артерии сетчатки.
При правосторонней локализации миксомы наблюдается эмболия легочных сосудов с развитием посттромбоэмболической легочной гипертензии. В некоторых случаях повышение давления в правом предсердии приводит к открытию овального окна и возникновению парадоксальных эмболий. При обтурации опухолью левого предсердно-желудочкового отверстия либо устьев легочных вен возникает синдром внутрисердечной обструкции, что проявляется развитием венозной и/или артериальной гипертензией сосудов малого круга и синдромом малого сердечного выброса. В таких случаях у больного возникают одышка, ортопноэ, кашель, кровохарканье, отек легких, сердцебиение, периферические отеки.
Изменения данных электрокардиограммы (ЭКГ) неспецифичны. Диагноз обычно устанавливают при трансторакальной эхокардиографии, которая позволяет хорошо рассмотреть форму, размеры и место прикрепления находящейся в левом предсердии опухоли на ножке.
Увеличение размеров правого предсердия, как правило, связано с патологией трехстворчатого клапана — его недостаточностью либо стенозом. При недостаточности трехстворчатого клапана он не закрывает полностью вход в правое предсердие и часть крови из правого желудочка в систолу попадает обратно в правое предсердие, вызывая его объемную перегрузку и дилатацию. Различают абсолютную (при ревматических и других поражениях клапана, когда створки клапана изменены рубцами и не могут выполнять свою функцию) и относительную (при растяжении клапанного кольца вследствие дилатации (расширения) правого желудочка при кардиомиопатиях и других поражениях мышцы правого желудочка) недостаточность трехстворчатого клапана. Стеноз правого атриовентрикулярного отверстия приводит к тоногенной перегрузке и дилатации правых отделов сердца.
У детей наиболее частой причиной атриомегалии являются врожденные пороки сердца. Среди врожденных пороков сердца увеличение правого предсердия наблюдается при дефекте межпредсердной перегородки (ДМПП), дефекте межжелудочковой перегородки (ДМЖП), аномальном дренаже легочных вен, пороках трехстворчатого клапана и клапана легочной артерии. Увеличение левого предсердия возникает при изменении направления шунта в стадии декомпенсации при ДМПП, ДМЖП, пороках митрального клапана и клапана аорты. Резкое увеличение правого предсердия наблюдается при аномалии Эбштейна.
Аномалия Эбштейна — редкий врожденный порок сердца (встречается в 0,5–1 % случаев всех ВПС), для которого характерна деформация и смещение створок (чаще задней либо септальной) трикуспидального клапана в полость правого желудочка. Смещенные створки чаще резко деформированы, истончены, хорды их укорочены, мышцы гипоплазированы. К фиброзному кольцу прикрепляется только малоизмененная передняя створка. Чаще всего она является единственной функционирующей створкой трикуспидального клапана.
Патология трехстворчатого клапана сопровождается и расширением фиброзного кольца, что приводит к выраженной недостаточности клапана. В результате смещения створок по направлению к верхушке сердца полость правого желудочка оказывается разделенной на две части. Верхняя часть, расположенная над смещенным клапаном, является «атриализованной» частью правого желудочка и образует с правым предсердием общую, большую по объему полость. Меньшая, нижняя часть располагается под смещенным клапаном и функционирует в качестве правого желудочка. Полость правого предсердия иногда расширена до гигантских размеров и может вмещать до 2–2,5 л крови. Застой крови в правых отделах сердца приводит к застою крови в большом круге кровообращения. В 80–85 % случаев при аномалии Эбштейна наблюдается межпредсердное сообщение, чаще обусловленное растяжением краев овального отверстия, реже — сопутствующим вторичным ДМПП. Такой вариант порока является более благоприятным, т.к. компенсаторно уменьшает перегрузку правых отделов сердца.
Изменения гемодинамики определяются степенью смещения и дисплазии трехстворчатого клапана, наличием или отсутствием межпредсердного сообщения. При небольшом смещении трехстворчатого клапана нарушения гемодинамики минимальны. Более значительные изменения приводят к дефициту легочного кровотока, недостаточности трехстворчатого клапана и при существовании межпредсердного сообщения — сбросу крови справа налево, кардиомегалии и постепенному развитию сердечной недостаточности.
При выраженных клинических проявлениях аномалия Эбштейна диагностируется в первые месяцы жизни ребенка. Основные жалобы: одышка, боли в сердце, снижение толерантности к физической нагрузке, возможны приступы сердцебиений (пароксизмальная тахикардия). При осмотре у 75–85 % больных выявляется диффузный цианоз, который может появиться в любом возрасте. Цианоз обусловлен сбросом крови справа налево через ДМПП. У больных с цианозом отмечаются изменения концевых фаланг рук и ног в виде «барабанных палочек» и «часовых стекол», в анализах крови — эритроцитоз, повышение гематокрита. При отсутствии ДМПП цианоза может не быть. В ряде случаев выявляется акроцианоз как проявление сердечной недостаточности.
Для аномалии Эбштейна характерна правожелудочковая недостаточность: одышка, тахикардия, увеличение печени, набухшие шейные вены и их пульсация. Она возникает иногда с первых месяцев жизни, но может появиться и очень поздно, что обусловлено степенью тяжести течения заболевания. При осмотре грудной клетки у больных с тяжелым течением определяется «сердечный горб». Верхушечный толчок смещен и определяется в V–VI межреберьях по передней аксиллярной линии (смещение за счет увеличенных правых отделов).
При аномалии Эбштейна нередко отмечается отсутствие параллелизма между выраженной кардиомегалией и незначительными жалобами, скудными аускультативными данными. При аускультации определяются глухие ослабленные тоны, 3- или 4-членный ритм, обусловленные раздвоением I–II тонов, наличием IV тона. У большинства больных выслушивается систолический шум в IV–V межреберьях слева от грудины, у мечевидного отростка, обусловленный недостаточностью трехстворчатого клапана. Шум усиливается на вдохе (шум Корвалло).
ЭКГ может быть различной, но имеет ряд характерных признаков, что часто помогает в диагностике этого порока. Электрическая ось отклонена вправо, в V1 — признаки блокады правой ножки пучка Гиса с небольшой амплитудой зубцов R и S. Зубец Р увеличен по амплитуде и продолжительности. Иногда высота зубца Р превышает амплитуду зубца R, в таких случаях прогноз заболевания плохой. Возможен синдром WPW (чаще тип В), трепетание и мерцание предсердий, приступы пароксизмальной тахикардии. Всем больным с аномалией Эбштейна показано холтеровское мониторирование для выявления нарушений ритма.
Одномерная эхокардиография (ЭхоКГ) позволяет выявить замедленное (свыше 0,03 с) закрытие трикуспидального клапана, увеличение экскурсии передней створки трикуспидального клапана, одновременную визуализацию двух атриовентрикулярных клапанов. При двухмерной ЭхоКГ можно обнаружить смещение септальной створки в полость правого желудочка в проекции 4 камер с верхушки (более 20 мм — у взрослых и 15 мм — у детей), наличие атриализированной порции правого желудочка (дистанция между смещенным клапаном и трикуспидальным кольцом), дилатацию правого атриовентрикулярного отверстия. В 85 % случаев визуализируется открытое овальное окно или ДМПП. Допплерэхокардиография выявляет недостаточность трикуспидального клапана, позволяет оценить величину легочной гипертензии.
При тяжелом течении порока смерть может наступить уже в раннем детском возрасте от сердечной недостаточности и нарушения ритма, которые могут привести к внезапной смерти. Основная масса больных умирает в 20–30-летнем возрасте. Оптимальным для операции является возраст 15–17 лет. При тяжелом течении заболевания оперируют и в возрасте до 10 лет. В настоящее время применяется радикальная операция — пластическая реконструкция трехстворчатого клапана, а при невозможности ее выполнения — протезирование клапана.
Причинами изолированного увеличения предсердий могут быть заболевания миокарда (рестриктивная кардиомиопатия — РК), а также болезни перикарда (констриктивный перикардит — КП) различной этиологии (рис. 1).
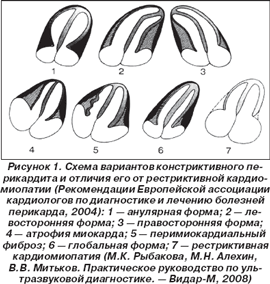
Констриктивный перикардит возникает обычно как исход острого экссудативного перикардита, но может иногда развиваться и как самостоятельное заболевание. Причинами возникновения констриктивного перикардита могут быть ревматизм, туберкулез, другие инфекции, травмы сердца и грудной клетки, заболевания крови, заболевания почек с накоплением в крови продуктов обмена мочевины. Наиболее частой причиной являются туберкулез (до 30 % всех туберкулезных перикардитов осложняются констрикцией) и бактериальные перикардиты.
При данном заболевании оба листка перикарда тесно спаиваются между собой. Потеря эластических свойств перикарда приводит к ограничению его растяжимости, вследствие этого затрудняется наполнение камер сердца в период диастолы. Развивается диастолическая дисфункция, стойко повышается венозное (может превышать 200–300 мм вод.ст.) и диастолическое давление в правом желудочке, возникает застой крови в большом круге кровообращения.
С течением времени в утолщенный и уплотненный перикард, особенно в случае его туберкулезной природы, по ходу коронарных артерий и атривентрикулярной борозды откладываются соли кальция, что приводит к формированию «панцирного сердца». В части случаев при формировании рубцовой капсулы в ней остается растяжимый участок, через который прилежащая часть стенки желудочка имеет возможность в период диастолы выбухать, обеспечивая тем самым увеличение диастолического объема полости, также происходит прогиб межжелудочковой перегородки (МЖП) в сторону более свободно расслабляющегося желудочка. Такой феномен получил название фенестрации («эффект открытого окна»).
Заболевание может протекать бессимптомно. Обращают на себя внимание цианоз щек, ушей, отечность лица и головы («консульская голова», «воротник Стокса»), пульсация шейных вен, гепатоюгулярный симптом (при надавливании в области правого подреберья набухание шейных вен усиливается). Признаки спаечного процесса можно обнаружить при внешнем осмотре. К их числу относятся систолическое втяжение области верхушечного толчка (симптом Сали — Чудновского). Стремительное заполнение кровью «распятого» на спайках сердца приводит к появлению диастолического венозного коллапса (синдром Фридрейха) и протодиастолического тона. Симптомокомплекс КП был охарактеризован триадой Бека: высокое венозное давление, асцит, малое тихое сердце.
Одышка постепенно усиливается по мере прогрессирования болезни. У некоторых пациентов развиваются ангинозные боли, неприятные ощущения, вздутие живота, увеличение печени (псевдоцирроз Пика) и селезенки (25 %). Верхушечный толчок определить, как правило, не удается. Тоны сердца приглушены, и лишь у некоторых больных бывают глухими, тахикардия. У многих больных отмечается трехчленный ритм за счет дополнительного тона в диастолическую фазу (тон послесистолического галопа).
Наиболее характерными ЭКГ-признаками КП являются: расширенный высокий зубец Р, низковольтажный комплекс QRS, отрицательный Т. Оперативное лечение приводит к немедленному повышению вольтажа и нормализации зубца Т. На эхокардиограмме обнаруживается нарушение сокращения и расслабления сердечной мышцы, усиленный сигнал от листков перикарда, что указывает на их уплотнение, увеличение предсердий при нормальном либо уменьшенном размере желудочков, парадоксальное движение МЖП и МПП влево на вдохе, дилатация нижней полой вены и печеночных вен, эффект спонтанного контрастирования, рестриктивный тип трансмитрального кровотока. На компьютерной или магнитно-резонансной томограмме выявляют утолщение перикарда, расширение полых вен, деформацию желудочков.
Рентгеноскопия грудной клетки позволяет установить только позднее распространенное обызвествление перикарда. Так же могут быть обнаружены спайки между сердцем и прилежащими органами: контур сердца приобретает зубчатый характер, сращения с диафрагмой образуют лентообразную тень, которую сравнивают с тенью наброшенного тента.
Медикаментозное лечение констриктивного перикардита бесперспективно, поэтому, когда появляются первые признаки сдавления сердца, проводится оперативное лечение. Производят перикардэктомию — оперативное удаление перикарда. Удаление части сердечной сумки неэффективно, поэтому удаляется почти весь перикард. Грудную клетку открывают, отделяют перикард от сердца, начиная с левого желудочка, и удаляют почти весь перикард, оставляя только участки, где проходит нерв.
Рестриктивная кардиомиопатия — заболевание миокарда неустановленной этиологии, которое характеризуется рестриктивным наполнением и уменьшением диастолического объема одного или обоих желудочков с нормальной систолической функцией и утолщением стенки в результате разрастания фиброзного интерстиция.
Происхождение рестриктивной кардиомиопатии остается невыясненным, как и многих из тех заболеваний, которые сопровождаются возникновением такого вида кардиомиопатий. Предполагается вирусное или наследственное происхождение.
Эта наиболее редкая форма кардиомиопатии. Она может быть как самостоятельным заболеванием (эндомиокардиальный фиброз, миокардит Леффлера, идиопатическая рестриктивная кардиомиопатия), так и одной из составляющих различных болезней. По данным Ю.М. Белозерова (2001), семейные варианты РК могут наследоваться по менделевскому типу. Генетически обусловленная РК встречается у детей при следующих заболеваниях: faciocardiorenal-синдроме, эластической псевдоксантоме, системном дефиците карнитина, синдроме Корнели де Ланге, синдроме Рубинштейна — Траубе, амилоидозе сердца, гемохроматозе, саркоидозе, поражении сердца при коллагенозах, болезни Уиппля, болезни Фабри, болезни Леффлера, склеродермии.
Поражения сердца характеризуются ригидностью стенок миокарда, что приводит к уменьшению: стенок миокарда, эластичности и растяжимости и, вследствие этого, к уменьшению диастолического наполнения желудочка, что ведет к недостаточности кровообращения, нарушению кровоснабжения и питания миокарда.
Клиническая картина РК характеризуется признаками сердечной недостаточности по лево- и правожелудочковому типу. Клинические симптомы заболевания сводятся к наличию одышки, утомляемости, слабости. Иногда при осмотре больного визуализируются акроцианоз и увеличение околоушных желез. При правожелудочковом варианте РК последствиями повышения давления в центральных венах являются асцит, увеличенная пульсирующая печень плотной консистенции и увеличенная селезенка, усиленное наполнение и пульсация яремных вен и сравнительно слабый отек в области голеностопных суставов. Границы относительной тупости сердца могут оставаться в норме либо быть расширенными. Аускультативно выслушивается на фоне ослабленных тонов ранний диастолический (III) тон. При левожелудочковом варианте поражения отмечаются симптомы левожелудочковой недостаточности с легочной гипертензией.
Выслушивается шум митральной недостаточности в сочетании с III тоном. Биветрикулярное поражение миокарда при РК характеризуется сочетанием симптомов недостаточности кровообращения по право- и левожелудочковому типу с преобладанием правожелудочковой декомпенсации. Иногда ведущим симптомом при РК является перикардиальный выпот. Описано несколько форм эндомиокардиального фиброза: аритмическая — различные нарушения ритма предсердного происхождения; перикардиальная — рецидивирующий перикардиальный выпот; псевдоцирротическая — увеличенная печень, асцит (накопление жидкости в животе); кальцинозная — кальцификация верхушки и пути оттока правого желудочка. При любой форме эндомиокардиального фиброза отмечается эозинофилия в крови. В начале болезни пациенты могут жаловаться на слабость, снижение переносимости физической нагрузки, одышку. Боль в области сердца или грудной клетки встречается редко. В дальнейшем постепенно возникает сердечная недостаточность в зависимости от места поражения эндокарда лево- или по правожелудочковому типу. Часто заболевание обнаруживается лишь тогда, когда у больного уже возникают признаки сердечной недостаточности: отеки на ногах, асцит, цианоз лица, набухание шейных вен.
Рентгенологически у больных РК обнаруживают кардиомегалию с деформацией контуров сердца либо выбухание левой границы сердца и увеличение левого и правого предсердия. Нередко выявляются кальцификаты вблизи верхушки сердца.
На ЭКГ при правожелудочковом варианте выявляют различные нарушения ритма предсердного и атриовентрикулярного происхождения. Встречается патологический зубец Q в отведениях V1–V2, увеличение вольтажа QRS, изменение сегмента ST–T. При левожелудочковом варианте РК ЭКГ регистрирует признаки гипертрофии левого желудочка, внутрижелудочковые блокады. В случае перикардиального выпота при РК наблюдается низкий вольтаж QRS и Т.
При ЭхоКГ определяют незначительную гипертрофию стенок желудочков, иногда уменьшение объема полостей желудочков, увеличение предсердий, связанное с задержкой крови в желудочках, парадоксальное движение МЖП, часто нарушения клапанного аппарата сердца, нормальную или несколько сниженную сократимость, легочную гипертензию, наличие легочной и митральной регургитации. Отношение Е/А > 2,5. При ангиокардиографии обнаруживают уменьшение размеров, неровность контуров желудочков сердца, снижение сердечного выброса. В случаях вторичной РК эффективна биопсия миокарда (рис. 2).

Эффективного лечения РК пока не найдено. Проводится симптоматическое лечение при возникновении сердечной недостаточности небольшими дозами мочегонных и дигоксина. Пересадка сердца чаще всего неэффективна, так как через некоторое время в трансплантированном сердце развивается тот же процесс: 70 % больных погибает в течение 5 лет.
1. Белозеров Ю.М., Болобиков В.В. Ультразвуковая семиотика и диагностика в кардиологии детского возраста. — М.: МЕДпресс, 2001.
2. Белозеров Ю.М. Детская кардиология. — М.: Медпресс-информ, 2004. — 600 с.
3. Митина И.Н., Бондарев Ю.И. Неинвазивная ультразвуковая диагностика врожденных пороков сердца: Атлас. — М.: Видар, 2004.
4. Мутафьян О.А. Врожденные пороки сердца у детей. — СПб.: Невский диалект, 2002.
5. Мутафьян О.А. Кардиомиопатии у детей и подростков. — С п б.: Невский диалект, 2003.
6. Рыбакова М.К., Алехин М.Н., Митьков В.В. Практическое руководство по ультразвуковой диагностике. Эхокардиография. — М.: Видар, 2008.
7. Angelini A., Calzolari V., Thiene G. et al. Morphologic spectrum of primary restrictive cardiomyopathy // Am. J. Cardiol. — Oct 15, 1997. — 80(8).
8. Nelson textbook. — 18 th ed./ Edition by Robert M. Kliegman, MD, Richard E. Behrman, MD, Hal B. Jenson, MD and Bonita F. Stanton, MD. — SAUNDERS? 2007.
9. Russo L.M., Webber S.A. Idiopathic restrictive cardiomyopathy in children // Heart. — 2005. — 91.
10. Schwefer M., Aschenbach R., Heidemann J., Mey C., Lapp H. Constrictive pericarditis, still a diagnostic challenge: comprehensive review of clinical management // Eur. J. Cardiothorac Surg. — Apr 24, 2009.
