Журнал «Здоровье ребенка» 4 (25) 2010
Вернуться к номеру
Возрастные аспекты кальциевого гомеостаза
Авторы: Рычкова Т.А., Черепахина Л.П., Луганский государственный медицинский университет
Рубрики: Педиатрия/Неонатология
Версия для печати
В статье освещены вопросы физиологической роли кальция в организме человека, становления и регуляции кальциевого гомеостаза в различные возрастные периоды. Приведены возрастные нормы потребления кальция, распространенность несбалансированного питания и его последствия для организма в возрастном аспекте.
Кальций, физиологическая роль, гомеостаз, возрастные особенности
Одним из самых значимых элементов в человеческом организме является кальций (Са), который занимает пятое место после углерода, кислорода, водорода и азота, а среди металлов, которые образуют основания (щелочи), — первое место [3]. Интерес к изучению вопросов кальциевого гомеостаза объясняется участием кальция во многих физиологических и биохимических процессах, таких как поддержание целостности и проницаемости цитоплазматических мембран, регуляция синаптической передачи, в процессах нервно-мышечной проводимости, мышечного возбуждения и сокращения, в поддержании тонуса парасимпатической, симпатической и центральной нервной системы, регуляции ряда гормональных механизмов, контроле и активации ферментативных процессов, регенерации костной ткани, процессах свертываемости крови, во взаимодействии типа клетка — клетка, где Са выступает биологическим сигнализатором, информационной молекулой для многих процессов [1, 6, 8, 10].
У детей Са определяет прочность скелета, его устойчивость к компрессии, создает условия для роста костей в длину, своевременного прорезывания зубов, способствует достижению генетически детерминированного максимального уровня костной массы (пикового), обеспечивает реализацию полуростового, пубертатного и постпубертатного скачков роста [6, 11, 17].
Становление кальциевого обмена проходит два основных этапа: внутриутробный и постнатальный, каждый из них имеет свои особенности.
На первом этапе важным фактором, модулирующим генетическую программу формирования костного обмена у ребенка, является состояние кальций-фосфорного обмена у его матери. Как известно, в организме беременной происходит перераспределение витаминов с образованием витаминных депо в плаценте, а также возрастает потребление Са на нужды развивающегося плода, особенно в III триместре беременности. В случае дефицита витамина D 3 усвояемость Са в организме беременной снижается на 90 %, а фосфора (Р) — на 60 % [5], в результате наблюдаются уменьшение массы и незрелость плода, снижается синтез остеокальцина и инсулинзависимого фактора роста, тиреотропного гормона гипофиза и пролактина. Дефицит активного метаболита витамина D 3 кальцитриола (1,25(ОН) 2 D 3 ) обусловливает уменьшение синтеза фосфатидилсерина и фосфатидилинозита, что, с одной стороны, приводит к нарушениям синтеза гидроксиапатита вследствие дефекта образования комплекса «фосфолипиды — Са — неорганический фосфор», а с другой — к уменьшению активности Са-зависимой и фосфатидилсеринзависимой протеинкиназы, которая фосфорилирует белки, обеспечивающие процессы роста и дифференцировки клеток. В результате этих нарушений рождаются дети с уменьшенной минерализацией костной ткани [9, 12, 16, 19, 20]. Если же эти процессы протекают без нарушений, то в организме здорового новорожденного будет содержаться в среднем 30 г Са, причем максимальное накопление отмечается в последние месяцы беременности — до 100–150 мг/кг в сутки [13].
После рождения в течение 2–5 дней отмечается транзиторная гипокальциемия, что объясняется функциональным гипопаратиреоидизмом. У части детей диагностируют неонатальную гипокальциемию в случае, если уровень Са в сыворотке крови ниже 1,75 ммоль/л [16].
Необходимо отметить, что на данном этапе основным источником пополнения запасов кальция в организме новорожденного является грудное молоко. Невзирая на то что содержание Са в нем в 4 раза меньше, чем в коровьем, грудное молоко имеет идеальное соотношение Са : Р, содержит лактозу, которая позволяет поддерживать оптимальную рН-среду кишечника, обеспечивает максимальную биодоступность минеральных солей, при этом коэффициент усвоения Са из женского молока составляет 60–70 %, что в 3–3,5 раза больше, чем из коровьего [2, 3].
У детей, получающих искусственное вскармливание, как и у детей старших возрастных групп, усвояемость Са из пищи значительно ниже, чем при грудном вскармливании. Это объясняется тем, что в пище и питьевой воде Са содержится в виде практически нерастворимых в водной среде соединений. Поэтому уже в ротовой полости Са, содержащийся в пище, подвергается действию специфических Са-связывающих белков, способствующих образованию растворимых комплексов. Далее в желудке происходит высвобождение Са из его комплексов за счет воздействия соляной кислоты и протеолитических ферментов (но всасывается всего 2 % Са) и в ионизированном виде он поступает в двенадцатиперстную кишку. Щелочная среда тонкого кишечника способствует образованию трудноусвояемых соединений Са, и лишь воздействие желчных кислот позволяет перевести их в легкоусвояемое состояние [3].
Усвояемость Са зависит также и от возраста. Известно, что у младенцев в тонком кишечнике всасывается до 60 % Са, у подростков — 34 %, у взрослых — 20–40 % Са, остальное количество проходит транзитом через кишечник. Всасывание осуществляется путем как простой облегченной диффузии при высоком уровне поступления Са, так и активного транспорта, преобладающего при низком уровне поступления элемента [2, 13]. Активный транспорт происходит в двенадцатиперстной кишке и проксимальном отделе тонкой кишки и зависит от содержания кальцитриола. Перенос Са против градиента концентрации сопряжен с затратой энергии и включает 3 этапа: попадание в клетку через апикальную мембрану щеточной каймы, переход через цитоплазму к базальному полюсу клетки, высвобождение из клетки через базолатеральные мембраны и поступление в кровяное русло. Далее с током крови через систему воротной вены Са поступает в печень, где на некоторое время задерживается, в результате чего происходит его относительно равномерное поступление в периферическую кровь [3].
В плазме крови Са представлен двумя фракциями: диффундирующей (ионизированный Са (45–50 %) и комплексы с различными моно- и бивалентными низкомолекулярными анионами (5–15 %)) и недиффундирующей (комплексы кальция с белками около 40–45 %) [3, 4]. При этом следует отметить, что Са в сыворотке крови создает комплексы в основном с альбуминами — до 80 %, и только около 20 % Са связывается с глобулинами, преимущественно b -фракцией. В целом белки, взаимодействующие с кальцием, можно разделить на две большие группы — мембранные белки, управляющие перемещением ионов Са через мембраны, и растворимые белки — посредники в действии кальциевого сигнала [1, 4].
Изучая активность различных форм Са в организме, исследователи установили, что физиологически активным является ионизированный Са. Его концентрация у взрослых составляет 45–47 мг/л; при этом 2/3 общего количества ионизированной фракции находится в электростатически связанном состоянии с молекулами воды, и лишь 1/3 является истинно свободной [1, 13].
Комплексно-связанный Са (вторая часть диффундирующей фракции Са) представляет собой комплексы с одно-, двух- и более валентными анионами (лактат, бикарбонат, фосфат, ацетат, сульфат, цитрат), которые участвуют в клеточных и внеклеточных транспортных процессах. Установлено, что основной комплексной фракцией Са является бикарбонат (50–80 %, что соответствует 0,10–0,14 ммоль/л) [1, 4].
Ассоциированный с белками и низкомолекулярными анионами Са физиологически инертен и играет роль своеобразного депо — его белковые и небелковые комплексы способны дополнительно связывать ионы Са при их избыточном поступлении или, наоборот, высвобождать ионы при их недостатке. Эти внутрисосудистые буферные системы являются способом экстренной регуляции, направленной на сохранение концентрации ионизированного Са в крови даже в условиях ее резких колебаний [1, 8].
Внутри клетки кальций содержится в низкой концентрации и находится в трех состояниях: Са, локализованный внутри клеточных органелл; хелатированный Са, ассоциированный с молекулой цитоплазматического белка, а также ионизированный Са, который является регулятором разнообразных клеточных процессов и обеспечивает проведение специфического трансмембранного сигнала в клетку [11]. Плазматическая мембрана покоящейся клетки относительно непроницаема для Са. В неактивную клетку Са проникает со скоростью около 4 мкмоль/(мин х кг –1 клеточной воды) под влиянием высокого трансмембранного потенциала (150 мВ, отрицательный внутри), а также по концентрационному градиенту. Из клетки Са выводится с помощью АТФ-зависимого Са-насоса, который фактически является Са 2+ -Н + -АТФазой. Эти процессы осуществляются посредством каналов трех типов — потенциалзависимых, рецептора ктивируемых и натриевых [4].
Кальциевый баланс в организме ребенка и взрослого человека также тесно связан с состоянием костной ткани и интенсивностью протекающих в ней обменных процессов. Исследователями установлено, что у растущих детей скелет полностью обновляется за 1–2 года, а у взрослых — за 10–12 лет [3]. Процессы роста и минерализации костей у детей разного возраста характеризуются динамизмом и сменой доминантного фактора регуляции. Костная ткань постоянно обновляется благодаря процессам моделирования (роста) и ремоделирования (внутренней перестройки). Скорость обновления костной ткани у детей достигает 30–100 % в год и осуществляется на 100 % ее поверхности. Это существенно отличается от перестройки костной ткани у взрослых [15].
Физиология накопления костной массы неразрывно связана с достижением так называемой пиковой костной массы, которая определяет прочность скелета на протяжении всей жизни человека. Возраст достижения пиковой костной массы до настоящего времени окончательно не выяснен [6, 12, 15]. Необходимо также отметить, что в детском возрасте преобладают процессы моделирования костной ткани, а в зрелом — на первый план выступают процессы ремоделирования. У взрослых интенсивность процессов остеосинтеза и остеорезорбции одинакова, то есть баланс Са нулевой. После 60–65 лет процесс остеорезорбции преобладает над процессом остеосинтеза и баланс Са становится отрицательным, то есть идет его естественная возрастная потеря [2]. У взрослого человека за 1 сутки из костной ткани выводится до 700 мг Са и столько же откладывается вновь. Следовательно, костная ткань, помимо опорной функции, играет роль депо кальция и фосфора, откуда организм извлекает их при недостатке поступления с пищей [3].
Гомеостаз Са в организме поддерживается сложными многофакторными процессами регуляции. К таким механизмам в первую очередь относят кальцийрегулирующие гормоны: паратгормон (ПТГ), кальцитонин (КТ) и кальцитриол.
Ведущая роль в передаче информации об уровне Са принадлежит магнийзависимой аденилатциклазе, активность которой обратно пропорциональна концентрации Са в сыворотке крови [10]. При нормальной концентрации Са в сыворотке крови отмечается постоянная базальная секреция ПТГ, вероятно, обусловленная действием катехоламинов на паращитовидные железы. Изменение уровня ионизированного Са крови на 1 % запускает механизмы, восстанавливающие равновесие. При гипокальциемии до 2,25 ммоль/л происходит линейное увеличение уровня ПТГ, уменьшение концентрации Са до 1,75 ммоль/л вызывает резкое увеличение секреции ПТГ [12]. Эффект действия ПТГ достигается через мобилизацию Са из костей в межклеточную жидкость за счет повышения активности остеокластов путем стимуляции продукции фактора активации остеокластов остеобластами, снижения активности и пролиферации остеобластов, торможения синтеза коллагена. Влияние ПТГ на почки заключается в повышении способности почечной ткани образовывать кальцитриол, а также в увеличении реабсорбции Са в дистальных и снижении реабсорбции фосфора в проксимальных канальцах [11]. При длительном воздействии ПТГ его высокая активность и быстрота регуляции уровня внеклеточного Са могли бы привести к деминерализации костей. Однако этого не происходит, так как в течение короткого промежутка времени, пока ПТГ сохраняет активность (период полураспада — около 10 мин), он инициирует долговременную стабилизацию баланса фосфата Са за счет активации кальцитриола, который выступает в роли активного ремодулятора костной ткани. Он повышает минерализацию костной ткани путем увеличения синтеза остеокальцина. С другой стороны, кальцитриол увеличивает пролиферацию остеокластов, уменьшает синтез коллагена, в результате повышается резорбция костной ткани. В почках этот метаболит повышает реабсорбцию Са и фосфора путем активации транспортных белков [12, 18].
Еще одним регулятором кальциевого гомеостаза явля ется кальцитонин — гормон, вырабатываемый С-клетками щитовидной железы и секретируемый со скоростью 13,8 мкг/сут. Продукция и секреция КТ — автоколебательный процесс, подчиненный циркадному ритму экспрессии гена КТ и связанный с отклонением концентрации ионизированного Са. При высокой концентрации секреция КТ возрастает, при низкой — снижается. КТ снижает концентрацию Са и Р в крови за счет угнетающего действия на остеокласты, а соответственно, на костную резорбцию, подавление которой ведет к снижению экскреции Са и Р в почках, посредником действия является Са-зависимая АТФаза [6, 11]. Кроме того, к факторам, регулирующим процессы костного ремоделирования, относятся другие системные гормоны — глюкокортикоиды, тироксин, половые гормоны, соматотропный гормон, инсулин, а также ростовые факторы (инсулиноподобные ростовые факторы, ростовой фактор фибробластов, трансформирующий фактор роста b , ростовой фактор тромбоцитарного происхождения, эпидермальный ростовой фактор), и наконец, местные факторы, продуцируемые непосредственно костными клетками, — простагландины, остеокластактивирующий фактор и другие [11].
Регуляция содержания кальция в организме осуществляется и за счет процессов его выведения во внешнюю среду. При этом основным путем выведения (до 80 %) является выведение с экскрементами. Установлено, что около 20 % всосавшегося Са выделяется в просвет кишечника вместе с продуктами его секреции, желчью, секретами пищеварительных желез, отмершим эпителием; значительная часть выделившегося Са подвергается повторному всасыванию, но уже в дистальных отделах кишечника. Кроме того, выделение Са осуществляется через кожу (пот, слущивающийся эпителий), а также с мочой. Выведение с мочой составляет примерно 20 % всего выводимого Са, параллельно с этим процессом идет обратная реабсорбция Са в почечных канальцах, наиболее интенсивная при условии низкого его поступления с пищей [2, 10, 12]. В физиологических условиях почки фильтруют до 275 ммоль Са в сутки, и только 0,5–1,0 % этого количества выделяется с мочой. Через клубочки фильтруется до 60 % общего Са плазмы крови, составляющего ультрафильтруемую фракцию. В проксимальном извитом канальце реабсорбируется 55–60 % фильтрационной нагрузки, причем реабсорбция Са, натрия и воды происходит параллельно. По механизму это опосредованная диффузия и трансцеллюлярный активный транспорт. В толстом восходящем сегменте петли Генле реабсорбируется 20–30 % профильтровавшегося Са. Здесь также сочетаются транспорт по электрическому градиенту и активный перенос через клетки канальцевого эпителия. В дистальном извитом канальце реабсорбируется 9 % фильтрационного заряда. В системе собирательных трубок реабсорбируется от 3 до 10 % поступающего Са. Большая часть фильтрационного заряда, входящего в этот отдел нефрона, реабсорбируется в срединных и глубоких кортикальных нефронах, имеющих обширные гранулярные сегменты. В дистальных извитых канальцах и собирательных трубках существует только активный транспорт Са [4].
Заслуживает внимания тот факт, что удивительная способность почек сохранять Са не сопровождается такой же способностью освобождать организм от избытка Са при гиперкальциемии. Это, по-видимому, результат взаимосвязи гомеостаза Са и фосфора. Фосфор реабсорбируется и экскретируется почечными канальцами. Вероятно, главенствующая роль почек в усилении экскреции фосфора ограничивает их способность к одновременной экскреции Са из-за явной опасности преципитации фосфата Са в канальцах. Таким образом, способность почек сохранять Са при гипокальциемии намного больше их способности выделять его при гиперкальциемии, что гарантирует достаточное количество Са для осуществления его разнообразных функций [6, 8].
Поддержание адекватного кальциевого гомеостаза неразрывно связано с вопросами достаточного поступления Са в организм с момента зачатия и на протяжении всей жизни человека. Особого внимания заслуживает тот факт, что низкое потребление Са ребенком может длительно не проявляться клинически. Однако впоследствии это часто становится причиной развития остеопении, остеопороза и увеличения частоты переломов в критические периоды жизни, в зрелом и пожилом возрасте [6, 15, 16].
Говоря в целом о процессах развития и становления организма, следует отметить, что потребность в Са у детей выше, чем у взрослых. Это наглядно демонстрируют среднесуточные нормы потребления Са, которые приведены в табл. 1.
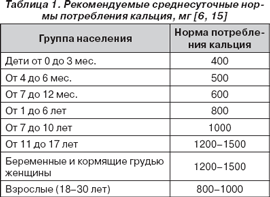
Однако, по данным украинских исследователей, около 72–80 % здоровых детей получают несбалансированное питание, в котором отмечается выраженный дефицит Са и витамина D 3 [6, 7, 11]. В России более 75 % детей потребляют недостаточно Са с продуктами питания [15].
Интересным является тот факт, что рецепторы гормонов, влияющих на гомеостаз Са в организме, располагаются и в отделах головного мозга, ответственных за пищевое поведение (сложный гипоталамо- лимбико- ретикулокортикальный комплекс). При снижении уровня Са в сыворотке крови изменение содержания гормонов приводит к тому, что человек отдает предпочтение молочным продуктам [2]. Однако неожиданный результат получен Д.Е. Шилиным — частота переломов была одинаковой как у детей, полностью избегающих молоко, так и пьющих его в среднем по 1 л в день. Данный парадокс достаточно легко объяснить тем, что в зарубежных странах, где неоднократно описано протективное воздействие молока на костные структуры, технология его производства включает обязательное обогащение витамином D — до 500 МЕ на 1 л , а наши дети получают его невитаминизированным [14]. Эти данные согласуются с данными других исследователей о необходимости адекватного обеспечения детей и взрослых не только Са, но и витамином D [7, 11].
В заключение следует отметить, что совокупность представленных данных научной литературы убедительно свидетельствует о значимой биологической роли Са в организме человека на любом этапе его жизни. Кроме того, ежегодное увеличение количества больных, страдающих как скрытой, так и клинически выраженной формой нарушений кальциевого обмена, доказывает актуальность дальнейших исследований в этом направлении с целью разработки наиболее рациональных схем профилактики и лечения данной группы заболеваний как среди взрослого, так и среди детского населения.
1. Андрианова М.Ю. Кальций крови и его фракции // Анестезиология и реаниматология. — 1995. — № 1. — С. 61-65.
2. Булатова Е.М., Габрусская Т.В., Богданова Н.М., Ялфимова Е.А. Современные представления о физиологической роли кальция в организме человека // Педиатрия. — 2007. — Т. 86, №5. — С. 117-124.
3. Буслаева Г.Н. Значение кальция для организма и влияние питания на его метаболизм // С onsilium Medicum . Приложение № 3 (Педиатрия). — 2009. — С. 4-6.
4. Григорьев А.И., Ларина И.М. Принципы организации обмена кальция // Успехи физиологических наук. — 1992. — Т. 23, № 3. — С. 24-52.
5. Жабченко И.А. Состояние кальций-фосфорного обмена и коррекция его нарушений при нормально протекающей и осложненной беременности (обзор литературы) // Здоровье женщины. — 2005. — № 3(23). — С. 34-38.
6. Квашнина Л.В. Кальций и его значение для растущего организма // Doctor . — 2003. — №2. — С. 68-70.
7. Квашніна Л.В., Апуховська Л.І., Радіонов В.П. Особливості кальцій-фосфорного обміну у здорових дітей в сучасних умовах та оптимізація методів профілактики його порушень // Перинатологія та педіатрія. — 2004. — № 1. — С. 29-32.
8. Кон P.M., Рот К.С. Ранняя диагностика болезней обмена веществ: Пер. с англ. — М.: Медицина, 1986. — С. 114-144.
9. Коровина Н.А., Захарова И.Н., Дмитриева Ю.А. Современные представления о физиологической роли витамина D у здоровых и больных детей // Педиатрия. — 2008. — Т. 87, № 4. — С. 124-130.
10. Лобода В.Ф., Кінаш М.І. Участь печінки в підтриманні кальцій-фосфорного гомеостазу в організмі // Перинатологія та педіатрія. — 2003. — № 1. — С. 52-55.
11. Лукьянова Е.М., Антипкин Ю.Г., Омельченко Л.И. и др. Роль витамина D 3 в сохранении и улучшении здоровья детей // Перинатология и педиатрия. — 2006. — № 3(27). — С. 91-96.
12. Поворознюк В.В., Лук''янова О.М., Віленський А.Б. Регуляція кальцій-фосфорного гомеостазу, формування кісткової тканини у дітей в нормі та при дії радіаційного чинника (огляд літератури) // ПАГ. — 2000. — № 1. — С. 42-48.
13. Романенко В.Д. Физиология обмена кальция. — К.: Наукова думка, 1975. — 172 с.
14. Шилин Д.Е. Эпидемиология переломов в детском возрасте: обоснование фармакологической коррекции дефицита кальция и витамина D // Педиатрия. — 2007. — Т. 3, № 3. — С. 71-79.
15. Остеопения у детей: диагностика, профилактика и коррекция: Пособие для врачей / Щеплягина Л.А., Моисеева Т.Ю., Коваленко М.В. и др. / Под ред. Л.А. Щеплягиной. — Москва, 2005. — 40 с.
16. Щеплягина Л.А., Лебедева Е.А., Моисеева Т.Ю. и др. Эффективность антенатальной профилактики дефицита кальция у младенцев // Врач. — 2008. — № 4. — С. 11-13.
17. Behrman R.E., KIiegman R.M., Jenson H.B. et al. Nelson textbook of pediatrics. — 17 th ed. — Indian Reprint by Thomson Press (India) Ltd. — 2005. — P. 208-209.
18. Christakos S., Dhawan P., Liu Y. et al. New insights into the mechanisms of vitamin D action // J. Cell Biоchem. — 2003. — № 88. — P. 695-705.
19. Mannion C.A., Gray-Donald K., Koski K.G. Association of low intake of milk and vitamin D during pregnancy with decreased birth weight // CMAJ. — 2006. — 174(9). — P. 937-95.
20. Thomas M., Weisman S.M. Calcium supplementation during pregnancy and lactation: effects on the mother and the fetus // Am. J. Obstet. Gynecol. — 2006. — 194(4). — P. 908-915.
