Журнал «Здоровье ребенка» 5 (26) 2010
Вернуться к номеру
Діагностичний тренд щодо виявлення замаскованої харчової алергії у дітей з бронхіальною астмою
Авторы: Гуцул І.В., Юрчишена Е.В., Яковець Г.М., Юрчишен О.М., Мисько Л.В., Мисько Ю.Л., Хмельницька міська дитяча лікарня, Хмельницька обласна дитяча лікарня
Рубрики: Педиатрия/Неонатология
Версия для печати
У статті висвітлено основні погляди на особливості клінічного перебігу та діагностичний пошук щодо виявлення замаскованої харчової алергії у дітей, хворих на бронхіальну астму.
Діти, діагностика, харчова алергія, бронхіальна астма.
Вступ
У контексті сучасних вимог до лікування бронхіальної астми (БА) у дітей, згідно з якими усунення контакту з факторами ризику розвитку нападів є одним із основних програмних положень [1, 4, 5], проблема виявлення замаскованої харчової алергії (ХА) у дітей з БА є актуальною. Ускладнюється цей діагностичний процесс відносною інформативністю стандартних алергологічних тестів [2, 7], що мають певні недоліки [10–12]. З огляду на вищевказане актуальним є вирішення такого питання, як визначення параклінічних алергоімунологічних маркерів трофалергії у дітей із замаскованою ХА.
Мета роботи. На основі клініко-імунологічного обстеження дітей, хворих на бронхіальну астму, розробити діагностичні критерії виявлення трофалергії для удосконалення лікувальних заходів.
Матеріал і методи
Першу (основну) групу становили 50 дітей, які хворіли на бронхіальну астму та мали клініко-анамнестичні і параклінічні прояви харчової алергії. Другу групу порівняння сформували 45 дітей із бронхіальною астмою, але без ознак харчової алергії. За основними клінічними показниками групи були порівнянними.
Результати дослідження та їх обговорення
Діагностика ХА вимагає ретельного збирання анамнезу для диференціації харчової непереносимості та істинної реакції гіперчутливості [4, 6]. При збиранні анамнезу враховують вид продукту, що викликає алергію, кількість їжі, здатну викликати реакцію; перебіг реакції у кожному конкретному випадку; тривалість проміжку між вживанням їжі та розвитком реакції; зникнення симптомів після припинення контакту з алергеном.
У багатьох роботах наведено дані про зв’язок шкірних прік-тестів та специфічного IgE сироватки крові [3, 9], асоціацію їх із тяжкістю перебігу ХА та тяжкістю БА. Діагностика ХА може так само включати проведення дієтотерапії [2, 4], яка передбачає утримання від їжі, здатної викликати алергічні прояви, впродовж 7–14 днів. У випадку збереження симптомів алергії на тлі дієти доходять висновку про безпечність даного продукту. Для одержання цієї інформації зазвичай радять вести харчовий щоденник, куди заносять усі дані про види споживаних продуктів, а також усі реакції на їх приймання. Недоліками даного методу можна вважати те, що вилучення з раціону окремих продуктів здатне викликати у дітей різноманітні розлади травлення та при тривалому вилученні (впродовж одного року і більше) з дієти причинних алергенів у дітей у сироватці крові все ж присутні специфічні IgE-антитіла.
Серед лабораторних методів найбільш інформативними вважаються імунологічні, наприклад метод імуноферментного аналізу (ІФА), за допомогою якого виявляють з великою вірогідністю специфічні IgE-антитіла до різних харчових алергенів [9] і який використовують у випадках тяжкого атопічного дерматиту чи за наявності вираженого дермографізму.
У результаті вивчення анамнезу захворювання у групах порівняння нами виявлена тенденція до тривалішого перебігу БА у пацієнтів І групи. Так, тривалість хвороби менше одного року у І групі зареєстровано у 21,4 ± 3,9 % випадків, у ІІ групі — у 33,9 ± 4,5 % спостережень (Р < 0,05). Вказану особливість перебігу БА у дітей з ХА пояснювали більш раннім дебютом клінічних проявів атопії [4] у вигляді бронхообструктивного синдрому у дітей з ХА, що відображало «алергічний марш» дитини до респіраторних проявів ХА та зміну органів-мішеней БА.
У табл. 1 наведені результати вивчення власного алергоанамнезу дітей груп порівняння з оцінкою частоти індивідуальної непереносимості окремих продуктів у дітей.
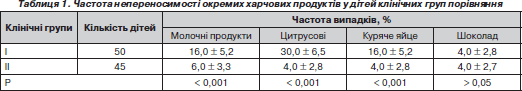
Таким чином, за винятком шоколаду у дітей основної клінічної групи спостерігалося вірогідне переважання випадків індивідуальної непереносимості окремих харчових продуктів, що відображало коректність формування клінічних груп спостереження.
Показники діагностичної цінності позитивного алергоанамнезу обстежених дітей щодо виявлення в них ознак харчової алергії були такі: чутливість (Se) тесту становила 84,0 %, специфічність (Sp) — 78,0 %, позитивна (PV(+)) та негативна (PV(–)) передбачувана цінність відповідно дорівнювали 79,7 та 82,5 %. Таким чином, даний тест у виявленні ХА в пацієнтів із БА був більш чутливим, ніж специфічним, що зумовлювалося хибнопозитивними результатами у 22 % випадків, які пояснювалися наявністю в дітей харчової непереносимості, що імітувала алергію на продукти.
Діагностика ХА у дітей — це складне завдання, зумовлене як наявністю численних «масок» даного захворювання [2], так і можливістю замаскованого перебігу даної патології. За результатами проведення алергопроб із харчовими алергенами у дітей груп порівняння встановлено, що в І групі позитивні відповіді реєструвалися у 93,8 ± 2,3 % випадків, у ІІ групі — лише в 19,3 ± 3,78 % спостережень (Р < 0,001). Наявність майже у кожної п’ятої дитини ІІ клінічної групи позитивної відповіді при введенні стандартних трофалергенів пояснювали з позицій можливих хибнопозитивних результатів за умови неспецифічної чутливості шкіри у дітей з атопічною реактивністю організму.
При проведенні шкірних алергопроб з побутовими алергенами (пір’я, пух, домашній пил) отримані дані збігалися з попередніми. Так, у І групі позитивні відповіді реєструвалися в 66,0 ± 4,8 % спостережень, у ІІ групі — в 51,2 ± 4,5 % випадків (Р < 0,05). Серед пацієнтів І групи дітей з позитивною відповіддю як на харчові, так і на побутові алергени було 75,9 ± 3,4 %, у ІІ групі у 17,4 ± 4,0 % (Р < 0,001).
З огляду на отримані дані уявлялося доцільним визначити діагностичну цінність та показники клініко-епідеміологічного ризику позитивних шкірних алергопроб за прік-тестом до харчових продуктів щодо наявності ХА у дітей груп порівняння (табл. 2).

Таким чином, у визначенні ХА позитивні шкірні алергопроби з харчовими алергенами виявилися високочутливими за рахунок лише 6,3 % хибнонегативних результатів, із середньою специфічністю — за рахунок 19,3 % хибнопозитивних результатів. Якщо перша їх властивість свідчила на користь коректно сформованих клінічних груп спостереження, то друга лише підтверджувала можливість полівалентної чи перехресної алергії у дітей з нехарчовими алергенами, що знижувало діагностичну цінність даного методу виявлення замаскованої ХА.
Нами було оцінено діагностичну цінність гіперергічного характеру шкірної відповіді на введення харчових алергенів щодо виявлення ХА у дітей. Показники діагностичної цінності гіперергічних шкірних проб із трофалергенами наведені в табл. 3.
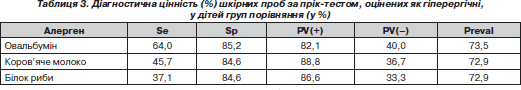
Отже, гіперергічні шкірні проби із трофалергенами, маючи достатньо високу специфічність, можуть використовуватися для поглибленого обстеження пацієнтів груп ризику щодо ХА внаслідок їхньої достатньої специфічності за рахунок невеликої кількості хибнопозитивних результатів — 14,8 % для овальбуміну, 16,4 % для коров’ячого молока та 16,4 % для білка риби. Недостатня їхня чутливість пов’язана з наявними хибнонегативними результатами (36 % для овальбуміну, 54,3 % для коров’ячого молока та 63,9 % для білка риби), які, можливо, віддзеркалювали стан стійкої ремісії, або ж фіксацію антитіл-реагінів у інших «шокових» органах, що не виключало наявності замаскованої ХА. Присутність у 15 % випадків хибнопозитивних результатів пояснювали неспецифічною шкірною чутливістю у дітей ІІ групи та можливістю полівалентної сенсибілізації з нехарчовими алергенами.
Широковідомий так званий «алергічний марш» у дітей з атопічною реактивністю організму, що супроводжується зміною «шокового» органу по мірі зростання дитини [2, 4]. Вважається, що ХА є лише «стартом» у розвитку сенсибілізації дитини, на тлі якої, у зв’язку з подібністю антигенних структур харчових і нехарчових алергенів, а також наявністю перехресних реакцій розвивається гіперчутливість до інших видів алергенів із розвитком полівалентної алергії [10]. З огляду на це вивчено характер відповідей на проведення шкірних алергопроб із побутовими алергенами — пір’ям, пухом, домашнім пилом. У табл. 4 подано оцінку результатів проведення шкірних алергопроб за прік-тестом з антигенами пуху та пір’я у пацієнтів груп порівняння.

Таким чином, тенденції, виявлені нами при проведенні шкірних алергопроб з харчовими стандартними алергенами, підтвердилися і при використанні побутових алергенів, що свідчило про формування у дітей І групи полівалентної алергії і нашарування нехарчової алергії з переважанням гіперергічних відповідей на шкірне введення алергенів, що збігалося з літературними даними [8].
У табл. 5 подано результати проведення шкірних алергопроб за прік-тестом з домашнім пилом у дітей клінічних груп порівняння.
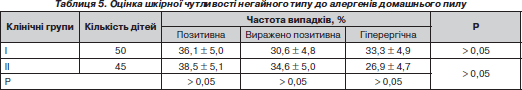
Щодо формування полівалентної алергії до домашнього пилу у дітей з ХА, то наша гіпотеза не отримала свого підтвердження, як у випадку використання інших побутових алергенів, що можна пояснити швидким та домінуючим розвитком сенсибілізації до домашнього пилу.
Таким чином, проведені дослідження з вивчення особливостей шкірної чутливості до харчових алергенів у пацієнтів груп спостереження дозволяють дійти висновку, що незважаючи на те, що гіперергічні відповіді на введення стандартних трофалергенів були однією з групоформуючих ознак, усе частіше в основній групі реєструвалися випадки різкопозитивних шкірних проб із побутовими алергенами. Цей факт відображав вищий рівень сенсибілізації дітей І групи у вигляді полівалентної або перехресної алергії і негативно впливав на показники специфічності даного тесту, що у 20 % випадків мав хибнопозитивні результати. Це свідчило про добру чутливість, ніж специфічність даного діагностичного методу, і підкреслювало його ефективність у діагностиці ХА на етапі первинного скринінгу.
ХА супроводжується підвищеною продукцією загального, а також специфічних імуноглобулінів класу Е (IgE), що, фіксуючись на тучних клітинах і базофілах, при наступних контактах з причинно-значущими алергенами запускають негайну фазу алергічного запалення. З огляду на це нами оцінено вміст специфічних до харчових алергенів IgE у дітей груп порівняння. Так, у пацієнтів І групи специфічні IgE до трофалергенів виявлені у 87,3 ± 4,7 % випадків, у ІІ групі вони реєструвалися у 2 дітей, що становило 4,0 ± 2,7 % спостережень (Р < 0,001) і збігалося з літературними даними [9]. Так, до білка яйця в І групі специфічні IgE-антитіла, виявлені в 63,0 ± 6,8 % випадків, гідролізатів коров’ячого молока — у 48,0 ± 7,1 %, до білка риби — в 20,0 ± 5,6 % спостережень. Низький відсоток дітей із наявними алергенспецифічними IgE до білка риби пояснювався раннім віком дітей, для яких риба як продукт харчування має менше значення на відміну від коров’ячого молока та яєць [10]. Наведені показники у пацієнтів ІІ клінічної групи обмежувалися лише наявними алергенспецифічними ІgЕ-антитілами до білка яйця, що відповідно дорівнювало 4,0 ± 2,7 % (Р < 0,05).
Отже, переважання специфічних IgE-антитіл відображало коректність формування клінічних груп, незважаючи на стан клінічної ремісії щодо проявів ХА у пацієнтів І групи. Існують дані про залежність рівня IgE в сироватці крові від тривалості захворювання, ступеня тяжкості і поширеності шкірних уражень. Цей факт впливав на наявність у І групі у 12,7 ± 4,7% випадків негативних відповідей при вивченні вмісту алергенспецифічних IgE-антитіл до трофалергенів, причому у ІІ групі кількість негативних відповідей становила 96,0 ± 4,7 % (Р < 0,001). Лише у дітей І групи спостерігались ознаки полівалентної ХА, що виражалося наявністю специфічних IgE до двох трофалергенів та більше. Так, позитивні відповіді при вивченні даного показника щодо трьох алергенів виявлялися у дітей І групи у 60,0 ± 6,9 % випадків, до двох харчових алергенів — у 16,0 ± 5,2 % спостережень. Специфічні IgE лише до одного харчового алергену реєструвались у І групі в 24,0 ± 6,0 % випадків, у ІІ групі — в 4,0 ± 2,8 % спостережень (Р < 0,001).
Таким чином, у дітей, які сформували І групу, спостерігалися переважання за вмістом алергенспецифічних до трофалергенів IgE-антитіл та полівалентна сенсибілізація до харчових продуктів. Позитивні результати цього імунологічного обстеження мали вірогідні, але непереконливі кореляційні зв’язки з позитивними шкірними пробами з причинно-значущими алергенами. Ці обставини потребували подальшого вивчення діагностичної цінності позитивних алергенспецифічних IgE-антитіл у виявленні замаскованої ХА у пацієнтів. Результати цього дослідження наведені в табл. 6.
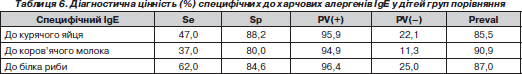
Таким чином, показники діагностичної цінності визначення специфічного IgЕ в сироватці крові дітей на відміну від шкірних алергопроб з трофалергенами, оцінених, як гіперергічні, характеризувалися більшою специфічністю, але меншою чутливістю, що робить доцільним їх використання у випадках, коли є протипоказання до проведення шкірних алергопроб із прік-тестом на етапі поглибленого обстеження пацієнтів груп ризику. Наявні у 12–20 % випадків хибнопозитивні результати при проведенні даного тесту відображали полівалентну алергію у дітей, хворих на БА. Наявність у сироватці крові алергенспецифічних IgE-антитіл до компонентів їжі була найбільш специфічним, але малочутливим тестом у виявленні замаскованої ХА. Але при застосуванні даного методу виявлено приблизно у 12 % випадків хибнопозитивні результати, що пояснювалося перехресним характером алергічного процесу у пацієнтів ІІ групи.
Для цього діагностичного комплексу характерні такі показники діагностичної цінності у виявленні ХА в пацієнтів, хворих на БА: чутливість тесту — 77,7 %, специфічність — 92,7 %, позитивна передбачувана цінність — 91,6 %, негативна передбачувана цінність — 80,2 %, точність методу — 85,1 %.
Отже, у верифікації замаскованої ХА слід використовувати діагностичний тренд від чутливих до специфічних методів, які підвищують точність і передбачувану цінність такого методу.
Висновки
1. Результати проведеного аналізу діагностичної цінності анамнестичних та алергоімунологічних методів дослідження у виявленні харчової алергії у дітей, хворих на бронхіальну астму, показали, що всі вони, окремо взяті, не можуть забезпечити одночасної сенситивності та специфічності у випадках, коли харчова алергія має замаскований перебіг.
2. Серед алергологічних досліджень найбільш чутливим тестом у виявленні замаскованої харчової алергії слід вважати позитивні шкірні проби з харчовими алергенами, що мають найнижчий відсоток хибнонегативних результатів.
3. Наростання тяжкості місцевої реакції при проведенні шкірних алергопроб супроводжується підвищенням частоти розвитку полівалентної (харчової та побутової) алергії у пацієнтів груп порівняння.
4. Визначення специфічного IgE доцільно використовувати при поширеному запальному процесі на шкірі, коли використання шкірних проб недоцільне.
5. Найдоцільніше для діагностики замаскованої харчової алергії використовувати діагностичний тренд від чутливих (позитивний алергоанамнез) до специфічних (позитивні шкірні проби з трофалергенами, наявність специфічних IgE до харчових продуктів) методів.
1. Банадига Н.В. Атопічний дерматит з позиції педіатра // Здоровье ребенка. — 2008. — № 4(13). — С. 86-89.
2. Ласиця О.І., Ласиця Т.С., Недельська С.М. Алергологія дитячого віку. — К.: Книга плюс. — 2004. — 368 с.
3. Ласиця О.І. Специфічна діагностика алергічних захворювань у дітей: Метод. рекомендації для лікарів-інтернів, лікарів загальної практики та лікарів-алергологів / За ред. О.І. Ласиці, С.М. Недельської. — КМАПО, Запорізький державний медичний університет. — Запоріжжя, 2002. — 67 с.
4. Чоп’як В.В., Головін Р.Р., Насадюк Х.М. Харчова алергія // Клінічна імунологія. Алергологія. Інфектологія. — 2008. — № 5(16). — С. 22-26.
5. Калюжная Л.Д. Атопический дерматит // Клінічна імунологія. Алергологія. Інфектологія. — 2006. — № 1(02). — С. 19-22.
6. Пампура А.Н., Чебуркин А.А., Смолкин Ю.С. Ключевые вопросы диагностики и лечения атопического дерматита у детей // Педиатрия. — 2000. — № 4. — С. 93-96.
7. Ревякина В.А. Общие принципы диагностики и лечения пищевой аллергии у детей // Русский медицинский журнал. — 2000. — Т. 8, № 18(119). — С. 739-745.
8. Смирнова Г.И. Диагностика и современные методы лечения аллергодерматозов у детей // Российский педиатрический журнал. — 2002. — № 3. — С. 40-44.
9. Тузанкина И.А., Синявская О.А., Шершнев В.М. Определение аллергенспецифического IgE в диагностике атопических заболеваний у детей // Клин. лабор. диагностика. — 1997. — № 12. — С. 44-48.
10. Bischoff S.C. et al. Food allergies. // Interhist (Berl.). — 2001 Aug. — Vol. 42, № 8. — P. 1108-1117.
11. Kanny G., Beaudouin E., Moneret-Vautrin D.A. Atopic dermatitis and food allergy // Rev. fr. Allergol. et Immunol. Clin. — 2000. — Vol. 40, № 6. — P. 606-611.
12. Monti G., Muratore M.C., Peltran A., Bonfante G., Si L., Oggero R., Mussa G.C. High incidence of adverse reactions to egg children on first known exposure in young atopic dermatitis: predictive value of skin prick test a radioallergosorbent test to egg proteins // Clin. Exp. Allergy. — 2002 Oct. — Vol. 32, № 10. — P. 1515-1519.
13. Rance F., Dutan G. Asthma and food allergy: report of 163 pediatric cases // Arch. Pediatr. — 2002 Aug. — Vol. 9, Suppl . 3. — P. 402-407.
