Журнал «Здоровье ребенка» 5 (26) 2010
Вернуться к номеру
Молекулярно-генетические механизмы развития и современные методы лечения легочной артериальной гипертензии у детей 4. Лечение детей с легочной артериальной гипертензией
Авторы: Волосовец А.П.1, Абатуров А.Е.2, Герасименко О.Н.2, Высочина И.Л.2, 1Национальный медицинский университет им. А.А. Богомольца, 2Днепропетровская государственная медицинская академия
Рубрики: Педиатрия/Неонатология
Версия для печати
В статье представлены современные патогенетические методы лечения легочной артериальной гипертензии (ЛАГ) у детей — респираторная, антикоагуляционная и вазодилатационная терапия. Подробно рассматриваются разрабатываемые подходы к лечению ЛАГ — антипролиферативная, проапоптотическая и клеточная терапия, усиливающая васкуляризацию легочной ткани. Представлен алгоритм медикаментозного лечения детей с ЛАГ.
Легочная артериальная гипертензия, лечение, дети.
Сокращения: АМФ (аденозинмонофосфат), ГМФ (гуанозинмонофосфат), ЛАГ (легочная артериальная гипертензия), ИЛАГ (идиопатическая ЛАГ), ОФП (острая фармакологическая проба), СЛАГ (семейная ЛАГ), цГМФ (циклический гуанозинмонофосфат), ЭПК (эндотелиальные прогенеративные клетки), EDNR (эндотелиновый рецептор), ET (эндотелин), FDA (Администрация контроля продуктов питания и лекарственных веществ США), HGF (фактор роста гепатоцитов), HIF (индуцибельный гипоксией фактор), NO (монооксид азота), NOS (нитрооксидсинтаза), PDEV (фосфодиэстераза V), PDGF (тромбоцитарный фактор роста), ROC (receptor-operated cation channels/рецепторуправляемые каналы), sGC (солютабная гуанилатциклаза), SOC (store-operated channels/резервуправляемые каналы), TXA2 (тромбоксан A2), VEGF (сосудистый эндотелиальный фактор роста), VIP (вазоактивный интестинальный пептид).
Введение
Легочная артериальная гипертензия, в основе которой лежат различные молекулярно-патогенетические механизмы, приводящие к вазоконстрикции и облитерации сосудов легочной ткани, является тяжелой патологией человека, характеризующейся быстро прогрессирующей правожелудочковой сердечной недостаточностью и высоким уровнем ранней летальности. При отсутствии эффективных методов лечения средняя продолжительность жизни больных с ЛАГ от появления первых признаков заболевания составляет 2–3 года [29, 32, 61, 112]. Современные методы лечения позволяют достоверно увеличить пятилетнюю выживаемость больных с ЛАГ. Так, в Японии уровень пятилетнего выживания пациентов с ИЛАГ за последние четыре года увеличился и составляет 91 % [23, 22, 37, 60, 110].
Основными направлениями патогенетического лечения легочной артериальной гипертензии являются:
1) ограничение изометрических физических нагрузок;
2) профилактика и лечение инфекций бронхопульмональной системы;
3) респираторная, антикоагуляционная и вазодилатационная терапия (табл. 1) [1, 6].

Профилактика острых респираторных инфекций
В целях профилактики острых респираторных инфекций детям с ЛАГ рекомендуются охранительный режим и минимизация контактов с инфекционными больными. Дети раннего возраста нуждаются в профилактическом назначении паливизумаба (synagis), который представляет собой гуманизированные моноклональные антитела к респираторно-синцитиальному вирусу (по 15 мг/кг внутримышечно) для предупреждения респираторных инфекций, вызванных респираторно-синцитиальным вирусом, а также противогриппозной и антипневмококковой вакцин [57, 59, 64, 74, 84].
Респираторная терапия
Назначение кислорода показано всем больным с ЛАГ при любых ее формах; исключением является ЛАГ, возникшая на фоне врожденных пороков сердца с рефрактерной к кислородотерапии гипоксемией (при шунтировании крови справа налево). Больным с ЛАГ рекомендуется длительная (12–15 ч/сут) или постоянная кислородотерапия (2 л/мин), которая позволяет поддерживать сатурацию кислородом на уровне 90 %. Однако у больных с синдромом Эйзенменгера и ИЛАГ отмечается низкая эффективность кислородотерапии. В то же время считают, что у данных групп больных применение кислородотерапии в ночное время предупреждает развитие полицитемии [20, 101].
Медикаментозная терапия
Общая терапия
Антикоагулянты и дезагреганты
В отличие от взрослых у детей с ЛАГ антикоагулянты применяются только при высоком риске развития венозных тромбоэмболий [134]. Препаратами выбора для проведения антикоагуляционной терапии у детей с легочной артериальной гипертензией являются варфарин и гепарин. Не исключено назначение ацетилсалициловой кислоты [51, 62, 109].
Диуретики
Мочегонные препараты не рекомендуют использовать у детей с ЛАГ как рутинную терапию, их назначение показано при развитии декомпенсации [104]. Применяются петлевые диуретики — фуросемид, торасемид в сочетании с антагонистом альдостерона — спиронолактоном [131].
Патогенетическая терапия
Основными лекарственными средствами, действие которых обеспечивает дилатацию легочных артерий, являются: антагонисты кальциевых каналов, аналоги простациклина, антагонисты эндотелиновых рецепторов, ингибиторы фосфодиэстеразы V, монооксид азота [62, 95, 108, 131].
Антагонисты кальция
Антагонисты кальция в истории медикаментозного лечения первичной легочной артериальной гипертензии были первыми лекарственными средствами, предложенными для достижения вазодилатационной терапии [55, 105]. В основе фармакологического действия антагонистов кальция лежит их способность ингибировать прохождение ионов кальция через мембранные потенциалзависимые кальциевые каналы во внутреннее пространство клеток, что приводит к снижению внутриклеточной концентрации ионов Са2+, предопределяя развитие релаксации гладкомышечных клеток [3]. Производные дигидропиридина преимущественно блокируют цитоплазматические кальциевые каналы гладких мышц сосудов, в связи с чем при легочной артериальной гипертензии наиболее часто используются амлодипин, исрадипин, лацидипин, нифедипин (табл. 2) [128].

Антагонисты кальция назначают исключительно больным с ЛАГ, которые отвечают на острое применение вазодилататоров. Терапия антагонистами кальция показана пациентам с сатурацией венозной крови более 63 % и/или давлением в правом предсердии менее 10 мм рт.ст. и с положительным ответом на острое назначение вазодилататора. Острая фармакологическая проба проводится с использованием короткодействующих вазодилататоров — простагландина Е1 и NO — во время катетеризации правых отделов сердца и легочной артерии. Снижение среднего уровня давления в легочной артерии более чем на 10 мм рт.ст. при увеличении или отсутствии динамики сердечного выброса является признаком положительной пробы, позволяющей рекомендовать назначение антагонистов кальция. При сатурации венозной крови менее 63 % и/или давлении в правом предсердии более 10 мм рт.ст. антагонисты кальция абсолютно противопоказаны [5, 6].
Пациентам с ЛАГ с брадикардией рекомендуется назначение антагонистов кальция дигидропиридинового ряда, с тахикардией — дилтиазема [5, 79]. Однако контингент больных с ЛАГ, которые отвечают на применение антагонистов кальция, составляет 13–27 %, с ИЛАГ — менее 10 %, у детей эффективность и безопасность данной терапии не доказаны [84, 104].
Простациклин и его аналоги
Простациклины (простагландин I2 и простагландин E1) и TXA2 являются метаболитами арахидоновой кислоты и принадлежат к семейству эйкозаноидов, которые продуцируются сосудистым эндотелием. Простациклин, благодаря способности стимулировать продукцию цАМФ, обладает мощным сосудорасширяющим, антипролиферативным, цитопротекторным и антиагрегирующим действием [56, 84, 90, 109]. У больных с первичной легочной гипертензией преобладает синтез антагониста простациклина TXA2, который вызывает вазоконстрикцию и агрегацию тромбоцитов [48]. Терапия простагландинами показана пациентам с ИЛАГ, ЛАГ, индуцированной аноректическими средствами, при ЛАГ у больных с заболеваниями соединительной ткани, врожденными пороками сердца, портальной гипертензией, саркоидозом, ВИЧ-инфекцией, хронической тромбоэмболической ЛАГ при III или IV ФК (NYHA), при рO2 в крови легочной артерии менее 63 % и/или давлении в правом предсердии более 10 мм рт.cт. [5].
В 1995 году FDA было рекомендовано использовать эпопростенол для лечения больных с ИЛАГ (III и IV ФК по NYHA). И по настоящее время самой эффективной терапией для данной группы больных считают непрерывное внутривенное введение эпопростенола (простагландин I2). Терапия эпопростенолом показана и для других типов ЛАГ. Период полураспада эпопростенола составляет 3–5 минут. Показанием для назначения эпопростенола (флолан) является III и IV ФК по NYHA. Стартовая доза составляет 2 нг/кг/мин, в дальнейшем дозу повышают на 2 нг/кг/мин каждые 15 минут до максимально переносимой дозы [40, 71, 85]. Терапевтическая доза варьирует от 21 ± 7 нг/кг/мин на протяжении первого года лечения и до 32 ± 10 нг/кг/мин после 41 месяца [62]. К сожалению, лечение эпопростенолом является технически сложной, очень дорогостоящей терапией (около 100 000 US$ в год) и сопровождается выраженными побочными эффектами — головной болью, мышечной болью в нижних конечностях, тошнотой, диареей, аллергической сыпью [84]. Трехлетнее выживание больных с ИЛАГ, получавших лечение эпопростенолом, составляет 63 % [85]. Алпростадил (алпростан, вазапростан, каверджект) — простагландин E1 — разработан для внутривенного применения у новорожденных с увеличенным давлением в малом круге кровообращения. Однако алпростадил в 6 раз менее эффективен, чем эпопростенол [119].
Более устойчивый аналог простациклина c периодом полураспада 4 часа — трепростинил (remodulin), который применяется как внутривенно, так и подкожно. Лечение начинают с инициирующей дозы — 2 нг/кг/мин. В последующем дозу трепростинила постепенно повышают до оптимальной. Максимальная доза составляет 80 нг/кг/мин. Для применения у взрослых трепростинил в США был одобрен в 2004 году. В связи с выраженными побочными эффектами, такими как головная боль и боль в нижних конечностях, не был рекомендован для использования в педиатрической практике [35, 73, 86, 99, 120].
Одним из последних аналогов простациклина является берапрост, разработанный для применения внутрь, однако не получивший рекомендации для применения у детей [24, 44, 72].
Илопрост (иломедин, ventavis, actelion) — аналог простациклина для ингаляционного применения (был рекомендован FDA для использования при лечении ЛАГ в 2004 году). Назначается каждые 2 часа. Максимальная суточная доза составляет 45 мкг. Показано, что применение как коротких, так и пролонгированных курсов илопроста у детей характеризуется достаточно хорошим профилем эффективности и безопасности [33, 68, 78, 117].
В последнее время был синтезирован простациклин ONO-1301, обладающий способностью ингибировать тромбоксансинтетазу. ONO-1301 индуцирует продукцию HGF, VEGF, активирующих ангиогенез [15].
Антагонисты эндотелиновых рецепторов
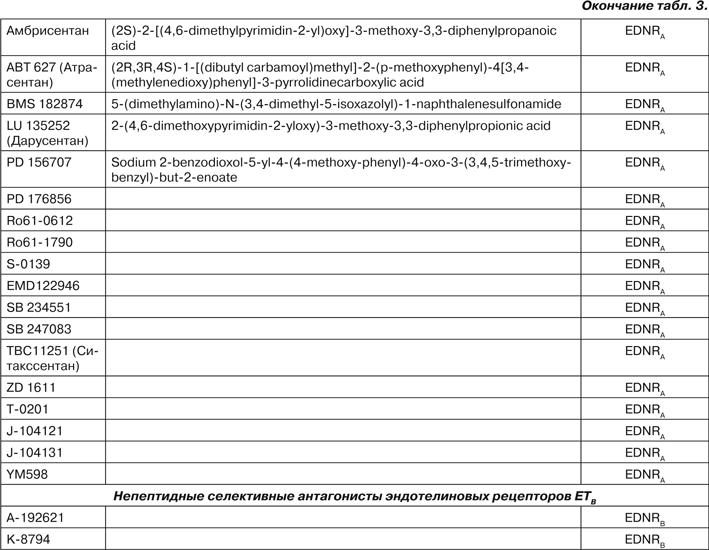
Учитывая, что эндотелин-1, который высоко экспрессирован в ткани легкого у больных ЛАГ, является одним из самых мощных факторов вазоконстрикции и активаторов пролиферации как фибробластов, так и клеток гладких мышц, в терапии ЛАГ используют блокаторы его рецепторов. Блокаторы рецепторов эндотелина уменьшают тонус артерий, что обусловливает снижение периферического сосудистого сопротивления, системного давления и давления в малом круге кровообращения, препятствуют облитерации легочных сосудов. Различают неселективные и селективные антагонисты эндотелиновых рецепторов (табл. 3) [14, 21, 36, 63, 66, 94].
В настоящее время для использования при лечении ЛАГ рекомендовано три антагониста рецепторов эндотелина — двойной антагонист рецепторов эндотелина босентан (tracleer) и два селективных антагониста рецепторов эндотелина для применения внутрь амбрисентан (letairis), ситакссентан (thelin) [41, 45, 76, 100].
В 2001 году FDA для лечения больных с легочной артериальной гипертензией (III и IV ФК по NYHA) был рекомендован босентан, обладающий аффинитетом к различным типам рецепторов эндотелина в соотношении EDNRA : EDNRB = 40 : 1 [26, 50, 122]. Двухлетняя выживаемость пациентов с ИЛАГ, получавших лечение босентаном, составляет 87–89 % [77].
Показано, что назначение босентана внутрь одновременно с эпопростенолом или без него безопасно и эффективно у детей в дозах, соответствующих возрасту (табл. 4). Детям, у которых легочная артериальная гипертензия развилась после пересадки костного мозга, босентан противопоказан, так как он взаимодействует с циклоспорином [45, 76].

Селективный антагонист эндотелинового рецептора A амбрисентан был рекомендован FDA в 2007 году для использования при лечении больных с ИЛАГ (II и III ФК). Препарат назначают внутрь в суточной дозе 5–10 мг [36, 84]. Селективный антагонист эндотелиновых рецепторов А ситакссентан, обладающий аффинитетом к рецепторам эндотелина в соотношении EDNRA : EDNRB = 6000 : 1, получил одобрение для использования в клинической практике в Канаде (2007) и Европе (2006). Назначают внутрь по 100 мг в сутки. Однако в педиатрической практике оба эти препарата не применяются [14, 27, 104].
Ингибиторы фосфодиэстеразы V
Фосфодиэстераза V входит в семейство 11 фосфодиэстераз (металлофосфогидролаз). PDEV экспрессируется в ткани пещеристых тел, пищеварительном тракте, в миоцитах сосудов внутренних органов и тромбоцитах, участвуя в регуляции гладкомышечного тонуса, агрегации тромбоцитов, эрекции [37, 97, 111]. PDEV находится в антагонистических взаимоотношениях с NO. Известно, что NO, продуцируемый эндотелиальной NOS, индуцирует внутриклеточную sGC, обусловливая увеличение концентрации цГМФ, а PDEV специфически гидролизирует цГМФ в 5'-ГМФ, снижая внутриклеточный уровень концентрации цГМФ. Флуктуации внутриклеточной концентрации цГМФ регулируют сокращение мышц. Под влиянием цГМФ происходит открытие BKCa каналов, что приводит к снижению цитозольного Ca2+ и расслаблению миоцитов. К ингибиторам PDEV относятся следующие лекарственные средства — ролипрам, кофеин, теофиллин, цилостамид, дипиридамол, запринаст, силденафил. Данные ингибиторы PDEV представлены в порядке увеличения селективности [2, 53].
В настоящее время в клинической практике используется селективный конкурентный ингибитор PDEV силденафил, и проходят испытания тадалафил, варденафил (табл. 5).

Силденафил (первоначальное название UK-92,480) — один из первых препаратов данной группы, который был применен у детей с ЛАГ (2005) [59]. Силденафил (виагра, супервита, потенциале и др.) — селективный и мощный ингибитор PDEV, предотвращающий деградацию цГМФ, что приводит к релаксации гладких мышц сосудистых стенок, обусловливая снижение как сосудистого сопротивления в малом круге кровообращения, так и перегрузки правого желудочка. Основными побочными эффектами при использовании высоких доз силденафила являются эрекция у мальчиков и системная гипотензия. Силденафил назначают больным ЛАГ при неэффективности предшествующей медикаментозной терапии внутрь в дозе 0,5–1,0 мг/кг три-четыре раза в день [8, 18, 23, 80, 111, 115]. Средняя годовая стоимость терапии при использовании силденафила составляет 12 000 US$ [84].
Монооксид азота
Моноoксид азота, активируя гуанилатциклазу, повышает уровень цГМФ, который индуцирует релаксацию гладких мышц сосудистой стенки [134]. Рекомендованный для использования в клинической практике FDA в 1999 году, NO применяется при различных формах ЛАГ. NO назначают ингаляторно — 20–40 ppm в течение 5–6 часов в сутки 2– 3-недельными курсами. Однако высокая стоимость терапии (100 US$/час) ограничивает широкое применение NO [67, 68, 81, 92].
Комбинированная терапия
В различных исследованиях приведены вариации комбинированного лечения ЛАГ — сочетание босентана с илопростом, сочетания силденафила с эпопростенолом, босентаном, берапростом, илопростом, ингаляциями NO (80 ppm), босентаном и илопростом [2, 89, 104, 108].
Оперативное лечение
Предсердная септостомия
Предсердная баллонная септостомия (перфорация в межпредсердной перегородке) рекомендуется при выраженной правожелудочковой сердечной недостаточности при неэффективности медикаментозного лечения [131].
Трансплантация легкого
Неэффективность медикаментозной терапии является показанием для трансплантации легкого. Средняя продолжительность жизни у детей после трансплантации легкого составляет 4,3 года [103].
Разрабатываемые подходы к лечению
Вазодилатационная терапия
Разрабатываются препараты, заменяющие NO и несущие значительно меньший риск как продукции токсических активных радикалов азота, так и возникновения метгемоглобинемии. Проходит испытание этилнитрат (ENO2), и хотя его вазодилатирующий эффект приблизительно в 100 раз меньше NO, ингаляторное применение достоверно снижает давление в легочной артерии [7]. Предложено ингаляторное введение аэрозоля аденовирусных векторов со встроенным геном еNOS [11, 52, 75].
Учитывая, что монооксид углерода (СО), эндогенно синтезируемый микросомальными гемоксигеназами, является мощным индуктором активности sGC и калиевых каналов эндотелиоцитов, разрабатываются методы его использования в качестве дилататора легочных сосудов [4, 28].
Предложены лекарственные средства, индуцирующие или сохраняющие активность sGC независимо от действия NO. В частности, представлены NO сенситизаторы — имидазольные препараты (YC-1 и его аналог BAY 41-2272), под действием которых происходит стабилизация активной конформации sGC и снижается активность PDEV, sGC-активатор — BAY 58-2667 [34].
В настоящее время установлена роль вазоактивного интестинального пептида в патогенезе ЛАГ. Известно, что VIP, взаимодействуя со специфическими мембранными рецепторами VPAC-1 и VPAC-2, возбуждение которых обусловливает повышение внутриклеточной концентрации цАМФ и цГМФ, вызывает бронхо- и вазодилатацию и ингибирует пролиферацию гладкомышечных клеток. В Европе и США проходят клинические испытания ингаляционного применения VIP (по 100–200 мкг/сут) при лечении ЛАГ [88, 132].
Исследуется возможность применения пептида, связанного с геном препрокальцитонина (calcitonin gene-related peptide/CGRP), который, взаимодействуя со специфическими рецепторами, экспрессированными на гладкомышечных клетках легочных сосудов, вызывает выраженную вазодилатацию и подавляет пролиферацию гладкомышечных клеток [42, 46].
Современные достижения молекулярной биологии позволили определить роль малых ГТФ-связанных протеинов (семейства Rho, Ras, Rab, Sarl/Arf, Ran) во внутриклеточной трансдукции сигнала множества агонистов — ангиотензина II, серотонина, тромбина, ET-1, норэпинефрина, PDGF, аденозинтрифосфата/аденозиндифосфата, уротензина II. Представители семейства Rho, ингибируя миозиновую фосфатазу (MLCPh), участвуют в модуляции активности Са2+-чувствительных гладкомышечных клеток сосудистой стенки [47, 116, 125, 127]. Основными эффекторными элементами семейства Rho являются Rho-киназа a/ROKa/ROCK2, Rho-киназа b/ROKb/ROCK1 и дополнительными — протеинкиназа N (PKN), рофилин, ротекин, цитрон, p140mDia, цитронкиназа. Субстратами Rho-киназ являются миозин-связанная субъединица (MBS), фосфатаза легкой цепи миозина (myosin light chain phosphatase/MLCPh), ERM (эзрин, радицин, моэзин) семейство, аддуцин, виментин, Na+-H+-обменник, сериновая протеинкиназа LIM (low calcium medium)-киназа [12, 98, 136]. В настоящее время ингибиторы Rho-киназ представлены производным пиридина Y-27632, связанным компаундом Y-32885, фазудилом и его дериватами HA-1077, H-1152. Фармакологический спектр действия ингибиторов Rho-киназ включает в себя эффекты различных лекарственных средств, используемых при ЛАГ: статинов (повышение продукции NO), ингибиторов ангиотензинпревращающего фермента (повышение продукции NO, снижение активности ангиотензина II), антагонистов кальция (расслабление гладкомышечных клеток), b-блокаторов (снижение симпатического воздействия), блокаторов эндотелиновых и 5HT2A рецепторов (ET1 и 5HT2A блокада) [117]. В экспериментальных работах показано, что болюсное внутривенное введение Y-27632 или фазудила быстро снижает периферическое сосудистое сопротивление. Представлены данные о высокой эффективности ингибиторов Rho-киназ у пациентов, невосприимчивых к терапии NO [49, 70, 127, 135].
Антипролиферативная, проапоптотическая терапия
Наблюдаемая пролиферация апоптозрезистентных эндотелиоцитов и гладкомышечных клеток сосудов легочной ткани при ЛАГ сопряжена с усилением экспрессии рецепторов PDGF, транспортера серотонина, проапоптотического протеина сурвивина, с активацией HIF-1a, а также со снижением экспрессии O2-чувствительных K+-каналов (Kv1.1, Kv1.2, Kv1.5, Kv2.1 и Kv9.3) [65, 87]. В связи c чем перспективными направлениями медикаментозного лечения считают применение иматиниба, ингибиторов редуктазы HMG-CoA (статинов), блокаторов рецепторов серотонина, ингибиторов рецепторных тирозинкиназ, антисурвивина, дихлорацетата, модуляторов калиевых каналов [17, 49, 51, 54, 91, 93, 126, 131].
Применение иматиниба мезилата (STI571, glivec), являющегося антагонистом рецепторов PDGF и рецепторной тирозинкиназы (abelson tyrosine kinase — ABL), радикально изменяет процессы ремодуляции сосудистой стенки, предотвращая формирование слоя микрофибробластов и организацию внеклеточной матрицы (неоинтимы) между эндотелиоцитами и внутренней эластической пластиной. До настоящего времени иматиниба мезилат применялся при лечении CD117-позитивной гастроинтестинальной стромальной опухоли [16, 19, 47, 107]. K.C. Patterson и соавт. [96] представили описание эффективного использования иматиниба при ЛАГ, нечувствительной к комбинированной терапии босентаном, илопростом и силденафилом.
Ингибиторы редуктазы 3-гидрокси-3-метилглютарил-кофермента А (HMG-CoA) (статины) оказывают разнообразные фармакологические действия — холестеринснижающее, антипролиферативное, противовоспалительное. Статины, ингибируя Rho/Rho-киназозависимый путь, усиливают активность эндотелия, индуцируют экспрессию eNOS и продукцию NO, ингибируют пролиферацию эндотелиоцитов и гладкомышечных клеток сосудов легочной ткани, в связи с чем апробируются при лечении ЛАГ [83, 104, 121]. Аторвастатин ингибирует экспрессию протеинового транспортера серотонина у особей с экспериментальной ЛАГ, что сопровождается увеличением легочного кровотока, снижением выраженности правожелудочковой недостаточности [113]. Показано, что симвастатин подавляет пролиферацию гладкомышечных клеток, снижает активность ингибиторов eNOS, рецепторов костного морфогенетического белка 1, усиливает апоптоз люменоблитерирующих клеток [118, 135].
Апоптоз является одним из важнейших механизмов, контролирующих количественное представление гладкомышечных клеток в стенке сосудов и процессы ремоделирования сосудистой стенки. При ЛАГ гладкомышечные клетки приобретают резистентность к действию апоптотических факторов, что приводит к неконтролируемой их пролиферации и облитерации просвета сосудов. Ремоделирование структуры сосудистой стенки, в частности, обеспечение регрессирования медиальной гипертрофии легочных сосудов, в настоящее время считают ключевой терапевтической целью [58]. Методами генной инженерии на основе аденовирусных векторов, несущих мутированный ген сурвивина, было разработано новое лекарственное средство генной терапии — антисурвинин. Сурвинин (Birc5) принадлежит к протеиновому семейству ингибиторов апоптоза, он практически не экспрессируется здоровыми тканями. При ЛАГ отмечается значительное увеличение экспрессии сурвинина эндотелиоцитами, особенно теми, которые контаминируют с неоинтимой. Индукция экспрессии сурвинина эндотелиоцитами связана с действием PDGF и VEGF. Ингаляторное использование антисурвинина приводило к увеличению чувствительности к апоптотическим факторам апоптозрезистентных гладкомышечных клеток сосудистой стенки у крыс с экспериментальнгой ЛАГ и, как следствие, к уменьшению медиальной гипертрофии легочной артерии и снижению сосудистого сопротивления [10, 13, 17].
Для индукции апоптоза апоптозрезистентных клеток разрабатывается возможность трансферта гена апоптоз-сигналрегулирующей киназы-1 (ASK-1) [9, 58]; синтезирован агонист брадикининовых рецепторов B2 B9972 с выраженным пролонгированным проапоптотическим действием [58, 130]; исследуется дихлорацетат, который увеличивает митохондриальное окислительное фосфорилирование, способствует высвобождению перекиси водорода и цитохрома С, усиливая в 10 раз активность апоптоза в зоне медии [30, 38, 58].
Клеточная терапия, усиливающая васкуляризацию легочной ткани
Идентификация эндотелиальных прогенеративных клеток как потенциального источника неоваскуляризации открыла новые возможности клеточной терапии ЛАГ (1997). Установлено, что ЭПК являются гетерогенной популяцией, состоящей из ранних ЭПК с фенотипом CD34/CD31/CD14, продуцирующих высокие уровни цитокинов, и поздних (с отсроченным ростом) ЭПК с фенотипом CD31, продуцирующих высокие уровни цитокинов и способных формировать тубы. Ранние ЭПК, секретируя высокие уровни цитокинов, паракринно модифицируют метаболизм эндотелиоцитов, а поздние ЭПК способны заместить поврежденные эндотелиоциты [25, 29, 31, 39, 102]. Также показано, что ЭПК экспрессируют проангиогенные факторы, ингибиторы пролиферации гладкомышечных клеток (CGRP) [43]. После внутривенного введения ЭПК преимущественно локализуются в местах поражения эндотелия. В пилотном трайле, который был выполнен в Университете Чжэцзяна (Китай), было показано, что эффективность внутривенного введения аутологичных ЭПК значительно превосходит результат традиционной терапии [82, 129]. В 2008 году проведено лечение ЛАГ у 3 пациентов введением ранних ЭПК (курсовая доза 7 млн клеток) с целью суперэкспрессии eNOS. Установлено, что на 3-й день клеточной терапии наблюдалось снижение сосудистого легочного сопротивления практически на 50 % [123]. Несмотря на безопасность внутривенного введения ЭПК, M.R. Ward и соавт. [133] полагают, что для рекомендации использования клеточной терапии ее эффективность должна быть доказана в больших рандомизированных клинических испытаниях.
Заключение
Терапия больных с ЛАГ является сложной и окончательно не решенной задачей. При традиционном подходе к ее решению можно рекомендовать использование следующего алгоритма действий (рис. 1). Объем первоначальной терапии после установления диагноза ЛАГ ограничен респираторной терапией, антикоагулянтами, симптоматическими лекарственными средствами (диуретиками — при задержке жидкости, гликозидами — при рефрактерной правожелудочковой недостаточности и/или суправентрикулярной тахикардии и т.д.). На фоне первичных лечебных мероприятий всем пациентам с ЛАГ показано проведение ОФП.
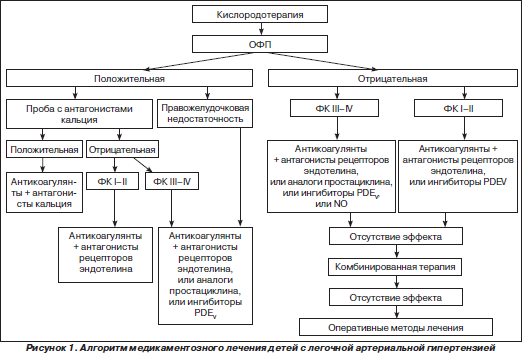
Назначение медикаментозной терапии больным с положительным ответом на острую пробу с вазодилататором зависит от чувствительности к антагонистам кальция и тяжести заболевания. При достаточном вазодилатирующем ответе на введение антагонистов кальция на фоне антикоагуляционной терапии назначают амлодипин, нифедипин в максимально переносимых дозах. При отсутствии ответа на острое введение антагонистов кальция пациентам с I и II ФК рекомендуются кислородотерапия, антикоагулянты и босентан, пациентам с III и IV ФК — антикоагулянты в сочетании с босентаном, или с эпопростенолом, или с илопростом, или с силденафилом.
Пациентам с отрицательным ответом на острую пробу с вазодилататором при I и II ФК назначают кислородотерапию, антикоагулянты в сочетании с босентаном или с силденафилом, пациентам при III и IV ФК — антикоагулянты в сочетании с босентаном, или с эпопростенолом, или с илопростом, или с силденафилом, или с NO. Отсутствие эффекта от проводимой терапии является показанием для назначения комбинированной терапии: сочетаний аналогов простациклина с босентаном, аналогов простациклина с силденафилом, босентана с силденафилом.
Отсутствие клинического эффекта комбинированной медикаментозной терапии обусловливает назначение оперативных методов лечения — предсердной баллонной септостомии и/или трансплантации легких.
Список литературы находится в редакции