Журнал «Здоровье ребенка» 6 (27) 2010
Вернуться к номеру
Особливості діагностики та небулайзерної терапії у лікуванні бронхіальної астми в дітей із харчовою алергією
Авторы: Юрчишена Е.В., Добровольська Л.О., Мисько Л.В., Мисько Ю.Л., Юрчишен О.М., Хмельницька міська дитяча лікарня, Хмельницька обласна дитяча лікарня
Рубрики: Педиатрия/Неонатология
Версия для печати
У статті висвітлено основні погляди на особливості клінічного перебігу, діагностики та небулайзерної терапії бронхіальної астми в дітей із харчовою алергією.
Діти, бронхіальна астма, харчова алергія, небулайзерна терапія.
Вступ
Алергічні захворювання характеризуються тривалим перебігом із частими рецидивами, вимагають довготривалого застосування дієтотерапії та медикаментозної терапії і одночасно виступають найбільш частою причиною підвищеної захворюваності, особливо в ранньому та дошкільному віці [1–3]. У зв’язку з цим проблема харчової алергії (ХА) та пов’язаних з нею захворювань (атопічний дерматит, бронхіальна астма (БА), набряк Квінке, кропив’янка тощо) набуває особливої актуальності та вимагає розробки нових методів лікування, що дозволили б попереджувати як виникнення алергічних реакцій, особливо у дітей високого ризику з розвитку атопії, так і подальше прогресування хвороби. Міжнародною асоціацією алергологів та клінічних імунологів (IAACI-WAO) та Всесвітньою організацією охорони здоров’я запропонована комплексна програма, що включає первинну (спрямовану на попередження виникнення алергічних захворювань у дітей із генетично детермінованим високим ризиком розвитку атопії), вторинну (спрямовану на попередження загострень і подальшого прогресування хвороби) і третинну (спрямовану на попередження несприятливих наслідків алергічних захворювань: летальності, інвалідності, тяжких ускладнень) профілактику харчової алергії [4–6].
Мета дослідження: на основі комплексного клініко-параклінічного обстеження дітей, хворих на бронхіальну астму на тлі харчової алергії, вивчено особливості небулайзерної терапії у дітей із бронхообструктивним синдромом (БОС).
Матеріал і методи
Першу (основну) групу становили 50 дітей, які з загостренням бронхіальної астми надійшли до лікарні та мали одночасно клініко-анамнестичні й параклінічні прояви харчової алергії. Другу групу порівняння сформували 45 однолітків із бронхіальною астмою, але без ознак харчової алергії. За основними клінічними показниками групи були порівнянні.
Результати дослідження та їх обговорення
При надходженні пацієнтів груп порівняння до стаціонару в них виявлялося загострення бронхіальної астми у вигляді типового бронхообструктивного синдрому. Так, серед дітей, які становили І клінічну групу, розгорнута клініка нападу БА спостерігалась у 81,5 ± 4,1 % випадків, а у ІІ групі — у 94,4 ± 2,4 % спостережень (Р > 0,05). Тяжкість БОС визначали за клінічною системою бальної оцінки обструкції нижніх дихальних шляхів у дітей раннього віку [7].
Тяжкість бронхообструктивного синдрому відповідно до цієї бальної системи оцінки наведена в табл. 1.
Таким чином, у І клінічній групі переважали порівняно з ІІ групою випадки з легкою бронхіальною обструкцією, оціненою за системою бальної оцінки. Одночасно в групах порівняння вірогідно переважав тяжкий БОС порівняно з випадками середньої тяжкості, що, на нашу думку, відображувало особливість перебігу БА на тлі харчової алергії у вигляді маргінальних за своєю вираженістю варіантів БОС.
Так, установлено, що в 45,7 ± 5,2 % дітей І та в 55,6 ± ± 5,2 % пацієнтів ІІ групи (Р > 0,05) спостерігалися ознаки гострої респіраторної інфекції, що відповідно відбивалося на частоті підвищення температури тіла. Так, стійке підвищення температури тіла вище субфебрильної — у 47,8 ± 5,2 % пацієнтів І групи та у 53,3 ± 5,3 % дітей ІІ групи (Р > 0,05).
Одночасно виявлені відмінності в аускультативній картині при дослідженні системи органів дихання в пацієнтів груп порівняння дозволяли стверджувати, що тяжкі дихальні порушення також були прерогативою дітей із харчовою алергією.
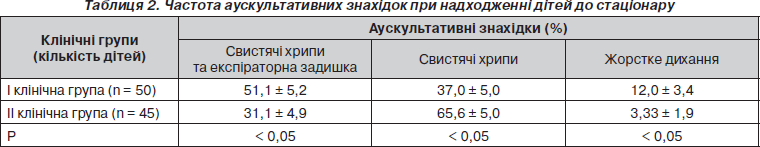
У табл. 2 наведена частота аускультативних знахідок при дослідженні системи органів дихання в дітей груп порівняння при надходженні їх до стаціонару.
Таким чином, у пацієнтів І клінічної групи всередині самої групи, а також порівняно з однолітками, які становили ІІ групу, переважали випадки з одночасною наявністю експіраторної задухи та сухих свистячих хрипів над легенями. Одночасно в ІІ групі превалювали варіанти з наявністю сухих свистячих хрипів, а випадки з виключно жорстким диханням також переважали в пацієнтів основної групи. Це підтверджувало отримані нами попередні дані про переважання у дітей із БА на тлі харчової алергії маргінальних (тяжких або легких) варіантів перебігу нападного періоду.
Крім того, слід визнати, що тяжкий БОС у дітей з ХА хоча й зустрічається з такою ж частотою, як і в групі порівняння, проте характеризується превалюванням тяжких форм порушення бронхіальної прохідності.
З огляду на виявлені клінічні особливості перебігу нападного періоду в пацієнтів із БА на тлі ХА виявлялося доцільним вивчити їх діагностичну цінність та показники епідеміологічного ризику в якості тестів з виявлення замаскованої ХА при надходженні до стаціонару.
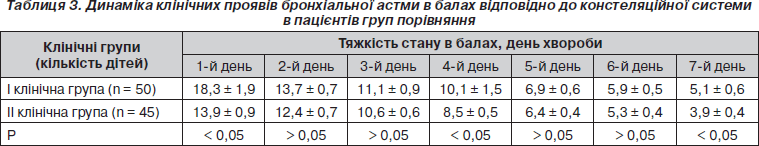
У табл. 3 наведені динамічні показники тяжкості стану пацієнтів груп порівняння впродовж перебування в стаціонарі.
Таким чином, за констеляційною системою оцінки тяжкості стану дітей з БА виявлено, що на 1-й, 4-й та 7-й дні перебування в стаціонарі тяжкість пацієнтів І групи була вірогідно вища порівняно з однолітками, які становили ІІ клінічну групу. Темпи покращання стану в пацієнтів основної групи були більш швидкими, і на 4-ту добу перебування в клініці оцінка тяжкості загального стану зменшилась в середньому на 10 балів, а у пацієнтів ІІ групи — лише на 3,8 бала. Проте в подальшому зниження тяжкості стану відбувалося приблизно з однаковим темпом, хоча на 7-му добу госпіталізації стан пацієнтів І групи був тяжчим.
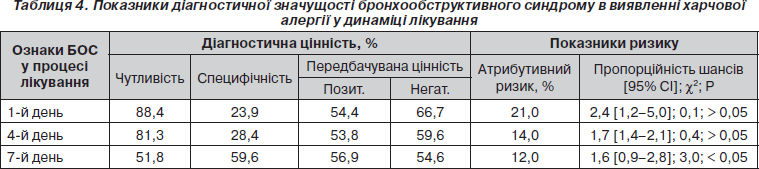
Показники клініко-епідеміологічного ризику та діагностичної значущості у виявленні ХА ознак бронхіальної обструкції в динаміці лікування наведені в табл. 4.
Для І групи характерною була швидка дезобструкція, що, можливо, пояснювалося надходженням трофалергенів при невиявленій ХА дітям, які не отримували елімінаційної дієти. На нашу думку, саме цим і можна було пояснити високу специфічність у виявленні замаскованої ХА наявності цього клінічного симптомокомплексу впродовж лікування в лікарні.
На першу добу за тяжкий загальний стан дітей приймали суму балів 18 і більше, що перевищувало середньогруповий показник; на 4-ту добу середньогруповий показник становив 10 балів, тому враховували пацієнтів із показником 10 балів і вище, а на 7-му добу (відповідно до середньогрупового показника) — 6 балів і вище. При надходженні до стаціонару І комплекс дезобструктивної терапії, що включав b2-агоністи та глюкокортикостероїди (ГКС), у випадку тяжкості загального стану, оціненої у 18 балів і вище, призначався в І клінічній групі у 72,5 ± 7,1 % пацієнтів, а в ІІ групі — у 45,5 ± 8,6 % випадків (Р < 0,05).
Таким чином, серед пацієнтів з ознаками вираженої тяжкості загального стану на 1-й день стаціонарного лікування призначення комбінації b2-агоністів адренергічних рецепторів із глюкокортикостероїдами вірогідно частіше реєструвалося в І клінічній групі.
На 4-ту добу госпіталізації пацієнтам, загальна тяжкість стану яких оцінювалася в 10 балів і вище, також вірогідно частіше призначався І дезобструктивний комплекс за наявності в них харчової алергії, що становило 77,4 ± 5,3 % спостережень у І групі, а у ІІ групі — 37,7 ± 6,6 % випадків (Р < 0,05). Для показників розподілу частоти використання антигістамінних засобів ці дані відповідно дорівнювали 66,7 ± 9,1 % і 35,0 ± 10,7 % (Р < 0,05), а ІІ дезобструктивний комплекс, що включав агоністи b2-адренергічних рецепторів бронхів, інгаляційні ГКС та еуфілін, у І групі використовували в 60,0 ± 12,6 % спостережень та у ІІ групі — у 10,0 ± 7,1 % випадків (Р < 0,01). Одночасно виявлено, що на 4-й день лікування в дітей із загальною тяжкістю загального стану 10 балів і вище еуфілін призначався вірогідно частіше у ІІ клінічній групі, що становило 55,3 ± 8,1 % випадків, а у І групі — 31,4 ± 6,5 % спостережень (Р < 0,05).
Таким чином, на 4-ту добу госпіталізації пацієнти з ХА і вираженою тяжкістю перебігу загострення БА частіше потребували інтенсивнішого лікування з включенням протизапальних ГКС-препаратів місцевої дії, а серед дітей групи порівняння кожний другий тяжкий випадок лікувався за допомогою еуфіліну.
Виявлені тенденції зберігалися в дітей із тяжкістю загального стану вище 6 балів також на 7-му добу лікування. Використання І комплексу дезобструктивної терапії у разі збереження тяжкості стану в І групі реєструвалося в 66,7 ± 5,9 % випадків, а в ІІ групі — у 40,6 ± 6,1 % спостережень (Р < 0,05), а показники розподілу частоти використання антигістамінних препаратів відповідно дорівнювали 70,0 ± 10,2 % і 30,8 ± 12,8 % випадків (Р < 0,05). За характером розподілу використання інших комплексів та компонентів дезобструктивної терапії на 7-й день лікування вірогідних відмінностей не встановлено.
Таким чином, при збереженні тяжкості загального стану дітей, хворих на БА, упродовж лікування в стаціонарі пацієнтам з ознаками ХА вірогідно частіше призначалася комбінація бронхолітичних препаратів та інгаляційних ГКС.
Використання агоністів b2-адренергічних рецепторів бронхів у ліквідації нападу БА є базисною терапією, вважали за доцільне оцінити ризик використання ГКС у дітей із вираженою тяжкістю нападного періоду та ознаками ХА щодо дітей без алергії до харчових продуктів у динаміці перебування в стаціонарі. Установлено, що ГКС включалися до комплексної терапії тяжких нападів БА на першу добу госпіталізації у І групі в 68,9 ± 5,4 % випадків, а в ІІ групі — у 38,9 ± 6,3 % спостережень (Р < 0,05). На 4-ту добу лікування ці показники відповідно становили 73,5 ± 5,4 % і 37,3 ± 6,8 % спостережень (Р < 0,05), а на 7-й день перебування в стаціонарі вони відповідно дорівнювали 73,6 ± 6,1 % випадків та 30,4 ± 6,5 % спостережень (Р < 0,05).
Показники клініко-епідеміологічного ризику необхідності використання у комплексній терапії нападу БА глюкокортикостероїдних препаратів дітям з ознаками ХА та вираженою тяжкістю загального стану в динаміці лікування щодо дітей без ознак ХА наведені в табл. 5.
Таким чином, у пацієнтів з ознаками ХА та тяжкого перебігу нападного періоду БА показники ризику застосування стероїдних протизапальних препаратів у комплексній терапії були вірогідно вищими щодо дітей без ХА, чим і пояснювалася більш активна терапія дітей даної клінічної групи в цілому та тяжко хворих представників цієї групи.
Нами було оцінено ефективність небулайзерної терапії БОС у дітей, хворих на БА. Так, у дітей І групи при використанні b2-агоністів короткої дії (вентоліну в небулах) при загостренні БОС покращення стану наступало відразу після проведення небулайзерної терапії, що склало 95,6 ± 8,6 %, у дітей ІІ групи — 93,8 ± 7,5 % (Р > 0,05). Діти, хворі на БА, знаходилися на цій терапії залежно від тяжкості стану в середньому 3–5 днів, причому діти, хворі на БА з ХА, відносно краще відповідали на дезобструктивну терапію. З відхаркуючою метою пацієнтам призначався лазолван в ампулах: у дітей, хворих на БА на тлі ХА, покращення стану відбувалося на 2–3-й день, що становило 88,9 ± 6,9 %, у дітей групи порівняння — 83,4 ± 6,6 % (Р > 0,05). При використанні з протизапальною метою інгаляційних ГКС (фліксотиду в небулах) для небулайзерної терапії за допомогою компресорного небулайзера позитивний ефект спостерігався в 96,7 ± 8,8 % дітей І групи та 94,8 ± 8,6 % дітей ІІ групи (Р > 0,05).
Отже, можна зробити висновок, що вірогідних відмінностей стосовно небулайзерної терапії у дітей груп порівняння не виявлено, проте діти, хворі на бронхіальну астму з харчовою алергією, краще відповідали на дезобструктивну терапію, що проявлялося в швидких темпах одужання. Можливо, це відображає відносну резистентність цих пацієнтів до традиційного лікування без врахування необхідності проведення елімінаційних заходів.
Висновки
1. У дітей, хворих на бронхіальну астму на тлі харчової алергії, переважають маргінальні (тяжкі або легкі) варіанти перебігу нападного періоду.
2. Для дітей, хворих на бронхіальну астму з ознаками харчової алергії, характерна швидка дезобструкція.
3. Стосовно частоти використання дезобструктивних комплексів пацієнти з харчовою алергією мали показники вираженої тяжкості загального стану впродовж лікування та отримували активнішу терапію, що полягало в переважному використанні у них стероїдних протизапальних препаратів місцевої дії.
4. Раннє використання глюкокортикостероїдних препаратів у комплексній дезобструктивній терапії нападного періоду бронхіальної астми має кращу ефективність у пацієнтів з харчовою алергією.
1. Международный консенсус по бронхиальной астме // Рос. мед. журнал. — 1996. — № 2. — С. 11-16.
2. Pocket Guide for Asthma Management and Prevention in Children. NHLBI/WHO Report. — 2002. — 26 p.
3. Ревякина В.А. Общие принципы диагностики и лечения пищевой аллергии у детей // Русский медицинский журнал. — 2000. — Т. 8, № 18(119). — С. 739-745.
4. Pajno G.B., Passalacqua G., La Grutta S., Vita D., Feliciotto R., Parmiani S., Barberio G. True multifood allergy in a 4-years-old child: a case study // Allergol. Immunopathol. (Madr). — 2002. — Nov-Deс. — Vol. 30, № 6. — P. 338-341.
5. Chandra R.K. Food hypersensitivity and allergic diseases // Eur. J. Clin. Nutr. — 2002. — Aug. — Vol. 56 (Suppl. 3). — P. 54-56.
6. Ревякина B.А., Гамалеева А.В., Бакрадзе М.Д. Проблемы профилактики пищевой аллергии у детей // Детский доктор. — 2001. — № 4. — С. 48-50.
7. Безруков Л.А., Нечитайло Ю.Н., Черевко С.А., Лукащук И.В., Тришкова Л.А., Михайлова А.М. Диагностика и лечение острых пневмоний и ОРВИ, осложненных БОС у детей раннего возраста / Под ред. А.Ф. Мозолевского. — Черновцы, 1989. — 23 с.