Журнал «Здоровье ребенка» 6 (27) 2010
Вернуться к номеру
Эффективность медикаментозной терапии при острой респираторной инфекции
Авторы: Попов С.В., Сумской государственный университет, медицинский институт
Рубрики: Педиатрия/Неонатология
Версия для печати
В работе представлены данные об особенностях и эффективности терапии при острой респираторной инфекции у детей на основании литературных данных. В собственном исследовании проведена оценка вариантов терапии у 147 детей с использованием соотношения оддса. Сделаны выводы об отсутствии данных об эффективности гомеопатических средств, частичной эффективности пробиотиков, необходимости разумного ограничения использования лекарственных средств.
Дети, острая респираторная инфекция.
Патология органов дыхания является одной из ведущих причин заболеваемости и летальности в детском, особенно раннем, возрасте. В Украине ежегодно выявляется 4–5 млн детей, больных острыми респираторными инфекциями (ОРИ). Около 30 % летальных случаев в возрасте до 5 лет обусловлено ОРИ и связанными с ними осложнениями. Большая часть обращений к педиатру или семейному врачу связана именно с острыми респираторными заболеваниями. Причем высокая заболеваемость ОРИ сохраняется круглогодично, хотя, конечно, в период эпидемий ее величина выше — до 90 % детей переносят ту или иную форму респираторной патологии. К тому же ребенок может заболеть ОРИ неоднократно в течение года, в среднем до 8 раз. В основном болеют дети раннего возраста — от 6 месяцев до 6 лет с пиком в 3–6 лет. Основным этиологическим фактором ОРИ являются вирусы — более чем в 90 % случаев. Однако в дальнейшем возможно присоединение бактериальной инфекции. При ОРВИ, в частности, такой вариант развития событий может отмечаться в 10 % случаев [1, 2].
Терапия ОРИ представляется и простой и сложной — имеются рекомендации соответствующих приказов МЗ Украины [3, 4], с другой стороны, они не перекрывают разнообразия особенностей клинической картины и статуса пациента. В конечном итоге педиатр определяет объем и качество лечебных мероприятий, необходимость использования лекарственных средств, ориентируясь на собственный опыт и знания, а также на традиции того или иного учреждения. Существует еще один фактор влияния — спонсорская работа от фармацевтических компаний и/или посредников в ее нынешнем отечественном виде. Количественный и качественный состав программы лекарственной терапии в некоторых отделениях, стационарах, поликлиниках может определять величина бонусов, прямо пропорциональная нагрузке на кошелек пациента или его родственников. Хорошо, если эти препараты близки к оригинальным, хотя, возможно, было бы лучше, если бы они были просто безвредными.
Практически бесспорно то, что объем терапевтических воздействий должен быть минимально возможным. Или хотя бы направленным в сторону ограничения использования медикаментозных препаратов, оставляя лишь те, что действуют или могут действовать по типу «магической пули». В действительности число назначаемых лекарственных средств обычно велико, даже в развитых странах. В США, к примеру, медикаментозная нагрузка составляет 3,2 препарата на одного ребенка [5].
Назначение препаратов может вести к развитию неблагоприятных событий, в число которых входят побочные реакции и медицинские ошибки. Их вероятность у детей в 3 раза выше, чем у взрослых. Частота развития собственно побочных реакций также немалая. В разных странах она варьирует от 1,5 % (Нигерия) до 19,9 % (Германия) среди госпитализированных детей и составляет в среднем 1 % среди пациентов вне стационара. Причем эта частота возрастает в 2–3,6 раза при лечении препаратами, у которых отсутствуют обоснованные рекомендации как способа применения, так и доз для детского возраста. Расчет в этом случае проводится экстраполяцией от имеющихся данных для взрослых. Доля таких медикаментов может составлять от 11 до 80 %, что само по себе является отдельной значительной проблемой. Не случайно, что в 2007 году ВОЗ инициировала глобальную кампанию «Make medicines child size». Чаще всего развитие побочных эффектов связано с назначением антибиотиков, по некоторым данным, прежде всего с оксациллином, ванкомицином, амоксициллином. Определяется это, видимо, наибольшей частотой использования именно этих препаратов. Первоочередные органы-мишени — желудочно-кишечный тракт (ЖКТ) и кожные покровы [6, 7].
Частота врачебных ошибок в педиатрии точно неизвестна, в Англии их частота может составлять до 500 000 случаев в год [8]. Аппроксимация этого числа в Украине дает величину в более чем 400 000 случаев в год. Учет качественного состояния отечественной медицины, во всех ее компонентах, по-видимому, внесет некоторую, и скорее положительную, поправку к указанной цифре.
Решение вопроса о необходимости использования антибиотиков является одним из главных и постоянных составляющих выбора терапии острых респираторных инфекций. Показания к ее назначению указываются в приказах МЗ Украины, изложены ведущими учеными. Выделяют следующие показания к назначению антибиотиков [2]:
— повышение температуры тела выше 38 °С более 3 дней;
— наличие одышки без обструкции и асимметрии хрипов;
— лейкоцитоз (выше 15 ×109);
— острый средний отит;
— тонзиллит стрептококковой этиологии;
— синусит с болями и отеком лица;
— бронхит, вызванный атипичной флорой (хламидии, микоплазма);
— пневмония.
В действительности антибиотики назначаются значительно чаще вследствие различных факторов, в числе которых, видимо, доминируют опасения врача и родственников пациента относительно возможности развития осложнений ОРИ. При анализе особенностей медикаментозной терапии в трех ведущих европейских странах отмечено, что антибактериальные средства были наиболее часто применяемыми средствами, особенно в возрасте до 2 лет, когда они назначаются в 48 % случаев при посещении врача [6]. Трудно предположить, что во всех этих случаях медикаментозные вещества действительно показаны. В развитых странах необоснованное и нерациональное использование антибактериальных средств отмечается в 25–40 %, в нашей стране — в 40– 50 % случаев [9]. Негативные аспекты неконтролируемой антибиотикотерапии известны: аллергические реакции, повышение резистентности патогенных микроорганизмов, изменение нормального микробного пейзажа макроорганизма и т.д.
Еще одной группой препаратов, назначение которых особенно часто происходит у стационарных больных и/или имеющих вероятность развития диареи, являются пробиотики. Основные показания к их назначению у детей — антибиотикассоциированная диарея (ААД), ротавирусная диарея, атопический дерматит [10].
Частота развития ААД у детей, исследованная в ретроспективном анализе сообщений PubMed, Medline и Cochrane за 25 последних лет, составила 11 %. Основными факторами риска ААД являлись возраст менее 2 лет и тип антибиотика. Для специфической формы ААД, вызываемой Clostridium difficile с возможными проявлениями в виде псевдомембранозного колита, препаратами выбора являются метронидазол и ванкомицин. В большинстве же случаев проявления ААД редуцировались отменой антибиотикотерапии либо ее изменением [11].
Об эффективности пробиотиков при ААД имеются противоречивые данные. Использование их для предупреждения возникновения нозокомиальных инфекций у детей в отделении интенсивной терапии, в частности Lactobacillus rhamnosus strain GG, имело скорее отрицательный результат [12]. В другом исследовании использование трех пробиотиков — Bifidobacterium longum PL03, Lactobacillus rhamnosus KL53A, Lactobacillus plantarum PL02 — на фоне терапии острых инфекционных заболеваний у детей снизило частоту стула в день, но не имело эффекта в длительности диареи [13]. В то же время обследование более 1000 детей в возрасте до 5 лет показало, что назначение пробиотиков снижало частоту бактериальных инфекций и гастроинтестинальных осложнений [14].
Гомеопатия — еще один метод лечения, популярный как среди врачей, так и среди родителей маленьких пациентов. В Норвегии, в частности, до 25 % детей в возрасте до 10 лет посещают гомеопатов. Наиболее частая причина обращения — респираторная инфекция [15]. Систематизированных данных распространенности терапии гомеопатическими препаратами в нашей стране не найдено, но, по-видимому, она не меньше указанной выше.
Имеющиеся за рубежом работы по оценке эффективности гомеопатии имеют как позитивные, так и негативные свидетельства. Однако с точки зрения доказательной медицины ее ценность сомнительна. В достоверных двойных слепых плацебо-контролируемых рандомизированных клинических исследованиях гомеопатия не показала наличия эффективности в лечении и профилактике различных заболеваний у детей и подростков [16]. Это касается и респираторных инфекций. Наряду с этим было показано наличие побочных эффектов гомеопатии, хотя последняя априори всегда считалась безопасной. Этих эффектов немного, обычно средней степени выраженности, но они есть. В частности, из 93 больных астмой в возрасте 5–15 лет у 3 отмечалось утяжеление симптоматики, у 3 — головная боль, у 1 — лихорадка, у 1 — слабость, у 3 — депрессия или возбуждение и т.д. При изучении эффективности гомеопатических средств у 251 ребенка с ОРИ у 13 из них были найдены средней степени выраженности и преходящие побочные эффекты. Это составляет 22 % для больных с астмой и 5 % для больных с острой респираторной инфекцией, что не так уж и мало. В целом указывается возможность утяжеления симптомов заболевания в 20 % случаев использования гомеопатии [17]. Сюда надо прибавить случаи задержки назначения и выполнения более эффективных методов диагностики и лечения.
Таким образом, объем назначаемых терапевтических воздействий, в том числе и за рубежом, при возникновении острой респираторной инфекции может быть достаточно велик. Это требует постоянной ревизии используемых средств для исключения полипрагмазии.
Целью настоящего исследования было сравнительное изучение эффективности некоторых компонентов терапии у детей с острой респираторной инфекцией.
Материалы и методы
В ходе работы было обследовано 147 детей, из них 62 — в возрасте до года, а 85 — в возрасте от 1 до 3 лет. Все они находились на амбулаторном лечении с диагнозом острой респираторной вирусной инфекции, поставленным согласно критериям диагностики, изложенным в соответствующем протоколе [5].
В зависимости от возраста больные были разделены на 2 группы: группа 1 — в возрасте до 1 года (62 ребенка); группа 2 — от 1 до 3 лет (85 детей). Средний возраст пациентов составил 7,82 месяца и 2,32 года соответственно. В зависимости от варианта получаемой терапии были выделены 4 подгруппы. В первую входили дети, получающие только симптоматическую терапию, во вторую — антибиотикотерапию наряду с симптоматической терапией, в третью — антибиотикотерапию в сочетании с пробиотиками, в четвертую — антибиотикотерапию, пробиотики, гомеотерапию. Препараты назначались в соответствии с рекомендуемыми возрастными дозами, энтерально.
Для каждого варианта терапии в соответствующих группах определялись частота эпизодов повышения температуры более 3 дней от начала терапии, величины лейкоцитарного индекса интоксикации (ЛИИ) выше возрастной нормы после 3-го дня от начала терапии, прибавки массы тела после 3-го дня от начала терапии, наличие дисфункций желудочно-кишечного тракта после 5-го дня лечения. В число последних входили наличие явлений метеоризма, изменения частоты и консистенции стула.
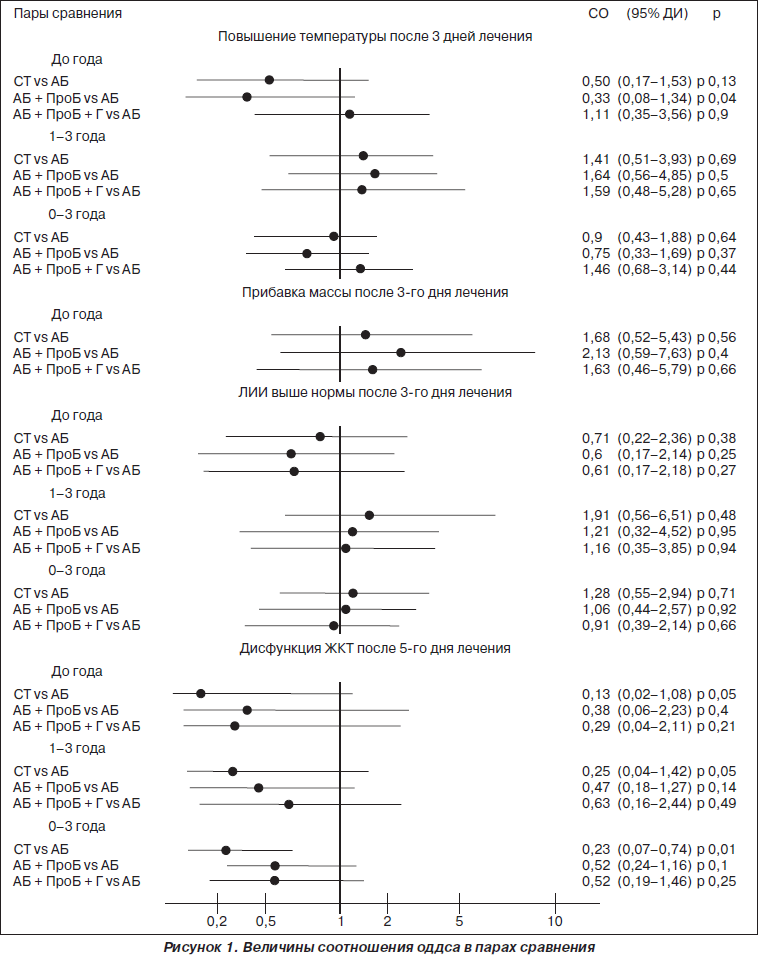
Сравнение вариантов лечения проводилось с помощью расчета соотношения оддса (СО) для выбранных пар, его 95% доверительного интервала (ДИ). Достоверность результатов рассчитывалась по критерию (c2) Пирсона, критерию (z) с поправкой Йейтса.
Результаты и обсуждение
Наиболее частым вариантом терапии у детей в возрасте до года было использование антибиотиков с пробиотиками — в 50 % случаев. Остальные варианты встречались реже и с примерно одинаковой частотой (табл. 1). Видимо, это определялось прогнозируемо более высоким риском антибиотикассоциированных диарей у детей раннего возраста. В группе 2 чаще использовались варианты антибиотики + симптоматическая терапия и антибиотики + пробиотики.
Среди антибиотиков наиболее часто использовались полусинтетические пенициллины (амоксициллин) — у 34 и 40,2 % детей групп 1 и 2 соответственно. Аминогликозиды назначались реже — 28 и 15,58 % больных. Из пробиотиков в обеих группах наиболее часто применялся хилак — у 32,6 и 28,6 % детей группы 1 и 2 соответственно. Практически с той же частотой использовался линекс — у 27,9 и 26,3 % больных. Лактовит был назначен 18,6 и 16,7 % больных групп 1 и 2 соответственно. Из гомеопатических препаратов наиболее часто использовались гастрикумель и хепель. Первый применялся у 66,7 и 54,5 % детей в группах 1 и 2, соответственно из 12 и из 11 пациентов. Хепель применялся несколько реже — у 33,3 и 45,4 % больных. Таким образом, различий в частоте назначения разных групп препаратов между исследуемыми группами найдено не было.
Изучение влияния вариантов лечения на длительность повышения температуры показало достоверно позитивный эффект сочетания антибиотиков с пробиотиками в сравнении с монотерапией антибиотиками для детей в возрасте до года — величина СО составила 0,33 при р = 0,04 (рис. 1). Для пациентов старшей возрастной группы такого эффекта не наблюдалось. Наоборот, все варианты терапии имели тенденцию к пролонгации гипертермии (p > 0,05). Общим для обеих возрастных групп было наличие скорее негативного эффекта применения в комплексе препаратов гомеопатических средств, однако значение СО не было достоверным. Примерно такая же картина прослеживалась для величины ЛИИ. Наилучшее значение СО отмечалось для варианта терапии антибиотики + пробиотики в возрастной группе до года, хотя величина (р) и здесь не была значимой.
Оценивалось наличие положительной прибавки массы тела после 3-го дня лечения у пациентов младшей возрастной группы. При всех вариантах лечения имелась положительная связь, более выраженная при добавлении пробиотиков, хотя значения (р) были недостоверны. При анализе наличия дисфункции ЖКТ после 5-го дня отмечено снижение вероятности ее развития при всех вариантах лечения сравнительно с антибиотикотерапией. Однако достоверный результат отмечен лишь для симптоматической терапии. Для последней во всех возрастных группах значение СО было достоверным. В то же время добавление к антибиотикотерапии пробиотиков и гомеопатических средств не показывало достоверного эффекта.
Изучалось влияние альтернативных вариантов лечения на развитие дисфункций желудочно-кишечного тракта. Все они имели меньший эффект на развитие указанных расстройств сравнительно с монотерапией антибиотиками. Однако достоверное значение СО было получено только для симптоматического варианта лечения и для всех возрастных групп. Таким образом, в исследуемой группе положительный результат от введения препаратов — пробиотиков и/или гомеопатических средств — получен лишь для одного варианта терапии. Была отмечена отрицательная связь длительности температуры с назначением пробиотиков. Дисфункция ЖКТ имела тенденцию к снижению лишь вне введения антибиотиков.
Таким образом, добавление к антибиотикотерапии пробиотиков и гомеопатических средств в целом не оказывало влияния на длительность температурной реакции, выраженность интоксикации. Был отмечен лишь частичный эффект использования пробиотиков у детей в возрасте до года на длительность температурной реакции. Не было выявлено эффекта назначения пробиотиков и гомеопатических средств на изменение выраженности дисфункции желудочно-кишечного тракта и прибавки массы. Уменьшение объема лекарственной нагрузки с использованием симптоматической терапии, наоборот, снижало риск развития расстройств ЖКТ.
Вряд ли можно ожидать радикального сокращения использования антибактериальных средств в частности и медикаментов вообще, если даже 84 % родителей ожидают назначения последних [7]. Однако усиление образовательной и пропагандистской работы с населением и медицинскими работниками может дать определенный эффект. В развитых странах частота назначений противомикробной терапии при острой респираторной инфекции в течение последних десятилетий снижается. В США она уменьшилась на 36 % для детей в возрасте до 5 и на 18 % — старше 5 лет. В Великобритании частота предписания антибиотиков редуцировалась с 46 до 31 %. Наибольшую роль в этом играет именно активное обучение клиницистов [18, 19]. По-видимому, и у нас необходимо акцентировать внимание на минимизацию медикаментозной нагрузки на пациента, в особенности на маленького, с его несовершенными возможностями детоксикации и выведения, учитывая вероятность побочных эффектов и ошибок.
Выводы
Добавление к терапии антибиотиками гомеопатических средств не ведет к уменьшению выраженности интоксикации, дисфункций желудочно-кишечного тракта у исследуемого контингента детей, а пробиотиков — дает лишь частичный эффект.
Необходимо усиление работы по пропаганде разумного ограничения использования у детей медикаментозных средств, особенно тех, относительно которых имеются спорные данные об их эффективности, учитывая также отсутствие абсолютно безвредных препаратов.
1. Антипкин Ю.Г., Лапшин В.Ф., Уманец Т.Р. Принципы диагностики и лечения негоспитальных пневмоний у детей // Здоров’я України. — 2008. — № 24/1. — С. 11-13.
2. Крамарев С.А. Рациональная терапия наиболее распространенных инфекций: решенные и нерешенные вопросы // Здоров’я України. — 2008. — № 24/1. — С. 30-31.
3. Про затвердження Протоколів діагностики та лікування інфекційних хвороб у дітей: Наказ МОЗ України № 354 від 09.07.04. — К.: МОЗ України, 2004.
4. Про затвердження Протоколів надання медичної допомоги дітям за спеціальністю «Дитяча пульмонологія»: Наказ МОЗ України № 18 від 13.01.05. — К.: МОЗ України, 2005.
5. Clavenna A., Bonati M. Drug prescriptions to outpatient children: a review of the literature // Eur. J. Clin. Pharmacol. — 2009. — Vol. 65, № 8. — P. 749-755.
6. Sturkenboom M., Verhamme K., Nicolosi A. Drug use in children: cohort study in three European countries // BMJ. — 2008. — Vol. 337. — a2245.
7. Clavenna A., Bonati M. Adverse drug reactions in childhood: a review of prospective studies and safety alerts // Arch. Dis. Child. — 2009. — Vol. 94. — P. 724-728.
8. Wong C.K., Wong L.Y.L., Cranswick N.E. Minimising medication errors in children // Arch. Dis. Child. — 2009. — Vol. 94. — P. 161-164.
9. Юлиш Е.И., Коринева Л.С., Ярошенко С.Я. Рациональный выбор антибактериальной терапии внебольничных бактериальных инфекций ЛОР-органов и органов дыхания у детей // Здоровье ребенка. — 2008. — № 1. — С. 21-26.
10. Аряев Н.Л., Циунчик Ю.Г., Варбанец Д.А., Поплавская Л.Л., Кузьменко И.В. Клиническое значение пробиотиков в профилактике и лечении антибиотикассоциированной диареи у детей // Здоровье ребенка. — 2007. — № 4. — С. 10-13.
11. Alam S., Mushtaq M. Antibiotic associated diarrhea in children // Indian Pediatr. — 2009. — Vol. 46, № 6. — P. 491-496.
12. Honeycutt T.C., El Khashab M., Wardrop R.M. Probiotic administration and the incidence of nosocomial infection in pediatric intensive care: a randomized placebo-controlled trial // Pediatr. Crit. Care Med. — 2007. — Vol. 8, № 5. — P. 452-458.
13. Szymański H., Armańska M., Kowalska-Duplaga K., Szajewska H. Bifidobacterium longum PL03, Lactobacillus rhamnosus KL53A, and Lactobacillus plantarum PL02 in the prevention of antibiotic-associated diarrhea in children: a randomized controlled pilot trial // Digestion. — 2008. — Vol. 78, № 1. — P. 13-17.
14. Lin J.S., Chiu Y.H., Lin N.T. et al. Different effects of probiotic species/strains on infections in preschool children: A double-blind, randomized, controlled study // Vaccine. — 2009. — Vol. 27, № 7. — P. 1073-1079.
15. Steinsbekk A., Bentzen N., Fonnebo V., Lewith G. Self treatment with one of three self selected, ultramolecular homeopathic medicines for the prevention of upper respiratory tract infections in children. A double-blind randomized placebo controlled trial // Br. J. Clin. Pharmacol. — 2005. — Vol. 59, № 4. — P. 447-455.
16. Altunc U., Pittler M.H., Ernst E. Homeopathy for Childhood and Adolescence Ailments: Systematic Review of Randomized Clinical Trials // Mayo Clin. Proc. — 2007. — Vol. 82, № 1. — P. 69-75.
17. Grabia S., Ernst E. Homeopathic aggravations: a systematic review of randomised, placebo-controlled clinical trials // Homeopathy. — 2003. — Vol. 92. — P. 92-98.
18. Meropol S.B., Chen Z., Metlay J.P. Reduced antibiotic prescribing for acute respiratory infections in adults and children // Br. J. Gen. Pract. — 2009. — Vol. 567, № 59. — P. 321-328.
19. Grijalva C.G., Nuorti J.P., Griffin M.R. Antibiotic prescription rates for acute respiratory tract infections in US ambulatory settings // JAMA. — 2009. — Vol. 302, № 7. — P. 758-766.