Журнал «Здоровье ребенка» 6 (27) 2010
Вернуться к номеру
Парадигма формирования и развития хронических соматических заболеваний на фоне персистирующих инфекций
Авторы: Юлиш Е.И., Донецкий национальный медицинский университет им. М. Горького
Рубрики: Педиатрия/Неонатология
Версия для печати
В работе представлена концепция формирования хронических заболеваний на фоне длительно текущего воспалительного процесса, обусловленного персистирующими внутриклеточными инфекциями.
Персистирующие инфекции, хроническое воспаление.
Выдающиеся открытия микробиологии, создание эффективных антибактериальных препаратов — сульфаниламидов, антибиотиков, успехи в разработке вакцин породили к середине ХХ века иллюзию возможности полного искоренения инфекционных заболеваний. Достижения действительно были весьма значительными. Обузданы эпидемии чумы, холеры, брюшного и сыпного тифа. Ликвидирована натуральная оспа. Существенно снизилась заболеваемость полиомиелитом, корью, коклюшем, эпидемическим паротитом, дифтерией, уменьшилась летальность от инфекционных болезней: при особо опасных инфекциях — в 10 раз, при некоторых других — в 100 раз и более. Сегодня в отличие от недалекого прошлого инфекционные заболевания в причинах смертности занимают далеко не первое место. Лидерами в структуре смертности в развитых странах являются онкологические, сердечно-сосудистые заболевания, травмы.
В ХХ веке за работы в области инфекционной патологии были присуждены двадцать пять Нобелевских премий, в том числе только за последние 40 лет — одиннадцать, за открытия в вирусологии (главным образом в онковирусологии) и шесть — за открытия в иммунологии.
Однако планам ликвидации инфекций не суждено было сбыться, причем неудачи потерпели оба направления в борьбе с инфекциями — и профилактика, и лечение. К исходу ХХ века в области инфекционной патологии накопилось множество проблем, наиболее важные из которых связаны с 3 группами инфекций.
Во-первых, это инфекции, которые достались нам в наследство от предыдущих веков, включая ХХ. Они лишь ушли в тень, грозя возвратиться в любой момент, а некоторые из них уже вернулись (так называемые возвращающиеся инфекции — reemerging diseases): туберкулез, малярия, инфекции, передающиеся половым путем, и др. Во многом их возврат обусловлен социально-экономическими факторами.
Во-вторых, это новые, а точнее, впервые выявленные инфекции, ставшие известными в конце ХХ века. Число таких инфекций уже превысило три десятка. Среди них — ВИЧ-инфекция, болезнь Лайма, эрлихиоз, иерсиниоз, легионеллез, вирусные лихорадки Ласса, Эбола, Марбург, энтеротоксигенные и энтерогеморрагические эшерихиозы, Т-клеточный лейкоз, кампилобактериоз, ряд вирусных кишечных болезней, гепатиты Е, С, D, F и G, хантавирусный легочный синдром и др. К этой же группе, хотя далеко не «новых» инфекций, относятся другие, очень распространенные в человеческой популяции внутриклеточные патогены, которым свойственно персистирующее течение, — группа герпесвирусов, хламидии, микоплазма, токсоплазма, хеликобактер и другие. Эти инфекции, возбудителями которых могут быть и вирусы, и простейшие, и бактерии, развиваясь на фоне временных, транзиторных иммунодефицитов, способствуют развитию хронического иммунодефицитного состояния [1]. Известно, что эти патогенные микроорганизмы обладают способностью снижать или вообще прекращать воспалительный процесс, исходно направленный на их уничтожение, но повреждающий и собственные ткани макроорганизма. В связи с этим персистирующие инфекции, получившие широкое распространение у человека, животных и растений в начале XXI века, могут быть серьезной проблемой и в новом тысячелетии.
И, наконец, третью группу составляют инфекции, которые условно можно назвать Х-инфекциями. Это заболевания, которые в настоящее время еще не известны, но которые непременно будут диагностироваться в ХХI веке. Эта группа инфекций будет пополняться в том числе и за счет многих болезней, считавшихся ранее неинфекционными.
Сегодня проблема инфекционной патологии выходит далеко за рамки этого раздела медицины. Она весьма актуальна для целого ряда медицинских специальностей и требует, по сути, иных идеологических подходов. В начале ХХ века И.И. Мечников высказал предположение о том, что соматические болезни и злокачественные опухоли имеют инфекционную природу. Он писал: «...со временем, вероятно, удастся открыть паразитов не только при болезнях типично инфекционного характера, но и при болезнях совершенно другого рода…» [2]. Великий ученый предсказывал открытие паразитов злокачественных опухолей, а также микробов-возбудителей сахарной болезни. Гипотеза И.И. Мечникова получила серьезное подтверждение, и в настоящее время список соматических и онкологических заболеваний, ассоциируемых с инфекционными возбудителями, достаточно велик. Данные подтверждаются результатами эпидемиологических наблюдений, серологических исследований, обнаружением антигенов бактерий или вирусов, выделением чистой культуры конкретного микроорганизма из органа-мишени, а также воспроизведением некоторых видов соматической патологии (миокардит, диабет) при заражении лабораторных животных. Более того, при обследовании тканей умерших в результате хронических соматических заболеваний больных антигены цитомегаловируса и вируса простого герпеса встречаются в различных органах в 3–6 раз чаще, чем в результате несчастных случаев. Причем более часто антигены вирусов обнаруживаются в ткани печени и эндотелии сосудов [3]. Авторы считают, что процесс персистенции герпесвирусной инфекции, кроме того, сопровождается интеграцией инфекта в геном клетки хозяина, а также развивающимся при этом вторичным иммунным дисбалансом и дефицитом. По их мнению, развитие стрессовой ситуации на фоне хронической соматической патологии вызывает реактивацию персистирующего инфекционного процесса и усугубление течения основного заболевания.
Следует подчеркнуть, что до настоящего времени вывод об участии конкретного микроорганизма в развитии той или иной патологии базируется, как правило, на выявлении одного, реже двух признаков триады Коха, поэтому имеют в виду не этиологическую роль микроорганизма, а его ассоциацию с рассматриваемым заболеванием.
Инфекционный процесс и инфекционная болезнь наступают тогда, когда адаптация является односторонней и микроорганизм размножается и разрушает макроорганизм, который оказывается не в состоянии предотвратить эти разрушения. Поэтому в последние годы стал более сложным ответ на вопрос о причинах отдельных соматических и инфекционных болезней и даже проведения различий между ними.
О влиянии хронических, медленных инфекций на соматический статус человека известно давно. Так, передавая факты из жизни людей допотопного периода, Библия сообщает нам очень интересную статистику о продолжительности жизни людей в то время. Оказывается, Адам жил 930 лет, его сын Сиф — 912 лет, сын Сифа — Энос — 905 лет; представители последующих поколений: Каинан (сын Эноса и внук Сифа) — 910 лет, Малелеил (сын Каинана, из потомства Сифова) — 895 лет, Иаред (сын Малелеила и отец Еноха) — 963 года, Мафусал (самый долго проживший из «собственно» людей) — 969 лет, его сын Ламех — 777 лет. Библия упоминает не только потомков Адама и Евы, но и живущих среди них сынов Божьих, людей-гигантов: «…Когда люди начали умножаться на земле и родились у них дочери, тогда сыны Божии увидели дочерей человеческих, что они красивы, и брали [их] себе в жены, какую кто избрал» [Быт. 6:1–2].
После потопа наступил так называемый период кочевания. Постепенно потомки Ноя заселяли территории к югу от Арарата. Они населили собою западную часть Азии, северо-восточную Африку, продвинулись в верховья Нила, на территории, населенные другими приматами. Голод вынуждал их постоянно скитаться, разводить скот, рацион питания людей резко изменился. И хотя Господь запретил людям контактировать с кровью животных: «…все движущееся, что живет, будет вам в пищу; как зелень травную даю вам все; только плоти с душою ее, с кровью ее, не ешьте» [Быт. 9:3], но в тех условиях это было трудно сделать. Забвение Закона, данного Богом, не прошло бесследно для людей. Были нарушены межвидовые барьеры; отдельные человеческие популяции стали осваиваться паразитами животных, вызывающих медленные инфекции. «Когда начали размножаться обитающие на земле, и умножились сыны и народы и поколения многие, и опять начали предаваться нечестию, более, нежели прежние», — с горечью писал пророк Ездра [3 Езд. 3:12]. Колоссальное оскудение того, что сегодня мы называем моралью и нравственностью, превратило потомков Ноя в «сухие дрова» для пожаров необычных для «допотопных» людей эпидемий и пандемий. Уже праведник Ной имел привычку напиваться вина до бесчувствия и валяться голым в шатре. Дочери Лота (Лот — племянник Авраама, родоначальника еврейского народа) спаивали отца и рожали от него детей. Появилась проституция: «И увидел ее Иуда и почел ее за блудницу, потому что она закрыла лице свое» [Быт. 38:15]. Распространение гомосексуализма приобрело самые невероятные размеры [Быт. 19:4–9]. За этими легендами проглядываются события неявные и не попавшие в «Пятикнижие Моисея».
Но попробуем представить эпидемическую ситуацию того времени. Малочисленность людей не давала возможности для вспышек инфекций, возбудители которых имеют короткий инкубационный период. Однако для микроорганизмов, распространяющихся при невысокой плотности населения (возбудители медленных инфекций), существовали весьма благоприятные условия. В первую очередь это касается возбудителей ретровирусных и прионных болезней. Следы древних инфекционных процессов, в которых участвовали ретровирусы, ретроэлементы и прионы, запечатлены в нашем геноме (только копии различных ретроэлементов составляют, по современным данным, около 15 % генома человека). Видимо, тогда же началось «освоение» новой «экологической ниши» возбудителями других медленных инфекций, вызывающих болезни, обычно принимаемых как соматические: Chlamydia pneumoniae — атеросклероз и такое его осложнение, как инфаркт миокарда; Helicobacter pylori — язвенная болезнь желудка, переходящая в рак (В-клеточная лимфома желудка); вирус Ljungan — инсулинозависимый сахарный диабет; микоплазмы — ревматоидный артрит, бесплодие, болезнь Крона; вирус герпеса 6-го типа — множественный склероз и другие болезни, в их числе злокачественные новообразования. От более древних приматов к человеку перешли возбудители СПИДа, лейкозов; те, в свою очередь, «потянули» ассоциируемые с ними инфекции. Библия не фиксирует моров, но продолжительность жизни каждого последующего поколения потомков Ноя убывает. Сам Ной (сын Ламеха), умирая, имел от роду 960 лет, сын Ноя Сим жил 600 лет, его сын Арфаксад — 438 лет, Сал — 433 года, сын Салы и внук Сима Евер жил 464 года, его сын Фалег — 239 лет, Рагов — 239 лет, Шруг — 230 лет, Нахор (дед Авраама) — 148 лет, его сын Фарра — 205 лет, его сын Авраам жил 175 лет, сын Авраама Исаак — 180 лет, его сын Иаков жил 147 лет, сын Иакова Иосиф — только 110 лет. Сегодня люди и этого возраста — большая редкость. Следовательно, за 2,5 тыс. лет (период кочевания) продолжительность жизни людей сократилась почти в 10 раз, но при этом резко возросла их численность. И только тогда Библия впервые зафиксировала такие явления (эпидемии), как проказа и моровая язва.
На сегодняшний день сложилась достаточно парадоксальная ситуация. Ряд заболеваний человека, инфекционная природа которых была установлена относительно недавно (например, хеликобактерная инфекция, болезнь Уиппла и др.), оказался в зоне компетенции иных клинических специалистов, в результате чего произошло разделение болезней на «инфекционные» и «неинфекционные». В научном понимании подобное подразделение не имеет ни смысла, ни объяснения. Мы оказались заложниками классических представлений об инфекционных заболеваниях, критерии которых первоначально были определены по степени их контагиозности, т.е. эпидемической опасности для окружающих. И даже по прошествии нескольких десятилетий интенсивных исследований мы продолжаем выделять инфекционные заболевания в отдельную самостоятельную группу болезней человека в соответствии с каноническими представлениями, хотя накопилось достаточное количество научных данных, требующих более широкого взгляда на инфекционную патологию, в частности, с общепатологических позиций.
В настоящее время происходит накопление принципиально новых сведений о роли возбудителей инфекционных заболеваний в общей патологии человека, логическим завершением чего следует ожидать разработку новых концепций относительно роли и значения микроорганизмов как в общей патологии человека (а не только при инфекционных нозоформах), так и в естественных (физиологических) условиях развития.
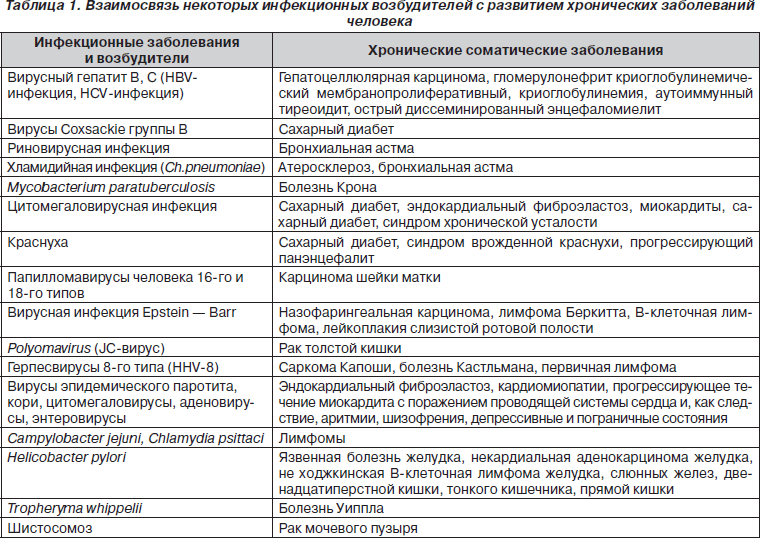
Принципиально новыми тенденциями в эволюции наших представлений об инфекционных заболеваниях являются расширение границ инфекционной патологии, прежде всего за счет установления роли возбудителей в развитии заболеваний, ранее считавшихся неинфекционными, и определение значения возбудителей инфекционных заболеваний в хронической патологии человека. Список этих заболеваний уже сейчас достаточно велик и продолжает постоянно увеличиваться (табл. 1).
Несмотря на многочисленные факторы, подтверждающие данную теорию, еще остается немало вопросов. Основных, глобальных — два. Если около 80 % населения земного шара инфицированы герпесвирусами, хламидиями, микоплазмами и другими внутриклеточными персистирующими инфекциями, причем у основной массы людей имеет место их латентное течение, то как к ним относиться — как к больным, здоровым или как к группе риска по возможной реализации соматической патологии? Хотя уже становится очевидным, что существует единый материальный субстрат проявлений жизнедеятельности, включающий весь диапазон уровней организации от молекулярного до организменного, и никакие, даже ничтожнейшие, функциональные изменения не могут возникнуть и исчезнуть, не отразившись в соответствующих структурных изменениях. Потому что не существует «чисто функциональных» болезней, все они являются структурно-функциональными. Взаимодействие патогенного фактора с организмом, на наш взгляд, длительное время ограничивается периодическим появлением едва уловимых ничтожных «неправильностей» в функционировании той или иной системы, еще никак не сказывающихся на общей работе организма. Со временем персистирующий воспалительный процесс обязательно приводит и к структурным нарушениям — заболеванию.
Пролиферативное или продуктивное воспаление, вызываемое рецидивирующим течением персистирующих внутриклеточных инфекций, сопровождается преобладанием размножения тканевых клеточных элементов и интенсивной микро- или макрофагальной, лимфоцитарной инфильтрацией. При этом пролиферативный воспалительный процесс протекает, как правило, длительно и носит хронический характер с вероятной гиперпродукцией соединительнотканных элементов.
Воспаление как стандартный неспецифический комплекс сосудистых и тканевых изменений начинает постепенно формироваться в эмбриональном периоде, причем на ранних этапах эмбриогенеза воспаление как типовой патологический процесс в своем окончательном виде еще не развивается. В период формирования бластулы, эмбрио- и трофобласта действие экзогенных раздражителей инфекционной природы приводит или к гибели зародыша, или к частичному повреждению указанных структур, причем в случае продолжения развития зародыша могут возникать множественные врожденные пороки развития как самого зародыша, так и его провизорных органов. В 1951 г. был описан синдром Грега, обусловленный развитием коревой краснухи у беременных женщин, особенно в первом триместре беременности. При этом возникают множественные врожденные пороки развития органов эктодермального гистогенеза (зачатков глаз, органов слуха, головного мозга) и мезодермального происхождения (сердца, почек и других органов). Сегодня подобная патология выявляется и при других персистирующих инфекциях — герпесвирусе, токсоплазме и др.
Продуктивный компонент воспалительной реакции, особенно со стороны мезенхимальных элементов кроветворного и стромального ряда, начинает формироваться в конце эмбриогенеза и в раннем периоде фетогенеза, когда происходит дальнейшая дифференциация тканей органов. Воздействие персистирующих инфекционных патогенных факторов на материнский организм и плод приводит в этом периоде к формированию так называемых мезенхиматозов в виде пролиферации миелоидной ткани, диффузного фиброза селезенки и печени, фиброэластоза миокарда, фиброза стромы поджелудочной железы в сочетании с разрастанием жировой ткани.
В позднем фетальном периоде, соответствующем 28 неделям беременности, когда завершается формирование большинства органов плода, воспаление характеризуется не только альтеративно-пролиферативным характером, но и присоединением реакции микроциркуляторного русла.
Характерной особенностью воспалительного процесса в фетальном периоде является отсутствие эффективных местных механизмов защиты, обеспечивающих формирование барьеров, в связи с чем возникают быстрая генерализация инфекции и ареактивные некрозы в различных органах и на слизистых оболочках с развитием множественных эрозий слизистых. Образование обширных некрозов с последующим возникновением диффузного глиоза в головном мозге отмечается при инфицировании плода цитомегаловирусом, вирусом герпеса 2-го типа, а при возникновении токсоплазмоза в мозге формируются многочисленные кисты, содержащие зернистые шары и псевдоцисты. В то же время при названных инфекциях обнаруживаются признаки генерализации процесса в виде очагов некроза в паренхиматозных органах.
У детей первых 2–3 месяцев жизни отмечается недостаточность фагоцитоза в связи с незрелостью рецепторного аппарата мембран фагоцитов, отсутствием достаточного количества опсонинов и хемоаттрактантов, в роли которых выступают, в частности, комплемент и иммуноглобулины. В связи с этим не формируются нейтрофильный и моноцитарный барьеры, обеспечивающие элиминацию инфекционных возбудителей за счет процессов киллинга и переваривания в фаголизосомах, в отличие от таковых у взрослого человека. Кроме того, у детей первых месяцев жизни недостаточен синтез в печени плазменных факторов свертывания крови, преобладают антикоагулянтные механизмы, поэтому отсутствуют явления тромбоза в кровеносных сосудах и, соответственно, фиксация патогенного агента в зоне его инокуляции.
Таким образом, особенностями воспалительного процесса у детей первых месяцев жизни, преимущественно у недоношенных, являются склонность к генерализации процесса в связи с недостаточностью местных механизмов защиты, преобладание альтеративного и продуктивного компонентов воспаления, недостаточность процессов экссудации и связанных с ней механизмов защиты.
Недостаточность формирования местных механизмов защиты, склонность к генерализации инфекции, развитию септического состояния при развитии воспаления могут сохраняться в течение первых лет жизни.
В отроческом периоде, характеризующемся сменой молочных зубов на постоянные, происходят определенные сдвиги иммунного и гормонального статуса ребенка, что и приводит к развитию гиперергических воспалительных реакций типа крапивницы, отека Квинке, бронхиальной астмы и других.
В пубертатный период, когда происходит перестройка нервной, эндокринной, иммунной систем организма, нередко зона воспаления также в достаточной мере не выполняет своей барьерной функции, что приводит к учащению развития заболеваний инфекционно-аллергической или аутоиммунной природы.
Таким образом, воспалительная реакция начинает формироваться в раннем фетальном периоде в виде так называемых пролиферативных мезенхиматозов в сочетании с врожденными пороками развития. В позднем фетальном периоде преобладают альтеративно-пролиферативные сдвиги в зоне воспаления, возникают очаги некроза, формируются гранулемы, содержащие значительные количества возбудителей. В этот период развития плода еще не сформированы в достаточной мере специфические иммунологические механизмы защиты, местные механизмы резистентности. Фагоцитоз носит незавершенный характер, в связи с чем зона воспаления не выполняет барьерной функции, не обеспечивает элиминации возбудителя, что приводит к быстрой генерализации инфекции, развитию множественных очагов некроза в различных органах и тканях.
С возрастом ребенка отмечается снижение уровня Т-лимфоцитов в крови, уменьшается способность Т-лимфоцитов к последующей дифференцировке в иммунные регуляторные и киллерные клетки на фоне антигенной стимуляции, нарушается рецепция интерлейкинов, обеспечивающих реакции межклеточного взаимодействия, снижается продукция интерлейкина-2, то есть возникают характерные особенности развития иммунодефицитных состояний и обусловленная этим фактором недостаточность механизмов защиты в зоне воспалительного процесса инфекционной природы.
Биологический смысл воспаления заключается в отграничении патогенного раздражителя, его уничтожении и элиминации, после чего воспаление заканчивается репарацией и восстановлением гомеостаза. Однако нередко возникает ситуация, когда в силу различных причин патогенный раздражитель не подвергается уничтожению либо возникает поломка в механизмах самой воспалительной реакции, что мы наблюдаем при персистирующем инфекционном процессе. В этом случае воспаление приобретает хроническое течение. По существу хроническое воспаление является проявлением возникшего дефекта в системе защиты и приспособления организма к меняющимся условиям существования.
К сожалению, современный этап учения о воспалении характеризуется явно недостаточными знаниями о природе хронического воспаления. Не сформулировано даже определение этого процесса, остаются неясными его причины и динамика развития, не установлен хотя бы ориентировочно срок течения воспаления, после которого его можно считать хроническим. Именно изучение данного процесса в рамках вероятности воздействия персистирующих инфекций может, на наш взгляд, ответить на многие вопросы. Ведь причина хронического воспаления лежит, по всей видимости, в персистенции повреждающего фактора, обусловленной либо особенностями этого фактора, либо разнообразными дефектами в системе самозащиты самого организма. Данная ситуация моделирует пато- и морфогенез хронического воспаления, в результате чего резко затруднены репарация тканей в воспаленной области и восстановление гомеостаза. В связи с этим воспаление теряет свое приспособительное значение.
Из общей патологии известно, что воспаление является стимулом для включения в патологический процесс иммунокомпетентной системы. Тем более что действие иммунной системы всегда реализуется через механизмы и морфологию воспаления. Поэтому естественно предположить, что иммунные механизмы должны играть ключевую роль в патогенезе хронического воспаления. На это указывал еще И.В. Давыдовский [4], но возможности медицины его времени не позволяли углубиться в эту проблему. Современный же методический уровень исследований может помочь оценить функции иммунокомпетентной системы в условиях хронического воспаления. В связи с этим необходимо расширение исследований особенностей иммунологических и иммунопатологических реакций в динамике этого процесса.
Сегодня известно [5], что при хронических воспалительных заболеваниях имеются тяжелые и разнообразные изменения иммунного статуса больных в виде лимфоцитопении, выраженного иммунного дефицита Т-лимфоцитов, субпопуляций Т-хелперов и Т-супрессоров, их дисбаланса, повышения уровня IgA, IgG и циркулирующих иммунных комплексов (ЦИК), увеличения популяции активных Т-лимфоцитов. Следовательно, при хроническом воспалениии клеточные и гуморальные иммунные реакции вовлечены в иммунопатологический процесс, и при этом эффективность их отчетливо снижена. Кроме того, cнижение спонтанной и хемотаксической двигательной активности нейтрофильных лейкоцитов доказывает участие факторов неспецифической резистентности в этом процессе, указывающих на участие иммунопатологических реакций в патогенезе и морфогенезе хронического воспаления.
Определено, что при всех хронических воспалительных заболеваниях изначально имеет место персистенция повреждающего фактора, постоянно стимулирующая иммунную систему. На определенном этапе течения болезни появляется комплекс иммунопатологических и иммуноморфологических изменений, отражающих выраженную дисфункцию иммунокомпетентной системы, и этот комплекс уже сам обусловливает хронизацию процесса, становясь важнейшим звеном патогенеза хронического воспаления. При этом наблюдается резкое, патологическое повышение в крови больных уровня ЦИК, концентрации IgA, IgM, IgG, a также снижение хемотаксической активности лейкоцитов. Как следствие, в стенках сосудов фиксируются ЦИК, IgG, IgA и комплемент, что определяет развитие васкулитов, причем чем дольше течет воспаление, чем хуже протекают репаративные процессы, тем больше ЦИК, включающих комплемент, оказывается в сосудистой интиме. На этом фоне страдают эндотелиоциты, являющиеся секреторными клетками и имеющие существенное значение в межклеточных взаимоотношениях. Они продуцируют ряд медиаторов иммунитета, в том числе интерлейкин-1, усиливающий пролиферацию фибробластов и синтез ими коллагена. Поэтому повреждение эндотелия сосудов способствует нарушению ее созревания и межклеточной регуляции. Эти нарушения усугубляются гипоксией, нарастающей по мере редукции патологически измененных сосудов. В тканях нарушаются функции фибробластов, в том числе и синтез ими коллагена и эластина. Образующиеся при этом коллагеновые фибриллы являются нестойкими к действию протеаз тех же фибробластов и гидролаз клеток воспалительного инфильтрата, так как они построены из несовершенного коллагена. Дефектные эластические волокна, играющие большую роль в репарации, также не выполняют своей функции.
Характерными особенностями всех исследованных хронических воспалительных заболеваний являются развитие продуктивных васкулитов в стенках артериол и венул, пролиферация эндотелия в более крупных сосудах, вплоть до облитерации их просветов. При этом на электронной микроскопии выявляются деструкция эндотелия и резкое снижение пиноцитоза, но часто — некробиоз всей стенки микрососудов.
При хроническом воспалении, обусловленном персистенцией латентной инфекции, нередко в периоде репарации наблюдается формирование соединительной ткани в основном за счет нестойкого коллагена III типа, значительно меньше — I типа, иногда — V типа. Коллаген IV типа, характерный для базальной мембраны эпидермиса, не выявляется, и при этом нарушается образование эластических волокон. Развитие таких процессов в различных органах и структурах (сердце, сосуды, печень, почки, нервная система и т.д.) может привести к склерозированию, дистрофическим процессам и т.д.
Таким образом, получаемые сегодня данные позволяют выделить основные параметры, обусловливающие развитие хронического воспаления и формирование разнообразной соматической патологии: персистенция повреждающего фактора (в данном случае инфекции), иммунологическая недостаточность или иммунная дисфункция и связанные с этим характерные морфологические изменения в органах и тканях, вероятное включение на определенном этапе патогенеза механизмов аутоиммунизации и прогрессирование воспаления по принципу порочного круга, что чрезвычайно затрудняет репарацию поврежденных тканей и восстановление гомеостаза. При этом хроническое воспаление теряет свою биологическую целесообразность как защитно-приспособительная реакция организма, ибо утрачивает способность уничтожения и элиминации повреждающего фактора и становится фактором, способствующим формированию заболеваний. Тем более что сегодня уже известно, что при многих болезнях, ранее считавшихся неинфекционными, выявляется инфекционный агент, определяющий процессы хронического воспаления.
Постоянная антигенная стимуляция иммунокомпетентной системы, связанная с персистенцией патогенного фактора, а также интоксикация, обусловленная как этим раздражителем, так и наличием микробов и непрекращающимся некротизированием ткани в зоне хронического воспаления, не только повышают функциональную нагрузку на иммунную систему, но и повреждают ее. Нарушаются соотношения между Т- и В-системами лимфоцитов, между субпопуляциями Т-лимфоцитов, снижается активность макрофагов, развиваются вторичный иммунодефицит и иммунологическая недостаточность. Вместе с тем снижение бактерицидной и фагоцитарной функции гранулоцитов, наряду с угнетением их хемотаксиса, приводит к нарушению фагоцитоза, что способствует персистенции инфекции.
Сегодня, когда появились новые технологические возможности методов диагностики, связь хронического воспаления как фактора в развитии соматических заболеваний и персистирующих инфекций стала более очевидной. Так, при ПЦР-исследовании пораженных тканей сердца у больных миокардитами нередко выявляются вирусы Коксаки В и его антигены, цитомегаловирус. Выявлена роль кардиотропных энтеровирусов и хронической формы вирусной инфекции Коксаки (Коксаки А13, А18, В1, В2, В3, В5) в этиологии ревмокардита и неревматического кардита [6, 7]. В экспериментах на мышах продемонстрирована способность вируса Коксаки В вызывать поражение мышцы сердца. При атеросклерозе в атеросклеротических бляшках коронарных сосудов и аорты человека обнаружено присутствие бактерий Chlamydia pneumoniae. Чистые культуры Helicobacter pylori изолировали в 50 % случаев при обследовании пациентов с гастритом, у 70–90 % больных с язвой желудка и у 95 % лиц, страдающих язвой двенадцатиперстной кишки [8].
На протяжении более 100 лет роль возможного связующего звена между воспалением и процессами атерогенеза отводили разным специфическим микробным агентам (S.typhi, стрептококки, вирусы Коксаки В, Mycoplasma gallisepticum, аденовирусы, вирус болезни Марека, цитомегаловирус, Ch.pneumoniae, H.pylori, Mycoplasma fermentans, Coxiella burnetii). В последние годы в центре внимания находятся цитомегаловирусы, H.pylori и Ch.pneumoniae [9]. Риск развития коронарной болезни сердца значительно повышался у пациентов с антителами к вирусу гепатита А, у лиц с высоким уровнем С-реактивного белка.
Инфекция (в том числе хроническая экстраваскулярная — гингивит, простатит, бронхит и т.п.) приводит к многочисленным системным эффектам, в частности к увеличению продукции цитокинов, реактантов острой фазы и моноцитов/макрофагов, являющихся основными воспалительными медиаторами атеросклероза. Кроме того, инфекция может послужить триггер-фактором разрыва покрышки бляшки и развития острого коронарного синдрома. При этом, вероятно, главную роль в возникновении и прогрессировании атеросклероза играет не столько конкретный патоген, сколько патогенная нагрузка, т.е. суммарное действие нескольких патогенов [10]. Так, на большом эпидемиологическом материале продемонстрировано, что в период сезонного подъема гриппа увеличивается число госпитализированных с обострениями сердечно-сосудистых заболеваний и нарушениями мозгового кровообращения с ростом летальности в этот период.
Развитие диабета I типа многие исследователи также связывают с инфекциями, вызываемыми представителями шести семейств вирусов: Paramyxoviridae (вирус паротита), Picornaviridae (вирус Коксаки В), Retroviridae (ретровирус), Togaviridae (вирус краснухи), Reoviridae (ротавирус), Herpesviridae (цитомегаловирус, вирус Эпштейна — Барр). Наиболее интересные данные получены при изучении роли вирусов паротита, краснухи и Коксаки В. Связь диабета с вирусом паротита была продемонстрирована более 25 лет тому назад с помощью эпидемиологических методов. Развитие инсулинозависимого диабета при краснухе происходит после заражения плода в последнем триместре беременности. Установлено, что у 10–20 % пациентов с синдромом врожденной краснухи в возрасте 5–20 лет развиваются нарушения углеводного обмена. Эти цифры существенно больше, чем показатели в популяции в целом. Ассоциацию инфекции вирусом Коксаки В с ранними этапами развития диабета доказывают результаты эпидемиологических наблюдений, находки вирусного антигена в поджелудочной железе и изоляции вируса из этой железы. Описано выделение вируса из кала больной диабетом, у которой симптомы патологии обмена развились через 10 дней после Коксаки-вирусной инфекции. После инокуляции этого штамма у лабораторных животных наблюдали развитие диабета. В многочисленных исследованиях продемонстрировано, что инфекция человека ретровирусами, ротавирусами, цитомегаловирусом и вирусом Эпштейна — Барр, как правило, сопровождается формированием аутоантител к клеткам поджелудочной железы. Эти аутоантитела рассматривают в качестве одного из ведущих механизмов развития инсулинозависимого диабета.
Современные исследования свидетельствуют, что в большинстве (до 80 %) случаев этиология злокачественных новообразований ассоциирована с инфекционными агентами (папилломавирус, вирусы герпетической группы, гепатитов В и С, лимфотропные вирусы LVI, II и др.). H.pylori обнаруживают у 55 % пациентов с аденокарциномой и лимфомой желудка. Вирус папилломы выделяют в новообразованиях половых органов у 65 % пациентов из развитых и 87 % больных из развивающихся стран. Развитие гепатокарциномы в 73 % случаев связывают с инфекцией вирусом гепатита В, а в 27 % — с заражением вирусом гепатита С.
Патогенез соматических или онкологических заболеваний, ассоциированных с микроорганизмами, изучен недостаточно. Обсуждается несколько вариантов событий:
— микроорганизм нарушает функцию органа-мишени, разрушая зараженные клетки. Эксперименты с культурами клеток in vitro позволяют думать о таком механизме действия вирусов паротита, краснухи и Коксаки В. Описано несколько случаев выделения последнего из поджелудочной железы пациентов с диабетом I типа;
— патоген запускает первые этапы патологического процесса, затем исчезает из организма. В дальнейшем процесс развивается самостоятельно. Такую гипотезу предложил Л.А. Зильбер при построении вирусной теории происхождения опухолей [11];
— микроорганизм действует как кофактор, усиливая эффекты субпороговых доз других факторов. В качестве примера рассматривают развитие злокачественного процесса при взаимодействии вируса папилломы человека, никотина, оральных противозачаточных препаратов при дефиците витаминов А и С у людей с определенным генетическим статусом;
— ассоциированный возбудитель запускает аутоиммунный процесс, направленный против клеток органа-мишени. Наиболее подробно описаны аутоиммунные события при инсулинозависимом диабете, ассоциированном с вирусами. Практически во всех случаях у пациентов с такой патологией выявляют аутоантитела и аутореактивные Т-лимфоциты, направленные против b-клеток поджелудочной железы. При наличии симптомов диабета у пациентов с синдромом врожденной краснухи аутоантитела обнаруживают у 50–80 % обследованных при 20 % в контроле.
Очевидно, что при развитии соматического или злокачественного процесса, ассоциированного с микроорганизмом, действует несколько повреждающих механизмов, которые обусловлены этим патогеном. При этом большую роль играет генетическая предрасположенность организма, что хорошо продемонстрировано на примере диабета I типа и папилломатоза наружных половых органов. Имеют значение и свойства микрорганизма. Изучение роли вируса Коксаки В показало, что лишь немногие штаммы этого возбудителя обладают диабетогенной активностью.
В настоящее время гипотеза об ассоциации соматических и злокачественных микроорганизмов является общепризнанной. Следует ожидать, что список таких связей будет увеличиваться.
Главным следствием рассмотренной гипотезы является предложение использовать существующие вакцины не только для профилактики конкретных заболеваний, но и для предупреждения ассоциируемой с этой инфекцией соматической или злокачественной патологии [12]. Так, сегодня создана и эффективно используется вакцина против вируса папилломы человека, вызывающего рак шейки матки, что отмечено человечеством присуждением Нобелевской премии ее создателям.
И в заключение хочется еще раз подчеркнуть, что значительное количество исследований, проводящихся сегодня в мире, все чаще указывают на персистирующую инфекцию как на этиологический и патогенетический фактор развития хронических соматических заболеваний атеросклероз с поражением органов кровообращения, кардиты, аритмии сердца, бронхиальная астма, хронические и рецидивирующие обструктивные заболевания легких, язвенная болезнь желудка и двенадцатиперстной кишки, рефрактерные формы хронического гломерулонефрита, сахарный диабет, синдром хронической усталости, шизофрения, онкологические процессы). Кроме того, необходимо учитывать и доказанную роль персистирующего течения внутриклеточных инфекций в патологии беременности, плода и детей различного возраста и их значение в младенческой смертности. Результатом полученных данных было то, что в 2003 году Европейское региональное бюро ВОЗ включило группу персистирующих внутриклеточных инфекций в число болезней, определяющих будущее как инфекционной, так и соматической патологии в человеческой популяции.
1. Ройт А., Бростофф Дж., Мейл Д. Иммунология. — М., 2000. — 582 с.
2. Мечников И.И. Невосприимчивость в инфекционных болезнях. — М., 1947. — 146 с
3. Смелянская М.В., Перемот С.Д., Мартынов А.В. Персистирующие герпесвирусы как потенциальный триггер-фактор соматических заболеваний // Annals of Mechnicov Institute. — 2006. — 4. — С. 29-33.
4. Давыдовский И.В. Общая патология. — М., 1990. — Т. 2. — 345 с.
5. Пауков В.С., Салтыков Б.Б., Ермакова Н.Г., Шашлов С.В. Патогенетические аспекты хронического воспаления // Архив патологии. — 1998. — Том 60, № 1. — С. 34-38.
6. Лобзин Ю., Захаренко С. Проблема инфекции в современной клинической медицины // Врач. — 2004. — № 2. — С. 26-32.
7. Нагорная Н.В., Виноградов К.В. Клинические проявления врожденных пороков сердца у детей // Здоровье ребенка. — 2009. — № 5. — С. 49-56.
8. Smolinski M.S., Hamburg M.A., Lederberg J. Microbial threats to health. — Washington: The National Academies Press, 2001. — Р. 396.
9. Нге Дж., Гупта С. Chlamydia pneumoniae и атеросклероз: совпадение или закономерная связь? // Клиническая микробиология и антимикробная химиотерапия. — 2001. — Т. 3, № 2. — С. 104-110.
10. Лобзин Ю.В., Рудакова А.В. Роль инфекционно-воспалительного фактора в развитии атеросклероза // Мед. акад. журн. — 2003. — Т. 3, № 2. — С. 26-32.
11. Зильбер Л.А. Вирусная теория происхождения злокачественных опухолей. — М., 1946.
12. Семенов Б.Ф., Зверев В.В., Клименко С.М. Гипотеза о связи так называемых неинфекционных заболеваний с инфекционными возбудителями // Вакцинопрофилактика неинфекционных заболеваний. — 2004. — № 4. — С. 12-19.